HTD4010 可减轻脓毒症心肌病小鼠的心肌损伤::基于促进AMPK/mTOR信号通路介导的自噬
2024-04-13肖红敏韩保松郭家成吴敬医
肖红敏,韩保松,郭家成,吴 超,吴敬医
皖南医学院1第一附属医院急诊科,2病理生理学教研室,安徽芜湖241002
脓毒症是与感染有关的,由于机体炎症反应失调导致的可以危及生命的器官功能障碍[1]。研究表明,世界上脓毒症患者估计达4890万人,脓毒症死亡人数估计达到1100万例,约占全球总死亡人数的19.7%[2];脓毒症心肌病(SCM)是脓毒症及脓毒性休克常见的严重并发症,使脓毒症患者病死率增至70%[3],严重威胁着患者的生命安全。早期发现并进行相应干预,能有效地改善病人的临床结局,但目前相关药物治疗的效果仍不能令人满意。SCM的治疗问题仍然困扰着世界范围内的医护工作人员。
研究表明SCM的病理生理机制非常复杂,涵盖炎症反应,细胞凋亡损伤,线粒体功能障碍,自噬,细胞内钙离子转运蛋白异常调控及能量代谢紊乱等诸多方面,但SCM的具体病机尚不完全明确[4-6]。在大鼠盲肠结扎穿刺建立脓毒症模型的研究中发现,雷帕霉素可以通过抑制丝氨酸/苏氨酸蛋白激酶(mTOR)通路来激活自噬改善脓毒症大鼠心肌组织的病理损伤,缓解心功能不全,从而发挥心脏保护作用[7]。丙戊酸可以通过抑制组蛋白去乙酰化酶(HDAC)1和HDAC3介导的同源性磷酸酶张力蛋白(PTEN)表达而诱导自噬,降低脓毒症导致的心肌组织线粒体损伤、氧化应激及炎症反应,进而改善脓毒症心功能不全[8]。在关于重组人自噬效应蛋白(Beclin-1)的研究中,使用脂多糖(LPS)诱导的脓毒症小鼠模型,可观察到增加Beclin-1 依赖性自噬可减轻脓毒症结果,表现为收缩力改善、细胞因子减弱,并减少心脏纤维化损伤[9]。
腺苷单磷酸活化蛋白激酶(AMPK)和哺乳动物雷帕霉素靶标(mTOR)是自噬的两个主要调节因子,AMPK激活正向调节自噬活性,mTOR激活负向调控自噬活性,两者互相拮抗,AMPK/mTOR通路是调控自噬的经典通路[10-12]。研究显示,AMPK/mTOR介导的自噬在多种疾病中发挥调控作用,如溃疡性结肠炎[13]、心力衰竭[14]、LPS诱导的急性肺损伤[15]等。此外,褪黑素可以通过激活AMPK/mTOR/自噬通路,抑制炎症反应,减轻心肌细胞凋亡,对脂多糖诱导的心肌损伤产生保护作用[16]。
再生基因蛋白3(Reg3),尽管其最初是在急性胰腺炎中被发现,已有研究观察到在其他器官系统疾病,如心脏、肝脏、卵巢中也表达出显著的生物活性[17-21]。研究发现其对炎症反应,细胞凋亡,细胞增殖及组织修复均可产生有益的影响[17,22-24]。Reg3α是Reg3的一个亚型,HTD4010,Reg3α的活性中心类似物,是一种15氨基酸多肽,生物学活性与Reg3α相似。我们课题组前期研究发现,HTD4010可通过减轻炎症反应,减少凋亡及坏死等病理生理过程来保护急性胰腺炎[25,26]。目前,HTD4010对SCM作用的相关研究尚未见报道。故本文拟探讨HTD4010对SCM小鼠心肌损伤的作用,并探究其可能的作用机制。
1 材料和方法
1.1 实验动物
6~8周龄雄性ICR小鼠(体质量18~22 g),由长沙市天勤生物技术有限公司提供,许可证号:SCXK(湘)2019-0014。本研究所有动物均经皖南医学院动物保护与伦理委员会批准(LLSC-2022-005)。
1.2 主要试剂和仪器
主要试剂:HTD4010 是一种新型的15 氨基酸多肽,不含非天然氨基酸(由君泰生物技术有限公司提供,中国深圳),包含“IGLHDPSHGTLPAGS”序列,PCT国际专利号为WO 2014/139472。本研究中使用的HTD4010的纯度为99.1%,有效肽的浓度为90.9%。p-AMPKα、Beclin 1、mTOR、p-mTOR、p62 一抗(Cell Signaling Technology);脂多糖(LPS,Sigma);AMPK、GAPDH一抗(Affinity);Bax、Bcl-2一抗(Bioss);LC3B一抗(Abclonal);肿瘤坏死因子α(TNF-α)和白介素6(IL-6)测定试剂盒(Abclonal);Tunel试剂盒(G1501,Servicebio)。主要仪器:透射电子显微镜(HT7800/HT7700,HITACHI);正置荧光显微镜(NIKON ECLIPSE C1,日本尼康);正置光学显微镜(NIKON ECLIPSE E100,日本尼康);超声仪器(vevo2100LT,Visual Sonics)。
1.3 方法
1.3.1 动物模型建立与分组 雄性ICR小鼠饲养于环境温度22 ℃左右、相对湿度50%~60%、昼夜交替12 h的外界条件中,小鼠可自由获取食物及水分;适应性饲养1周后,将雄性ICR小鼠按随机数表法随机分为3组:对照组,LPS组,LPS+HTD4010组,15只/组。对照组小鼠腹腔注射等体积的生理盐水;LPS组采用腹腔注射10 mg/kg的LPS建立小鼠SCM模型;LPS+HTD4010组在模型建立后的1和6 h分别以2.5 mg/kg皮下注射HTD4010。造模12 h后,对用1.5%异氟醚麻醉后的小鼠行超声心动图评价其心功能,随后颈椎脱臼法处死动物收集心脏和血液。
1.3.2 超声心动图检查 LPS用药12 h后,通过超声心动图检查评估小鼠的心功能。采用1.5%异氟醚对小鼠进行麻醉,将其置于仰卧位脱毛,采用vevo2100超声成像系统获得超声心动图图像,使用系统软件在M模式图像上进一步计算小鼠左心射血分数(LVEF)和左室短轴缩短率(FS)等心功能指标来评价小鼠心功能。
1.3.3 苏木精-伊红染色(HE)将小鼠心脏组织标本用生理盐水洗涤后,固定,石蜡包埋,切片。然后将每个心脏组织切片用HE染色,最后脱水封片,将染色后的切片置于显微镜下镜检,进行图像采集分析。
1.3.4 酶联免疫吸附试验(ELISA)将小鼠血液样本在4 ℃以4000 r/min离心10 min以收集血清;取新鲜小鼠心脏心尖部组织充分匀浆后,离心,取上清液。TNF-α、IL-6采用半自助ELISA 试剂盒测定,严格按照ELISA试剂盒操作说明进行检测。
1.3.5 Western blotting 首先取之前采集的心肌组织提取心肌总蛋白,BCA法进行蛋白浓度测定。然后分别配置5%浓缩胶和不同浓度的分离胶,通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离不同相对分子质量大小的蛋白质,电泳后转膜,在室温下,用5%脱脂牛奶封闭条带1 h,回收条带,分别与LC3B(1∶1000)、p62(1∶1000)、Beclin1(1∶1000)、AMPKα(1∶1000)、p-AMPKα(1∶1000)、mTOR(1∶1000)、p-mTOR(1∶1000)、Bcl2(1∶1000)、Bax(1∶1000)、GAPDH(1∶5000)等一抗在4 ℃冰箱中孵育过夜。回收条带与相应种属的二抗在室温孵育1 h。最后加入ECL化学发光底物,化学发光检测仪检测蛋白表达,曝光成像。
1.3.6 TUNEL染色检测心肌细胞凋亡 Tunel染色检测试剂盒检测小鼠心肌细胞凋亡率。将新鲜小鼠心脏在4%多聚甲醛中固定后,石蜡包埋切片,之后严格遵守制造商说明进行后续操作步骤。封片后将切片置于荧光显微镜下观察并采集图像。计算凋亡指数。
1.3.7 透射电子显微镜 将新鲜小鼠心肌组织切成1 mm3的小组织块,用电子显微镜固定液快速固定,1%锇酸避光室温固定2 h,梯度脱水后用树脂包埋,切成60~80 nm 的超薄切片。用2%醋酸铀饱和酒精溶液和2.6%枸橼酸铅溶液依次染色。最后,利用HT7800-HT7700透射电子显微镜对其进行观测和影像的获取。
1.3.8 统计学方法 所有数据均采用GraphPad Prism 8.0软件进行分析。结果以均数±标准差表示,组间比较采用单因素方差分析。P<0.05认为差异具有统计学意义。
2 结果
2.1 HTD4010对SCM小鼠心功能不全的影响
与对照组相比,LPS组小鼠的LVEF和FS显著减低(P<0.01),与LPS组相比,HTD4010给药后,小鼠的心功能障碍得到改善,LVEF和FS显著升高(P<0.01,图1A~C)。
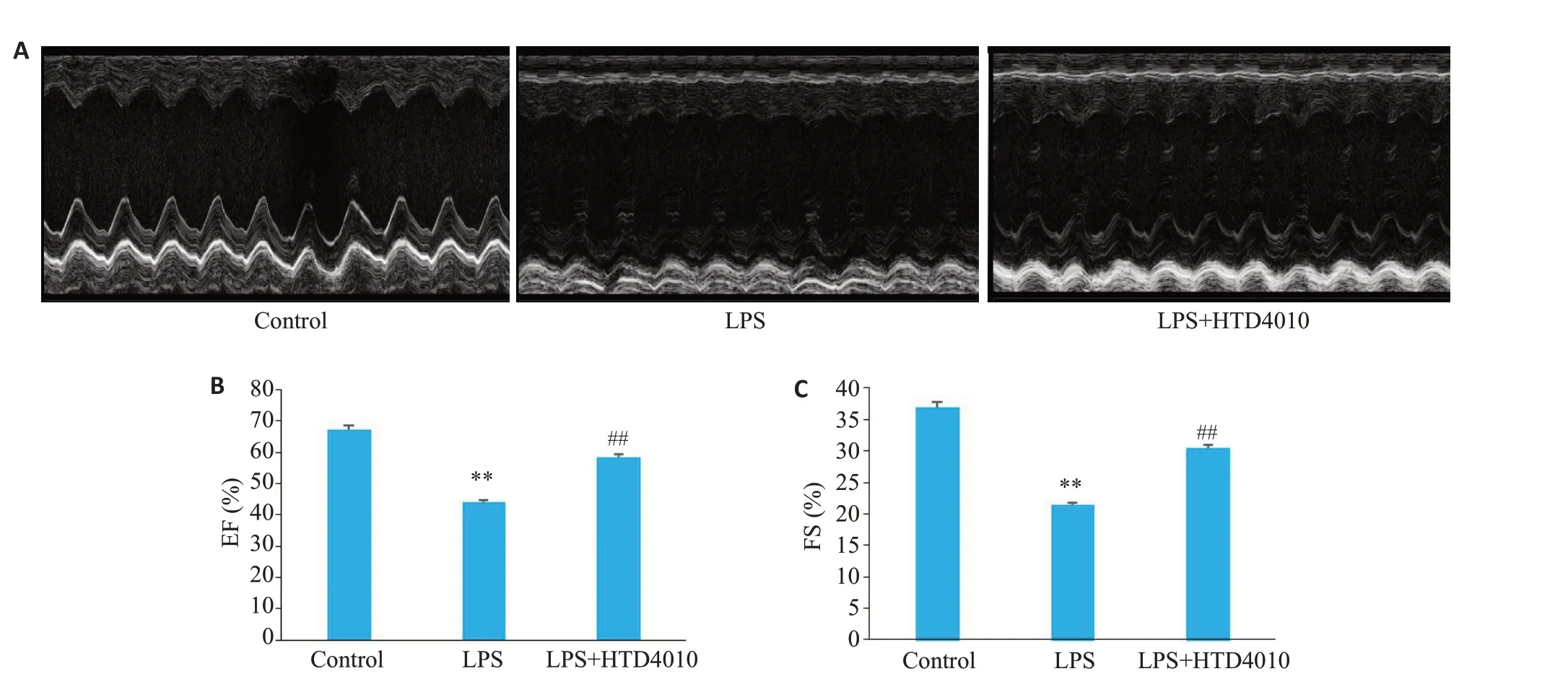
图1 HTD4010改善SCM小鼠心功能Fig.1 HTD4010 improves cardiac function in SCM mice.A: Echocardiograms in different groups. B: Left ventricular ejection fraction(EF,%).C:Left ventricular fraction shortening(FS,%).**P<0.01 vs control group;##P<0.01 vs LPS group.
2.2 HTD4010对SCM小鼠心肌损伤和炎症反应的影响
对照组为正常心肌细胞,心肌纤维排列整齐,结构正常,无炎性细胞浸润。LPS组小鼠心肌组织出现明显损伤,可见心肌细胞排列疏松、紊乱,心肌纤维发生断裂,心肌间质可见炎性细胞浸润。LPS+HTD4010组中HTD4010的应用明显减轻了LPS组中小鼠心肌组织的病理损伤(图2A)。

图2 HTD4010减轻SCM小鼠心肌损伤和炎症反应Fig.2 HTD4010 attenuates myocardial injury and inflammatory response in SCM mice. A:Histopathological changes in the myocardium of the mice in different groups (HE staining,original magnification: ×400).B:Serum TNF-α level.C:Serum IL-6 level.D:Myocardial TNF-α levels.E:Myocardial IL-6 levels.**P<0.01 vs control group;##P<0.01 vs LPS group.
与对照组相比,LPS组小鼠血清和心肌组织中的TNF-α和IL-6含量有明显增加(P<0.01),与LPS组相比,LPS+HTD4010 组中小鼠血清和心肌组织中的TNF-α和IL-6含量明显下降(P<0.01,图2B~E)。
2.3 HTD4010对SCM小鼠心肌细胞凋亡的影响
TUNEL染色结果显示,与对照组相比,LPS组小鼠发生凋亡的心肌细胞显著增多(P<0.01),与LPS组相比,应用HTD4010后小鼠心肌细胞凋亡的数量明显减少(P<0.01,图3A、B)。与此一致的是,Western blot结果显示,与对照组相比,LPS组小鼠中Bcl-2蛋白表达降低(P<0.05),Bax蛋白表达增加(P<0.05),与LPS组相比,HTD4010的应用使Bcl-2蛋白表达增加(P<0.05),Bax蛋白表达降低(P<0.01,图3C~E)。

图3 HTD4010减轻SCM小鼠心肌细胞凋亡Fig.3 HTD4010 attenuates cardiomyocyte apoptosis in SCM mice. A: TUNEL assay of the myocardial tissues in the 2 groups (scale bar=400 μm). B: The proportion of apoptotic cells. C-E:Results of Western blotting for detecting Bax and Bcl-2 expression in the myocardial tissues in the 3 groups.**P<0.01 vs control group;##P<0.01 vs LPS group.
2.4 HTD4010对自噬水平及AMPK/mTOR信号通路的影响
与对照组相比,LPS组小鼠心肌组织中LC3Ⅱ/Ⅰ(P<0.05)、Beclin-1(P<0.01)蛋白表达下调,p62蛋白表达上调(P<0.05),与LPS组相比,HTD4010的应用使LC3Ⅱ/Ⅰ(P<0.05)、Beclin-1(P<0.01)蛋白表达上调,p62(P<0.05)蛋白表达下调(图4A、F~H)。
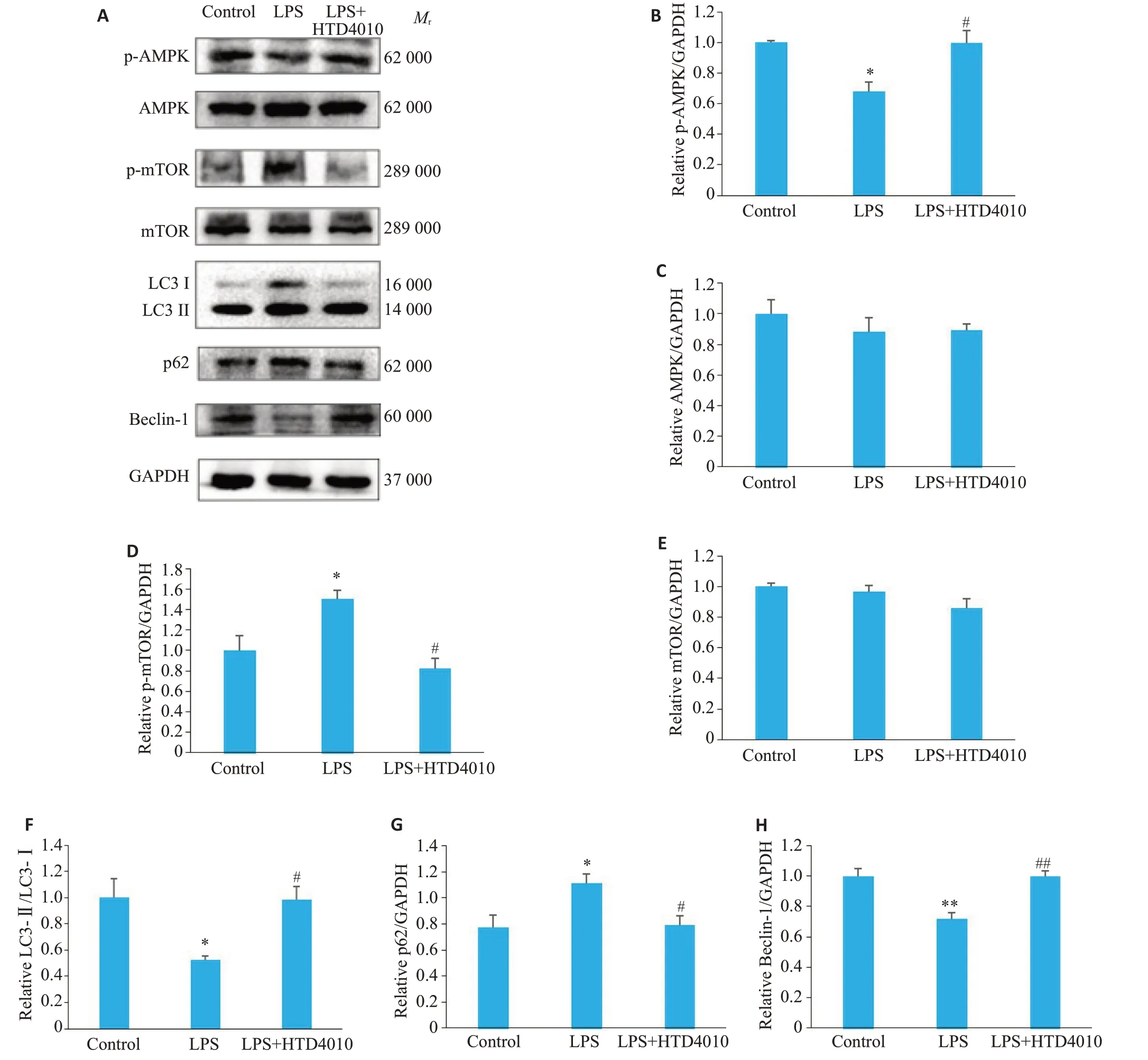
图4 HTD4010激活AMPK/mTOR通路,增强自噬水平Fig.4 HTD4010 activates the AMPK/mTOR pathway and enhances autophagy in the myocardial tissues of the rats. A:Western blots of p-AMPK,AMPK,p-mTOR,mTOR,LC3,Beclin-1,and p62 protein in each group.B-H:Quantitative analysis of the protein expression levels of p-AMPK(B),AMPK(C),p-mTOR(D),mTOR(E),LC3-II/LC3-I(F),p62(G),Beclin-1(H).*P<0.05,**P<0.01 vs control group;#P<0.05,##P<0.01 vs LPS group.
与对照组相比,LPS组小鼠心肌组织中p-AMPK蛋白表达降低(P<0.05),p-mTOR蛋白表达升高(P<0.05),与LPS 组相比,应用HTD4010 后小鼠心肌组织中p-AMPK蛋白表达升高(P<0.05),p-mTOR蛋白表达降低(P<0.05),差异有统计学意义。3组中AMPK,mTOR蛋白表达无显著改变(P>0.05,图4A、B~E)。
2.5 HTD4010对SCM小鼠心肌组织超微结构变化的影响
对照组心肌纤维和线粒体结构正常,排列整齐;与对照组相比,LPS组心肌纤维及线粒体排列紊乱,可见心肌纤维的断裂,线粒体肿胀,线粒体膜模糊,甚至破裂;与LPS组相比,HTD4010应用后,上述病理改变均有不同程度减轻,还可观察到自噬小泡,有较多自噬小体形成(图5)。

图5 HTD4010改善SCM小鼠心脏超微结构病理改变,透射电镜观察小鼠心脏超微结构的代表性图像Fig.5 HTD4010 ameliorates ultrastructural changes of the cardiomyocytes in SCM mice (transmission electron microscopy,×2000).
3 讨论
本研究结果表明,HTD4010的应用可以一定程度上改善LPS诱导的心功能不全,抑制炎症反应,减少心肌细胞凋亡,减轻心肌病理损伤,HTD4010对SCM具有保护作用,其作用机制可能与AMPK-mTOR信号通路调控的自噬有关。
再生基因蛋白(Reg)家族包括Reg1、Reg2、Reg3、Reg4,因其最初是在急性胰腺炎模型的胰液中发现的并提纯的,又称为胰腺炎相关蛋白(PAP),大量研究已经证实它参与炎症反应,细胞分化、增殖和细胞凋亡等病理生理过程,可以激活经典MAPK信号传导途径等多种信号通路[17,27],具体机制有待进一步研究。Reg蛋白已被证明参与多种炎症相关疾病的发病进程,如炎症性肠病、干燥综合征等[28-30]。Reg3是Reg蛋白家族的一员,包括Reg3α、Reg3β、Reg3γ、Reg3δ等不同亚型[17]。有研究表明,Reg3α可以减轻炎症性肠病的肠道炎症和损伤[31,32]。HTD4010 是一种15 氨基酸多肽,与人类Reg3α蛋白中发现的肽序列(104-118位氨基酸序列)同源,HTD4010和Reg3α蛋白有相似的生物学活性。本课题组前期研究发现HTD4010能缓解急性胰腺炎、减轻腺泡细胞坏死及炎症反应[25,26],但有关HTD4010治疗SCM的研究尚未见报道。根据已有的理论基础,我们假设HTD4010对SCM可能具有保护作用。
为验证这一假设,本研究将HTD4010应用于SCM小鼠动物模型中。本实验观察到,相比于对照组,LPS组小鼠血清中IL-6和TNF-α显著升高,心肌组织细胞凋亡率显著升高,Bcl-2蛋白表达降低,Bax蛋白表达增加,心脏LVEF、FS值显著降低,心肌病理损伤严重,有不同程度心肌纤维断裂及排列结构的紊乱、炎性细胞的浸润和线粒体损伤,以上结果均提示LPS导致的小鼠心肌损害的存在。相比于LPS组,应用HTD4010后,小鼠血清中IL-6和TNF-α明显降低,心肌组织细胞凋亡率明显减少,Bcl-2蛋白表达增加,Bax蛋白表达降低,心脏LVEF、FS值明显升高,心肌病理损伤明显缓解。这些研究结果表明,HTD4010对LPS诱导的SCM心肌损伤具有保护作用,但其具体机制尚不明确。
自噬是一种重要且广泛保守的细胞内降解过程,受损细胞器或胞浆蛋白被包裹形成自噬体,然后与溶酶体结合进行降解,生成氨基酸及生物小分子,进入物质循环再利用。自噬可分为4个步骤:诱导启动、自噬体形成、转运融合、降解回收,在细胞生存、分化、发育和稳态中等方面都发挥着至关重要的作用[33]。自噬过度或不足都有不良影响。近年来自噬对脓毒症心肌病的影响日益受到关注,然而这种作用却存在的一定的争议性。一些研究认为增强自噬可以改善脓毒症引起的心功能障碍[16],另一些研究发现抑制自噬可能在脓毒症心肌病中发挥心脏保护作用[34]。如何靶向调控自噬启动以限制损伤扩散和抑制过度自噬将是后续研究关注的热点。
AMPK是真核生物能量稳态的中枢调节剂,直接和间接地参与了调控多种细胞过程[35]。mTOR 是AMPK的下游分子,AMPK可以通过抑制mTOR的磷酸化而参与多种病理生理过程,其中就包括自噬[36]。Takagi[37]和其他学者发现缺血性损伤可以通过AMPK/mTOR信号通路来上调自噬和清除损伤线粒体以保护心肌细胞。Liu等[38]发现,来自间充质干细胞衍生的外泌体通过激活AMPK/mTOR和Akt/mTOR信号通路来促进细胞自噬,从而对缺血再灌注的心肌起到保护作用。现有的研究已表明,AMPK/mTOR途径介导的自噬在多种疾病中的病理生理过程中发挥着重要作用。在我们的研究中,与LPS组相比,HTD4010的应用使LC3Ⅱ/Ⅰ、Beclin-1蛋白表达升高,p62蛋白表达降低,提示自噬水平的增强;此外,相较于LPS组,HTD4010的应用能上调p-AMPK蛋白表达,降低p-mTOR蛋白表达,提示AMPK/mTOR信号通路的激活。以上结果表明HTD4010可能通过AMPK/mTOR信号通路调节自噬对SCM产生保护作用。
综上所述,本研究结果表明HTD4010可以对SCM产生保护作用,减轻炎症反应,减少心肌细胞凋亡,改善心肌组织病理损伤,其作用机制可能与促进AMPK/mTOR信号通路调节自噬有关。但以上研究仅在动物模型中初步进行了探讨,缺乏体外实验进行验证,是否有其他信号传导途径参与其中也仍需进一步探索。本研究提示HTD4010可能作为SCM的潜在治疗药物,后续需要更深入广范的实验数据提供支持。
