RNA甲基化调控细胞衰老机制的研究进展
2024-04-13朱晨雨程文栎张文娟
朱晨雨,程文栎,张文娟
(暨南大学基础医学与公共卫生学院,广东广州 510632)
RNA甲基化是在甲基转移酶催化下,由S-腺苷甲硫氨酸提供甲基供体,在转录后阶段由甲基取代RNA 分子中氮原子和氧原子的过程[1]。RNA 甲基化动态可逆,影响RNA定位、剪接、翻译、稳定性、易位和衰变等多种生物学功能[2],进而参与调控疾病的发生和发展。
外源因素,如电离辐射、缺氧、化疗药物、氧化物和重金属等,可诱导机体发生氧化应激,进而使RNA 甲基化发生不同程度的改变,导致细胞衰老。细胞衰老可呈现细胞表型变化、代谢重编程、染色质重塑和(或)自噬调节等方面的改变;同时,衰老细胞分泌不同种类的炎症因子和趋化因子,这些复杂的因子组合称为衰老相关分泌表型(senescence-associated secretory phenotype,SASP)[3]。RNA 甲基化参与调控细胞衰老的关键分子事件,并直接影响细胞衰老进程。因此,本文对RNA甲基化调控细胞衰老的机制进行综述,以期为衰老的预防和干预提供新的理论依据和方向。
1 细胞衰老相关的RNA甲基化
RNA 甲基化是动态可逆的,受到甲基转移酶、去甲基化酶和阅读蛋白的联合调控,其中与细胞衰老密切相关的RNA甲基化主要有以下几种类型(图1)。
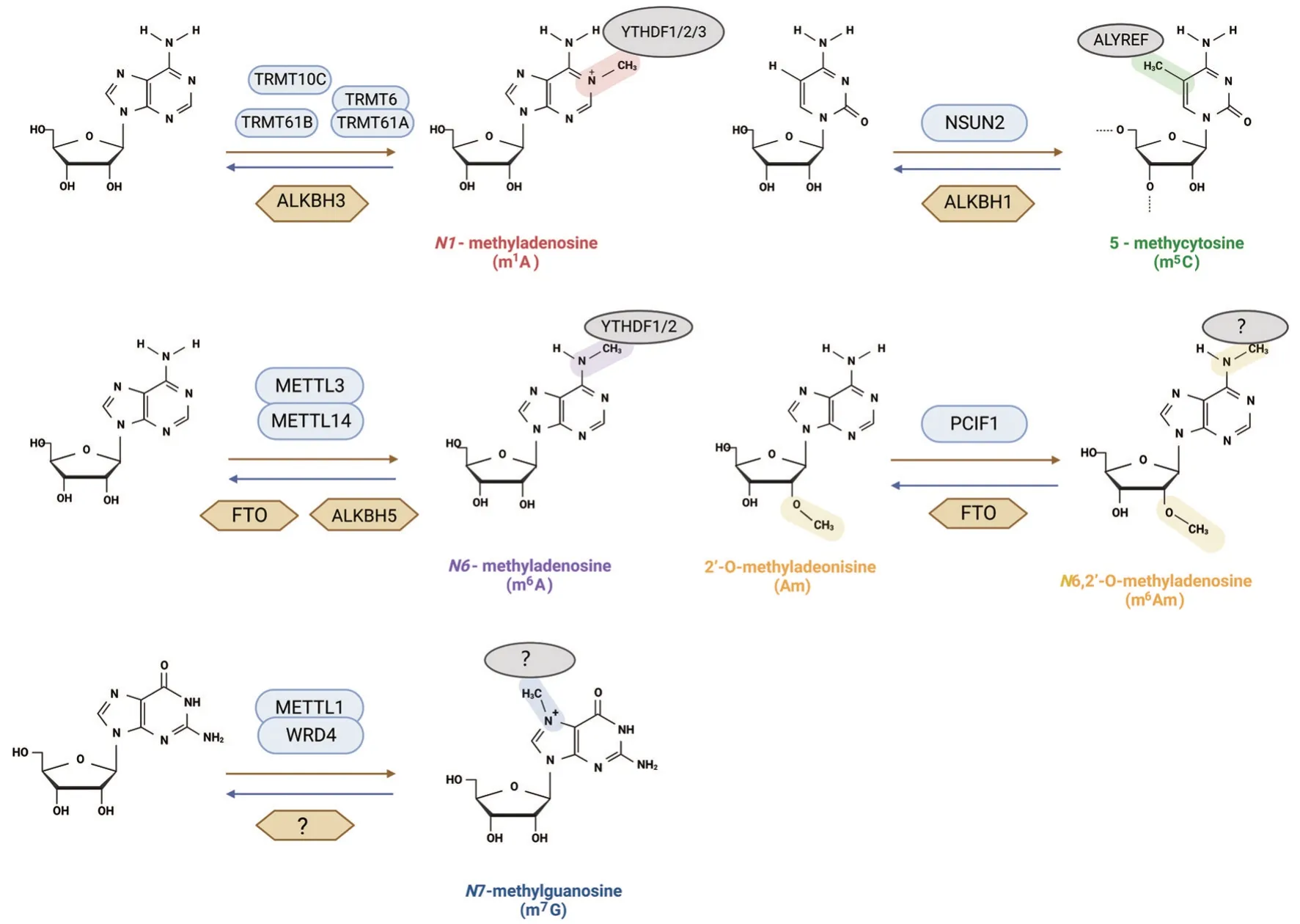
图1 RNA 甲基化修饰的常见类型及其调控机制. TRMT:tRNA 转移酶;ALKBH:ALKB 同源蛋白;YTHDF:YTH 结构域家族蛋白;NSUN2:NOP2/Sun 结构域家族成员2;ALYREF:Aly/REF 输出因子;METTL:甲基转移酶样蛋白;FTO:脂肪量和肥胖相关蛋白;PCIF1:磷酸化的CTD-相互作用因子1;WRD4:WD重复结构域4.
N1-甲基腺苷(N1-methyladenosine,m1A)修饰是指RNA 分子腺嘌呤第1 位氮原子位置添加甲基基团,可修饰mRNA,tRNA 和rRNA。在mRNA上主要分布于5′非编码区,并参与调节翻译起始过程[4]。m1A 甲基化在tRNA 上比mRNA 丰度更大,tRNA 甲基转移酶6(tRNA methyltransferase 6,TRMT6),TRMT10C,TRMT61A 和TRMT61B 发挥甲基化作用,去甲基化酶AlkB 同源蛋白3(AlkB homologue 3,ALKBH3)发挥去甲基化作用[5]。YTH结构域家族蛋白1(YTH domain family protein 1,YTHDF1)、YTHDF2 和YTHDF3 等,具有m1A 甲基化阅读蛋白的功能[6]。
5-甲基胞苷(5-methylcytidine,m5C)修饰是指RNA 分子胞嘧啶第5 位氮原子位置添加甲基基团,可修饰mRNA,tRNA 和rRNA。m5C 在应激反应、肿瘤发生和胚胎发育等生理病理反应中起重要作用[7]。甲基转移酶NOP2/Sun 结构域家族成员2(NOP2/Sun RNA methyltransferase family member 2,NSUN2)、去甲基化酶ALKBH1 和阅读蛋白Aly/REF输出因子[8],可联合调控m5C 甲基化动态可逆过程。
N6-甲基腺苷(N6-methyladenosine,m6A)修饰是指RNA 分子腺嘌呤第6 位氮原子位置添加甲基基团,可修饰mRNA,snRNA,rRNA 和tRNA。m6A 修饰参与昼夜节律、生长发育和退化等生理病理过程[9]。甲基转移酶样蛋白3(methyltransferase like 3,METTL3)和METTL14 是m6A 甲基化的核心甲基转移酶[10],而脂肪量和肥胖相关蛋白(fat mass and obesity associated protein,FTO)和ALKBH5 可作为m6A 去甲基化酶[11-12]。阅读蛋白YTHDF1 能够结合RNA 特定的m6A 甲基化位点参与调控mRNA 翻译,YTHDF2 能促进mRNA降解[13]。
N6,2′-O-甲基腺苷(N6,2′-O-methyladenosine,m6Am)发生于转录起始位点,与哺乳动物细胞中mRNA 的稳定性密切相关。在N7-甲基鸟苷(N7-methylguanosine,m7G)帽子结构形成后,转录起始核苷酸的2′-羟基由帽甲基转移酶1共转录甲基化,第2 个核苷酸的羟基由帽甲基转移酶2 共转录甲基化,当转录起始核苷为2′-O-腺嘌呤(2′-O-methyladeonisine,Am)时,在第6 位氮原子位置由磷酸化的CTD-相互作用因子1 作为甲基转移酶进一步甲基化形成m6Am[14]。FTO 作为去甲基化酶,将m6Am去甲基化为Am[15]。
m7G 即RNA 分子鸟嘌呤第7 位氮原子位置添加甲基基团,发生于mRNA 5′帽子结构,可修饰mRNA,tRNA,rRNA 和pri-miRNA。METTL1 和WD 重复结构域4 复合体介导的m7G tRNA 甲基化增强了mRNA 翻译,并与多种疾病的调控机制相关[16]。
2 RNA甲基化调控细胞衰老的机制
内外源因素均可诱导体内产生过量活性氧(reactive oxygen species,ROS),触发氧化应激反应,促进细胞衰老[17]。持续的炎症反应也可增加体内的氧化应激水平,从而促进衰老进程[18]。细胞自噬可抑制与衰老相关的炎症反应,自噬增加与延缓衰老密切相关[19]。此外,细胞周期阻滞也是细胞衰老的经典特征[20]。因此,氧化应激、炎症、自噬和细胞周期阻滞是细胞衰老的关键事件,并受到RNA甲基化调控,进而影响细胞衰老进程,RNA甲基化调控细胞衰老的机制和作用如表1所示。

表1 RNA甲基化在细胞衰老中的关键分子事件和调控作用
2.1 RNA甲基化调控衰老相关氧化应激
RNA 甲基化通过激活或抑制氧化应激相关信号通路,调控细胞衰老进程[21]。
src 同源性2 含结构域的转化蛋白C1(66-kilodalton isoform of shc gene products,p66Shc)是调控细胞氧化应激的关键蛋白[22]。在高糖环境的氧化应激作用下,上调p66Shc 表达水平会提高NSUN2表达增加m5C甲基化水平,激活p38 MAPK信号通路并增加细胞内ROS水平,使细胞出现早衰现象[23]。
P53 可在不同应激水平下影响线粒体功能,从而调控细胞内ROS 的水平[24]。NSUN2 通过调节miR-125b 水平从而提高P53的表达水平,进而促进氧化应激作用诱导的衰老进程[25]。过表达NSUN2和METTL3/METTL14 增加m5C 和m6A 甲基化水平,协同提高细胞周期蛋白依赖性激酶抑制因子1A(cyclin dependent kinase inhibitor 1A,p21)mRNA的翻译效率,显著增加p21 和衰老相关β-半乳糖苷酶的活性,促进氧化应激所致的细胞衰老[26]。
在敲除METTL3 小鼠的海马体中,氧化应激标志物4-羟基-2 反式壬烯醛显著增加[27],FTO 可减少m6A 甲基化修饰水平,并增加其靶基因过氧化物酶体增殖物激活受体γ 辅激活子1α mRNA 翻译效率,从而诱导氧化应激发生,增加ROS 水平[28],促进细胞衰老。
敲除PCIF1 引起m6Am 甲基化表达下降,显著降低超氧化物歧化酶1 mRNA 翻译效率,诱导人肾细胞对氧化应激敏感[14],使人肾细胞出现早衰。
2.2 RNA甲基化调节SASP和炎症
SASP 是细胞衰老微环境的重要组成成分,可增强自分泌细胞的自主功能并介导细胞旁分泌效应[29]。SASP 持续表达可诱发慢性炎症,导致衰老及相关疾病[30]。慢性炎症状态是衰老特征之一,即“炎性衰老”,与多种老年病密切相关。
敲低TRMT6/61A,可引起小鼠T细胞早期活化时,其tRNA 的m1A 甲基化水平下降,并降低MYC表达水平,从而降低细胞周期蛋白依赖性激酶2 和细胞周期蛋白E水平,进而减轻结肠炎症[31]。
过表达NSUN2 引起m5C 甲基化水平增加,增加靶基因细胞间黏附分子1(intercellular adhesion molecule-1,ICAM-1)mRNA 稳定性和表达水平,并促进血管内皮炎症进程[32]。高同型半胱氨酸血症的T 淋巴细胞中,NSUN2 介导m5C甲基化促进白细胞介素17A(interleukin-17A,IL-17A)表达,进而引起多种慢性炎症性疾病[33]。
SASP 对免疫监视和衰老细胞清除至关重要,而METTL3/METTL14 复合体也以m6A 非依赖性方式正向调节SASP 的表达水平,从而介导衰老细胞清除,延缓衰老进程[34]。脂多糖可上调METTL3,提高人巨噬细胞中m6A甲基化水平,阻止炎症细胞因子IL-6 和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)产生,并通过NF-κB 信号通路减轻脂多糖诱导的巨噬细胞炎症[35]。敲低METTL14 引起m6A甲基化水平下降,降低髓样分化因子88(myeloid differentiation factor 88,MyD88)和IL-6 表达水平,显著降低人巨噬细胞炎症反应[36]。ROS 水平升高负向调节YTHDF2 表达,并增加目标基因丝裂原激活蛋白激酶激酶4 mRNA 稳定性和蛋白表达,激活NF-κB 信号,并促进SASP 相关基因表达和过量分泌[37]。
RNA 甲基化可调节SASP 表达水平和作用特征,调控细胞衰老进程。m1A 与m5C 高甲基化水平和METTL14 高表达可促进炎症发生,从而导致细胞衰老;而METTL3 介导m6A 甲基化水平与炎症进程方向相反,其高甲基化水平可抑制炎症进程,并抑制细胞衰老发生。
2.3 RNA甲基化调控衰老相关自噬
自噬已成为许多物种的一个衰老特征,细胞衰老进程中自噬水平降低,而自噬水平降低亦进一步加速衰老,导致细胞早衰和器官功能障碍,并发展为多种衰老相关疾病[38]。
敲低ALKBH3 引起m1A 甲基化水平增加,降低磷酸化蛋白激酶AKT1 抗体底物1 水平,介导其磷酸化激活的哺乳动物雷帕霉素靶蛋白复合物1信号传导而促进自噬[39],抑制细胞衰老的发生。
过表达METTL3 引起m6A 甲基化水平增加,促进靶基因叉头框O3 蛋白(forkhead box O3,FOXO3)mRNA 翻译,进而阻断自噬相关蛋白基因表达抑制自噬[40]。敲低METTL14 和过表达ALKBH5 使m6A 甲基化水平下降,促进靶基因蛋白磷酸酶1A mRNA 翻译,降低靶基因钙/钙调素依赖的蛋白激酶激酶2 mRNA 稳定性抑制自噬[41]。FTO 表达引起m6A 甲基化水平下降,影响UNC-51样激酶1(UNC-51-like kinase 1,ULK1)丰度,促进自噬[42]。
敲低METTL1 引起m7G tRNA 甲基化水平下降,降低靶基因mTORC1调节相关蛋白mRNA 翻译,导致ULK1 异常磷酸化,使得人食管鳞状细胞癌细胞中自噬增加[43],从而抑制细胞衰老进程。
2.4 RNA甲基化调控衰老相关细胞周期
细胞周期调控细胞分化与增殖,影响细胞功能,与细胞衰老密切相关[44]。敲低ALKBH3 引起m1A 甲基化水平下降,降低还原型烟酰胺腺嘌呤二核苷酸磷酸氧化酶2 介导ROS 生成,使细胞周期在G1期阻滞[45]。
过表达NSUN2引起m5C mRNA甲基化水平增加,抑制CDKN1B 翻译,提高CDK1翻译水平,延迟复制性衰老发生[46]。敲低NSUN2使m5C 甲基化水平下降,抑制葡萄膜黑色素瘤细胞增殖,诱导细胞周期在G1期阻滞[47]。
敲低METTL3 引起m6A 甲基化水平下降,导致小鼠原代神经元中CCND1 和CCND2 水平异常升高[27]。敲低FTO 引起m6A 甲基化水平增加,增加CCND1mRNA 降解,诱导细胞周期阻滞于G1期[48];同时,敲低FTO还可下调CCNA2和CDK2水平,使细胞周期在G1/S期阻滞[49]。
过表达PCIF1引起m6Am甲基化水平增加,并显著增加CCND1 及CDK4 蛋白水平,诱导细胞周期在G2/M期阻滞[50]。
敲低METTL1 引起m7G tRNA 甲基化水平下降,导致富集在m7G tRNA密码子的细胞周期mRNA翻译抑制,使细胞周期在G2/M 期阻滞[16]。因此,RNA 甲基化可参与调控细胞周期进程,从而促进细胞衰老的发生发展。
3 外源因素与细胞衰老
细胞衰老是各种刺激诱发的复杂应激反应,除个人生理特征,如年龄和健康状况外,环境和遗传毒性应激,包括化疗药物依托泊苷、紫外线暴露、高糖浓度、外源环境致癌物和金属及其化合物均可诱导细胞代谢过度活跃,产生丰富的SASP 和炎症因子改变细胞微环境,加速细胞衰老。
百草枯可诱导小鼠神经母细胞瘤细胞Neuro-2a 产生过量ROS 诱导氧化应激,促进高甲基化和细胞衰老,从而进一步在神经元中诱导神经毒性作用和神经退行性疾病,如帕金森病等[51]。急性暴露于高葡萄糖水平的氧化应激,使得总m5C甲基化水平升高,引发人脐静脉内皮细胞衰老发生[23]。高亚砷酸盐暴露(250~1000 μg·L-1)可刺激人体角质形成细胞产生过量ROS 诱导氧化应激,使METTL14 和m6A 表达水平升高[52],表明在亚砷酸盐暴露下可能会诱导细胞衰老和毒性。长期慢性暴露于结晶二氧化硅,会增加矽肺小鼠整体m6A水平和炎症反应,肺泡巨噬细胞吞噬结晶二氧化硅导致细胞衰老和自噬,肺泡巨噬细胞积累会导致慢性炎症产生[53]。此外,慢性恒定光、氯化钴和麻醉剂七氟醚等外源因素可通过调控相关酶和氧化应激,使相关mRNA 甲基化水平发生改变和促进细胞衰老,导致神经退行性损害和细胞毒性作用[54]。
4 结语
在外源环境因素影响下,包括化疗药物、缺氧条件、紫外线暴露和金属及其化合物等,使机体的RNA 甲基化调控发生改变,从而调控细胞衰老的关键分子事件,包括氧化应激、SASP 和炎症因子、自噬和细胞周期事件,导致促进或抑制细胞衰老。细胞衰老是许多年龄相关疾患的病理基础,当衰老细胞不断累积,会使器官或组织发生异常变化,最终导致与年龄相关疾病发生,常见的疾病有神经退行性疾病、心脑血管疾病和癌症等。
目前对RNA 甲基化与细胞衰老的因果关联研究仍然有限,除m6A 甲基化研究较多外,其他m1A,m5C 和m7G 调控细胞衰老相关机制仍较局限,同时外源因素与RNA 甲基化之间的剂量-反应关系和规律,不同种RNA甲基化类型之间的相互作用等均需要深入探究,这将丰富衰老相关RNA表观遗传学理论,并推动细胞衰老与衰老相关疾患的研究新进展。RNA 甲基化调控机制与细胞衰老的关联,可为细胞衰老及年龄相关疾病的预防和精准干预提供新的线索。
