成纤维细胞激活在组织纤维化、自身免疫病和肿瘤中作用的研究进展
2024-04-13顾馨许宇佼孙家锐刘蕴瑶强磊
顾馨,许宇佼,孙家锐,刘蕴瑶,强磊
(中国药科大学基础医学与临床药学学院,江苏南京 210000)
成纤维细胞广泛分布于全身组织和器官基质中,是维持机体细胞外基质(extracellular matrix,ECM)稳态的核心细胞[1]。成纤维细胞分泌胶原蛋白、纤维蛋白等参与ECM 的合成,同时它还通过合成基质金属蛋白酶(matrix metalloproteinase,MMP),影响ECM分解,维持ECM稳态[2]。
大量单细胞组学研究表明,成纤维细胞具有异质性,不同发育阶段、组织来源的成纤维细胞存在基因表达、形态和功能差异[1,3-4]。在皮肤等富含上皮细胞的组织器官中,成纤维细胞及其分泌的胶原蛋白和层黏蛋白等形成具有弹性和黏性的组织结构,支撑上皮细胞抵抗外源损伤[5];在骨骼肌、心肌等组织器官中,成纤维细胞自身的机械收缩能力和其分泌的胶原蛋白、纤维连接蛋白等参与电信号和机械力的传导,帮助这类器官收缩和舒张[6-7]。在健康组织器官中,成纤维细胞呈相对静息状态。当组织器官损伤或者癌症发生时,成纤维细胞被炎症因子、生长因子等诱导激活。激活的成纤维细胞活跃在组织损伤处和癌细胞周围,发挥重构ECM、维持炎症反应等作用。鉴于成纤维细胞分布的广泛性及其功能的多样性,成纤维细胞激活被认为是组织纤维化[8]、肿瘤[9]和免疫调节[10]等病理过程的关键。因此,本文对成纤维细胞激活在组织纤维化、自身免疫病和肿瘤发生发展中发挥的作用及潜在的调控靶点进行综述。
1 成纤维细胞激活
组织器官发生损伤时,转化生长因子β(transforming growth factor-β,TGF-β)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)和白细胞介素17(interleukin-17,IL-17)等细胞因子通过TGF-β、丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)、Janus 激酶(janus kinase,JAK)/信号转导和转录活化因子(signal transducer and activator of transcription,STAT)等信号通路协同刺激成纤维细胞激活。激活的成纤维细胞主要通过以下方式参与损伤修复[11]:①大量增殖、迁移、分泌胶原蛋白和纤维蛋白等,参与组织重塑、基质再生;②分泌炎症因子、趋化因子和细胞间黏附因子等,募集免疫细胞、促进内皮细胞和上皮细胞等周围其他细胞增殖;③产生机械力,牵拉伤口收缩。但成纤维细胞过度激活可导致损伤处异常纤维化,形成纤维性瘢痕。纤维性瘢痕不仅影响机体美观,更影响组织器官的功能[12],损害患者的身心健康及生活质量。激活的成纤维细胞主要来源于基质成纤维细胞、骨髓成纤维细胞、脂肪细胞、内皮细胞、上皮细胞和血管周细胞等。成纤维细胞特异性蛋白1、血小板衍生生长因子受体α(platelet-derived growth factor receptor α,PDGFRα)、胶原蛋白、波形蛋白、纤连蛋白和胸腺细胞抗原1是常用的成纤维细胞标志物,成纤维细胞激活蛋白(fibroblast activation protein,FAP)、α 平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)、骨膜蛋白、细胞周期相关蛋白、胶原蛋白和鬼臼拉宁是成纤维细胞激活最常见的标志物[13],同时成纤维细胞激活后PDGFRα、胶原蛋白、波形蛋白和纤连蛋白等表达大幅上调,也可作为成纤维细胞激活的标志。但上述标志物在部分免疫细胞、上皮细胞以及血管周细胞上也有表达,一般使用≥2 种标志物标记成纤维细胞[14]。
2 成纤维细胞激活在纤维化中的作用
纤维化可发生于多种器官,主要病理改变表现为纤维化的结缔组织增多,实质细胞显著减少,导致器官结构破坏和功能减退乃至衰竭。成纤维细胞过度激活是组织纤维化的重要诱因。激活的成纤维细胞通过分泌细胞因子维持患处的炎症环境;也通过分泌大量的基质蛋白,使细胞外基质过度沉积,最终导致组织纤维化。
靶向成纤维细胞激活是诊断和治疗纤维化的关键。Rurik 等[15]研发出一种瞬时CAR-T 疗法,通过短暂抑制成纤维细胞激活减少器官组织纤维化。Long 等[16]制备出一种保留膜受体的自体皮肤成纤维细胞仿生纳米颗粒,通过靶向给药可有效阻断刺激因子对成纤维细胞的激活,阻止纤维化的发生,为治疗组织纤维化提供了新策略。多项研究证实,利用68Ga 标记的FAP 抑制剂进行正电子发射断层扫描成像(68Ga-FAPI PET)能够实现无创评估心肌、肺、肝纤维化疾病进展和治疗干预效果[17-19]。
2.1 心肌纤维化
心脏成纤维细胞主要由前心外膜器官和心瓣膜形成过程中上皮间质转化发育而来,特异性表达盘状结构域受体2(discoidindomain receptor 2,DDR2)[7]。心肌纤维化是心脏ECM 过度沉积和心肌结构紊乱、最终导致心功能不全和心力衰竭的心血管病变[20]。慢性高血压和缺血性损伤等心血管疾病均会诱发心肌纤维化[21]。多种心血管疾病诱发的心力衰竭会引起肾素-血管紧张素-醛固酮系统及交感神经系统代偿性激活以维持心脏正常功能[22]。但大量的血管紧张素Ⅱ导致成纤维细胞过度激活,最终诱发心室重构、心肌纤维化和心室扩张等病理改变[4,23]。
血管紧张素受体和醛固酮受体等的拮抗剂可延缓心肌纤维化并改善心功能[24]。例如,联用血管紧张素受体拮抗剂缬沙坦(valsartan)和脑啡肽抑制剂沙库巴曲(saubitril)可通过促进蛋白酶G 信号传导抑制成纤维细胞的激活,从而减轻心肌纤维化、改善心功能[25]。G 蛋白家族偶联受体激酶5(G-protein family-coupled receptor kinase 5,GRK5)是在心肌细胞中表达、维持心血管稳态的重要GRK家族蛋白。心力衰竭后,GRK5 表达异常上调[26]。Eguchi等[26]研究报道,小鼠心肌成纤维细胞特异性敲除GRK5 显著抑制了血管紧张素Ⅱ介导的成纤维细胞激活,减轻心力衰竭诱导的小鼠心肌肥厚和纤维化。
Hippo、TGF-β、c-Jun N 端激酶(c-Jun N-terminal Kinase,JNK)、MAPK 和STAT 等信号通路在心肌成纤维细胞激活过程中发挥重要作用。Hippo 信号通路通过抑制生长相关基因表达抑制心肌成纤维细胞激活,从而抑制心肌纤维化[27]。成纤维细胞特异性缺失Hippo信号通路下游关键分子Yes相关蛋白(Yes-associated protein,YAP)和PDZ 结合基序转录共激活因子(transcriptional co-activator with PDZ-binding motif,TAZ)可显著抑制心肌纤维化的发生发展[28]。癌蛋白SKI 通过下调TGF-β/Smad信号[29],激活Hippo 信号[30]抑制心肌成纤维细胞激活。含硫氧还蛋白域5 在纤维化的心肌中高表达,通过氧化还原敏感的JNK 信号通路促进ECM 蛋白折叠和心肌成纤维细胞激活,从而促进心肌纤维化[24]。Kumar等[31]研究表明,低氧诱导丝裂原因子上调IL-6 表达,激活MAPK 和STAT3 信号通路,促进心肌成纤维细胞的激活,最终加重心肌纤维化。上述研究为靶向心肌成纤维细胞激活治疗心肌纤维化提供新靶点。
2.2 肺纤维化
吸烟、长期粉尘吸入和病毒感染都能引发肺部损伤和炎症,连续急性损伤或长期慢性炎症刺激肺基质成纤维细胞激活和肺泡上皮细胞发生上皮间充质转化[32-33],激活的成纤维细胞合成大量ECM逐渐取代健康肺组织,肺泡失去其原本的结构和功能[34],气体交换困难,最终导致患者呼吸衰竭而死亡。成纤维细胞是肺纤维化过程中最关键的细胞之一,其丰度和激活状态都能作为评判肺纤维化程度的标志[35]。在纤维化的人和小鼠肺中均发现大量表达α-SMA 的激活的成纤维细胞[36]。神经丝束蛋白可作为肺成纤维细胞的标志物,有研究在患者纤维化的肺组织中分离出胶原三螺旋重复蛋白1阳性的肺成纤维细胞亚群,并发现该亚群细胞具有较强的迁移以及分泌胶原蛋白的能力,在肺纤维化进程中发挥重要作用[37]。
研究表明,β-半乳糖苷结合凝集素3[38]、热休克蛋白90[39]、赖氨酸特异性去甲基酶1[40]和血栓素-前列腺素受体[41]缺失或抑制,均能显著抑制TGF-β1诱导的肺成纤维细胞激活、增殖和肺泡上皮细胞的上皮间充质转化。接头蛋白p62通过促进转录因子核因子-E2 相关因子2 蛋白入核,抑制肺成纤维细胞激活,发挥抗肺纤维化作用[42]。在肺纤维化晚期,TGF-β 通过TAZ 转录增强相关结构域信号上调运铁蛋白受体(transferrin receptor,TFR)表达,增强细胞内不稳定的亚铁累积,促进成纤维细胞激活[43]。抑制TFR 的表达或使用铁死亡抑制剂或铁螯合剂均能减轻博来霉素(bleomycin)诱导的肺纤维化[43]。
尼达尼布(nintedanib)和吡非尼酮(pirfenidone)是美国FDA 目前批准用于治疗肺纤维化的药物[32,44],两者皆可减缓肺纤维化的发展速度[45-46]。尼达尼布是一种酪氨酸激酶抑制剂,通过抑制成纤维细胞生长因子受体、PDGFR 和血管内皮生长因子受体抑制成纤维细胞激活和ECM 沉积[32,35]。吡非尼酮通过介导TGF-β 信号通路,抑制成纤维细胞激活、增殖及胶原合成,从而延缓肺纤维化发展[44]。但两者均会导致严重的胃肠道反应、呼吸道反应、肝功能异常及皮肤的光敏性增加等不良反应[46]。因此,成纤维细胞激活在肺纤维化进程中具有重要作用。
2.3 肝纤维化
酒精性、胆汁淤积性、脂肪性肝病和慢性病毒性肝炎等都能诱发肝纤维化,不受控制的肝纤维化会发展为肝硬化,甚至演变为肝细胞癌[47]。肝纤维化过程中肌成纤维样细胞主要来源于肝星状细胞(hepatic stellate cell,HSC)、门静脉成纤维细胞、骨髓来源的成纤维细胞、上皮细胞和间皮细胞,其中HSC 是最关键的一类细胞[48]。HSC 是存在于肝和胰中的一类独特的成纤维细胞[49],呈梭形,是肝ECM 的主要来源[50]。静息状态下,HSC 储存维生素A脂滴。肝发生损伤时,肝内巨噬细胞、内皮细胞等细胞通过旁分泌的方式诱导HSC 激活,HSC 通过旁分泌和自分泌2 种途径维持自身活化状态。HSC 激活后,α-SMA、Ⅰ型胶原蛋白alpha 1 链(collagen typeⅠalpha 1 chain,COL1A1)、COL1A2和IL-6 等标志物表达上调[50-51],HSC 大量增殖、迁移到肝损伤处,合成并重构ECM,参与肝损伤修复和纤维性瘢痕的形成[51]。
HSC 失活能阻止小鼠肝纤维化进程[52],主要通过细胞凋亡和恢复静息状态2 种途径实现。GATA结合蛋白(GATA binding protein,GATA)和干扰素调节因子(interferon regulatory factor,IRF)是调控HSC 激活和失活的关键转录因子[50]。小鼠HSC 特异性缺失GATA4 使内皮PAS 结构域蛋白1(endothelial PAS domain protein 1,EPAS1)和低氧诱导因子2α(hypoxia inducible facto-2α,HIF-2α)表达上调,诱导肝纤维化,而在GATA4缺失的HSC重新过表达GATA4 能够促使肝纤维化消退[53]。此外,Tong 等[54]研究表明,在HSC 中过表达的成纤维细胞生长因子18(fibroblast growth factor18,FGF18)通过平滑受体/大肿瘤抑制激酶1/YAP 轴抑制HSC激活,减轻四氯化碳诱导的肝纤维化。上述研究为靶向诱导HSC失活、抑制和逆转肝纤维化的药物设计提供新的研究思路和新的潜在靶点。
3 成纤维细胞激活在自身免疫病中的作用
自身免疫病是免疫系统紊乱导致的免疫系统对自身抗原错误攻击的一类疾病[55]。研究表明,成纤维细胞参与调控自身免疫病的发生发展[56]。
成纤维细胞是治疗自身免疫病的潜在靶点。抗肺纤维化药物尼达尼布通过抑制成纤维细胞的激活在系统性硬化症(systemic sclerosis,SSc)中发挥抗纤维化作用[57-58]。Dorst 等[59]发现,靶向FAP 的光动力学疗法能显著延缓SSc 引发的皮肤纤维化。
3.1 系统性硬化症
SSc 是一种以炎症、血管病变和慢性纤维化[60]为特征的自身免疫病。成纤维细胞长期过度激活诱发的组织器官慢性纤维化是SSc 的难治性和高死亡率的主要原因[61-62]。因此,靶向成纤维细胞激活是延缓SSc 患者组织器官纤维化,进而提高患者生活质量以及延长患者生存时间的关键。
成纤维细胞激活是SSc 诱发组织纤维化的关键驱动因素[63]。SSc 早期,在炎症反应产生的促纤维化环境中,不同来源的生长因子、炎症因子和血管收缩因子等不断刺激成纤维细胞激活。Ⅰ型干扰素是参与SSc 发生发展的核心因子,IRF 家族通过Toll 样受体(toll-like receptor,TLR)途径参与干扰素途径的成纤维细胞激活[64]。SSc 患者真皮成纤维细胞TLR4 表达显著上调,TLR4 诱导IRF5 表达上调[65]。IRF5 被报道能够使得成纤维细胞对TGF-β 的敏感性上调,最终导致成纤维细胞中胶原生成相关基因COL1A1、COL1A2 以及结缔组织生长因子表达上调[65]。TLR9 也在SSc 患者皮肤中表达上调并促进TGF-β 信号诱导的成纤维细胞激活[62]。IRF7 在SSc 患者成纤维细胞中高表达,其能与Smad3 相互作用,上调TGF-β 介导的成纤维细胞激活,最终导致组织纤维化[66]。此外,有研究表明,SSc 患者皮肤成纤维细胞中线粒体转录因子A表达下调,线粒体损伤加剧,从而促进成纤维细胞激活,最终加重皮肤纤维化[67]。Dees 等[68]报道,在SSc 患者皮肤成纤维细胞中TGF-β 诱导细胞因子信号抑制因子3(suppressor of cytokine signaling 3,SOCS3)表达下调,低表达的SOCS3 刺激STAT3持续激活,从而促进成纤维细胞激活,使皮肤发生恶性纤维化。
3.2 类风湿性关节炎(rheumatoid arthritis,RA)
RA 是一种慢性、全身性自身免疫病[69],临床上主要表现为关节损伤,部分患者心血管及肺部出现炎性损伤[70]。目前,临床上主要应用IL-6 和TNF-α等炎症因子拮抗剂减少炎症和关节破坏,但疗效有限[71]。近年研究表明,成纤维细胞样滑膜细胞(fibroblast-like synovicytes,FLS)在RA 进程中发挥维持炎症和破坏关节的作用[72]。FLS 是介导RA发生发展的一类关键的成纤维细胞[73]。FLS 除表达胶原蛋白、波形蛋白等成纤维细胞共有的标志物,还特异性表达尿苷二磷酸葡萄糖脱氢酶、血管细胞黏附分子1 和钙黏蛋白11 等[71]。FLS 周围的细胞分泌TGF-β 和TNF-α 等生长因子和炎症因子刺激FLS 活化。例如,B 细胞通过TNF-α 介导的细胞外调节蛋白激酶1/2 和JAK/STAT1 途径诱导FLS 激活,促进RA 发生发展[74]。此外,关节中的基质、微粒和炎症因子也影响FLS 激活[75]。FLS 激活后大量增殖,对凋亡信号敏感度大幅降低,分泌IL-6、TNF-α、趋化因子配体2(chemokine C-C motif ligand 2,CCL2)和CXC 趋化因子配体10(chemokine C-X-C motif ligand 10,CXCL10)等[76]细胞因子募集单核细胞至关节处,维持关节处的炎症环境和FLS 自身的激活状态[77]。同时,FLS 还分泌MMP 促进关节处基质重构和软骨侵袭,破坏关节的正常生理结构和功能[72]。研究表明,FLS 表达多种TLR,关节处免疫反应产生的各种降解产物可与其结合,诱导FLS 激活并合成促炎因子、组织蛋白酶和破骨分化因子[75]。肌腱蛋白C(tenascin C,TNC)是一种主要存在于发育中或恶性组织中的糖蛋白[78]。TNC 在正常和其他炎症组织中表达量较少,但在RA 患者血清、软骨、滑膜和滑液中表达水平显著上调[79-81]。TNC 可刺激TLR4 的从头合成,并诱导FLS合成、分泌促炎因子和胶原蛋白[79-80]。
另外,FLS 异常的能量代谢也参与RA 的发生发展。激活的FLS 中葡萄糖代谢显著增加,抑制其糖酵解途径则可抑制促炎因子的表达、减弱FLS 的增殖、迁移和侵袭的能力[82-83]。当葡萄糖缺失时,谷氨酰胺可作为碳源为FLS 提供能量[84]。利用谷氨酰胺酶抑制剂影响谷氨酰胺的代谢也能抑制FLS 的增殖、迁移和侵袭,从而延缓RA 的发生发展[84]。由于糖酵解是全身细胞能量代谢的重要途径,非特异性抑制糖酵解途径必然导致极强的副作用。因此,寻找能够特异性抑制FLS 糖酵解的靶点尤其重要。研究表明,与骨关节炎FLS 相比,己糖激酶2(hexokinase 2,HK2)在RA 相关的FLS 中显著上调[83,85]。下调HK2的表达能够显著抑制RA 导致的FLS 异常糖酵解,从而抑制FLS 的异常激活、增殖和迁移[86]。因此,HK2 有望成为治疗RA 更低毒有效的新靶点。
4 成纤维细胞激活在肿瘤中的作用
肿瘤微环境(tumor microenvironment,TME)由以成纤维细胞为主的间质细胞、免疫细胞、血管形成相关细胞和细胞外基质组成[13]。TME 高度参与肿瘤的生长、侵袭转移、免疫逃逸、耐药以及预后不良[87-88]。由于肿瘤间质的生成与伤口愈合过程类似,均伴有血管新生、ECM 重构、细胞间附着改变,所以肿瘤被认为是“永不愈合的伤口”[89-90]。成纤维细胞在伤口愈合过程中发挥了重要作用[8],因此,其也是TME研究中的重点。肿瘤基质中激活的成纤维细胞被称为肿瘤相关成纤维细胞(cancerassociated fibroblast,CAF),是TME 中最丰富、最关键的细胞类型[91]。
CAF 主要来源于基质成纤维细胞、骨髓源性成纤维细胞[89]、肿瘤上皮和内皮细胞以及脂肪细胞[92]。肿瘤内部的低氧微环境、氧化应激以及肿瘤细胞和周围基质细胞分泌的TGF-β 和IL-6 等细胞因子均能驱动并维持成纤维细胞激活[93]。CAF 通过分泌TGF-β 和CXCL12 等细胞因子激活JAK/STAT,TGF-β 和Wnt 等信号通路[94],促进上皮细胞的增殖和恶性转化[93]以及肿瘤细胞的增殖、侵袭、迁移、血管生成[95-96]和耐药[97-98]。CAF 分泌的IL-32 通过与整合素亚基β3 结合激活乳腺癌细胞p38-MAPK信号通路,促进乳腺癌细胞侵袭转移[99]。FAP高表达已经被证明是肺癌、肝细胞癌和结肠癌预后不良的特异性标记物[100]。68Ga-FAPI PET,在鼻咽癌[101]、淋巴癌[102]、乳腺癌[103]和胆道癌[104]的分型和分期中均显示出良好的效果。
除影响肿瘤细胞本身,CAF还可通过影响TME调控肿瘤的发生发展。CAF 分泌TGF-β,IL-6,CXCL12 和血管内皮生长因子等细胞因子,抑制免疫细胞对癌细胞的效应[97]。CAF 分泌的CXCL12促进肿瘤相关巨噬细胞分泌纤溶酶原激活物抑制物1,促进肿瘤相关巨噬细胞向M2 型极化,最终导致肝细胞癌进一步恶化[105]。高表达FAP的CAF通过分泌大量TGF-β 抑制CD8+T 细胞内BCL-2 的表达,促进CD8+T 细胞凋亡,从而抑制其对肿瘤细胞的杀伤效应。
circFARP1 通过窖蛋白和miR-660-3p 两条途径促进白血病抑制因子(leukemia inhibitory factor,LIF)表达,并通过LIF/STAT3 信号轴介导胰腺癌吉西他滨(Gemcitabine)耐药[106]。CAF 抑制CAR-T细胞抗肿瘤活性并促进多发性骨髓瘤的进展[107]。作为ECM 的主要来源,CAF 分泌的胶原蛋白、纤维连接蛋白和层黏蛋白可帮助肿瘤细胞免疫逃逸[97],并抵抗抗肿瘤药物对肿瘤细胞的杀伤作用。靶向抑制CAF 的分泌物Wnt 家族成员2(Wnt family member 2,WNT2)可以作为免疫检查点抑制剂的辅助治疗方式,加强免疫检查点抑制剂在食管鳞状细胞癌和结直肠癌中的疗效[108]。此外,多项研究表明,检测CAF 相关标志物可预测免疫检查点抑制疗法治疗头颈部癌[109]和胰腺癌[110]等癌症的临床反应。研究报道,吡非尼酮通过抑制胰腺成纤维细胞激活、增殖和迁移发挥抗纤维增生及抗胰腺癌作用[111]。目前,吡非尼酮和其他抗癌药物联用治疗非小细胞肺癌的方案已进入Ⅰ期临床试验[112]。
综上所述,CAF 成为近年来肿瘤研究的新热点。虽然多数研究表明激活的成纤维细胞具有促进肿瘤发展的作用,但也有研究表明在肿瘤发生初期,CAF 表达下调会导致肿瘤快速增殖甚至加速患者死亡,提示肿瘤抑制性成纤维细胞群的存在[113-114]。因此,在肿瘤治疗中盲目抑制CAF 的激活可能造成严重后果。CAF 抑制剂在肿瘤发展中、晚期与其他抗肿瘤药物或治疗手段联用或许能发挥更好的抗肿瘤效果。
5 结语
激活的成纤维细胞在机体内广泛分布及其分泌大量蛋白和细胞因子,使得其在各类疾病中均发挥重要作用。成纤维细胞激活在组织纤维化、自身免疫病以及肿瘤中发挥的作用,近期研究发现的调控成纤维细胞激活的靶点,为这些疾病的诊疗提供新思路(图1)。但由于成纤维细胞特异性标志物难以确定及过去对成纤维细胞重要性的忽视,直到近20 年才有大量研究投入,目前针对这些靶点的研究大部分还停留在非临床阶段,只有极小部分的药物和诊疗手段投入到临床试验和应用中。
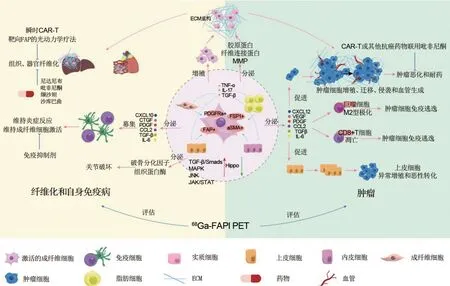
图1 成纤维细胞激活在组织纤维化、自身免疫病和肿瘤中的应用. ECM:细胞外基质;MMP:基质金属蛋白酶;TNF-α:肿瘤坏死因子α;IL:白细胞介素;TGF-β:转化生长因子β;PDGF:血小板衍生生长因子受体;FAP:成纤维细胞激活蛋白;FSP1:成纤维细胞特异性蛋白;α-SMA:平滑肌肌动蛋白α;CXCL:CXC 趋化因子配体;CTGF:结缔组织生长因子;CCL:趋化因子;VEGF:血管内皮生长因子;MAPK:丝裂原活化蛋白激酶;JNK:c-Jun 氨基末端激酶;JAK:Janus 激酶;STAT:信号转导和转录活化因子;68Ga-FAPI PET:68Ga标记的FAP抑制剂进行正电子发射断层扫描成像.
近年研究发现,以激活的成纤维细胞为靶点是针对多类疾病非常有潜力的诊疗手段。在多项非临床研究中,基于FAP 的放射性核素成像技术用于无创检测器官纤维化和肿瘤发展程度均显示出较好的效果。抑制成纤维细胞激活的药物尼达尼布和吡非尼酮在抗纤维化、抗肿瘤和抗自身免疫病中均显示出较好的疗效,但由于其不良反应较多,使它们在临床上的应用受到限制。因此,亟需深入探寻针对成纤维细胞激活治疗各类疾病更低毒、有效的靶点。
目前调控成纤维细胞激活的主要策略包括抑制成纤维细胞激活、耗竭已经激活的成纤维细胞、逆转成纤维细胞的激活及阻断激活成纤维细胞的功能。由于调控成纤维细胞激活信号通路的多样性、成纤维细胞分布的广泛性及其调控机体稳态的重要性,盲目地调控成纤维细胞激活会诱发严重的不良反应。成纤维细胞的异质性是研究成纤维细胞以及成纤维细胞激活的巨大阻碍,但同时也是实现靶向性诊疗的关键。但目前针对成纤维细胞激活的研究大多未考虑其异质性。随着单细胞测序等生物信息学手段的不断发展对成纤维细胞异质性的认识逐渐深入。近年来,在癌症和纤维化患者的病灶中中发现了与ECM 重构相关的成纤维细胞、炎症相关成纤维细胞和与免疫调节相关的抗原呈递成纤维细胞[92,112,115];在RA 发展进程中,Croft等[116]发现分别参与骨破坏和炎症的2 类成纤维细胞亚群。上述研究表明,不同亚群的成纤维细胞在疾病发展过程中发挥不同的功能,研究成纤维细胞激活对疾病的影响时应当考虑其异质性。目前针对成纤维细胞异质性的研究大多局限于单一疾病或组织,对于不同疾病或组织间成纤维细胞异质性的对比研究匮乏。而组织慢性纤维化最终可能诱发恶性癌变,因此针对纤维化和癌症中成纤维细胞异质性的对比研究可能能够揭示成纤维细胞在疾病恶性转化过程中的时空变化及其在此过程中发挥的作用,对于预防以及阻止纤维化疾病的恶性转化具有重要意义。因此,深入研究成纤维细胞的异质性、结合成纤维细胞异质性探寻特异性调控成纤维细胞激活的靶点是纤维化疾病、自身免疫病和肿瘤诊断及治疗的关键。
希望随着研究的不断深入,更多针对成纤维细胞激活的研究能在临床上实现应用,为组织纤维化、自身免疫病和肿瘤等疾病的早期诊断以及后续治疗带来新突破。
