eEF1A1调控水疱性口炎病毒和单纯疱疹病毒复制的初步研究
2024-04-13陈美桦徐含翠王林旭罗洪齐琦王勃段小涛
陈美桦,徐含翠,王林旭,罗洪,齐琦,王勃,段小涛
(1.南京中医药大学,江苏南京 210023;2.军事科学院军事医学研究院毒物药物研究所,国家安全特需药品全国重点实验室,北京 100850)
水疱性口炎病毒(vesicular stomatitis virus,VSV)是弹状病毒科水疱病毒属,是一种负链RNA病毒。VSV 具有广泛的宿主范围,能够感染猪、马和人类等各类哺乳动物,其症状表现为舌、唇和乳头等部位出现水疱和溃烂,头疼和发热等症状[1-3]。由于VSV 结构简单,且复制快,已被广泛用于研究RNA病毒转录和复制[4]。
单纯疱疹病毒Ⅰ型(herpes simplex virus 1,HSV-1)属于疱疹病毒亚科,是一种DNA 病毒[5]。人类是HSV-1 天然宿主,病毒经呼吸道、口腔、生殖器粘膜以及破损皮肤等途径侵入机体,引起口唇疱疹、角膜炎、脑炎和生殖器感染等疾病[6]。有研究报道,HSV-1可增加人类免疫缺陷病毒感染的风险[7],其复制快,致病性高,可使宿主终身感染[8]。
真核翻译延伸因子1A1(eukaryotic translation elongation factor1A,eEF1A1)属于GTP 结合蛋白,在mRNA 翻译时促进多肽链延伸[9]。eEF1A1具有多种功能,包括蛋白质翻译[10]、细胞生长[11-12]、肿瘤增殖[13]和病毒复制等[14-16]。eEF1A1参与多种蛋白的合成和翻译,而大多数病毒的复制都需要宿主蛋白的参与,因此提示eEF1A1 是病毒复制的一个重要因素。但目前关于eEF1A1影响病毒复制的研究大多都停留在eEF1A1 与RNA 病毒相互作用,如eEF1A1 可以与人类免疫缺陷病毒Ⅰ型的逆转录酶或乙型肝炎病毒X 蛋白相互作用[15-16];eEF1A1 对不同种类病毒基因组复制的影响尚未明确报道。
因此,本研究用VSV 与HSV-1 分别建立RNA与DNA 病毒感染体系,探究eEF1A1 对不同种类病毒复制的影响,以确定一个广谱抗病毒新靶点;用双链RNA 类似物聚胞苷酸〔polyinosinic-polycytidylic acid,poly(I:C)〕或脱氧核糖核酸钠盐(herringtestis DNA,HT-DNA)去探究eEF1A1 是否参与天然免疫,尝试从宿主角度出发探究eEF1A1 对病毒复制的影响。
1 材料与方法
1.1 细胞、病毒、试剂和仪器
人皮肤成纤维细胞株BJ-5ta 购自美国模式培养物集存库。VSV和HSV-1由本实验室于-80 ℃保存。poly(I:C)与HT-DNA,美国Sigma公司。
DMEM 培养基,德国Sigma 公司;胎牛血清、胰酶和磷酸盐缓冲液,北京中科迈晨;LipofectamineiMAX转染试剂,美国Invitrogen公司;苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)、蛋白酶抑制剂和磷酸酶抑制剂,美国Selleck公司;Bradford蛋白定量试剂盒和ECL显影液,美国Thermo公司;辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗鼠IgG 抗体(批号:AS003)和HRP 标记山羊抗兔IgG 抗体(批号:AS014),武汉爱博泰克生物科技有限公司;eEF1A1抗体(批号:sc21758),美国SantaCruz;VSV 糖蛋白(VSV-G)抗体(批号:Ab50549)、HSV 糖蛋白B(HSV-gB)抗体(批号:Ab6506)、干扰素调节因子3(Interferon regulatory factor 3,IRF3)抗体(批号:Ab68481)和p-IRF3 抗体(批号:Ab76393),英国Abcam 公司;TANK 结合激酶1(TANK binding kinase 1,TBK1)抗体(批号:3504S)和p-TBK1 抗体(批号:5483S),美国CST公司;PVDF 转印膜,美国Millipore 公司;RNA 提取试剂盒(批号:DP419),天根生化科技(北京)有限公司;逆转录试剂盒(批号:RR035A-1),日本TaKaRa 公司。siRNA 核酸序列,广州锐博生物科技有限公司。
CFX96 实时荧光定量PCR 仪,美国Bio Rad 公司;Synergy H1 多功能酶标仪,美国Bio Tek 公司;JY300HE电泳仪,北京君意东方电泳设备有限公司;2720 梯度PCR 仪、1384 生物安全柜、Heracell VIOS 160i CO2 细胞培养箱、NanoDrop One 分光光度计,美国Thermo 公司;TS2-FL 倒置荧光显微镜,德国Nikon 公司;KLCZ-1220A 超净工作台,北京亚泰科隆仪器技术有限公司。
1.2 细胞传代和培养
将BJ-5ta 细胞用DMEM 完全培养基(含10%胎牛血清和1%青/链霉素)培养于37 ℃,5%CO2饱和湿度培养箱中。细胞密度至80%,按1∶3传代。
1.3 小干扰RNA(small interfering RNA,siRNA)的转染
将对数生长期BJ-5ta细胞以7×107L-1接种于24孔板,待细胞融合率达35%,转染siRNA。siRNA 核酸序列见表1。A 液:Lipofectamine-iMAX 1 μL 与opti-MEM 25 μL 混合,静置5 min;B 液:siRNA(20 μmol·L-1)0.6 μL 与opti-MEM 25 μL 混合,静置5 min;将A 液和B 液轻轻混匀,室温静置15 min。均匀滴加至每孔培养基中,培养6 h 后更换新完全培养基,继续培养48 h后,进行后续实验。
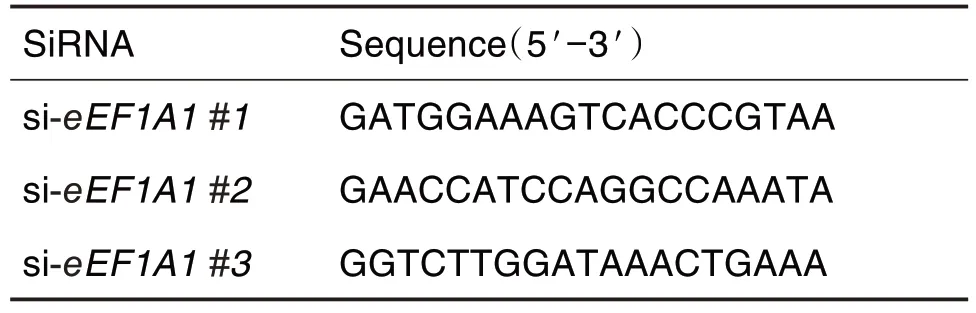
Tab.1 Sequences of small interfering RNA(siRNA)
1.4 病毒感染
将VSV 或HSV-1 病毒以感染复数(multiplicity of infection,MOI)为0.1 或1.0,加入至1.3 制备的细胞,培养2 h 后,更换新的含2%血清的培养基,放置37 ℃,5%CO2饱和湿度培养箱中培养。VSV 和HSV-1病毒均在Ⅱ级生物安全柜中使用。
1.5 核酸类似物poly(l∶C)或HT-DNA转染
取1.3 制备的细胞,然后转染poly(I:C)或HT-DNA。转染前1 h 更换DMEM 完全培养基,A液:Lipofectamine-iMAX 1 μL与opti-MEM 25 μL混合,静置5 min;B 液:poly(I:C)或HT-DNA(1 mg·mL-1)0.25 μL分别和opti-MEM 25 μL混合,静置5 min;将A 液和B 液轻轻混匀,室温静置15 min。均匀滴加至每孔培养基中,继续培养3 h和6 h 后收集细胞样品,提取RNA和蛋白检测相关分子的表达。
1.6 实时荧光定量PCR
按照RNA 提取试剂说明书提取细胞总RNA,将其逆转录为cDNA(反应条件:37 ℃15 min,85 ℃10 s),以cDNA为模板进行PCR扩增(反应条件:95 ℃10 min,95 ℃10 s,60 ℃30 s,共45个循环),数值均以GAPDH 为内参进行标准化,用2-ΔΔCt法计算目标基因mRNA 的相对表达水平,每组设置3复孔;相关引物序列见表2。
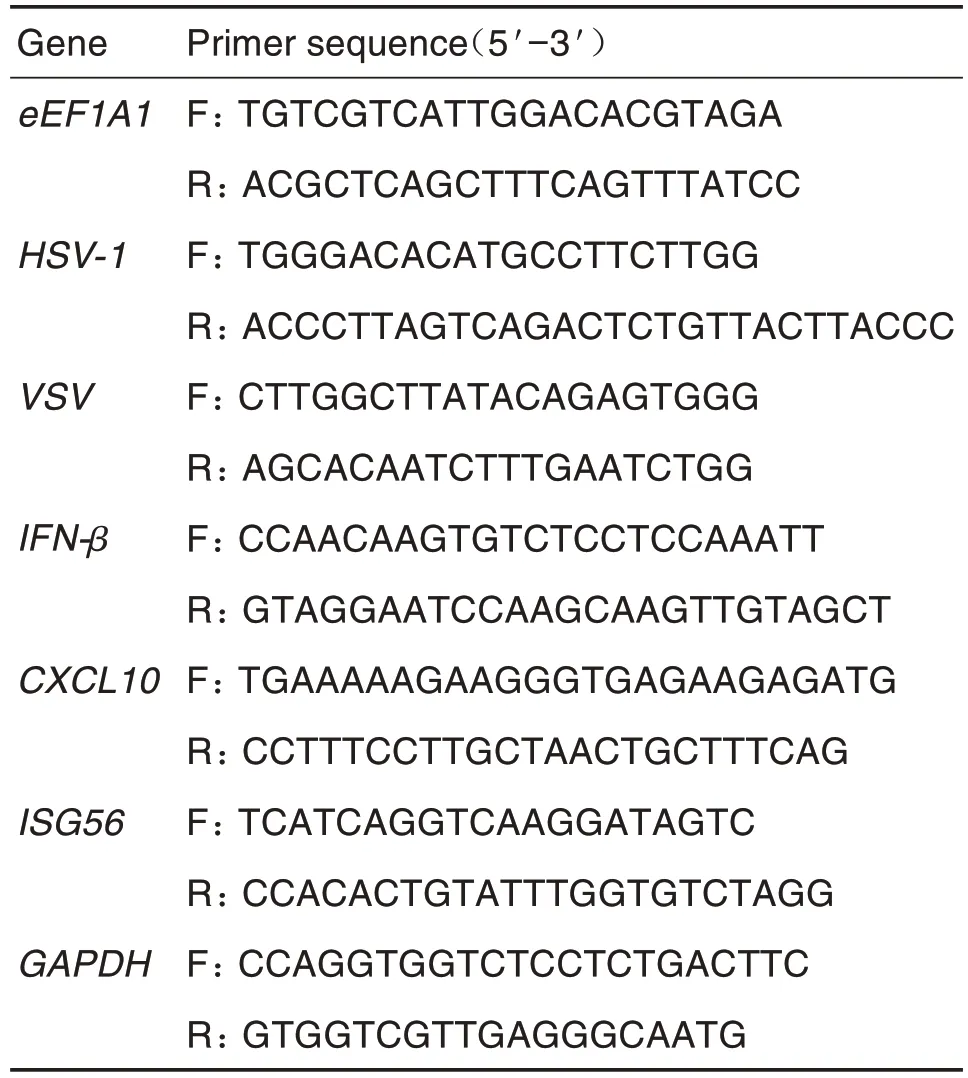
Tab.2 Primer sequence for RT-qPCR
1.7 Western印迹法
PBS 洗细胞,加入RIPA 裂解液(含蛋白酶和磷酸酶抑制剂)冰上静置5 min,BCA 法定量蛋白,取15 μg 蛋白样品经SDS-PAGE 电泳分离蛋白,蛋白湿转至PVDF 膜上,5%脱脂牛奶封闭1 h,一抗〔抗VSV-G,HSV-gB,p-IRF3,p-TBK1,IRF3 和TBK1(均1∶2500),GAPDH(1∶10 000)〕4 ℃孵育过夜,TBST 洗膜3 次,加入HRP 标记的山羊抗鼠或山羊抗兔lgG 抗体(1:5000)室温孵育1 h,TBST 洗膜3次,增强化学发光法(ECL)显影,暗室中曝光胶片。通过Image J软件对蛋白条带的积分吸光度进行分析,以目的蛋白与内参蛋白积分吸光度值的比值表示目标蛋白表达水平。
1.8 统计学分析
实验结果数据用±s表示,用Graphpad prism 8.3.0 软件进行统计分析。多组间采用单因素方差分析,两组间比较采用t检验。P<0.05 为差异具有统计学意义。
2 结果
2.1 敲低eEF1A1效果验证
图1 显示,与阴性对照组相比,eEF1A1基因沉默组eEF1A1 的mRNA 和蛋白水平显著降低(P<0.01),表明eEF1A1基因沉默的细胞模型构建成功。
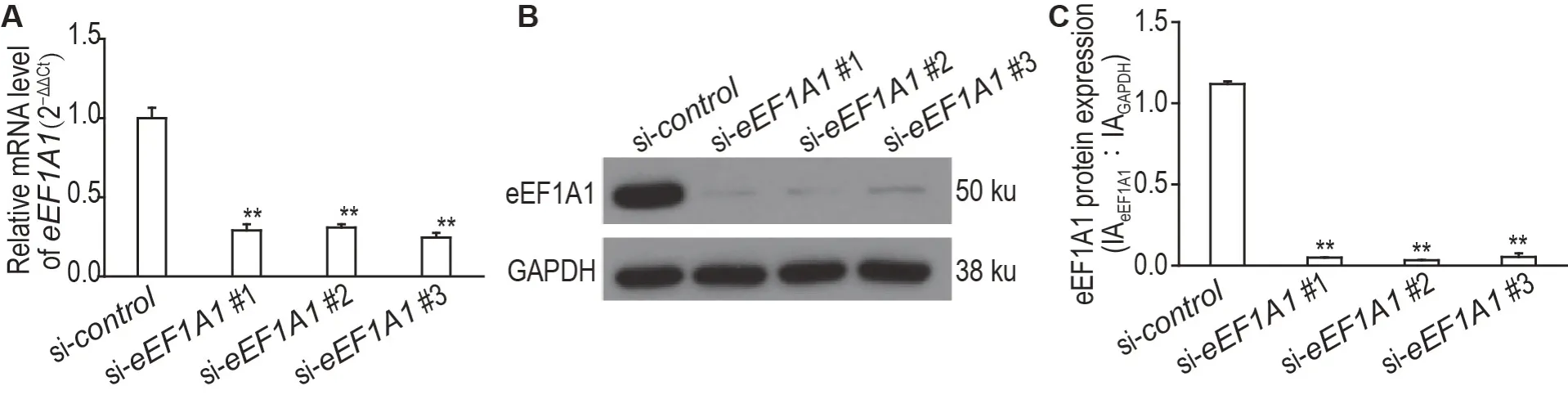
Fig.1 Efficiency verification of knocking down of eEF1A1. BJ-5ta cells were transfected with siRNA for 48 h. A:the mRNA level of eEF1A1 was detected by RT-qPCR. B:the protein level of eEF1A1 was detected by Western blotting. C was the semi-quantitative result of B.IA:integrated absorbance.±s,n=3.**P<0.01,compared with si-control group.
2.2 敲低eEF1A1抑制VSV复制
图2 显示,与阴性对照组相比,eEF1A1基因沉默组的VSV 基因拷贝数下降70%~80%(P<0.01);VSV蛋白表达显著降低(P<0.01)。
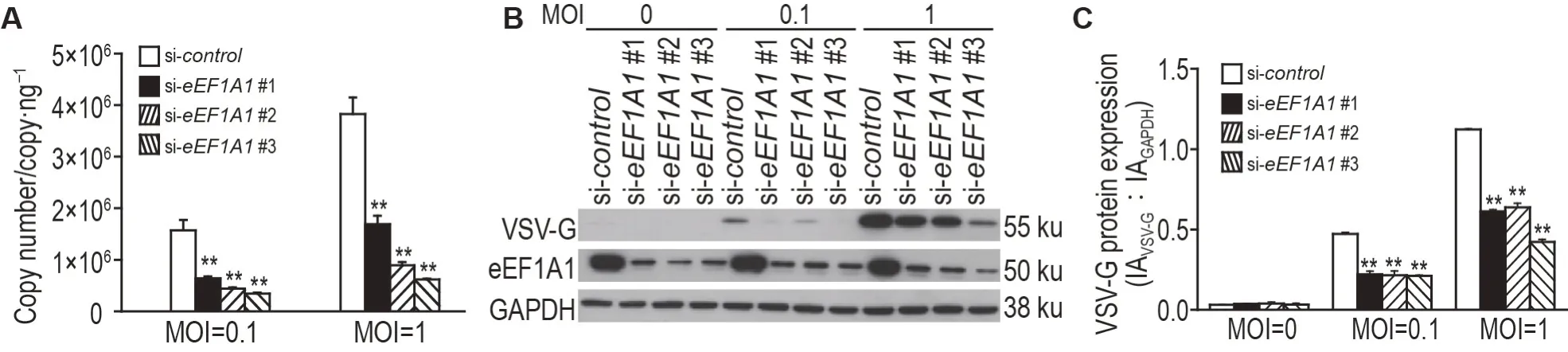
Fig.2 Knockdown of eEF1A1 inhibits vesicular stomatitis virus(VSV)replication.BJ-5ta cells were transfected with siRNA for 48 h and then stimulated with VSV for 12 h. A:the genome copy number of VSV was detected by RT-qPCR.B:the protein level of VSV was detected by Western blotting. C was the semi-quantitativeresultof B. x±s,n=3.**P<0.01,comparedwith si-control group.
2.3 敲低eEF1A1抑制HSV-1复制
图3显示,与阴性对照组相比,eEF1A1基因沉默组HSV-1 的mRNA 水平下降50%~60%(P<0.01);HSV-1蛋白水平显著降低(P<0.01)。
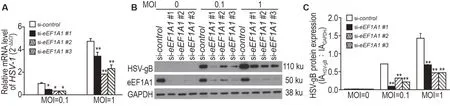
Fig.3 Knockdown of eEF1A1 inhibits herpes simplex virus 1 (HSV-1)replication. BJ-5ta cells were transfected with siRNA for 48 h and then stimulated with HSV-1 for 12 h. A:the mRNA level of HSV-1 was detected by RT-qPCR. B:the protein level of HSV-1 was detected by Western blotting.C was the semi-quantitative result of B. x±s,n=3. *P<0.05,**P<0.01,compared with si-control group.
2.4 敲低eEF1A1 不影响poly(l:C)及HT-DNA 激活的胞内核酸识别免疫通路
图4 和5 显示,poly(I:C)或HT-DNA 诱导后,与阴性对照组相比,eEF1A1基因沉默组的IFN-β、ISG56和CXCL10的mRNA水平以及IRF3与TBK1的蛋白磷酸化水平无显著差异。

Fig.4 Knockdown of eEF1A1 does not affect the innate immune response to polyinosinic-polycytidylic acid[poly(l∶C) ]. BJ-5ta cells were stimulated with poly(I:C)after transfected with siRNA for 48 h.A:the mRNA levels of IFN-β,CXCL10 and ISG56 were detected by RT-qPCR. B1:the protein levels of p-IRF3 and p-TBK1 were detected by Western blotting. B2 was the semiquantitative result of B1.
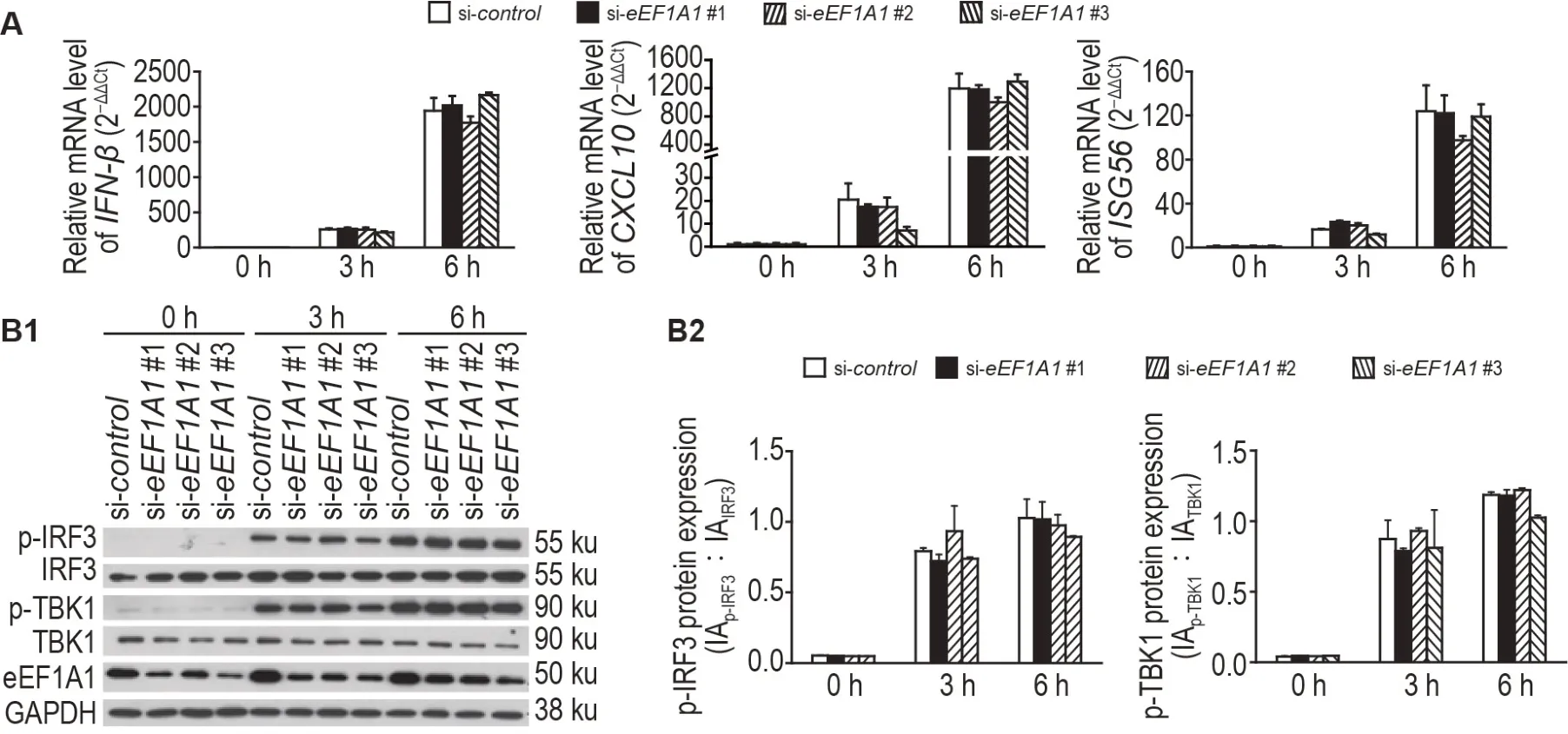
Fig.5 Knockdown of eEF1A1 does not affect the innate immune response to herringtestis DNA (HT-DNA). BJ-5ta cells were stimulated with HT-DNA after transfected with siRNA for 48 h. A: the mRNA levels of IFN-β,CXCL10 and ISG56 were detected by RT-qPCR.B1:the protein levels of p-IRF3 and p-TBK1 were detected by Western blotting.B2 was the semi-quantitative result of B1.
3 讨论
病毒基因组mRNA 和蛋白是评价病毒复制量的关键因素。研究报道,eEF1A1 参与RNA 病毒转录酶复合体的形成[17],但未涉及eEF1A1 对不同种类病毒基因组复制的影响。VSV 和HSV-1 常被当作工具病毒运用于先天免疫信号通路的研究中[18]。本研究表明,抑制eEF1A1 后,VSV 的基因拷贝数和蛋白水平显著降低;HSV-1的mRNA 和蛋白水平显著降低。以上结果提示,eEF1A1 对RNA 病毒和DNA病毒具有潜在的广谱调控作用。
病毒感染的先天免疫反应是由模式识别受体识别病毒核酸而引发的,其中包括Toll 样受体,RIG-I样受体和胞质DNA传感器。天然免疫是宿主抵抗病原入侵的第一道防线。感染病毒后,机体通过模式识别受体识别病毒的DNA 或RNA,快速启动固有免疫反应,有效清除入侵的病毒并进行机体损伤修复。在感知危险信号后,调控细胞抗病毒免疫的关键激酶TBK1 被激活,并进一步磷酸化转录因子IRF3,使其入核,诱导下游干扰素的产生[19]。TBK1 是固有免疫细胞抗病毒信号通路的中心节点,其活性和稳定性均需受到精细的控制,功能异常将导致自身免疫疾病和慢性炎症等疾病发生。本研究表明,干扰素激动剂双链RNA 类似物Poly(I:C)或HT-DNA刺激eEF1A1基因沉默的细胞后,IFN-β、CXCL10和ISG56的mRNA 水平以及TBK1与IRF3 的蛋白磷酸化水平均无显著差异。因此推测,eEF1A1 在体内对病毒复制量的影响可能不通过胞内核酸识别的天然免疫,但不排除eEF1A1 会通过其他天然免疫机制抑制病毒。同时有研究报道,eEF1A1 可与病毒相互作用[15-16],推测其可能是直接靶向病毒。因此,关于eEF1A1 对病毒的具体作用机制还需进一步探究。
综上所述,本研究首次提出eEF1A1 影响DNA病毒复制,也可影响RNA 病毒复制,为新型广谱抗病毒药物的研发提供了新思路。基于抑制eEF1A1 对Poly(I:C)或HT-DNA 刺激的天然免疫分子无影响,提示eEF1A1 可能不参与胞内核酸识别的天然免疫,可能会通过其他机制帮助病毒进行免疫逃逸,为宿主免疫和病毒逃逸的研究提供基础。
