肿瘤血管破坏剂5,6-二甲基黄嘌呤-4-乙酸对小鼠Lewis肺癌转移的抑制作用及机制
2024-04-13崔霞何微肖智勇王莹刘峰周文霞
崔霞*,何微*,肖智勇,王莹,刘峰,周文霞
(1.南京中医药大学,江苏南京 210023;2.军事科学院军事医学研究院毒物药物研究所,国家安全特需药品全国重点实验室,北京 100850)
血管主要由内皮细胞、壁细胞(周细胞和平滑肌细胞)和基底膜构成。然而,肿瘤组织中的血管具有结构和功能异质性的特点,表现为壁细胞覆盖差和基底膜结构异常等表型。异常的肿瘤血管会导致不利于免疫细胞“工作”的微环境(如低氧和酸性环境),从而促进肿瘤进展和化疗耐药。研究表明,实体瘤体积超过2 mm3便需要肿瘤血管的支持[1],肿瘤血管的产生是实体瘤的典型特征之一。在肿瘤生长过程中,脉管系统不仅供氧和营养,还清除肿瘤组织中产生的二氧化碳和代谢物。此外,肿瘤脉管系统还为肿瘤远处转移提供输运途径。因此,肿瘤血管在肿瘤的生长、增殖和转移中起重要作用,已被认为是肿瘤治疗的有希望的靶标。
目前针对肿瘤血管治疗的方法主要包括新生血管抑制剂和肿瘤血管破坏剂。新生血管抑制剂选择性作用于血管形成过程中的血管内皮细胞生长因子(vascular endothelial growth factor receptor,VEGF)和成纤维细胞生长因子等酪氨酸激酶受体,抑制肿瘤血管生长,减少肿瘤内部血供和氧供,导致肿瘤细胞坏死。苏尼替尼(sunitinib)是首个获得美国FDA 批准的VEGF 受体抑制剂,用于胃肠间质瘤、肾细胞癌和胰腺神经内分泌瘤等肿瘤的治疗[2-4]。然而,临床数据表明,苏尼替尼治疗9~12个月后,大部分癌症患者发生肿瘤转移[5],其导致的低氧微环境可能是引发肿瘤转移的重要原因之一[6-8]。
与新生血管抑制剂不同,肿瘤血管破坏剂利用肿瘤血管和正常组织血管之间的差别,选择性破坏肿瘤血管系统,现已成为肿瘤治疗领域的研究热点。当前临床试验中典型的小分子血管破坏剂之一,黄酮类肿瘤血管破坏剂5,6-二甲基黄嘌呤-4-乙酸(5,6-dimethylxanthenone-4-acetic acid,DMXAA),可选择性靶向肿瘤血管内皮,破坏肿瘤血管,切断血供,导致肿瘤细胞缺血坏死[9-10]。大量研究表明,DMXAA 可减轻小鼠乳腺癌[11]和结肠癌[12]等多种肿瘤转移,在临床试验中对非小细胞肺癌、宫颈癌和前列腺癌等继发性转移有明显抑制作用[13-14],但其作用机制尚不明确。
因此,本研究制备了小鼠Lewis 肺癌(Lewis lung cancer,LLC)异位移植瘤小鼠模型和转移型LLC 小鼠模型,研究DMXAA 对LLC 增殖、转移及对肿瘤血管结构和肿瘤微环境的影响,并与新生血管抑制剂苏尼替尼进行比较,为深入了解肿瘤血管破坏剂DMXAA抗肿瘤转移作用及其机制提供依据。
1 材料与方法
1.1 药物、试剂和主要仪器
DMXAA(批号:S1537)和苏尼替尼(批号:1042),美国Selleckchem 公司;小鼠抗小鼠血小板内皮细胞黏附分子1(platelet/endothelial cell adhesion molecule-1,CD31)单克隆抗体(批号:sc-376764)和兔抗小鼠周细胞α 平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)多克隆抗体(批号:sc-32251),美国Santa Cruz Biotechnology 公司;辣根过氧化物酶标记的山羊抗兔IgG 抗体(批号:ZB-2301)和辣根过氧化物酶标记的山羊抗小鼠IgG抗体(批号:ZB-2305),中国北京中杉金桥生物技术有限公司;酪酰胺信号放大(tyramide signal amplification,TSA)试剂盒(批号:NEL744001KT),美国perkinelmer 公司;低氧荧光探针哌莫硝唑(pimonidazole)试剂盒(HypoxyprobeTM RedAPC kit)(批号:HP2-100kit),美国Hypoxyprobe公司。
KLCZ-1220A 超净工作台,中国北京亚泰科隆仪器技术有限公司;3K15 高速离心机,德国Sigma公司;HF-90 二氧化碳细胞培养箱,上海Heal force公司;Milli-Q 纯水机,美国Millipore公司;DM4000B正置荧光显微镜,德国Leica 公司;EVOS XL Core倒置显微镜,日本OLYMPUS 公司;IVIS Spectrum小动物活体成像系统,美国Caliper公司。
1.2 细胞和细胞培养
LLC 细胞来源于中国科学院上海细胞库,用含10%灭活胎牛血清、1%青霉素和链霉素的DMEM完全培养基中培养,置于37 ℃,5% CO2饱和湿度的培养箱内孵育。表达荧光素酶的LLC 细胞(LLCLuc)为军事医学研究院卫生勤务与血液研究所詹林盛研究员实验室惠赠。
1.3 实验动物
SPF级雌性C57BL/6小鼠,6~8周龄,体重16~20 g,购自北京维通利华实验动物技术有限公司,实验动物生产许可证号:SCXK(京)2012-0001,饲养温度23~27 ℃,湿度50%~60%,每12 h 明暗交替,自由摄食饮水。实验中所有动物的处理均符合军事医学研究院伦理审查委员会的要求,伦理审批号(IACUC-DWZX-2022-78)。
1.4 LLC异位移植瘤小鼠模型的制备和分组
C57/BL6 小鼠实验前适应性饲养7 d。取LLC细胞,培养至对数生长期后,制备无血清单细胞悬液(4×109L-1),无菌条件下于小鼠右侧腋窝sc 接种细胞悬液(100 μL),制备小鼠LLC 异位移植瘤模型。
待移植瘤体积达约200 mm3时,将15只模型小鼠随机分为3 组:模型组(含1% DMSO 的生理盐水,ip,2天1次)、模型+苏尼替尼组(30 mg·kg-1,ip,2天1 次)和模型+DMXAA 组(25 mg·kg-1,ip,给药1次)(图1A)[15-17]。每隔1 天测量移植瘤体积和小鼠体重,移植瘤体积(mm3)=长径(mm)×短径2(mm)×0.5,绘制移植瘤体积生长曲线和小鼠体重变化曲线。
待移植瘤体积达约200 mm3时,将30只模型小鼠随机分为3 组,每组10 只,分组及给药方法同上,分别于给药后2 和5 d,每组处死5 只小鼠,每只小鼠处死前1 h 尾静脉注射低氧探针哌莫硝唑(60 mg·kg-1)。处死后剥离瘤体称重,每组取瘤体固定于4%多聚甲醛中备用,后期将进行CD31 和SMA 免疫荧光染色以及哌莫硝唑免疫荧光染色,详见1.6和1.7。
1.5 转移型LLC小鼠模型的制备和分组
将LLC-Luc细胞培养至对数生长期后,制备无血清单细胞悬液(4×109L-1),将细胞悬液(100 μL)经尾部静脉注射于小鼠体内,建立转移型LLC 小鼠模型。
将24 只模型小鼠随机分为3 组:模型组(含1% DMSO 的生理盐水,ip,1 周2 次)、模型+苏尼替尼组(60 mg·kg-1,ip,1 周2 次)及模型+DMXAA 组(25 mg·kg-1,ip,给药1 次)(图2A)[18-20]。分别于给药后2 和5 周,用小动物活体成像系统(IVIS Spectrum)观察小鼠体内肿瘤转移,并进行荧光定量分析。观测前将小鼠置于动物气体麻醉机的麻醉盒,用异氟烷诱导麻醉,然后迅速将已麻醉小鼠腹部朝上置于小动物活体成像系统曝光成像。
1.6 免疫荧光染色检测移植瘤组织中血管结构
取1.4 制备的移植瘤组织制备石蜡切片,依次经脱蜡、复水、抗原修复和封闭,加入一抗〔CD31(1∶1000)和α-SMA(1∶500)〕4 ℃孵育过夜;TBST清洗2 次,加入二抗〔山羊抗小鼠IgG(1∶1000),山羊抗兔IgG(1∶1000)〕室温孵育1 h;TBST 清洗2 次,加入TSA-FITC和TSA-CY3室温孵育15 min;TBST 清洗3 次,最后用抗荧光淬灭封片液(含DAPI)封片,用荧光显微镜拍照,Image pro plus 软件分析荧光强度。 α-SMA/CD31 荧光强度的比值表示周细胞覆盖率。
1.7 哌莫硝唑检测移植瘤组织低氧程度
哌莫硝唑可以共价结合低氧细胞的含巯基蛋白质[21]并发出绿色荧光[22],是动物和人类组织低氧标记物,常用于肿瘤低氧状态的定位和定量检测[23]。取1.4 制备的移植瘤组织进行免疫荧光染色:加入FITC 偶联的探针抗体,4 ℃孵育过夜;TBST 清洗3 次,用抗荧光淬灭封片液(含DAPI)封片。用荧光显微镜拍照,cellSens1.13 软件分析移植瘤组织低氧程度。
1.8 统计学分析
实验结果数据用±s表示,用GraphPad Prism 9.0 软件进行统计学分析。多组间比较采用One-way ANOVA,组间两两比较采用DunnettT检验,其中肿瘤转移结果数据不符合正态分布,组间两两比较采用Kruskal-Wallis 检验。不同时间点各组间比较采用Two-way ANOVA 结合Newman-Keuls检验。P<0.05为差异具有统计学意义。
2 结果
2.1 DMXAA抑制小鼠LLC移植瘤生长
与模型组相比,模型+苏尼替尼组小鼠移植瘤体积从给药后12 d 开始显著缩小(P<0.05),而模型+DMXAA 组则从给药后6 d 开始显著缩小(P<0.01)(图1B);与模型组相比,模型+苏尼替尼组瘤重从给药后5 d开始减小(P<0.05),而模型+DMXAA组则在给药后2 d 开始减小(P<0.01)(图1D)。同时,与模型组相比,模型+苏尼替尼组小鼠体重明显下降(P<0.05),而模型+DMXAA 组则无显著变化(图1C)。以上表明,DMXAA 较苏尼替尼起效更快,毒性更小。
2.2 DMXAA抑制小鼠体内的LLC转移
图2B 所示,模型组小鼠给药后2周出现肺部转移,5 周肿瘤几乎占满整个肺部,甚至转移到下腹部。给药后2和5周,与模型组相比,模型+苏尼替尼组荧光强度无显著差异,表明苏尼替尼未抑制LLC转移;与模型组相比,模型+DMXAA组荧光强度在给药后2 和5 周均显著降低(P<0.01),表明DMXAA可以抑制LLC转移(图2C,2D)。

Fig.2 DMXAA inhibits tumor metastasis in mouse model of metastatic LLC. C57BL/6 mice were injected with 4x106 LLC cells into the tail vein. The mouse model of metastatic LLC was randomly divided into 3 groups: model group [physiological saline containing 1% DMSO,ip,twice a week], model+sunitinib group [60 mg·kg-1,ip, twice a week] , and model+DMXAA group [25 mg·kg-1,ip,once]. Tumor metastasis were measured 2 and 5 weeks after administration. A:experimental metastasis assay scheme based on mouse model of metastatic LLC; B: representative images of bioluminescence intensity 2 and 5 weeks after administration;C was the semiquantitative result of B.±s,n=7-8.*P<0.05,**P<0.01,compared with model group.
2.3 DMXAA促进LLC血管正常化
图3所示,与模型组相比,给药后5 d,模型+DMXAA 组和模型+苏尼替尼组移植瘤组织中周细胞覆盖率均显著增加(P<0.05),表明DMXAA 和苏尼替尼均能诱导LLC血管正常化。
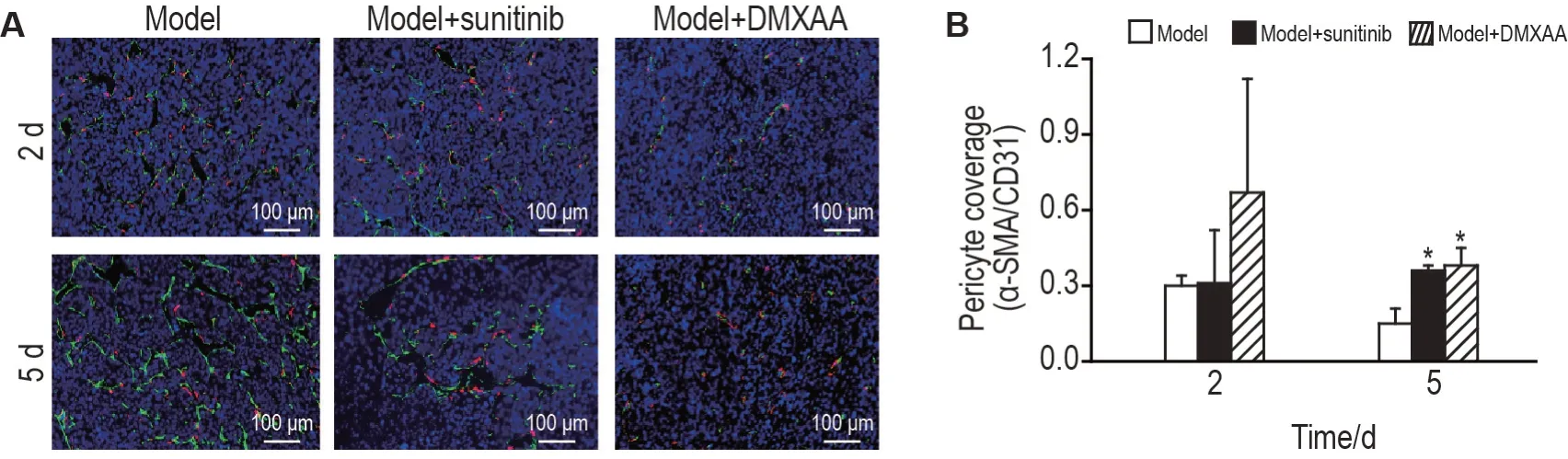
Fig.3 DMXAA induces LLC vasculature normalization. See Fig.1 for the mouse treatment.A:representative images of immunofluorescence staining of platelet/endothelial cell adhesion molecule-1(CD31)and α-smooth muscle actin(α-SMA)at 2 and 5 d after administration. Red:α-SMA;Green:CD31. B:statistical analysis of immunofluorescence staining of α-SMA/CD31.±s,n=3. *P<0.05,**P<0.01,compared with model group.
2.4 DMXAA改善LLC移植瘤组织低氧微环境
低氧探针哌莫硝唑染色结果显示,与模型组相比,给药后5 d,模型+苏尼替尼组移植瘤组织低氧面积无明显变化,而模型+DMXAA 组显著降低(P<0.01)(图4),表明DMXAA能显著改善移植瘤组织低氧微环境,而苏尼替尼无此作用,这可能是二者抗肿瘤转移存在差异的重要原因之一。

Fig.4 DMXAA improves LLC tumor hypoxic microenvironment. See Fig.1 for the mouse treatment. Tumor hypoxia was detected using hypoxyprobe(pimonidazole)staining. A:representative images of hypoxyprobe staining at 2 and 5 d after administration;B: the semiquantitative result of A.±s,n=5.**P<0.01,compared with model group.
3 讨论
DMXAA 在针对非小细胞肺癌的临床试验中表现出良好的抗肿瘤活性,能有效提高患者的客观缓解率(objective response rate)和中位生存期[24-27],但其作用机制尚不明确。本研究表明,DMXAA 显著抑制小鼠LLC皮下移植瘤的生长和转移。DMXAA提高移植瘤组织血管表面周细胞覆盖率,使肿瘤血管的表型趋于正常化,同时DMXAA 显著改善移植瘤组织低氧微环境,这可能是其抑制LLC 转移的重要原因之一。
肿瘤血管与正常血管不同,具有扭曲、膨胀、囊状扩张和血流局部停滞等多种结构和功能的异常。目前,评估肿瘤血管的指标主要包括血管形态、微血管密度、周细胞覆盖率、血流灌注和血管通透性等。CD31 属于免疫球蛋白超家族成员,表达于血管内皮细胞表面,是新生血管的标志物,被用于评估肿瘤微血管密度和血管生成[28]。α-SMA 是周细胞的标志物,与血管成熟相关[29]。周细胞是环绕血管内皮管的辅助细胞,周细胞与内皮细胞相互作用调节血管功能。肿瘤细胞通过与周细胞相互作用,逃避免疫监视并侵入周围组织和血管[30]。此外,周细胞还可以分泌促进肿瘤细胞转移的因子,如基质金属蛋白酶,从而破坏基底膜和组织结构,促进肿瘤细胞的转移[31]。α-SMA/CD31 的比值可作为反映肿瘤组织中血管结构的指标[32],α-SMA/CD31 比值升高表示肿瘤血管出现正常化倾向[33]。正常化的肿瘤血管可以帮助药物和氧更有效地输送到肿瘤内部,改善肿瘤患者对抗肿瘤治疗的敏感性,抑制肿瘤生长,减少肿瘤转移[30,34-35]。大量研究表明,苏尼替尼治疗肺鳞状细胞癌、乳腺癌等肿瘤后2~7 d,可使肿瘤血管成熟度提高,肿瘤微血管密度降低,促进肿瘤血管正常化[36-37]。本研究表明,苏尼替尼可使LLC 移植瘤中α-SMA/CD31比值升高,肿瘤血管出现正常化倾向,与文献报道一致。康普瑞汀磷酸钠(combretastatin A4-phosphate,CA4P)是一种强有力的肿瘤血管破坏剂。与DMXAA 类似,CA4P 对肿瘤生长过程中新形成血管的未成熟内皮细胞有特异性抑制作用,而对正常组织血管成熟内皮细胞无作用[38]。研究表明,CA4P 在子宫内膜异位症患者的治疗中可诱导血管正常化[39],这主要与肿瘤血管破坏剂主要破坏瘤内幼稚的脉管系统,相对提高了瘤内成熟血管的比例有关[40]。本研究表明,DMXAA也可通过增加周细胞覆盖率提高血管成熟度,并诱导肿瘤血管正常化,提示促进血管正常化是靶向肿瘤血管治疗的重要途径。
肿瘤低氧是诱发肿瘤转移的重要因素之一[41-42]。在低氧条件下,肿瘤细胞更易从原发部位扩散侵入邻近组织,进而实现远端转移[43],而缓解肿瘤低氧微环境可抑制肿瘤转移[44-45]。为进一步阐释DMXAA 显著抑制小鼠LLC 转移的作用机制,本研究检测了DMXAA 对小鼠移植瘤组织低氧的影响。结果表明,DMXAA给药后2 d移植瘤组织低氧面积有上升趋势,5 d 时低氧面积显著降低,表明DMXAA 给药后在短期内诱导肿瘤内大量血管破坏,加重肿瘤缺血低氧;后期肿瘤坏死消退耗氧量减少并伴随肿瘤内血管重构,肿瘤低氧缓解[46]。这一结果与文献报道中DMXAA 对肿瘤低氧的双向影响基本一致[46-49],提示DMXAA 对肿瘤低氧的影响可能与药物暴露后肿瘤血管的早期破坏及随后的正常化过程密切相关。目前关于苏尼替尼对肿瘤组织低氧影响的研究还比较有限,但有一些研究表明苏尼替尼可能会影响肿瘤组织的血供和氧供,从而改变肿瘤组织的低氧状态[50]。本研究表明,苏尼替尼给药后2 d 低氧面积无明显变化,5 d 时低氧面积有上升趋势,可能是苏尼替尼抑制血管新生的起效时间比较长,因此短期内低氧程度与模型相比无显著差异。而随着苏尼替尼开始抑制血管生成,虽然此时有肿瘤消退、耗氧量减少以及血管的正常化缓解低氧,但肿瘤血管减少诱发的低氧更明显,因此苏尼替尼治疗5 d 时肿瘤低氧有上升趋势,继续延长观察时间可能更有利于获得关于苏尼替尼对移植瘤组织低氧影响的确切数据。DMXAA 在促进肿瘤组织血管正常化、缓解肿瘤组织低氧的同时显著抑制肿瘤转移,而苏尼替尼虽然也促进血管正常化,但对肿瘤低氧和肿瘤转移均有促进的趋势,提示DMXAA 与苏尼替尼对肿瘤微环境低氧的不同影响可能是二者对肿瘤转移表现出差异效应的原因之一。
综上,肿瘤血管破坏剂DMXAA 抑制小鼠LLC生长和转移,促进肿瘤组织血管正常化并显著缓解肿瘤组织低氧状态。在抑制肿瘤转移和改善肿瘤低氧方面,DMXAA 与新生血管抑制剂苏尼替尼相比具有明显特色和优势。本研究为深入理解肿瘤血管破坏剂DMXAA 的抗肿瘤效应和作用机制提供了实验依据,为靶向肿瘤血管的药物研究提供新的思路。
