阿奇霉素对胃癌细胞增殖、凋亡及炎症因子表达水平的影响*
2024-04-13葛晓明
唐 悦,葛晓明,单 廷
江苏省无锡市第二人民医院普外科,江苏无锡 214000
胃癌为消化系统常见恶性肿瘤之一,多发于40岁以上中老年人群。胃癌的治疗手段主要根据病情发展阶段而定,手术和药物相结合的治疗方式能明显提高早期胃癌患者生存率。转移期胃癌一般使用抗菌药物和细胞毒性化合物(如5-氟尿嘧啶)等化疗药物进行治疗,但由于化疗药物的耐药性和胃癌的易复发性,不能明显延长胃癌患者生存期。因此,寻找诊断和治疗胃癌的有效手段具有重要意义[1-2]。阿奇霉素是一种大环内酯类抗菌药物,广泛应用于治疗细菌感染和炎症,具有疗效快、作用强及不良反应少等特点[3]。近年的研究发现,阿奇霉素具有抗菌和抗肿瘤作用:不仅可通过阻断病原菌的转肽过程治疗急性胃炎,还可通过促进非小细胞肺癌细胞凋亡,达到治疗肺癌的目的[4]。但关于阿奇霉素调控胃癌细胞生物学功能和影响胃癌恶性进程的相关报道较少。核转录因子-κB(NF-κB)信号通路普遍存在于细胞中,在调控细胞生物学过程中起重要作用[5]。有研究显示,党参多糖通过抑制NF-κB信号通路诱导胃癌细胞凋亡和抑制增殖[6]。另有研究显示,阿奇霉素通过抑制NF-κB通路活性对哮喘患者具有一定治疗作用[7]。本研究探讨阿奇霉素对人胃癌细胞(AGS细胞)上清液中炎症因子水平及增殖和凋亡的影响,分析NF-κB信号通路在其中的调控作用,旨在为胃癌的治疗提供新的参考。
1 材料与方法
1.1细胞 AGS细胞购于上海致备生物科技有限公司。
1.2仪器与试剂 使用的主要仪器包括CO2培养箱(深圳市瑞沃德生物科技有限公司,型号:D180),倒置荧光显微镜(上海无陌光学仪器有限公司,型号:WMS-1033),酶标仪(美国Billerica公司,型号:Multiskan Ascent),凝胶成像系统(广州科适特科学仪器有限公司,型号:GD-1000),低温高速离心机(山东博科医用材料有限公司,型号:TGL-16M)等。使用的主要试剂包括阿奇霉素、5-氟尿嘧啶[8](上海源叶生物科技有限公司,纯度≥98%),NF-κB通路抑制剂BAY11-7082[9]、激活剂Prostratin[10](美国MCE公司,纯度≥98%),4%多聚甲醛、3%牛血清白蛋白溶液(BSA,上海源叶生物科技有限公司),TritonX-100(北京北京伊塔生物科技有限公司),细胞计数试剂盒-8(CCK-8,上海炎煕生物有限公司),胎牛血清(FBS)、F12K培养基(美国Gibco公司),5-乙炔基-2’脱氧尿嘧啶核苷(EdU)细胞增殖检测试剂盒(北京索莱宝科技有限公司),Hoechst33258染色试剂盒(北京兰博利德有限公司),酶联免疫吸附试验(ELISA)试剂盒(上海初态生物有限公司),二喹啉甲酸(BCA)蛋白试剂盒(英国Abcam公司),鼠抗人增殖细胞核抗原(PCNA)、半胱氨酸蛋白酶-3(Caspase-3)、NF-κB p65、磷酸化(p)-NF-κB p65、NF-κB抑制蛋白(IκBα)、p-IκBα、β-actin一抗、山羊抗鼠IgG(H+L)二抗(英国Abcam公司)。
1.3方法
1.3.1AGS细胞培养 AGS细胞接种于F12K培养基(含10% FBS)中培养(37 ℃,5%CO2),70%~80%湿度培养箱中培养,换液间隔天数:2~3 d,传代(密度达80%)后用于研究(对数期细胞)。
1.3.2分组与干预 将AGS细胞(密度:2×105个/mL)分为对照组和不同水平阿奇霉素组。对照组不进行干预,不同水平阿奇霉素组分别加12.5、25.0、50.0、100.0 μg/mL阿奇霉素,干预24 h。用CCK-8检测细胞活力,筛选最适水平用于后续实验。细胞分组:对照组、阿奇霉素组、阳性药物组、抑制剂组和激活剂组。阿奇霉素组:加入50.0 μg/mL阿奇霉素;阳性药物组:加入50.0 μg/mL 5-氟尿嘧啶;抑制剂组:在50.0 μg/mL阿奇霉素的基础上加入1.0 μmol/L NF-κB通路抑制剂BAY11-7082;激活剂组:在50.0 μg/mL阿奇霉素基础上加入1.0 μmol/L NF-κB通路激活剂Prostratin。每组设3次重复,置培养箱,37 ℃,5%CO2条件下培养24 h后进行各项指标测定。
1.3.3CCK-8测定AGS细胞活力 取24 h细胞,参照CCK-8说明书进行操作,反应完成后检测各孔吸光度(A)值(450 nm处),计算细胞活力。细胞活力为各水平阿奇霉素组A值与对照组A值的百分比。
1.3.4ELISA测定AGS细胞上清液中的炎症因子水平 取各组细胞上清液,按照ELISA试剂盒说明书测定细胞上清液中的炎症因子[白细胞介素-10(IL-10)、白细胞介素-1β(IL-1β)]水平。
1.3.5EdU法测定AGS细胞的增殖率 取培养24 h的细胞,具体步骤参照EdU说明书操作处理,处理完成后装片、拍照(荧光显微镜)、处理图片(Image-J 1.8.0软件)。红色细胞占蓝色细胞的百分比即为增殖率。
1.3.6Hoechst33258法测定AGS细胞凋亡率 用磷酸盐缓冲液(PBS)清洗细胞2次(5分/次),固定(0.5 mL,4%多聚甲醛)10 min。PBS清洗3次(5分/次),染色(Hoechst33258染色液,5 mg/L)10 min,PBS清洗3次(5分/次),封固后观察(荧光显微镜),拍照(随机3个视野),计算凋亡率(Image-J软件)。正常细胞:细胞核为淡蓝色,形态清晰;凋亡细胞:细胞核染色不均,亮蓝色,荧光较强。凋亡率为凋亡细胞数占总细胞数的百分比。
1.3.7蛋白免疫印迹(WB)法检测AGS细胞中PCNA、Caspase-3和NF-κB信号通路关键蛋白表达水平 收集处理后的细胞,在冰上裂解并收集上清液。提取蛋白进行定量,上样后进行凝胶电泳分离蛋白,后经聚偏二氟乙烯膜转印电泳、封闭、一抗孵育、二抗孵育及膜显色。在凝胶成像系统上采集蛋白条带并用系统配备的分析软件进行蛋白灰度值(G)分析。以β-actin为内参,蛋白表达水平为目标蛋白与内参蛋白的比值。p-NF-κB p65/NF-κB p65为p-NF-κB p65蛋白表达水平与NF-κB p65蛋白表达水平的比值,p-IκBα/IκBα为p-IκBα蛋白表达水平与IκBα蛋白表达水平的比值。

2 结 果
2.1阿奇霉素对AGS细胞活力的影响 对照组,以及12.5、25.0、50.0、100.0 μg/mL阿奇霉素组的细胞活力分别为(100.63±5.72)%、(92.93±2.02)%、(88.80±4.04)%、(69.43±4.85)%、(70.94±3.97)%。不同水平(12.5、25.0、50.0、100.0 μg/mL)阿奇霉素组较对照组AGS细胞活力降低,但在12.5 μg/mL时的细胞活力比较,差异无统计学意义(P>0.05),而在25.0、50.0、100.0 μg/mL的细胞活力比较,差异有统计学意义(P<0.05),其中AGS细胞活力在50.0 μg/mL的阿奇霉素处理后的抑制效果最好,所以选择50.0 μg/mL阿奇霉素作为最适水平用于后续实验。
2.2各组AGS细胞上清液中的炎症因子水平比较 与对照组比较,阿奇霉素组和阳性药物组细胞上清液中的IL-1β水平下降(P<0.05),IL-10水平上升(P<0.05);与阿奇霉素组比较,抑制剂组IL-1β水平下降(P<0.05),IL-10水平上升(P<0.05);与阿奇霉素组比较,激活剂组AGS细胞IL-1β水平上升(P<0.05),IL-10水平下降(P<0.05)。见表1。
表1 各组AGS细胞炎症因子水平比较
2.3各组AGS细胞增殖能力比较 对照组、阿奇霉素组、阳性药物组、抑制剂组、激活剂组的AGS细胞增殖率分别为(32.75±2.32)%、(16.78±0.75)%、(16.05±0.36)%、(7.82±1.43)%、(30.20±2.18)%。结果显示,与对照组比较,阿奇霉素组和阳性药物组AGS细胞增殖率下降(P<0.05);与阿奇霉素组比较,抑制剂组AGS细胞增殖率下降(P<0.05),激活剂组AGS细胞增殖率上升(P<0.05)。见图1。
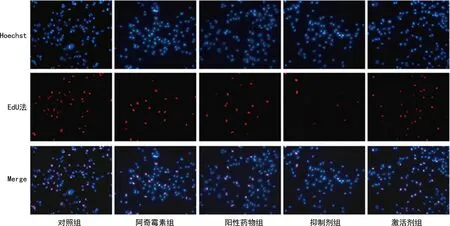
图1 EdU法检测AGS细胞增殖能力(×20)
2.4各组AGS细胞凋亡能力比较 对照组、阿奇霉素组、阳性药物组、抑制剂组、激活剂组的AGS细胞凋亡率分别为(3.62±0.15)%、(10.58±0.65)%、(11.37±0.97)%、(23.16±1.72)%、(5.05±0.52)%。对照组:细胞大小均匀、形态清晰、弥散均匀,细胞核呈淡蓝色;其他各实验组:细胞核呈亮蓝色、染色不均、体积浓缩/变小,荧光较强。量化后发现,与对照组比较,阿奇霉素组和阳性药物组AGS细胞凋亡率上升(P<0.05);与阿奇霉素组比较,抑制剂组AGS细胞凋亡显著上升(P<0.05),而激活剂组AGS细胞凋亡率下降(P<0.05)。见图2。

图2 Hoechst 33258染色法测定AGS细胞凋亡情况(×20)
2.5各组AGS细胞PCNA和Caspase-3表达水平比较 与对照组比较,阿奇霉素组和阳性药物组AGS细胞PCNA表达水平下降(P<0.05),而Caspase-3表达水平上升(P<0.05);与阿奇霉素组比较,抑制剂组AGS细胞PCNA表达水平下降(P<0.05),而Caspase-3表达水平升高(P<0.05),而激活剂组AGS细胞PCNA表达水平上升(P<0.05),Caspase-3表达水平下降(P<0.05)。见图3、表2。
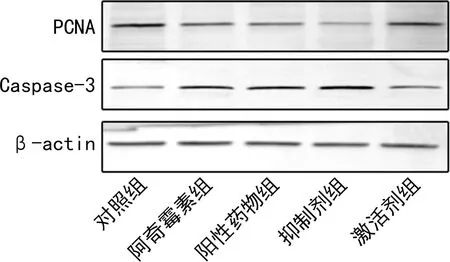
图3 WB法检测AGS细胞PCNA和Caspase-3表达情况

表2 各组AGS细胞PCNA和Caspase-3表达水平比较
2.6各组AGS细胞NF-κB通路蛋白比较 与对照组比较,阿奇霉素组p-NF-κB p65/NF-κB p65和p-IκBα/IκBα下降(P<0.05);与阿奇霉素组比较,抑制剂组p-NF-κB p65/NF-κB p65和p-IκBα/IκBα下降(P<0.05),而激活剂组则与抑制剂组趋势相反(P<0.05)。见图4、表3。

图4 WB法检测AGS细胞NF-κB通路蛋白表达情况

表3 各组AGS细胞NF-κB通路蛋白比较
3 讨 论
胃癌是病死率较高的恶性肿瘤之一,但无特征性临床症状,确诊时患者往往已进入胃癌进展期,且目前尚无有效的诊断和治疗手段。胃癌的发生是多种因素相互作用的结果,深入研究胃癌的发生、发展机制,寻找治疗胃癌的关键靶点是目前研究的热点[11-12]。阿奇霉素是新近发现的大环内酯类抗菌药物,早期主要用于治疗细菌感染,可在细胞中累积并缓慢释放,相较于其他大环内酯类药物,具有更高的局部浓度和更长的半衰期,且不良反应少,因此成为广大学者研究的热点。近年来,阿奇霉素在抗肿瘤方面的作用越来越被人们关注。有研究发现,阿奇霉素能抑制淋巴癌[13]和结肠癌[14]等肿瘤的恶性进程。阿奇霉素通过其抗炎作用对小儿胃炎有一定治疗效果[15]。但阿奇霉素对胃癌细胞的影响尚不清楚。基于此,本研究利用不同水平(12.5、25.0、50.0、100.0 μg/mL)阿奇霉素干预AGS细胞,结果发现,25.0、50.0、100.0 μg/mL阿奇霉素组AGS细胞活力明显低于对照组,其中50.0 μg/mL阿奇霉素组细胞活力最低,效果最好,因此选择50.0 μg/mL阿奇霉素为最适水平用于后续实验,与既往研究[13]结果相符,有一定的参考价值。为了进一步研究阿奇霉素对AGS细胞生物学行为的影响,本研究探讨了阿奇霉素对炎症细胞因子、AGS细胞增殖与凋亡的影响。结果发现,阿奇霉素干预后,IL-1β水平、AGS细胞增殖率和增殖标志物PCNA表达水平下降,而IL-10水平、凋亡率和凋亡标志物Caspase-3表达水平上升,提示阿奇霉素可抑制AGS细胞炎症,并诱导其凋亡、抑制增殖,有良好的研究及开发前景。
NF-κB属于二聚体转录因子家族,生理状态下以NF-κB和IκBα二聚体的形式存在于细胞质中参与细胞的炎症、增殖和凋亡等生物学过程。其异常激活后,NF-κB和IκBα二聚体在蛋白磷酸化酶的参与下发生磷酸化,二聚体NF-κB和IκBα解离,NF-κB迅速进入细胞核进行目标基因的转录[16]。研究发现,相关受体结合丝氨酸/苏氨酸激酶2通过下调p-NF-κB和p-IκBα的表达水平,抑制NF-κB信号通路活性,减缓裸鼠胃癌的发展进程[17]。另有研究证实能够通过NF-κB信号通路抑制胃癌细胞的增殖,并促进其凋亡[18]。赵朝华等[19]报道显示,阿奇霉素不仅可以通过抑制NF-κB通路活性改善慢性阻塞性肺模型大鼠肺脏组织形态和纤维化,还可以通过抑制NF-κB信号通路促进牙周膜干细胞的成骨分化[20]。但是阿奇霉素是否可通过调控NF-κB信号通路改变胃癌的发展进程尚不十分明确。因此,本研究分析了各实验组AGS细胞NF-κB信号通路关键蛋白,结果发现,阿奇霉素降低了p-NF-κB p65/NF-κB p65和p-IκBα/IκBα,说明阿奇霉素能明显抑制NF-κB信号通路活性。在阿奇霉素的基础上分别加入BAY11-7082和Prostratin后,BAY11-7082增强了阿奇霉素对AGS细胞的作用,Prostratin则明显减弱了阿奇霉素对AGS细胞的作用。
综上所述,阿奇霉素通过阻滞NF-κB通路信号转导抑制AGS细胞炎症和增殖,并诱导其凋亡。但是本研究仅从细胞层面研究了阿奇霉素对AGS细胞的影响,下一步可从体内水平研究阿奇霉素对胃癌的作用,为胃癌的相关治疗提供更有利的参考。
