安罗替尼对NCI-H226细胞糖酵解和增殖作用机制研究
2024-04-13胡益川朱述阳朱洁晨
胡益川 朱述阳 朱洁晨


收稿日期:2023-08-13;修回日期:2023-09-26。
作者簡介:胡益川,硕士研究生。
* 通信作者:朱洁晨,主治医师,主要从事肺癌的诊断与治疗方面的研究。E-mail: 396412645@qq.com。
摘 要:探究安罗替尼干预对人肺鳞癌NCI-H226细胞糖酵解、增殖、克隆形成、迁移的影响及作用机制,为肺癌的体外试验提供参考依据。将人肺鳞癌NCI-H226细胞分为对照组(不做干预)、10、20、40 μmol/L安罗替尼组和阳性药物组(20 μg/mL顺铂)。用活细胞计数(CCK-8)、5-乙炔基-2′脱氧尿嘧啶核苷(EdU)、平板克隆形成、乳酸检测试剂盒、葡萄糖检测试剂盒、Transwell小室、实时荧光定量PCR(RT-qPCR)及蛋白免疫印迹(Western blotting)法对增殖活性、增殖率、克隆形成率、乳酸含量、葡萄糖消耗水平、细胞迁移数及上皮细胞间质化(EMT)相关因子表达水平进行测定。对照组、10、20、40 μmol/L安罗替尼组、阳性药物组NCI-H226细胞增殖活性、增殖率、克隆形成率、乳酸含量、葡萄糖消耗水平及N-钙黏蛋白(N-cadherin)、波形蛋白(vimentin)和纤维黏连蛋白(FN)mRNA和蛋白表达水平组间比较差异具有统计学意义(P<0.05)。20、40 μmol/L安罗替尼和阳性药物组细胞增殖活性高于对照组(P<0.05)。10、20、40 μmol/L安罗替尼组和阳性药物组细胞增殖率、克隆形成率、乳酸含量、葡萄糖消耗水平及N-cadherin、vimentin和FN mRNA和蛋白表达水平高于对照组(P<0.05)。安罗替尼可显著抑制人肺鳞癌NCI-H226细胞的糖酵解、增殖、克隆形成及迁移。
关键词:安罗替尼;肺癌;糖酵解;癌细胞增殖;克隆形成
中图分类号:R734.2 文献标志码:ADOI:10.3969/j.issn.1007-7146.2024.01.010
Effects of Anlotinib on Glycolysis, Proliferation and Colony Formation of Lung Cancer Cells
HU Yichuan1, 2, ZHU Shuyang1, ZHU Jiechen1*
(1. Department of Respiratory Medicine, Affiliated Hospital of Xuzhou Medical University, Xuzhou 221000, China;
2. Department of Respiratory and Critical Care Medicine, Suqian Zhongwu Hospital, Suqian 223800, China)
Abstract: To investigate the effects and mechanism of anlotinib intervention on glycolysis, proliferation, colony formation and migration of human lung cancer NCI-H226 cells, to provide reference for in vitro test of lung cancer. Human lung cancer NCI-H226 cells were divided into control group which is without intervention, experimental group involving 10, 20, 40 μmol/L anlotinib, and positive control group involving 20 μg/mL cisplatin. The cell counting kit-8 (CCK-8), 5-acetylene-2′ deoxyuracil riboside (EdU) staining, plate clone formation, lactic acid detection kit, glucose detection kit, Transwell assay, RT-qPCR and Western blotting (WB) assays were used to detect proliferation viability, proliferation, colony-formation ability, lactic acid content, glucose consumption level, cell migration number and expression level of related factor levels. The proliferation activity, proliferation rate, clone formation rate, lactate content, glucose consumption level, N-cadherin, vimentin and fibronectin (FN) of NCI-H226 cells in control group, experimental group and positive drug group. There were significant differences in mRNA and protein expression levels between groups (P<0.05). The cell proliferation activity of 20 and 40 μmol/L anlotinib and positive drug groups was higher than that of control group (P<0.05). The cell proliferation rate, clone formation rate, lactate content, glucose consumption level and mRNA and protein expression levels of N-cadherin, vimentin and FN in the experimental group and the positive drug group were higher than those in the control group (P<0.05). Anlotinib can significantly inhibit glycolysis, proliferation, colony formation and migration of human lung cancer NCI-H226 cells.
Key words: anlotinib; lung cancer; glycolysis; proliferation of cancer cells; colony formation
(Acta Laser Biology Sinica, 2024, 33(1): 080-089)
肺癌(lung cancer)為全球范围内对人类健康威胁较大的常见恶性肿瘤之一,其发病率和死亡率在我国位居首位[1]。由于早期缺乏特异性症状,肺癌被发现时大多已为中晚期。在肺癌中,非小细胞肺癌占85%以上[2]。非小细胞肺癌又分为肺腺癌、肺鳞癌和大细胞癌,肺鳞癌占30%[3-5]。肺鳞癌在临床中具有诊断时分期晚、中心性生长等特殊的病理特征,治疗难度较大[6]。因而,了解探究其相关机制对于治疗肺癌具有重要意义。肿瘤细胞与正常细胞相比,除了有无限增殖和迁移能力,代谢重排也是其另一重要特征。肿瘤细胞为适应增殖、逃避机体免疫系统杀伤等,在有氧条件下为获取能量主动选择糖酵解方式,即为Warburg效应[7]。有研究显示,多种肿瘤中可见上皮细胞间质化(epithelialization,EMT),其可以通过诱导代谢酶的活性变化来影响肿瘤细胞相关特征的变化[8]。安罗替尼是由中国正大天晴药业集团自主研发的小分子多靶点酪氨酸激酶抑制剂,可以有效地抑制血管内皮生长因子受体(vascular endothelial growth factor receptor,VEGF)、成纤维细胞生长因子受体(fibroblast growth factor receptor,FGF)和血小板衍生生长因子受体(platelet-derived growth factor receptor,PDGFR)等激酶,通过多靶点实现对癌细胞的抑制作用[9-12]。研究表明,在肺癌治疗中,表皮生长因子受体酪氨酸激酶抑制剂和免疫检查点抑制剂有一定疗效,但多数研究集中在肺腺癌中,对于肺鳞癌临床用药的相关研究较少,故进一步开展关于安罗替尼通过糖酵解途径对肺鳞癌NCI-H226细胞具体机制的研究,可以为其临床治疗肺鳞癌补充试验依据。因此,本研究旨在探究安罗替尼对肺鳞癌NCI-H226细胞糖酵解、增殖、克隆形成、迁移的影响及作用机制,为肺癌的体外试验提供数据支撑。
1 材料与方法
1.1 细胞来源、主要试剂与仪器
人肺鳞癌细胞NCI-H226购自中国科学院典型培养物保藏委员会细胞库。安罗替尼(anlotinib)购自正大天晴药业集团,顺铂购自上海源叶生物科技有限公司,胎牛血清购自美国Gibco公司,RPMI-1640培养基购自上海慧颖生物科技有限公司,活细胞计数(cell counting kit-8,CCK-8)试剂盒购自日本Dojindo公司,胰蛋白酶购自美国HyClone公司,乳酸检测试剂盒、葡萄糖检测试剂盒购自美国BioVision公司,5-乙炔基-2′-脱氧尿苷(5-acetylidene-2′-deoxyuridine,EdU)细胞增殖检测试剂盒购自生工生物工程(上海)股份有限公司,鼠抗人[N-钙黏蛋白(N-cadherin)、波形蛋白(vimentin)、纤维黏连蛋白(fibronectin,FN)、E-钙黏蛋白(E-cadherin)及β-actin]一抗、二抗包括碱性磷酸酶(alkaline phosphatase,AP)标记的羊抗鼠IgG(H+G)来源于武汉三鹰生物技术有限公司,引物由北京擎科生物科技有限公司合成。二氧化碳培养箱(MCO18AIC)购自日本三洋电机公司,酶标仪(IMARK)购自美国BIO-RAD公司,GelDoc2000型凝胶成像系统购自美国Backman公司。
1.2 方法
1.2.1 NCI-H226细胞培养
将NCI-H226细胞(密度≥80%)接种于培养板或培养皿中,使用RPMI-1640完全培养基(含10%胎牛血清、100 U/mL青霉素和100 μg/mL链霉素),并置于37℃、5% CO2、70%~80%湿度的培养箱中培养。
1.2.2 分组及给药
将NCI-H226细胞分为对照组、10、20、40 μmol/L安罗替尼组和阳性药物组,对照组细胞不做干预,10、20、40 μmol/L安罗替尼组分别以10、20、40 μmol/L安罗替尼进行干预,阳性药物组加入20 μg/mL顺铂进行干预,每组重复3次。
1.2.3 NCI-H226细胞的增殖活性测定
将细胞接种于96孔板中,接种密度为1×104个/孔。细胞分组与给药同1.2.2。分别加药处理24 h后,各孔加入体积分数为10%的CCK-8溶液;细胞与CCK-8试剂在37℃、5% CO2培养箱中孵育培养1 h后,在酶标仪上检测各孔细胞在450 nm处的光密度(OD450 nm)值。
1.2.4 NCI-H226细胞的增殖率测定
药物处理24 h后,分别与10 μmol/L EdU溶液在37℃、5% CO2培养箱中孵育培养2 h;然后,细胞先后经受4%组织细胞固定液室温固定15 min、0.3% Triton X-100溶液室温通透10 min和TAMRA染色反应体系溶液室温避光孵育30 min。最后,按照说明书用试剂盒提供的Hoechst 33342溶液对细胞进行核复染。固定、通透、反应之间分别用3% BSA进行3次洗涤。在荧光显微镜下观察并采集EdU红色荧光信号和Hoechst 33342蓝色荧光信号,并用ImageJ软件进行细胞数目确定。增值率计算公式如下:
增殖率/%=红色细胞数/蓝色细胞数×100% (1)
1.2.5 NCI-H226细胞的克隆形成率测定
将接种于6孔板的细胞(2×105个/孔)培养24 h后,经固定(甲醇15 min)、染色(结晶紫30 min)、清洗(磷酸盐缓冲液)风干后拍照,计算细胞克隆形成率。公式如下:
细胞克隆形成率/%=(克隆细胞数/接种细胞数)×100% (2)
1.2.6 NCI-H226细胞上清液中乳酸含量与葡萄糖消耗水平测定
用乳酸含量检测试剂盒检测细胞上清液中的乳酸水平,用葡萄糖含量检测试剂盒检测上清液中的葡萄糖消耗水平,以不含细胞的对照孔培养液中的葡萄糖质量浓度作为初始质量浓度。按如下公式计算葡萄糖消耗量:
葡萄糖消耗量=初始葡萄糖质量浓度-实测葡萄糖质量浓度 (3)
1.2.7 NCI-H226细胞的迁移能力测定
各组细胞在药物干预24 h后,重悬在无血清的RPMI-1640培养基中,并调整细胞密度为每毫升4.5×105个细胞。取200 μL细胞悬液接种到Transwell小室的上室中,下室则填充500 μL含10%胎牛血清的RPMI-1640培养基。将上述细胞迁移体系置于37℃、5% CO2培养箱中,24 h后,下室膜表面的细胞与甲醇室温孵育15 min,再与1%结晶紫染色液室温孵育20 min。最后,将小室置于光学显微镜下观察,并采集细胞图片。ImageJ软件分析计算迁移细胞数量(小室下表面紫色细胞数量)。
1.2.8 NCI-H226细胞中EMT相关因子mRNA
表达情况测定
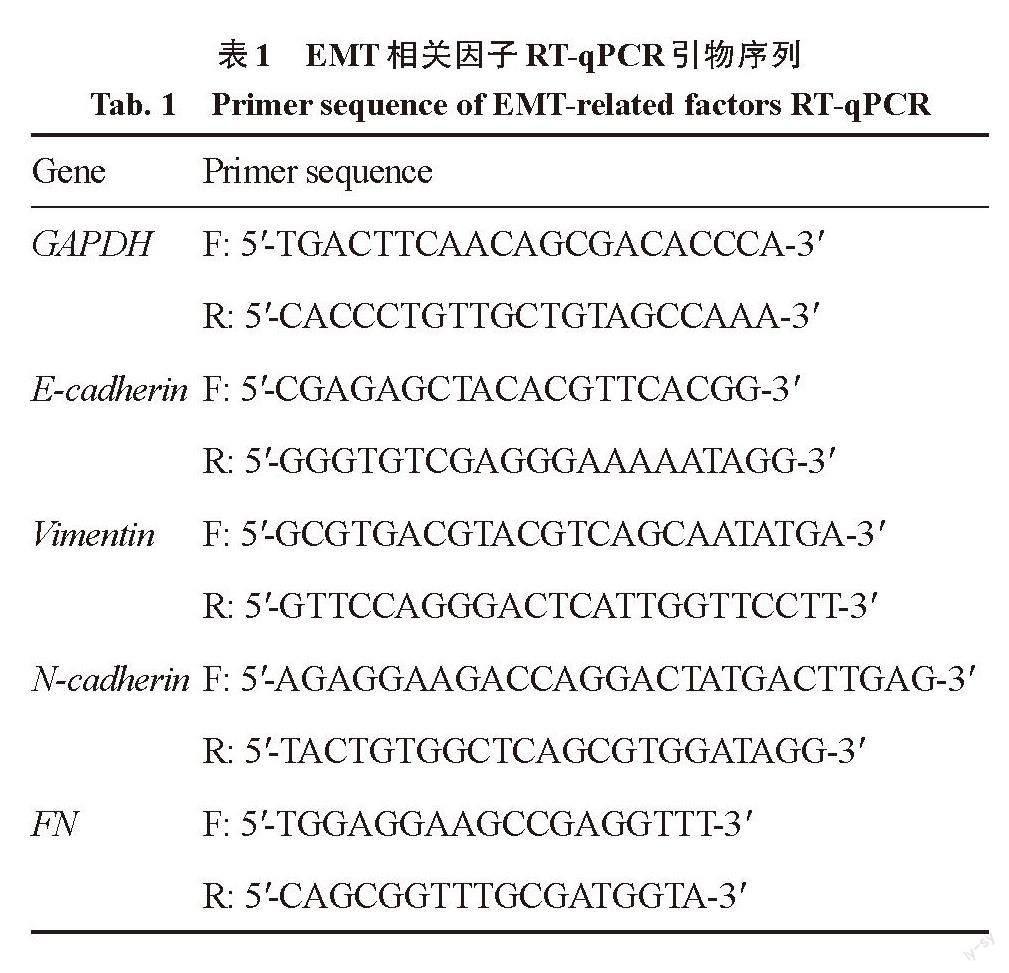
取干预24 h时的NCI-H226细胞,利用细胞/组织总RNA提取试剂盒提取各组干预后的细胞总RNA,具体步骤按照说明书进行;利用超微量分光光度计法检测提取RNA样品的质量浓度及纯度,取1 μg RNA作为模板,在逆转录试剂盒的帮助下在PCR仪中合成模板链cDNA;然后,取2 μL cDNA在SYBR qPCR MasterMix、特殊引物对的帮助下在实时荧光定量PCR(real time fluorescence quantitative PCR,RT-qPCR)仪中进行cDNA扩增。以GAPDH为内参,根据循环数(Ct)和2–ΔΔCt法计算目的mRNA相对表达水平,引物序列见表1。
表1 EMT相关因子RT-qPCR引物序列
Tab. 1 Primer sequence of EMT-related factors RT-qPCR
Gene Primer sequence
GAPDH F: 5′-TGACTTCAACAGCGACACCCA-3′
R: 5′-CACCCTGTTGCTGTAGCCAAA-3′
E-cadherin F: 5′-CGAGAGCTACACGTTCACGG-3′
R: 5′-GGGTGTCGAGGGAAAAATAGG-3′
Vimentin F: 5′-GCGTGACGTACGTCAGCAATATGA-3′
R: 5′-GTTCCAGGGACTCATTGGTTCCTT-3′
N-cadherin F: 5′-AGAGGAAGACCAGGACTATGACTTGAG-3′
R: 5′-TACTGTGGCTCAGCGTGGATAGG-3′
FN F: 5′-TGGAGGAAGCCGAGGTTT-3′
R: 5′-CAGCGGTTTGCGATGGTA-3′
1.2.9 NCI-H226細胞中EMT相关因子蛋白表达
水平测定
将细胞接种于6孔板,接种密度为1×105个/孔。各组细胞在药物作用24 h后,被放射免疫沉淀法(radio immunoprecipitation assay,RIPA)裂解液重悬并裂解;在4℃、12 000 r/min离心10 min后收集上清液,即总蛋白样品。蛋白样品先经过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(80~120 V恒压法)进行蛋白分离,再经过电泳法(300 mA恒流法)进行蛋白转膜。载有蛋白的聚偏二氟乙烯(polyvinglidene fluoride,PVDF)膜在5%脱脂牛奶中室温封闭1 h后,在4℃进行一抗孵育过夜或室温一抗孵育2 h;接下来,进行室温二抗孵育2 h。封闭、一抗孵育、二抗孵育和显影之间分别用Tris洗膜缓冲液进行3~5次膜洗涤。使用凝胶成像系统拍照记录,并用ImageJ软件进行蛋白灰度分析。
1.3 统计学分析
用GraphPad Prism 8软件作图,采用SPSS 26.0软件进行统计分析。符合正态分布的计量资料以平均值±标准差(x±s)表示,差异性分析采用单因素方差分析(多组间)和新复极差法检验(Dunnetts t)(两组间),P<0.05表示差异有统计学差异。
2 结果与分析
2.1 安罗替尼抑制NCI-H226细胞的增殖活性比较
干预24 h后,对照组、10、20、40 μmol/L安罗替尼组、阳性药物组NCI-H226细胞增殖活性分别为0.92±0.06、0.81±0.05、0.54±0.06、0.45±0.03、0.53±0.04,组间比较差异具有统计学意义(F=51.314,P<0.05)。对照组和10 μmol/L安罗替尼组间比较无统计学意义(P>0.05)。20、40 μmol/L安罗替尼组和阳性药物组细胞增殖活性低于对照组(P<0.05)。具体情况详见图1。
2.2 安罗替尼抑制NCI-H226细胞的增殖率
干预24 h后,对照组、10、20、40 μmol/L安罗替尼组、阳性药物组NCI-H226增殖率分别为(0.54±0.03)%、(0.46±0.04)%、(0.36±0.03)%、(0.26±0.03)%、(0.30±0.02)%,组间比较差异具有统计学意义(F=44.499,P<0.05)。对照组和10 μmol/L安罗替尼组间比较无统计学意义(P>0.05)。20、40 μmol/L安罗替尼和阳性药物组细胞增殖率低于对照组(P<0.05)。NCI-H226细胞的增殖率情况见图2。
2.3 安罗替尼抑制NCI-H226细胞的克隆形成能力比较
为了研究NCI-H226细胞的群体依赖性和增殖能力,本研究用平板克隆法测定了细胞的克隆形成能力。10、20、40 μmol/L安罗替尼组和阳性药物组处理24 h后,NCI-H226细胞的克隆数呈剂量依赖性降低。对照组、10、20、40 μmol/L安罗替尼组、阳性药物组NCI-H226细胞克隆形成率分别为(55.97±4.88)%、(46.63±5.32)%、(37.30±2.71)%、(12.30±4.26)%、(6.30±2.99)%,组间比较差异具有统计学意义(F=80.873,P<0.05)。对照组和10 μmol/L安罗替尼组间比较无统计学意义(P>0.05)。20、40 μmol/L安罗替尼和阳性药物组细胞克隆形成率低于对照组(P<0.05)。NCI-H226细胞克隆形成情况见图3。
2.4 安罗替尼抑制NCI-H226细胞的乳酸生成与
葡萄糖消耗水平比较
干预24 h,对照组、10、20、40 μmol/L安罗替尼组、阳性药物组NCI-H226细胞乳酸含量分别为(27.80±2.34)、(22.45±2.37)、(16.65±1.90)、(14.79±1.38)、(13.70±1.52)μmol·10-5 cell,葡萄糖消耗水平分别为(17.63±0.61)、(14.42±0.61)、(8.67±0.77)、(6.66±0.72)、(6.37±0.35)μmol·10-5
cell,组间比较差异具有统计学意义(F乳酸含量=27.867,P<0.05;F葡萄糖消耗水平=191.309,P<0.05)。10、20、40 μmol/L安羅替尼组和阳性药物组细胞乳酸含量、葡萄糖消耗水平低于对照组(P<0.05)。具体情况详见图4。
2.5 安罗替尼抑制NCI-H226细胞的迁移能力比较
干预24 h后,对照组、10、20、40 μmol/L安罗替尼组、阳性药物组NCI-H226细胞迁移数分别为(66.67±2.52)、(35.33±5.03)、(16.00±2.65)、(10.00±2.65)、(10.33±2.89)个,组间比较差异具有统计学意义(F=161.698,P<0.05)。10、20、40 μmol/L安罗替尼组和阳性药物组细胞迁移数低于对照组(P<0.05)。细胞的迁移情况详见图5。
2.6 安罗替尼对NCI-H226细胞中EMT相关因子mRNA表达水平比较
RT-qPCR检测结果显示:对照组、10、20、40 μmol/L安罗替尼组、阳性药物组E-cadherin mRNA相对表达量分别为1.00±0.09、1.19±0.03、1.56±0.06、1.73±0.06、1.85±0.06,N-cadherin mRNA相对表达量分别为1.00±0.10、0.75±0.03、0.55±0.06、0.44±0.04、0.38±0.05,vimentin mRNA相对表达量分别为1.00±0.10、0.73±0.06、0.54±0.05、0.44±0.09、0.40±0.04,FN mRNA相对表达量分别为1.00±0.11、0.87±0.04、0.70±0.07、0.64±0.06、0.48±0.04,组间比较差异具有统计学意义(FE-cadherin mRNA=87.843,FN-cadherin mRNA=54.231,Fvimentin mRNA=36.721,FFN mRNA=25.221,P均<0.05)。10、20、40 μmol/L安罗替尼组和阳性药物组E-cadherin mRNA相对表达量高于对照组,N-cadherin、vimentin、FN mRNA相对表达量低于对照组(P<0.05)。具体情况详见图6。
2.7 安罗替尼对NCI-H226细胞中EMT相关因子的蛋白表达水平比较
蛋白免疫印迹(Western blotting,WB)检测结果显示:对照组、10、20、40 μmol/L安罗替尼组、阳性药物组NCI-H226细胞E-cadherin蛋白水平分别为0.22±0.04、0.43±0.02、0.51±0.05、0.63±0.02、0.63±0.02,N-cadherin蛋白水平分别为0.64±0.04、0.36±0.03、0.25±0.02、0.16±0.02、0.19±0.02,vimentin蛋白水平分别为0.65±0.03、0.64±0.04、0.55±0.01、0.47±0.04、0.44±0.02,FN蛋白水平分别为0.74±0.02、0.65±0.04、0.43±0.02、0.45±0.04、0.33±0.02,组间比较差异具有统计学意义(FE-cadherin=80.755,FN-cadherin=147.455,Fvimentin=67.650,FFN=108.835,P均<0.05)。10、20、40 μmol/L安罗替尼组和阳性药物组E-cadherin蛋白高于对照组,N-cadherin、vimentin、FN蛋白低于对照组(P<0.05)。具体情况详见图7。
3 讨论
肺癌作为常见的恶性肿瘤之一,近年来发病率逐渐升高[15]。目前临床上主要采取手术治疗、放化疗、靶向治疗等手段对肺癌进行治疗,但肺癌的局部复发、远处转移涉及复杂的生物学过程[16-17]。肺鳞癌属于肺癌中的一种组织学类型,其增殖、迁移涉及诸多功能及结构异常。Warburg效应是指在肿瘤细胞生长繁殖时,即使氧气足够,它们依旧会进行糖酵解代谢反应,葡萄糖消耗加快,乳酸产量增加[18]。安罗替尼具有全面、多靶点、高选择性、强效抑制的特点。相关研究表明,安罗替尼可以有效抑制多种癌细胞增殖和转移[19-20]。本研究结果显示,安罗替尼可以抑制肺癌细胞的增殖和迁移,这与前人关于安罗替尼抗癌功能的试验结果相一致[21]。吴国成等[22]的研究表明,黄连素能够调节非小细胞肺癌A549中的糖酵解水平。在本研究中,NCI-H226细胞经安罗替尼干预处理后乳酸含量与葡萄糖消耗水平逐渐降低,说明安罗替尼能够抑制肺鳞癌NCI-H226细胞糖酵解水平、增殖、克隆形成及迁移。以上结果揭示了安罗替尼在肺癌糖酵解、增殖、克隆形成及迁移过程中发挥重要作用。
研究显示,肿瘤细胞代谢重编与EMT进程及肿瘤细胞转移关系密切[23-24]。EMT是指上皮细胞在一些因素作用下,失去极性及细胞间紧密连接和黏附连接,获得浸润和迁移能力,变成具备间充质细胞形态和特性的细胞的改变,被认为是肿瘤细胞发生发展和转移过程中至为关键的环节。抑制EMT被认为是治疗肿瘤细胞转移的有效方式。在乳腺癌、胃癌、黑色素瘤、肝癌等的迁移过程中均伴随着EMT的发生[25-28]。在EMT过程中,上皮表型细胞的减少和间质表型细胞的增加,使细胞变成纺锤状,在此过程中,细胞的运动性和迁移能力更强[29-30]。De Marcondes等[31]的研究表明,安罗替尼抑制直肠癌细胞的迁移与EMT关系密切。本研究检测了安罗替尼处理NCI-H226细胞24 h后EMT的表达情况,发现处理后NCI-H226细胞N-cadherin、vimentin和FN表达均显著下降,而E-cadherin表达明显升高。这些结果说明,在安罗替尼处理后,NCI-H226细胞的EMT进程被抑制,癌细胞迁移能力受到抑制,表明安罗替尼能够抑制肺鳞癌NCI-H226细胞的EMT进程。
综上所述,安罗替尼可抑制人肺鳞癌NCI-H226细胞糖酵解水平、增殖、克隆形成、迁移及EMT进程。本研究以期为进一步丰富安罗替尼治疗肺癌提供新的试验基础。
参考文献(References):
[1] 郑荣寿, 孙可欣, 张思维, 等. 2015年中国恶性肿瘤流行情况分析[J]. 中华肿瘤杂志, 2019, 41(1): 19-28.
ZHENG Rongshou, SUN Kexin, ZHANG Siwei, et al. Prevalence of malignant tumors in China in 2015[J]. Chinese Journal of Cancer, 2019, 41(1): 19-28.
[2] CUNLI Y, BIN H, XI Y, et al. Neoadjuvant sintilimab combined with chemotherapy in resectable locally advanced non-small cell lung cancer: case series and literature review[J]. World Journal of Surgical Oncology, 2023, 21(1): 5.
[6] 方明. miR-556-3p靶向NUAK1對肺鳞癌细胞增殖和侵袭迁移抑制的研究 [D]. 南昌: 南昌大学, 2021.
FANG Ming. Inhibition of proliferation, invasion and migration of lung squamous cell cells by miR-556-3p targeting NUAK1[D]. Nanchang: Nanchang University, 2021.
[7] CHANG Y, SU M, FENG L, et al. Vitamin C inhibits the growth of colorectal cancer cell HCT116 and reverses the glucose-induced oncogenic effect by downregulating the Warburg effect[J]. Medical Oncology, 2023, 40(10): 297.
[8] HOLM T M, YEO S, TURNER K M, et al. Targeting autophagy in thyroid cancer: EMT, apoptosis, and cancer stem cells[J]. Frontiers in Cell and Developmental Biology, 2022,10: 821855.
[9] 罗详冲. 安罗替尼治疗肺癌的临床研究进展[J]. 中国肿瘤生物治疗杂志, 2019, 26(6): 710-714.
LUO Xiangchong. Clinical research progress of antirotinib in the treatment of lung cancer[J]. Chinese Journal of Tumor Biotherapy, 2019, 26(6): 710-714
[10] JAYSON G C, KERBEL R, ELLIS L M, et al. Antiangiogenic therapy in oncology: current status and future directions[J]. Lancet, 2016, 388(10043): 518-529.
[11] BABINA I S, TURNER N C. Advances and challenges in targeting FGFR signalling in cancer[J]. Nature Reviews Cancer, 2017, 17(5): 318-332.
[12] 肖琳, 王志武, 刘春秋, 等. 晚期非小细胞肺癌安罗替尼治疗前后中医证素、证型演变特征 [J]. 中医药导报杂志, 2020, 26(2): 5.
XIAO Lin, WANG Zhiwu, LIU Chunqiu, et al. Evolution of TCM syndrome elements and syndrome types before and after treatment of advanced non-small cell lung cancer with arotinib[J]. Journal of Chinese Medicine, 2020, 26(2): 5.
[13] WANG M, ZHU J, ZHAO F, et al. Transcriptome analyses identify a metabolic gene signature indicative of antitumor immunosuppression of EGFR wild type lung cancers with low PD-L1 expression[J]. Frontiers in Oncology, 2021, 11: 643503.
[14] 姜玲, 林芷伊, 李娜, 等. 非小细胞肺癌PD-1/PD-L1的表达与EGFR突变相关性研究[J]. 中国肺癌杂志, 2021, 24(9): 623-631.
JIANG Ling, LIN Zhiyi, LI Na, et al. Correlation between expression of PD-1/PD-L1 and EGFR mutation in non-small cell lung cancer[J]. Chinese Journal of Lung Cancer, 2021, 24(9): 623-631.
[15] 吴保军, 王卓, 董宇, 等. 肺癌恶性胸腔积液中稀有肿瘤细胞的鉴定与单细胞测序分析[J]. 遗传, 2019, 41(2): 175-184.
WU Baojun, WANG Zhuo, DONG Yu, et al. Identification and single cell sequencing of rare tumor cells in malignant pleural effusion of lung cancer[J]. Genetics, 2019, 41(2): 175-184.
[16] 莫益俊, 张建华, 颜峻, 等. 靶向程序性死亡分子1抑制剂治疗晚期鳞状非小细胞肺癌2例并文献复习[J]. 临床荟萃, 2019, 34(3): 237-243.
MO Yijun, ZHANG Jianhua, YAN Jun, et al. Targeting programmed death molecule-1 inhibitors in the treatment of advanced squamous non-small cell lung cancer: a report of 2 cases and literature review[J]. Clinical Review, 2019, 34(3): 237-243.
[17] 武亚娟, 赵军, 姜蕾蕾, 等. 晚期非小细胞肺癌靶向治疗后失败模式及联合放疗临床意义 [J]. 中华放射医学与防护杂志, 2019, 39(2): 113-120.
WU Yajuan, ZHAO Jun, JIANG Leilei, et al. Failure pattern and clinical significance of combined radiotherapy after targeted therapy for advanced non-small cell lung cancer[J]. Chinese Journal of Radiology and Protection, 2019, 39(2): 113-120.
[18] YU M, CHEN S, HONG W, et al. Prognostic role of glycolysis for cancer outcome: evidence from 86 studies[J]. Journal of Cancer Research and Clinical Oncology, 2019, 145(4): 967-999.
[19] XIE C, WAN X, QUAN H, et al. Preclinical characterization of anlotinib, a highly potent and selective vascular endothelial growth factor receptor-2 inhibitor[J]. Cancer Science, 2018, 109(4): 1207-1219.
[20] HE C, WU T, HAO Y. Anlotinib induces hepatocellular carcinoma apoptosis and inhibits proliferation via Erk and Akt pathway[J]. Biochemical and Biophysical Research Communications, 2018, 503(4): 3093-3099.
[21] 劉细帮, 朱林芝, 焦德敏, 等. 安罗替尼联合氯喹促进人非小细胞肺癌细胞系H1299凋亡 [J]. 基础医学与临床, 2021, 41(7): 1018-1023.
LIU Xibang, ZHU Linzhi, JIAO Demin, et al. Anlotinib combined with chloroquine promotes apoptosis of human non-small cell lung cancer cell line H1299[J]. Basic Medicine and Clinic, 2021, 41(7): 1018-1023.
[22] 吴国成, 陈焕. 黄连素调节非小细胞肺癌细胞糖酵解水平并抑制A549细胞EMT的发生[J]. 临床肺科杂志, 2020, 25(8): 1206-1211.
WU Guocheng, CHEN Huan. Berberine regulates glycolysis in non-small cell lung cancer cells and inhibits EMT in A549 cells[J]. Journal of Clinical Pulmonology, 2020, 25(8): 1206-1211.
[23] CUI H, GAO Q, ZHANG L, et al. Knockdown of FOXK1 suppresses liver cancer cell viability by inhibiting glycolysis[J]. Life Sciences, 2018, 213: 66-73.
[24] GUIDO C, WHITAKER-MENEZES D, CAPPARELLI C, et al. Metabolic reprogramming of cancer-associated fibroblasts by TGF-β drives tumor growth: connecting TGF-β signaling with “Warburg-like” cancer metabolism and L-lactate production[J]. Cell Cycle, 2012, 11(16): 3019-3035.
[25] TANG Y, DURAND S, DALLE S, et al. EMT-Inducing transcription factors, drivers of melanoma phenotype switching, and resistance to treatment[J]. Cancers (Basel), 2020, 12(8): 2154.
[26] ZHA Z, LI J. MicroRNA?125a?5p regulates liver cancer cell growth, migration and invasion and EMT by targeting HAX1[J]. International Journal of Molecular Medicine, 2020, 46(5): 1849-1861.
[27] TIAN S, PENG P, LI J, et al. SERPINH1 regulates EMT and gastric cancer metastasis via the Wnt/β-catenin signaling pathway[J]. Aging (Albany NY), 2020, 12(4): 3574-3593.
[28] DU L, LI X, ZHEN L, et al. Everolimus inhibits breast cancer cell growth through PI3K/AKT/mTOR signaling pathway[J]. Molecular Medicine Reports, 2018, 17(5): 7163-7169.
[29] LI J, ZHANG J T, JIANG X, et al. The cystic fibrosis transmembrane conductance regulator as a biomarker in non-small cell lung cancer[J]. International Journal of Oncology, 2015, 46(5): 2107-2115.
[30] CHEN S, ZHAO E. Development and validation of a robust epithelial-mesenchymal transition (EMT)-related prognostic signature for hepatocellular carcinoma[J]. Clinics and Research in Hepatology and Gastroenterology, 2021, 45(5): 101587.
[31] DE MARCONDES P G, MORGADO-D?AZ J A. The role of EphA4 signaling in radiation-induced EMT-like phenotype in colorectal cancer cells[J]. Journal of Biological Chemistry, 2017, 118(3): 442-445.
