贝伐珠单抗靶向治疗卵巢癌患者对肿瘤标志物的影响
2024-04-12吴铃叶健文林培红赖雪丹
吴铃 叶健文 林培红 赖雪丹
卵巢癌是一种高度侵袭性的肿瘤,卵巢癌新生血管形成和生长在疾病治疗中具有重要的作用机制。在肿瘤组织中,卵巢癌细胞和周围组织可释放出大量的血管内皮生长因子(vascular endothelial growth factor,VEGF),促进血管内皮细胞的增殖和迁移,血管平衡紊乱,从而形成新的血管网络,为肿瘤提供充足的营养和氧气,加快肿瘤发展[1]。贝伐珠单抗是一种靶向治疗药物,通过抑制肿瘤新生血管的形成和生长,有效提高卵巢癌患者的治疗反应率,研究显示其可显著增加患者的无进展生存期、改善总生存期,且减少复发风险[2]。尽管抗血管生成治疗在卵巢癌中取得了一定的进展,但目前针对贝伐珠单抗的靶向治疗在卵巢癌治疗中仍处于实验室和临床研究阶段,存在治疗效果有限、药物耐药性的发展、不适宜用于某些患者群体等问题,尚需进一步的研究来验证其安全性和疗效。本研究选择福建医科大学附属福州市第一医院诊治的80例卵巢癌患者为研究对象,采用对比研究法探讨贝伐珠单抗靶向治疗卵巢癌的优势和安全性,现报道如下。
1 资料与方法
1.1 一般资料
选取2019年1月—2021年12月福建医科大学附属福州市第一医院收治的80例卵巢癌患者。纳入标准:(1)诊为卵巢癌。(2)治疗耐受。(3)预计生存期超过6个月。(4)8~80岁患者。(5)身体状况良好,具备较好的心肺、肝肾等基本功能。(6)卡氏评分≥70分,有较好的生活能力和心理状况。排除标准:(1)孕妇或哺乳妇女。(2)合并有其他类型的恶性肿瘤。(3)患有重要的心血管疾病、免疫系统疾病、肝功能不全等严重并发症的患者。(4)接受过其他形式的治疗。根据不同治疗药物进行分组,分别纳入化疗组和靶向组,每组40例。化疗组年龄53~80岁,平均(69.10±4.33)岁;病理分期ⅢB期19例、Ⅳ期21例;高分化20例、低中分化20例;靶向组年龄54~75岁,平均(68.60±4.66)岁;病理分期ⅢB期20例、Ⅳ期20例;高分化21例、低中分化19例。2组一般资料比较,差异无统计学意义(P>0.05),具有可比性。本研究获得福建医科大学附属福州市第一医院伦理委员会批准,受试者知情、了解并自愿签署同意书后参与研究。
1.2 方法
文章中体现了中国抗癌协会妇科肿瘤专业委员会编写的《卵巢恶性肿瘤诊断与治疗指南(2021年版)》[3]的临床参考。
1.2.1 化疗组
给药前12 h和6 h分别肌内注射地塞米松(国药集团容生制药有限公司,国药准字H41020036,规格:1 mL:5 mg)20 mg,输注前30 min静脉滴注盐酸异丙嗪(丹东医创药业有限责任公司,国药准字H21020328,规格:2 mL:50 mg)50 mg+0.9%氯化钠注射液20 mL、西咪替丁(国药集团容生制药有限公司,国药准字H20058427,规格:2 mL:30 mg)300 mg+0.9%氯化钠注射液20 mL和地塞米松10~20 mg;第1、8天,于30 min内静脉注射75 mg/m2多西他赛(美国LC labs,国药准字H20050879,规格:100 mg/支×6支);第1~3天,静脉注射75 mg/m2顺铂(齐鲁制药有限公司,国药准字H20024060,规格:10 mg/支×5支),每21天重复;治疗总周期21 d,共完成3个治疗周期化疗。
1.2.2 靶向组
开展常规化疗,具体方法同化疗组,加以贝伐珠单抗注射液(齐鲁制药有限公司,国药准字S20190040,规格:4 mL:100 mg)靶向治疗,具体方法如下:贝伐珠单抗注射液以7.5 mg/kg剂量静脉滴注;每21天进行肝肾功能的检测,无异常表现可重复使用,治疗总周期21 d,共完成3个治疗周期。
1.3 观察指标
(1)行胸部CT增强扫描确定肿块大小,行头颅MRI、腹部和骨扫查确定是否有远处转移,并参照世界卫生组织实体瘤疗效评价标准判断近期疗效,目标病灶全部消失且维持4周为完全缓解;基线病灶长径总和缩小程度≥30%且维持4周为部分缓解,基线病灶长径总和无变化或增加程度≤20%为稳定;基线病灶长径总和增加程度>20%为进展[3]。客观缓解率=(完全缓解+部分缓解)例数/总例数×100%;疾病控制率=(完全缓解+部分缓解+稳定)例数/总例数×100%。(2)取空腹肘静脉血15 mL于抗凝管中,化学免疫发光法测定肿瘤标志物蛋白芯片中糖链抗原125(glycoantigens in protein chips-125,CA-125)、人附睾蛋白4(human epididymal protein 4,HE4)水平,酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)测定血清VEGF水平,碱性磷酸酶染色法的T细胞亚群进行检测CD3+、CD4+、CD4+/CD8+百分比,所有检测均严格按照配套试剂盒说明书操作。(3)癌症患者生命质量测定量表(quality of life scale for cancer patients,FACT-G):评估个体在生理、社会/家庭、情感、功能4个方面的状况来得出综合评分,涉及27个项目,总分范围为0~108分,得分越高则表示个体的生活质量越好[4]。抑郁自评量表(self-rating depression scale,SDS)、焦虑自评量表(self-rating anxiety scale,SAS)包含一系列描述抑郁或焦虑症状的项目,被试者需要根据自己的实际感受选择适合自己的答案,总分范围为0~100分,最终得分越高则表示抑郁或焦虑程度越严重[5]。
1.4 统计学处理
采用SPSS 21.0统计学软件进行数据分析。计量资料以(±s)表示,组内比较采用配对样本均数t检验,组间比较采用独立样本均数t检验;计数资料以n(%)表示,采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 2组近期疗效比较
治疗后,靶向组客观缓解率、疾病控制率高于化疗组,差异有统计学意义(P<0.05)。见表1。
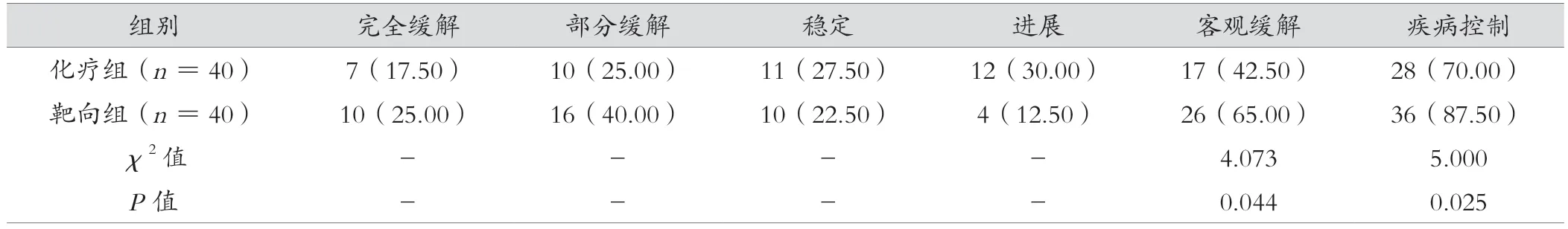
表1 化疗组与靶向组近期疗效比较[例(%)]
2.2 2组治疗前后肿瘤标志物、VEGF指标比较
治疗后,靶向组CA-125、HE4、VEGF指标低于化疗组,差异有统计学意义(P<0.05)。见表2。
表2 化疗组与靶向组治疗前后肿瘤标志物、VEGF指标比较(±s)
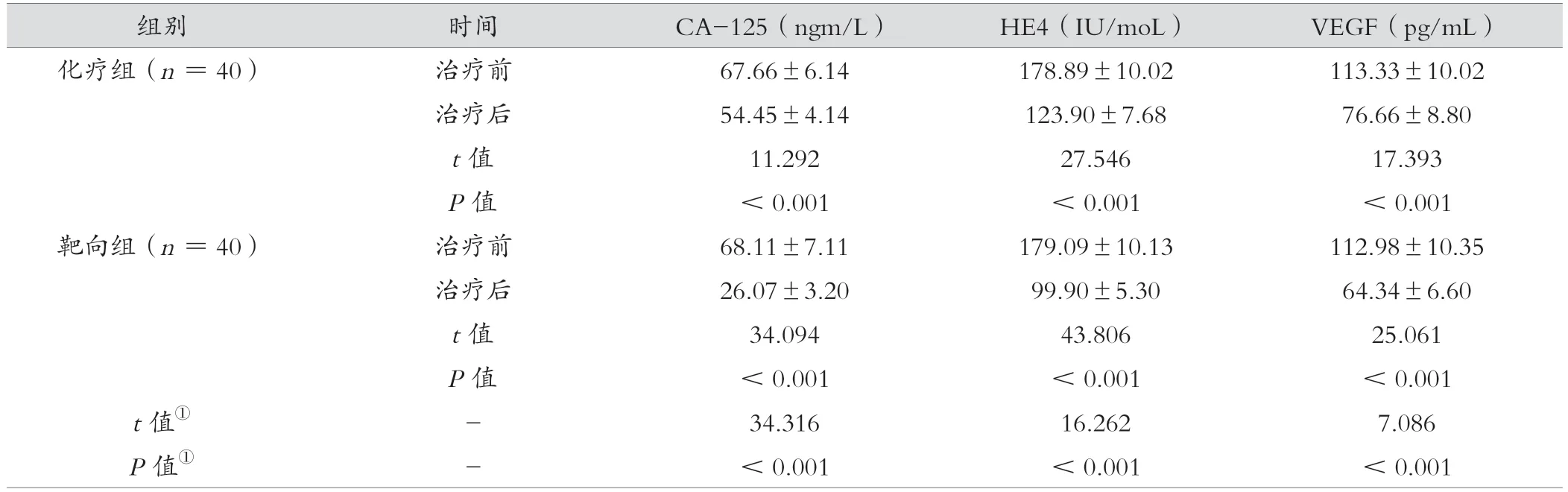
表2 化疗组与靶向组治疗前后肿瘤标志物、VEGF指标比较(±s)
注:①表示治疗后组间比较。
组别时间CA-125(ngm/L)HE4(IU/moL)VEGF(pg/mL)化疗组(n=40)治疗前67.66±6.14178.89±10.02113.33±10.02治疗后54.45±4.14123.90±7.6876.66±8.80 t值11.29227.54617.393 P值<0.001<0.001<0.001靶向组(n=40)治疗前68.11±7.11179.09±10.13112.98±10.35治疗后26.07±3.2099.90±5.3064.34±6.60 t值34.09443.80625.061 P值<0.001<0.001<0.001 t值①-34.31616.2627.086 P值①-<0.001<0.001<0.001
2.3 2组治疗前后免疫指标比较
治疗后,靶向组CD3+、CD4+、CD4+/CD8+高于化疗组,差异有统计学意义(P<0.05)。见表3。
表3 化疗组与靶向组治疗前后免疫指标比较(±s)
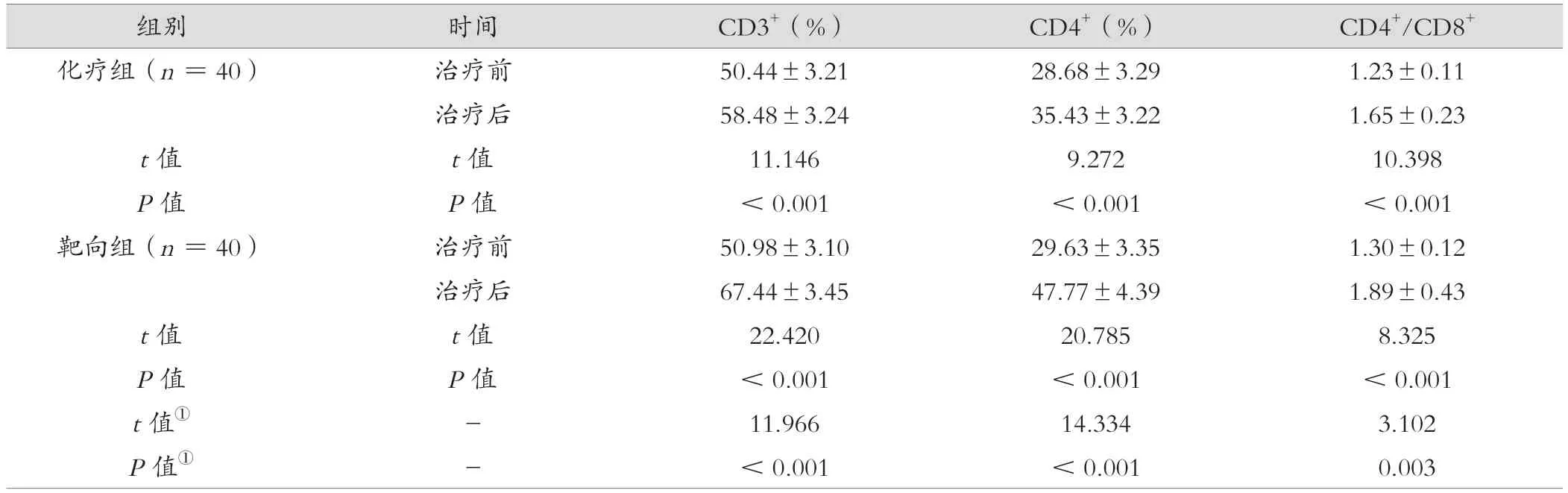
表3 化疗组与靶向组治疗前后免疫指标比较(±s)
注:①表示治疗后组间比较。
组别时间CD3+(%)CD4+(%)CD4+/CD8+化疗组(n=40)治疗前50.44±3.2128.68±3.291.23±0.11治疗后58.48±3.2435.43±3.221.65±0.23 t值t值11.1469.27210.398 P值P值<0.001<0.001<0.001靶向组(n=40)治疗前50.98±3.1029.63±3.351.30±0.12治疗后67.44±3.4547.77±4.391.89±0.43 t值t值22.42020.7858.325 P值P值<0.001<0.001<0.001 t值①-11.96614.3343.102 P值①-<0.001<0.0010.003
2.4 2组治疗前后FACT-G、SDS、SAS评分比较
治疗后,靶向组FACT-G、SDS、SAS评分均得到改善,靶向组FACT-G、SDS、SAS评分优于化疗组,差异有统计学意义(P<0.05)。见表4。
表4 化疗组与靶向组治疗前后FACT-G、SDS、SAS评分比较(分,±s)
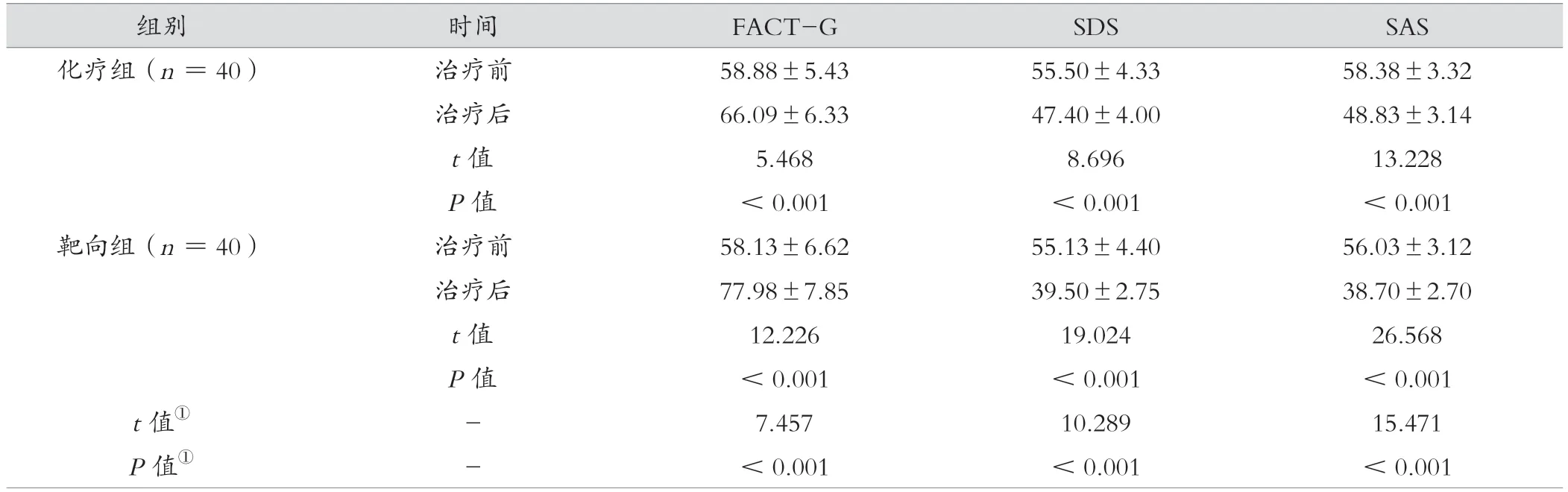
表4 化疗组与靶向组治疗前后FACT-G、SDS、SAS评分比较(分,±s)
注:①表示治疗后组间比较。
组别时间FACT-GSDSSAS化疗组(n=40)治疗前58.88±5.4355.50±4.3358.38±3.32治疗后66.09±6.3347.40±4.0048.83±3.14 t值5.4688.69613.228 P值<0.001<0.001<0.001靶向组(n=40)治疗前58.13±6.6255.13±4.4056.03±3.12治疗后77.98±7.8539.50±2.7538.70±2.70 t值12.22619.02426.568 P值<0.001<0.001<0.001 t值①-7.45710.28915.471 P值①-<0.001<0.001<0.001
3 讨论
卵巢癌的早期病情对化疗非常敏感,化疗在卵巢癌治疗中起到关键作用,常用药物包括紫杉醇和顺铂等,通过化疗可以杀灭残留肿瘤细胞,控制肿瘤的生长,缓解症状并提高患者的生活质量,减少复发风险[6]。长期接受化疗可能导致药物耐受性的发展,使化疗药物对肿瘤细胞的杀伤效果降低。另外化疗药物不仅会对肿瘤细胞产生作用,也对正常细胞造成损伤,引发一系列副作用,如恶心、呕吐、脱发和免疫功能下降等,同时对患者的身体、心理和社交状态都会带来影响,进而影响患者的生活质量[7]。靶向治疗是一种针对某些特定分子靶点的治疗方法,旨在通过抑制或阻断这些特定分子的功能来治疗疾病。它与常规的放化疗不同,不是广谱杀伤所有细胞,而是选择性地作用于癌细胞或其他疾病相关的异常细胞,在最大程度上减少对正常细胞的损害。靶向治疗在许多肿瘤类型和其他疾病的治疗中已经取得了一定根据特定的疾病和患者的基因和分子特征,医生可以根据个体情况选择合适的靶向治疗方案。
贝伐珠单抗是一种抗体药物,也被称为VEGF抑制剂,可以用于治疗卵巢癌患者,它的作用机制主要包括以下几个方面:(1)通过结合血液中的VEGF,阻断其与其受体的结合,从而抑制VEGF信号通路的激活,抑制卵巢癌新生血管的形成和生长。(2)新生血管的形成是肿瘤生长和转移的前提条件之一,贝伐珠单抗可以阻断VEGF通过与其受体结合而引发的下游信号通路,抑制肿瘤血管内皮细胞的增殖和迁移,从而减少新生血管的形成[8-9]。(3)贝伐珠单抗可以导致新生血管内皮细胞的凋亡和血管的破坏,从而阻断肿瘤血管的供应,导致肿瘤缺血和萎缩。肿瘤标志物CA-125和HE4是常用于卵巢癌的筛查和监测指标。其水平与卵巢癌的进展和预后密切相关。在大多卵巢癌患者中(约70%),CA-125水平会升高;因此,CA-125常被用作在高风险人群中筛查卵巢癌,以及在已经诊断出卵巢癌的患者中进行疾病进展和治疗反应的监测[10]。临床研究已证实,HE4水平不受月经周期及绝经状态影响,其值异常升高与疾病发展密切相关,可作为癌基因或抑癌基因促进或抑制肿瘤发生进展因子[11]。研究表明,贝伐珠单抗治疗卵巢癌患者可以对CA-125和HE4这2个肿瘤标志物产生影响[12]。在一些卵巢癌患者中,贝伐珠单抗治疗可以导致肿瘤标志物CA-125和HE4水平下降,这可能表明患者的肿瘤负荷减轻、肿瘤细胞被抑制或死亡[13]。本研究中显示,经贝伐珠单抗靶向治疗卵巢癌患者的靶向组CA-125和HE4水平低于单独化疗治疗组,这意味着免疫细胞治疗可以增强化疗的疗效,并对卵巢癌的治疗产生积极影响。而VEGF的降低提示贝伐珠单抗治疗对肿瘤新生血管形成和生长的抑制作用,进而发挥治疗效果。贝伐珠单抗通过多种机制改善卵巢癌患者的肿瘤标志物CA-125、HE4和降低VEGF水平,它不仅可以直接抑制肿瘤细胞的生长和扩散,同时还可以激活免疫系统,增强对癌细胞的攻击能力,这些作用机制共同决定了贝伐珠单抗对于卵巢癌患者的治疗效果。
卵巢癌可以通过多种途径来干扰宿主免疫系统,从而逃避免疫监测和攻击。本研究结果显示,靶向组CD3+、CD4+、CD4+/CD8+指标呈更高水平,提示患者经联合治疗后免疫功能改善程度更佳。CD3+和CD4+代表T淋巴细胞的亚群,而CD4+/CD8+比值则是判断免疫应答状态的一个指标,这些指标的显著升高可能意味着免疫细胞数量和功能的提高。贝伐珠单抗可以增强患者免疫系统对癌细胞的攻击能力,激活免疫细胞,促使它们识别和杀死癌细胞,这种免疫调节的作用可以提高患者的生存质量,并增强其抵抗力,减少感染等并发症的发生[14]。卵巢癌患者往往面临身体变化、治疗副作用和长期治疗带来的心理压力等问题,贝伐珠单抗作为一种有效的治疗手段,可以减轻或缓解癌症患者的疼痛和不适感,改善其生活质量,从而提高患者的心理情绪。
综上所述,贝伐珠单抗靶向治疗通过阻断血管生成免疫调节、抑制肿瘤新生血管形成和生长等多种机制,增强治疗效果,提高患者生活质量和改善心理情绪。针对卵巢癌不同亚型和临床特点的分子标志物,未来研究中应不断探索其他免疫细胞治疗方式,努力发展个性化的免疫细胞治疗联合化方案,以提高治疗效果并减少毒副作用。
