中医药对血管性认知障碍中调节性细胞死亡的调控作用研究进展△
2024-04-12钟奕黄川孙乐马培许利嘉肖培根
钟奕,黄川,孙乐,马培,许利嘉,肖培根*
1.中国医学科学院 北京协和医学院 药用植物研究所,北京 100193;2.教育部中草药物质基础与资源利用重点实验室,北京 100193
血管性认知障碍(VCI)是指脑血管病危险因素(如高血压病、糖尿病等)、明显(如脑梗死和脑出血等)或不明显的脑血管病(如白质疏松和慢性脑缺血)引起的,从轻度认知障碍到痴呆的一大类综合征,涵盖了血管源性认知损害从轻到重的整个发病过程[1]。VCI 和阿尔茨海默病是健康老龄化的主要障碍,也是工业化世界老年人慢性残疾和生活质量下降的主要原因,造成全球每年近6000 亿美元的经济负担,而发病率预计在未来50 年内将会翻4 番[2]。流行病学研究表明,我国的认知障碍发病人数呈上升趋势,在65 岁以上的老年人群中,轻度认知障碍总体患病率为20.8%,其中42.0%是由脑血管病和血管危险因素所致[3],长期以来受到广泛关注。维护老年人的认知健康和预防痴呆症是科学和公共卫生的一个重要优先事项。
目前,VCI 的主要防治手段是通过治疗血管疾病和干预其他VCI 危险因素进行干预,缺乏改变疾病进程的药物治疗[4]。因此,探究VCI 发病机制及寻找新的治疗策略,改善VCI 患者预后成为亟待解决的问题。已有的证据显示,调节性细胞死亡(regulated cell death,RCD)与VCI 密切相关,可能是导致VCI 疾病进展的核心因素,但其确切机制仍不明确,不同的RCD 途径之间的关系仍然未知[5]。因此,调控RCD 从而保护神经细胞,是VCI治疗领域的潜在有效策略。近年来,大量中医药防治VCI 的临床疗效和药理研究表明,中医药具有多靶点、多途径改善血管风险因素,降低神经系统损伤的优势,在VCI 的治疗方面取得了显著成果[6]。其研究也从单一经验方的临床疗效评估,逐渐向中医复方、中药及中药单体的体内外作用机制研究拓展。通过中医的手段调控RCD 治疗VCI显示出较好的发展前景,但尚未有关于中医药通过调控RCD 保护神经细胞并改善VCI 的系统综述。本文首先阐明了RCD 与VCI 的关系,然后综述了近15 年内发现或阐明详细机制的、研究较为丰富的4 种RCD 及中医药对其的改善作用、防治VCI 的机制,最后对中医药对RCD 的调控作用机制及其防治VCI 的价值进行总结与展望,以期为临床治疗提供参考。
1 RCD与VCI
RCD 是指依赖于专门的细胞和分子机制控制的细胞主动有序的死亡,旨在清除多余的、不可逆损伤的、和/或潜在的有害细胞。细胞死亡命名委员会(NCCD)已认定十几种RCD:细胞凋亡、坏死(necroptosis)、细胞焦亡(pyroptosis)、铁死亡(ferroptosis)、多聚二磷酸腺苷-核糖聚合酶-1(PARP-1)依赖性细胞死亡(parthanatos)、自噬依赖性细胞死亡(autophagy-dependent cell death)等[7]。RCD 普遍存在于生命活动过程中,对于生物体的正常发育和体内稳态的维持至关重要,过多或不足都会导致疾病,包括神经退行性疾病、脑血管疾病、自身免疫性疾病和癌症等,在应激反应、稳态调节和疾病中发挥着重要作用[8-9]。
血管病变导致脑血流量持续降低,进而慢性脑灌注不足,这是VCI 的主要发病原因[10]。认知障碍的发生是神经细胞丢失的直接表现之一。脑血流量降低将直接引起葡萄糖和氧气供应减少,导致生物能障碍和离子失衡,引发神经元内缺氧去极化导致的兴奋性毒性[5]。此外,慢性脑灌注不足激活分子和细胞损伤级联反应,通过氧化应激、炎症和基质金属蛋白酶等相关通路的激活,破坏神经血管单元的完整性,导致程序性神经元和神经胶质细胞死亡,最终造成结构损伤,如脑白质损伤、微血管损伤和海马萎缩。细胞凋亡和坏死是2 种典型细胞死亡方式,临床上已证实在其VCI中发生[5]。炎症在分子水平上与细胞死亡密切相关。最近研究表明,炎症小体信号通路激活后,产生白细胞介素-1β(IL-1β)和IL-18,并启动多种细胞死亡途径,如凋亡、焦亡和继发性坏死,表明炎症小体可能参与VCI 的发生发展[5]。近年来相关研究表明,缺血后脑组织内发生的细胞金属离子失衡可引起铁死亡、铜死亡等一系列RCD。并且,RCD 在VCI 的发生发展中发挥着重要作用[11]。VCI 中的部分RCD 形式及其热门靶点见图1。
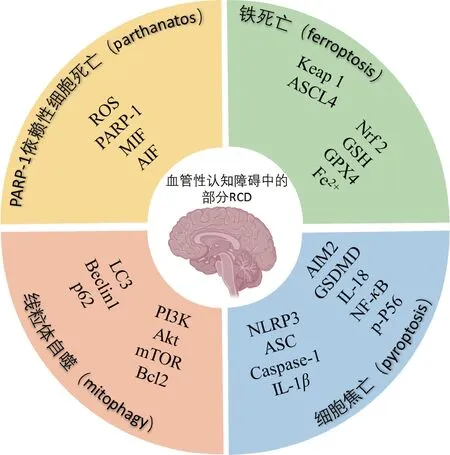
图1 VCI中部分RCD类型及靶点
2 中医药通过调控不同RCD治疗VCI的新进展
2.1 铁死亡
铁死亡是一种非凋亡和氧化损伤相关的RCD,是铁依赖的脂质过氧化积累介导的细胞死亡,其在形态及生物化学上不同于凋亡、坏死等细胞死亡方式。目前,对铁死亡的研究主要包括3 种调控机制:铁代谢、脂质代谢和氨基酸代谢[12]。研究表明,铁调节蛋白活性受损,转铁蛋白、转铁蛋白受体、线粒体铁蛋白的异常升高及各类铁离子的吸收、分布、代谢、排泄等铁稳态调节过程紊乱均与铁死亡高度相关[13]。谷胱甘肽(GPX)等还原性物质耗竭、谷胱甘肽过氧化物酶(GSH-Px)等酶活性下降也是铁死亡发生的重要原因。GPX4是一种依赖于GSH的含硒过氧化物酶,是铁死亡的中央调节剂,其失活被认为是铁死亡的执行信号[14]。铁死亡发生过程中还存在着明显的脂质过氧化现象,不饱和脂肪酸特别是花生四烯酸(PGE)和肾上腺素酸在特殊酶的作用下生成过量的脂质过氧化物并最终导致细胞损伤[15]。同时,铁死亡还可干扰PGE 代谢,导致炎性介质累积并出现炎症反应。
实验室及临床研究表明,铁死亡是VCI 发生发展的关键通路[16]。在缺血性脑卒中的动物模型中,铁离子的积累会加剧缺血再灌注(I/R)过程中神经元的损伤[17-18],铁螯合剂可以减少动物的I/R 损伤[19-20]。2017 年的一项研究表明,在大脑动脉闭塞模型(MCAO)中,铁死亡抑制剂对小鼠I/R损伤具有保护作用,提示铁死亡可导致缺血性脑卒中后神经元死亡[21],降低VCI 的发病风险。噻唑烷二酮是一种治疗糖尿病的药物,可以选择性地抑制酰基辅酶A 合成酶长链家族成员4(ACSL4)的活性并减轻慢性脑灌注不足期间海马神经元的脂质过氧化和氧化应激损伤,抑制神经细胞铁死亡,长期服用可以降低2型糖尿病患者患VCI的风险[22]。
2.1.1 中药单体化合物 研究表明,中药单体化合物可通过调节铁离子稳态、增加抗氧化能力、降低脂质过氧化的方式调节VCI 中的铁死亡。黄芩素在生理条件下可作为铁螯合剂,调节铁离子平衡;还可与微粒体膜结合,形成铁-黄芩素复合物,抑制脂质过氧化而发挥铁螯合剂的作用,减少缺血导致的神经元死亡[23-24]。天麻素可通过调节核因子-红细胞2 相关因子2/KELCH 样ECH 关联蛋白1(Nrf2/Keap1)-GPX4 通路抑制VCI 中铁死亡的发生发展,减少神经元损伤,保护神经[25]。槲皮素可通过增加GPX,降低脂质活性氧水平,减轻铁死亡导致的细胞形态变化[26]。羟基红花黄色素A 和脱水红花黄色素B 可以通过上调GPX4 表达水平减少细胞内铁离子沉积、减少脂质过氧化、下调铁死亡水平,从而保护神经细胞[27]。
2.1.2 单味药和中药复方 单味药和中药复方在维持铁离子平衡上也有较好的表现。脑泰方是目前治疗缺血性脑卒中的有效中药复方,其能够明显减轻MCAO 大鼠神经元损伤,并可促进大鼠神经功能的恢复[28]。以铁螯合剂去铁胺为阳性对照,脑泰方可以显著下调铁水平,通过调控脑出血后铁的转运及神经细胞中调节蛋白的表达,减少铁在脑组织中的沉积,抑制神经细胞铁死亡,从而减轻脑损伤后的二次脑损伤[29]。血管因素引起的氧化应激可通过芬顿反应激活铁死亡相关通路。富含黄酮类化合物及天然多酚的中药及其提取物具有良好的抗氧化作用,可通过减少脂质过氧化的方式抑制铁死亡[30]。石斛提取物可通过激活Nrf2/GPX4 轴抑制铁死亡,降低细胞在缺血时的氧化应激水平,保护神经细胞[31]。
2.1.3 中医疗法 电针、有氧运动等中医疗法可以通过各种氧化应激和抗氧化防御途径对铁死亡反应进行微调,通过调控microRNA 水平影响ASCL4、PTGS2、FPN、GPX4等铁死亡相关基因表达,进一步改善慢性脑低灌注导致的认知能力下降[32-33]。
2.2 细胞焦亡
细胞焦亡又称细胞炎性坏死,是近年来发现的一种伴随大量炎症因子释放的RCD 形式,其特征为依赖于半胱天冬氨酸蛋白酶-1(Caspase-1),并伴有大量促炎症因子的释放。作为机体一种重要的天然免疫反应,细胞焦亡在抗感染过程中发挥着重要作用。核苷酸结合寡聚化结构域样受体蛋白3(NLRP3)、NLRC4、黑素瘤缺乏因子2(AIM2)、炎素(pyrin)等炎症小体在细胞焦亡经典通路中被激活后将活化Caspase-1、gasdermin D(GSDMD)等蛋白,促进细胞死亡;同时Caspase-1还促进IL-1β的形成,扩大细胞外的炎症反应[34]。细胞焦亡的非经典途径主要由细胞质脂多糖(LPS)诱导,可直接与Caspase-4、Caspase-5 及Caspase-11 结 合[35]。活化 的Caspase-4、Caspase-5 及Caspase-11 一方面可以发挥与Caspase-1 相似的作用[36],还可激活间隙连接蛋白,释放三磷酸腺苷(ATP)以开放胞膜通道P2X7,引起钙、钠离子等外流,使细胞膨胀裂解,从而诱导细胞焦亡的发生。
临床和动物研究表明,细胞焦亡参与VCI 的发生发展:一方面细胞焦亡可导致神经细胞的丢失,引起神经缺损及大脑功能的损害;另一方面,其介导炎症反应加速大脑白质损害、突触可塑性损伤及脱髓鞘等病理改变,导致大脑功能结构紊乱,引起认知障碍[37-38]。临床数据显示,脑血管疾病患者海马组织炎症因子肿瘤坏死因子-α(TNF-α)、IL-1β和诱导型一氧化氮合成酶(iNOS)水平异常升高[39];缺血性脑卒中患者外周静脉血的单核淋巴细胞NLRP3、凋亡相关斑点样蛋白(ASC)、Caspase-1、IL-1β也显著高于对照组,且NLRP3 的活化程度与病情及脑卒中后认知功能损伤的发生密切相关[40]。相关动物实验也印证了这些发现:在小鼠及大鼠脑中动脉闭塞/再灌注(MCAO/R)诱导的卒中后认知障碍模型中均发现,脑内及外周炎症小体AIM2、Caspase-1、IL-1β和IL-18 表达增加,空间学习和记忆功能明显下降的现象,而在使用Caspase-1 抑制剂后这些现象得到了显著改善[41-42]。
2.2.1 中药单体化合物 多种中药单体化合物具有良好的抗炎活性,可通过直接或间接方式调控细胞焦亡,降低下游炎症因子的表达,减少神经元死亡,保护脑组织。抗炎化合物小檗碱预处理可上调过氧化物酶体增殖物激活受体-γ(PPAR-γ)水平,从而抑制核转录因子-κB(NF-κB)介导的细胞焦亡,保护氧糖剥夺(OGD)损伤后的大鼠海马原代神经元[43];腹腔注射蛇床子素可明显改善血管性痴呆大鼠认知功能,降低海马组织中NLRP3、Caspase-1、IL-18、IL-1β的表达水平,提示这一保护作用可能通过抑制NLRP3 介导的细胞焦亡发挥作用[44];一项Ⅱ期临床研究显示,静脉注射羟基红花黄色素A对血瘀型急性脑缺血患者有着良好的治疗效果[45]。动物实验中,静脉注射羟基红花黄色素A可显著下调I/R大鼠脑组织NLRP3、ASC、Caspase-1、GSDMD、IL-1β、IL-18、NF-κB 及p-P56 的表达水平,提示其可通过抑制焦亡,发挥神经保护作用[46]。
2.2.2 单味药和中药复方 复方汤剂在动物实验及临床试验中均表现出较好的抗细胞焦亡活性,显著降低Caspase-1 表达。补阳还五汤糖苷灌胃治疗I/R大鼠7 d,可有效干预NLRP3 介导的经典焦亡途径,降低大鼠海马区NLRP3、ASC、pro-Caspase-1、Caspase-1 和IL-1β的表达,从而减轻神经元损伤,改善神经功能障碍[47];益智防呆方可下调I/R 大鼠脑组织胶质细胞Caspase-1、Caspase-11、GSDMD、NLRP3 表达,减轻神经功能缺损、保护血脑屏障和神经元细胞,改善认知功能[48];气虚血瘀型脑梗死恢复期患者口服补阳还五汤治疗20 d 后,其外周血NLRP3 炎性小体及其下游因子IL-1β、IL-18 的浓度显著降低,并具有较好的恢复状态[49]。
2.2.3 中医疗法 通过针灸等传统中医疗法抑制细胞焦亡,改善VCI 也有较丰富的研究。与中药单方及其活性化合物相似,其机制主要集中在对细胞焦亡的经典途径的调控。通过下调NLRP3、Caspase-1水平、抑制NF-κB 通路、降低脑组织及外周炎症,显著抑制VCI 中发生的细胞焦亡、神经炎症,保护神经系统[50]。
2.3 线粒体自噬
线粒体是缺血后神经细胞死亡的关键靶区,作为组织内稳态必不可少的能量发生器和程序性凋亡、坏死细胞死亡的通道。基于线粒体的核心功能,线粒体的质量和数量应受到严格控制。线粒体自噬是一种选择性清除多余或受损线粒体的自噬过程,在调节细胞内线粒体数量和维持线粒体正常功能等方面发挥重要作用,并涉及诸多生理和病理学过程。线粒体自噬可以通过相关分子通路介导和线粒体动力学失衡发生。PTEN 诱导假定激酶1/Parkin(PINK1/Parkin)分子通路是最经典的线粒体自噬相关分子通路。线粒体功能紊乱时,随着线粒体膜电位降低,膜上的PINK1 聚集,将Parkin 从细胞质募集到线粒体,将标记的泛素化底物通过微管相关蛋白轻链3(LC3)相互作用区域在自噬体上募集,最终导致线粒体与自噬体结合发生自噬性降解[51]。在缺血/缺氧的条件下,低氧诱导因子-1(HIF-1)、Bcl-2 蛋白家族成员BNIP3 表达上调,通过竞争Bcl-2 结合位点释放Beclin1,激活线粒体自噬,降解受损的线粒体,以减少细胞凋亡[52]。
在VCI 的动物模型中,线粒体自噬的激活是一把双刃剑:适度激活的线粒体自噬可以保护神经元,减缓损伤,抑制或低效的线粒体自噬则会加重损伤;但同时,过度激活的自噬也会加重慢性脑缺血导致的神经元损伤,加重认知障碍。在大鼠与慢性脑低灌注导致的VCI 模型中,西地那非通过降低Beclin1表达、降低自噬活性改善大鼠的认知障碍。当自噬活性提高时,大鼠认知障碍加重[53]。URB597(URB)通过抑制受损的自噬降解和Beclin1/Bcl-2 复合物的破坏,防止异常过度的线粒体自噬,保护神经元。因此,URB 可能具有慢性脑低灌注导致的VCI 的治疗潜力[54]。有对脑I/R 损伤导致的VCI 的研究通过再灌注早期给予短暂温和的酸处理,激活Parkin依赖的线粒体自噬减轻神经元损伤,而Parkin被敲除时,酸处理不再具有神经保护作用[55]。
2.3.1 中药单体化合物 中医药可通过激活适当自噬来发挥对VCI 的保护、治疗作用。白藜芦醇是一种常见的多酚类化合物,广泛存在于中草药及各类食物中。研究发现,白藜芦醇可通过抑制蛋白激酶B/哺乳动物雷帕霉素靶标蛋白(Akt/mTOR)信号通路相关蛋白的表达,激活自噬并抑制神经元凋亡,改善慢性脑低灌注致VCI 大鼠模型的认知功能[56]。黄芪甲苷Ⅳ在I/R导致的VCI动物、细胞模型中也可通过抑制Akt/mTOR 通路相关蛋白的表达,促进线粒体自噬,减少细胞凋亡[57]。同时,抑制过度自噬的中药单体化合物和中药复方也有较好的神经保护作用。黄芩素能促进脑I/R损伤模型导致VCI的大鼠PI3K/Akt/mTOR信号通路磷酸化,抑制线粒体自噬,从而发挥神经保护作用[58]。天麻素通过激活mTOR蛋白磷酸化、抑制Ca2+/CaMKⅡ信号通路等方式抑制线粒体自噬,保护VCI 大鼠神经细胞,改善其认知、记忆能力[59-60]。
2.3.2 单味药和中药复方 单味药及中药复方也可通过调控线粒体自噬发挥VCI 的保护、治疗作用。圣愈汤可通过上调VCI 大鼠的Akt 表达,促进线粒体自噬,改善海马区病理变化并提高认知能力[61]。同时,在慢性脑低灌注大鼠模型中,小续命汤通过下调LC3、Beclin1、线粒体p62 的表达水平,抑制线粒体自噬,发挥神经保护作用,改善大鼠认知功能[62]。益髓复用汤可通过上调PI3K/Akt 通路、Bcl2表达等方式,抑制线粒体自噬并改善VCI 大鼠的认知能力[63]。
2.3.3 中医疗法 此外,电针等中医疗法也可通过调控自噬防治VCI。通过用电针刺激“神庭”“百会”穴治疗MCAO大鼠,可上调促自噬蛋白Beclin-1、下调抑制自噬蛋白LC3-Ⅱ/LC3-Ⅰ激活自噬,并提高线粒体自噬相关蛋白BNIP3L 和SQSTM1 的表达及其定位,促进BNIP3L 引导的线粒体自噬从而抑制细胞凋亡,提高神经细胞生存率,保护认知功能[64-65]。
2.4 PARP-1依赖性细胞死亡
PARP-1 依赖性细胞死亡是一种基于DNA 损伤、PARP-1 激活的程序性细胞死亡形式。PARP-1 依赖性细胞死亡广泛存在于脑卒中、帕金森、糖尿病、心力衰竭、脑I/R损伤等多种疾病中,在神经系统疾病中起着关键作用。因为该种死亡方式的可控性,通过药物抑制或基因沉默的方式对PARP-1依赖性细胞死亡进行干预的治疗方法越来越受到人们的重视。PARP-1 是一种主要存在于真核生物细胞核内的DNA 修复酶,约占细胞内PARP 的90%以上,在生理状态下对DNA 的损伤起到修复作用。在DNA 大量损伤状态下,PARP-1 被过度激活,催化胞内烟酰胺腺嘌呤二核苷酸(NAD)分解为尼克酰胺和PAR[11]。由于NAD 的大量消耗,线粒体氧化呼吸链复合酶Ⅰ~Ⅲ活性受到明显的抑制,三羧酸循环受阻,线粒体能量代谢出现障碍[66]。PAR 在胞内大量蓄积可诱导凋亡诱导因子(AIF)从线粒体释放并向细胞核转移,出现染色质凝集、DNA 大片段化,最终诱导细胞死亡[67]。
大量临床数据显示,在慢性、急性脑缺血发生时,神经细胞将在短时间内开始出现氧化应激,导致神经细胞通过不同方式受损、死亡。在缺血、缺氧条件下,神经细胞、炎症细胞中大量ROS 产生并在细胞内积累。当氧化能力超过细胞本身具有的抗氧化能力时,氧化应激发生,造成包括DNA 损伤在内的一系列损伤。相关动物实验结果也印证了PARP-1 依赖性细胞死亡在急性缺血、慢性缺血、缺氧条件下对神经细胞的保护作用。在小鼠大脑中动脉阻塞模型和小鼠局限性脑梗死模型中,应用PARP-1 阻滞剂3-AB 可以减小梗死面积,改善小鼠的神经功能缺损症状[68-70]。在西洛他唑预处理的大鼠I/R 模型中,海马CA1 区PARP-1 及AIF 表达减少,大鼠认知能力显著恢复[71]。
2.4.1 中药单体化合物 中医药通过抑制PARP-1依赖性细胞死亡治疗VCI 的研究主要集中在抗氧化应激方面。在氧葡萄糖剥夺再灌注的PC12 细胞模型中,红花的主要药理活性成分羟基红花黄色素A和脱水红花黄色素B 可通过抗氧化应激抑制ROS 的产生,从而抑制PARP-1 的过度活化,减少PAR 聚合物的产生和AIF 核易位[27]。大鼠局灶性缺血模型也证实人参皂苷Rd 通过降低PARP-1 的活性、抑制AIF 从线粒体到细胞核的转移起到神经保护作用[66,72];在I/R 导致的VCI 动物模型中,黄芪甲苷Ⅳ可通过保护线粒体HK-Ⅱ并减少AIF 的释放,降低PARP-1 依赖性细胞死亡的发生,保护神经元[73]。黄芩素可显著抑制脑I/R 大鼠PARP-1 的激活、AIF 和巨噬细胞迁移抑制因子(MIF)的核转位,降低脑梗死体积和神经功能缺损评分[74]。天麻素可通过减少缺血区的氧化应激水平,降低ROS 水平、减少PARP-1 过度活化[75],改善血管性痴呆大鼠的认知能力。
2.4.2 单味药和中药复方 枸杞多糖可显著抑制MCAO小鼠裂解的PARP-1过表达,降低脑梗死体积和神经功能缺损评分,还能减轻神经元形态学损伤,减轻神经元凋亡[76]。栝楼桂枝汤通过显著抑制缺血皮质中PARP-1、AIF 和核酸内切酶G 的表达,并显著增加热休克蛋白70(Hsp70)的表达,来抑制缺血诱导的神经元凋亡,改善认知功能[77]。
2.5 多种RCD方式的串扰
尽管上述各RCD 的途径、特征存在较大的差异,各种RCD 方式的调节间仍然存在着较多的交叉串扰。在铁死亡过程中,一方面产生的大量脂质过氧化产物可以诱导氧化应激的发生,从而引发坏死性细胞凋亡、PARP-1 依赖性细胞死亡等多种RCD;铁死亡过程中常出现能量代谢异常,并伴有线粒体变小、线粒体嵴减少、线粒体膜密度增加和线粒体膜破裂增加等线粒体相关现象,提示铁死亡与线粒体自噬可能存在某种串扰联系。另一方面,由于铁死亡过程中常伴随PGE 代谢异常及炎症反应,铁死亡与细胞焦亡等炎性RCD 也可能存在一定的串扰。作为一种炎性死亡,细胞焦亡的过程中产生的炎症因子可激活下游NF-κB通路,触发促炎机制、凋亡、坏死性凋亡等。由于线粒体在细胞内承担着供能的重任,过度激活的线粒体自噬将导致细胞能量代谢障碍,诱发细胞内外离子调控失衡,导致铁死亡、铜死亡等多种形式的RCD 出现。此外,氧化应激导致的DNA 损伤是PARP-1依赖性细胞死亡触发的起点,同时也常见于各类RCD 中,如凋亡、坏死性凋亡、铁死亡等,提示PARP-1依赖性细胞死亡可能与多种RCD 存在串扰。同时,由于PARP-1 的激活将促进促炎基因的转录,PARP-1 依赖性细胞死亡又可与细胞焦亡存在一定的串扰[78]。此类细胞死亡方式串扰在中医药治疗VCI 的过程中尤为明显,见图2、表1。

表1 中药治疗VCI的机制
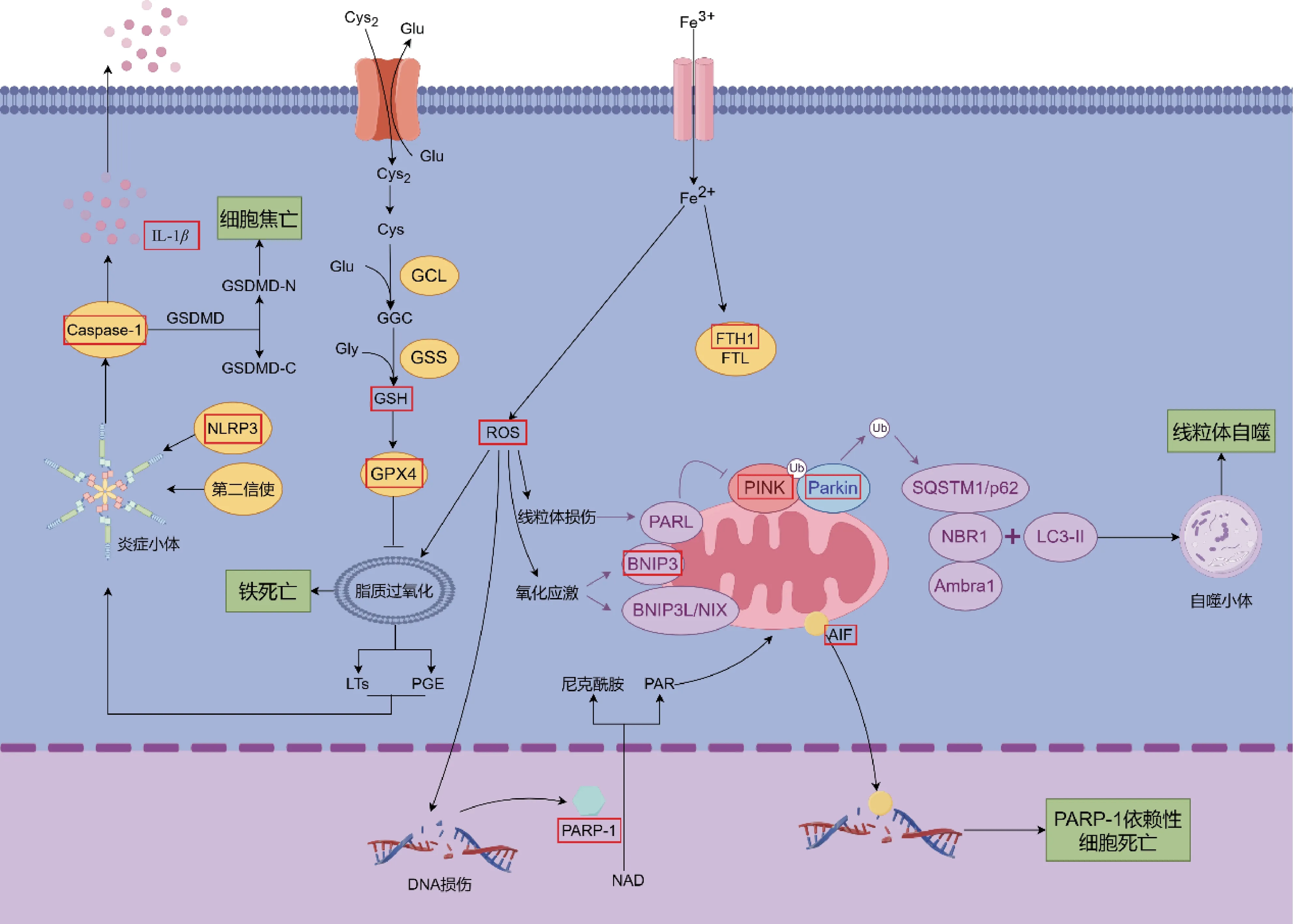
图2 VCI中的多种RCD串扰
2.5.1 中药单体化合物 中药单体化合物治疗VCI目前大多机制尚不明确,但可观察到其具有多通路同时调控的特点及较好的调节RCD 促细胞生存作用。以羟基红花黄色素A 和脱水红花黄色素B 为例,如前所述,其可以下调铁死亡水平[27]。同时,由于脂质过氧化水平降低,ROS 水平也明显降低,PARP-1 依赖性细胞死亡水平降低[27]。丹参酸B 是经典的抗炎活性化合物,可通过抑制Toll 样受体4/髓样分化蛋白88(TLR4/MyD88)通路抑制炎症水平,减少MCAO 大鼠的神经元焦亡[79]。丹参酸B 可通过提高血管性痴呆模型大鼠海马p-Akt 水平调控自噬,减少CA1 区海马神经元的凋亡并改善认知功能[80]。天麻素可同时通过调节线粒体自噬、铁死亡及PARP-1 依赖性细胞死亡保护缺血区神经细胞[25,75,81],改善血管性痴呆大鼠的认知能力。天麻素早期干预对糖尿病患者认知功能障碍也有一定的保护作用,其机制可能与改善血管功能障碍、减少Caspase-3 表达及活化相关[82]。
2.5.2 单味药和中药复方 中药复方由于含有丰富、复杂的成分,各组分可调控不同的细胞死亡方式,其具体机制更为复杂,串扰较单体更为明显。枸杞多糖可显著抑制MCAO 小鼠Bax、CytC、Caspase-3、Caspase-9 和裂解的PARP-1 的过表达,并抑制Bcl-2表达的减少,通过同时调控铁死亡、细胞凋亡、PARP-1 依赖性细胞死亡等RCD 保护缺血区神经细胞[76]。补阳还五汤糖苷类成分可干预NLRP3 介导的经典焦亡途径,减轻神经元损伤,改善神经功能障碍[47]。补阳还五汤全方还可通过抑制ROS 的产生,降低丙二醛(MDA)和8-羟基脱氧鸟苷(8-OHDG)水平,提高超氧化物歧化酶(SOD)和GSH-Px 活性以减少氧化损伤、减少DNA 损伤、减少PARP-1依赖性细胞死亡、保护神经细胞、改善认知能力[83]。脑泰方作为缺血性脑卒中的候选治疗药物,可通过STAT3/PI3K/Akt 信号通路调节神经炎症的发生发展及受损细胞的线粒体自噬,减少缺血导致的神经损伤[84]。同时,脑泰方提取物还可提高脑缺血大鼠海马体的转铁蛋白表达,显著降低细胞内的铁离子沉积,通过调节胞内铁离子水平抑制铁死亡的发生[85]。
2.5.3 中医疗法 非药物中医疗法治疗VCI的研究主要集中在针灸方面,也有少量关于艾灸的研究。针灸对VCI的治疗作用机制尚不明确,主要包括促进脑内脑源性神经营养因子表达、改善脑血液流变学指标和调控缺血区神经细胞RCD 等。针灸主要通过调控自噬相关基因减少细胞死亡[65],并通过调节铁死亡相关基因增强细胞抗氧化能力,降低细胞氧化应激水平[32,86]。针灸还可通过抑制细胞焦亡、降低缺血区炎症水平,减少慢性、有害性的神经胶质细胞激活[50]。
3 结语与展望
RCD 作为一种程序性的、受控制的细胞死亡,因其发生、进展可通过多种途径进行调节而备受关注。通过基因、蛋白水平的调控对RCD 进行调控,减少神经细胞损伤,对VCI 的早期干预、晚期治疗有着重要的意义。通过查阅中药调控VCI 的相关机制、通路,总结了中医药对4 种RCD 形式的调节作用及其相互串扰,发现中医药可通过对VCI 中神经细胞的一系列RCD 进行调控,减少神经细胞的损伤,保护认知。同时,中药组方还可作用于外周,改善基础疾病、降低血管风险。
控制基础病、降低血管风险因素、调控RCD 保护神经细胞是VCI治疗领域的潜在有效策略。未来,对RCD 的研究需要更加深入,更加准确地确定每种RCD 的独特分子效应,探明不同细胞死亡程序之间的相互作用,以评估调控RCD 时对促细胞生存的重编程作用。此外,还需要更多的研究来确定RCD 过量或不足在人类疾病中的作用,为精准调控RCD、保护正常细胞及细胞器提供参考。深入研究RCD 与VCI 的关系可以更加全面地认识其发生、发展,同时为其治疗提供新思路。
中医药调控RCD 具有多靶点、多途径、双向调节的优势,可同步调节多种RCD,促进受损细胞死亡及修复并促进正常细胞存活,降低神经系统受损程度,为VCI 的早期防治提供了新的思路,也为VCI 的后期治疗潜在靶点的发现提供了新的视角。当前已有羟基红花黄色素A、银杏叶提取物、塞络通、补阳还五汤、复方益智苁蓉胶囊、脑泰方等相关方剂在临床实践中被用于治疗VCI,取得了较好的疗效,但仍需大规模临床试验对药效进行进一步验证。同时,由于部分中药属药食同源品种,可在日常生活中摄入,对VCI 的早期干预具有良好的发展前景,中医药在VCI防治中具有巨大的潜能。
[利益冲突]本文不存在任何利益冲突。
