洪湖浮游植物群落结构稳态转换及其影响因子
2024-04-12谢高华陈燕飞董玉茹孙咏曦
谢高华,陈燕飞*,周 元,董玉茹,孙咏曦
(1.油气地球化学与环境湖北省重点实验室,长江大学资源与环境学院,湖北武汉 430100;2.湖北省荆州市水文水资源勘测局,湖北荆州 434000)
位于长江中下游、四湖水系下游的洪湖,兼具生活供水、灌溉、旅游、物种保护等多种功能,对于湖北省的经济增长及可持续发展具有重要作用。近年来,随着经济活动增加、人口骤增、农林渔业等产业结构的调整,人们对洪湖的开发程度加大,导致一系列环境问题,如湖泊面积萎缩、生物多样性退化、富营养化等,引起了众多学者对洪湖生态的高度重视,并开展了一系列对洪湖浮游植物群落结构特征的研究[1-3]。
浮游植物作为水生态环境中的初级生产者,参与生态系统的能量流动、物质循环等过程。作为水生态环境的重要基础组成部分,浮游植物在不同环境中的形态结构和竞争性均有所不同,对水环境条件极为敏感。因此,国内外对湖泊等水体水质的研究大多利用浮游植物群落结构特征进行判别,通过对浮游植物群落的研究能够全面了解水体质量。例如,利用典型相关分析,研究影响矿湖浮游植物群落的主要环境因子[4];分期对江汉平原主要湖泊的浮游植物群落进行主成分分析,并利用理化指标判别湖泊的富营养化程度[5]。STARS(Sequential t-test analysis of regime shifts)方法是用于分析稳态转换的一种新方法,该方法具有不需要突变时间的先验假设、可同步检测突然变化和渐进变化、能相对较早地发现突变以及识别多个突变点等优点[6],可用于分析时间上连续数据序列的转变,已经被应用于气候、水体富营养化、生态系统、大气等的稳态转换研究中[7-9],特别是在水生态系统的营养盐变化、藻种数量和鱼类产量[10]研究中已得到广泛应用。STARS方法主要由预先设定的截距长度和显著性水平确定突变点,得到稳态转换指数。稳态转换指数越大,可信度越高。
根据洪湖降水的季节特性以及来水流量大小,将5—9月划为丰水期,将3月、4月、10月和11月划为平水期,将1 月、2 月和12 月划为枯水期。将2010—2019 年丰水期、平水期和枯水期洪湖浮游植物的细胞密度划分成6个阶段,对6个阶段的藻类和水质指标进行冗余分析与蒙特卡洛置换检验,并分析洪湖浮游植物群落结构与环境因子的关系。2016 年大洪水和围网拆除以后,洪湖的藻类结构、藻细胞密度都发生了明显改变,因此有必要对新形势下洪湖浮游植物群落结构进行调查分析,从而为深入了解洪湖的生态环境状况以及洪湖生态保护策略的制定提供科学指导。
1 材料与方法
1.1 采样点设置
2010—2019年每月上旬,在洪湖5个具有代表性的采样点——茶坛岛、大口、官墩、蓝田和施墩河口,进行系统性采样并检测,采样点位置见图1。
图1 洪湖采样点分布示意图Fig.1 Schematic map of sampling points distribution in the Honghu Lake
1.2 样品采集与分析
洪湖属于浅水湖,在各个采样点距水面0.5 m深处,分别用25 号浮游生物网做“∞”字形来回拖动约3 min,再用蒸馏水冲洗附着在生物网上的浮游植物。同时采集1 000 mL 水样,用聚乙烯瓶盛装,并加入15 mL 鲁戈氏液以固定浮游植物。在室温下静置48 h后,用虹吸法缓慢吸去上清液,将下层的浮游植物样品浓缩至30 mL,然后加入4%的甲醛溶液,保存。取其中0.1 mL 浓缩液进行镜检,利用浮游植物计数框和10×40倍显微镜,参考《中国淡水藻类——系统、分类及生态》[11]和浮游植物密度计算公式[12]鉴定浮游植物的种数,并计算浮游植物细胞密度。计算公式如下:
公式(1)中,ni(cells/L)为每升水中第i种浮游植物的细胞数量;A为计数框面积(400 mm2);Ai(mm2)为计数面积;Vm(30 mL)为1 L 水样经沉淀浓缩后的样品体积;V(1 L)为原样本水量;hi(cells)为每片计数框得到的第i种藻类的细胞数。
在各采样点距水面0.5 m 深处采集水样,封装,并运送到实验室冷冻,分别采用气相分子吸收光谱法、钼酸铵分光光度法、碱性高锰酸钾氧化法和纳氏试剂分光光度法测定水体总氮浓度、总磷浓度、高锰酸盐指数和氨氮浓度;利用HANNA HI9829-10多参数分析仪,现场测定水温、pH和溶解氧浓度;采用塞氏盘法,测定水体透明度。
1.3 分析方法
1.3.1 优势度分析
根据Mcnaughton[13]优势度指数,分析洪湖各时期浮游植物的优势物种,计算公式如下:
公式(2)中,Y为优势度指数;ni(cells/L)为样品中第i种浮游植物的细胞密度;N(cells/L)为样品中浮游植物的总细胞密度;fi为第i种浮游植物在各监测位点出现的频率。当Y≥0.02 时,该物种为优势种[14]。
1.3.2 秩相关系数分析
Spearman秩相关系数法常被用于分析水质指标的变化趋势以及变化的显著性。利用SPSS Statistics 26.0 软件,对2010—2019 年洪湖主要水质指标的年平均浓度值进行定量分析,将水质指标数值按从小到大排序,得到序号Xi,将监测年份(2010—2019)按从小到大排列,得到序号Yi,并根据如下公式进行计算[15-16]:
公式(3)中,rs代表秩相关系数,N代表时间周期(2010—2019年),利用软件计算出rs和p值后,通过趋势分析标准进行对比。若p<0.05,表示指标变化具有显著意义;若p>0.05,表示指标变化趋势不具有显著意义。若rs<0,表示指标呈现下降趋势,若rs>0,表示指标呈现上升趋势。评价标准如表1所示。

表1 秩相关系数评价标准Table 1 Rank correlation coefficient of evaluation criteria
1.3.3 稳态转换划分法
基于不同年份丰水期、平水期和枯水期5个采样点浮游植物细胞密度的平均值数据,进行稳态转换分析。STARS 方法的提出者认为,截距长(l)的选取不会影响稳态转换的发生,此方法包含了双层检验的思想,先通过上下限的判断,再利用稳态转换指数(RSI)值进行二次检验[6]。具体计算流程详见参考文献[17],计算过程中显著水平取p=0.05,截距长度取5,即l=5(单位为年),然后计算浮游植物的平均方差σl2,计算公式如下:
公式(4)中,W1为2010 年至2014 年浮游植物细胞密度的方差;W2为2011年至2015年浮游植物细胞密度的方差;以此类推,W6为2015 年至2019 年浮游植物细胞密度的方差;σl2为浮游植物细胞密度方差的平均值。
丰水期、平水期和枯水期浮游植物细胞密度均在2016年发生稳态转换,计算得出丰水期、平水期和枯水期的稳态转换指数值分别为0.89、0.65和0.48。
1.3.4 冗余分析
冗余分析(Redundancy Analysis,RDA)是多元回归对多变量响应数据建模的直接扩展。在环境生态学领域,冗余分析常被用于阐明物种(响应变量)与环境因子(解释变量)之间的关系。在冗余分析模型图中,空心箭头代表环境因子,实心箭头代表某种生物,根据两者之间夹角的余弦值判断其关联性,即两者夹角越小,正相关性越大;两者夹角越大,负相关性越大;两者呈直角则无关。选择藻类相对数量大于1%的浮游植物或者在各采样点出现频率大于60%的优势浮游植物进行物种与环境因子排序分析[18]。为了使数据更趋于正态分布,分析时将物种和环境因子均进行lg(x+1)转换(pH除外)。
根据筛选出的各阶段的藻类,进行消除趋势对应分析(Detrended correspondence analysis,DCA),其中丰水期稳态转换前共有4 门14 属,转换后共有3 门14 属;平水期格局稳态转换前共有5 门18属,转换后共有3门16属;枯水期稳态转换前共有5 门14 属,转换后共有4 门16 属,6 个阶段得到的排序轴最大长度分别为2.12、1.91、1.95、1.74、2.2和1.79,均小于3,故采用冗余分析。在冗余分析过程中,采用方差膨胀因子(Variance Inflation Factor),度量环境因子的共线程度,结果表明所有环境因子的方差膨胀因子均小于10,无共线问题。
蒙特卡洛置换检验(Monte Carlo permutation test)是冗余分析后的置换检验步骤,它可以通过模拟计算,独立分析出每一个环境因子对生物群落的贡献度、解释量和显著性。
2 结果与分析
2.1 洪湖水环境变化趋势分析
采用Spearman 秩相关系数法,对洪湖的水质变化趋势进行定量分析(表2)。2010—2019年,洪湖水体总氮浓度和水温具有非常显著的上升趋势,而水体pH 和透明度呈极显著下降趋势,总磷浓度呈比较的显著下降趋势,而溶解氧浓度、高锰酸盐指数和氨氮浓度并没有显著变化。
2.2 藻种数量的稳态转换
2010—2019 年,洪湖丰水期、平水期和枯水期浮游植物细胞密度的稳态转换都发生在2016年(图2)。在丰水期稳态转换前,浮游植物细胞密度在8.17×106~40.7×106cells/L 之间,平均值为20.1×106cells/L,稳态转换后浮游植物细胞密度增加到75.6×106~149×106cells/L,平均值为107×106cells/L,是转换前的5.35 倍。
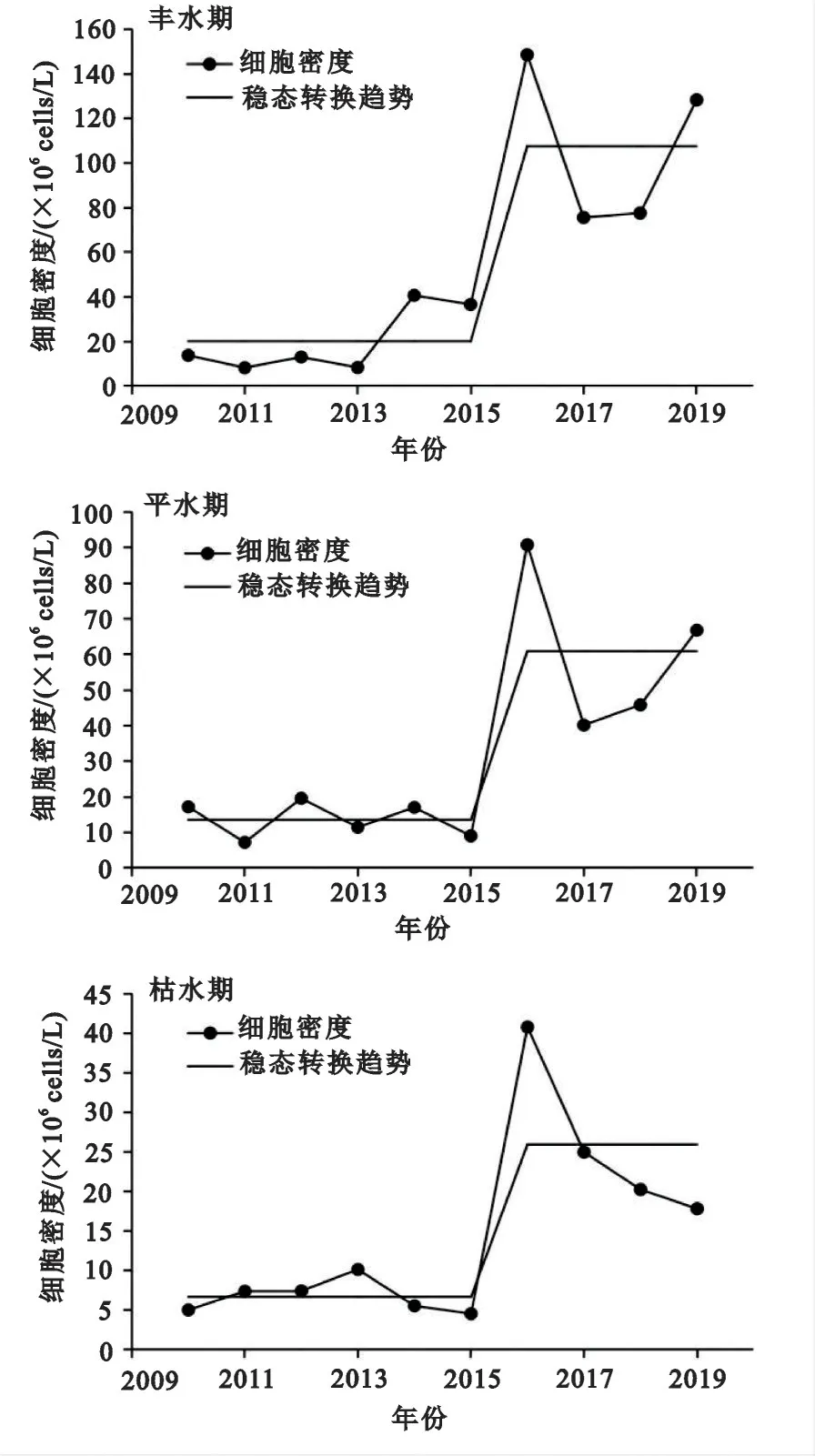
图2 洪湖浮游植物细胞密度的稳态转换Fig.2 Regime shift of cell density of phytoplankton in the Honghu Lake
在平水期稳态转换前,浮游植物细胞密度在7.21×106~20.0×106cells/L 之间,平均值为13.6×106cells/L,转换后浮游植物细胞密度增加到40.1×106~90.8×106cells/L,平均值为60.9×106cells/L,是转换前的4.48倍。
在枯水期稳态转换前,浮游植物细胞密度的变化范围为4.56×106~1.01×107cells/L,平均值为6.69×106cells/L,转换后浮游植物细胞密度增加到17.8×106~40.8×106cells/L,平均值为2.60×107cells/L,是转换前的3.88倍。
在丰水期、平水期和枯水期,洪湖浮游植物细胞密度在稳态转换之后都显著增加,这可能是因为水体总氮和总磷浓度的增加,为藻类的生长繁殖提供了丰富的营养元素。
2.3 种类组成和数量特征
不同时期在洪湖共检测出浮游植物7 门91属,丰水期稳态转换前共鉴定出7门65属,其中绿藻门30 属,硅藻门17 属;丰水期稳态转换后共鉴定出浮游植物7门75属,其中绿藻门32属,硅藻门19 属;平水期稳态转换前共鉴定出浮游植物7 门65属,其中绿藻门29属,硅藻门17属;平水期稳态转换后共鉴定出浮游植物7 门77 属,其中绿藻门32 属,硅藻门20 属;枯水期稳态转换前共鉴定出浮游植物7 门61 属,其中绿藻门28 属,硅藻门16属;枯水期稳态转换后共鉴定出浮游植物7 门67属,其中绿藻门30属,硅藻门15属(表3)。总体来看,洪湖流域浮游植物种类丰富,且绿藻门在各个时期均处于优势地位。

表3 洪湖各时期浮游植物组成Table 3 Phytoplankton composition in different regimes in the Honghu Lake
丰水期稳态转换前浮游植物细胞数量占比较高的为蓝藻门和硅藻门,占比分别为64.19%和22.33%,稳态转换后主要浮游植物为蓝藻门,占比高达84.20%;平水期稳态转换前水体中主要藻类为蓝藻门和硅藻门,占比分别为50.21%和29.07%,稳态转换后主要为蓝藻门,占比为72.37%;枯水期稳态转换前水体中主要藻类为蓝藻门和硅藻门,占比分别为19.69%和55.28%,稳态转换后主要藻类仍然为蓝藻门和硅藻门,占比分别为52.30%和30.87%;除了在枯水期稳态转换前,硅藻门在数量上占据优势之外,在其他6个阶段,蓝藻门在数量上均占据优势(图3)。这与硅藻和蓝藻的生存环境有关,在枯水期稳态转换前,水温偏低,占比最高的为硅藻门,而在丰水期稳态转换后,水温偏高,蓝藻门拥有绝对优势。

图3 洪湖各时期浮游植物细胞数量占比Fig.3 Proportion of phytoplankton cells in the Honghu Lake in different regimes
2.4 优势属
根据优势度指数对洪湖6 种格局的浮游植物种类进行分析,若浮游植物属的优势度≥0.02,则被视作优势属,共鉴定出浮游植物优势属4 门15 属(表4)。洪湖流域的优势属主要集中在蓝藻门、硅藻门以及小部分绿藻门。丰水期稳态转换前的优势属主要是硅藻门的直链藻属、蓝藻门的长孢藻属、平裂藻属等,稳态转换后的优势属主要为蓝藻门的尖头藻属、长孢藻属、泽丝藻属等;平水期稳态转换前的优势属主要是硅藻门的直链藻属、蓝藻门的长孢藻属、平裂藻属等,稳态转换后的优势属主要为蓝藻门的泽丝藻属、平裂藻属等;枯水期稳态转换前的优势属主要为硅藻门的直链藻属、针杆藻属等,稳态转换后的优势属主要为蓝藻门的泽丝藻属、硅藻门的直链藻属等。整体来看,洪湖浮游植物群落优势度分级明显,以蓝藻门中的众多藻属和少数硅藻门藻属为主要优势属。
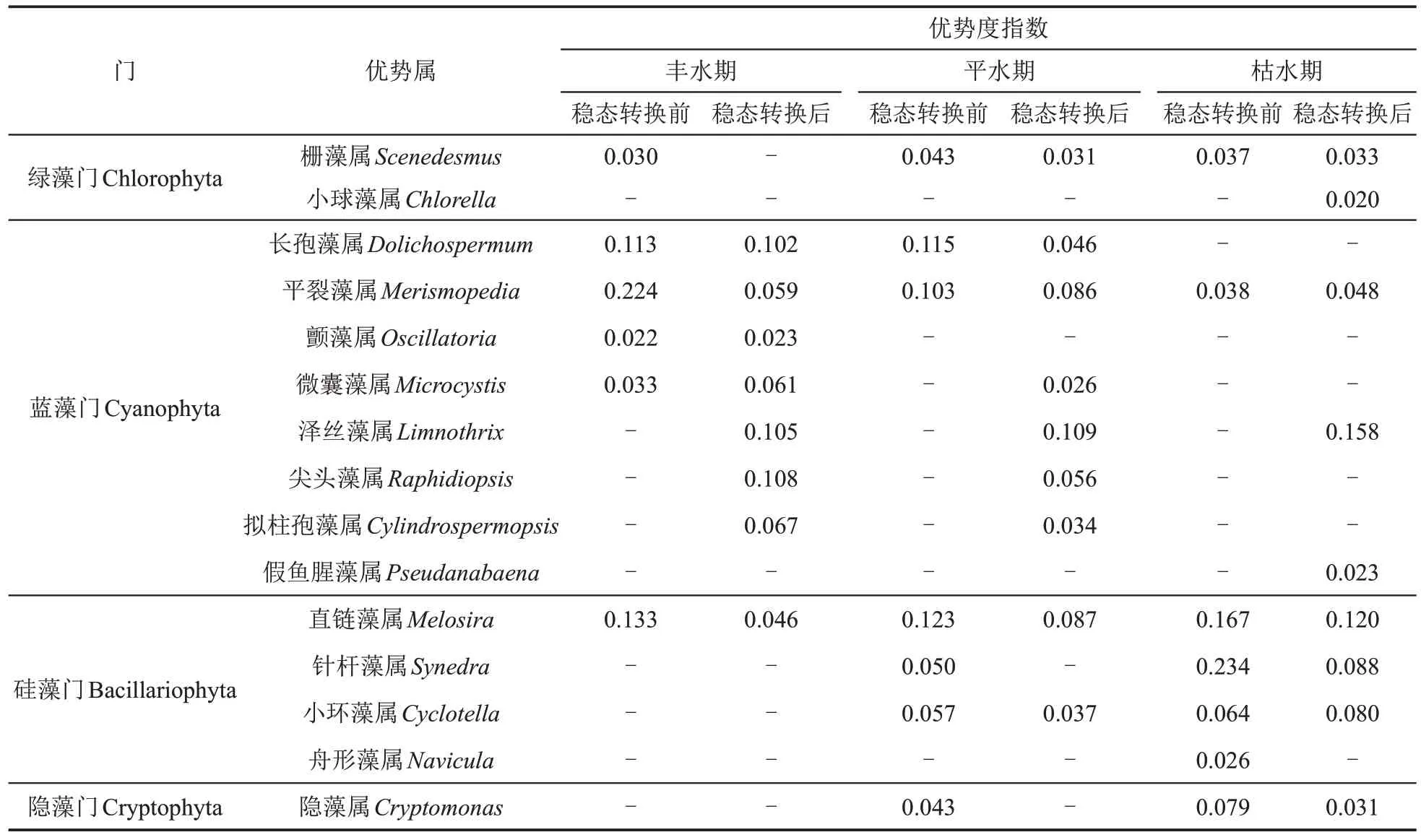
表4 不同时期洪湖浮游植物的优势属和优势度指数Table 4 Dominant genera and dominance indices of phytoplankton in the Honghu Lake in different regimes
2.5 冗余分析与检验
采用向前引入法,对洪湖6个时期5个采样点的水质指标进行逐步筛选,水质指标选取透明度、水温、pH、溶解氧浓度、氨氮浓度、高锰酸盐指数、总磷浓度和总氮浓度,得到冗余分析的排序图(图4)。其中,丰水期稳态转换前后的RDA 排序图分别对应图4a和图4b,平水期稳态转换前后的RDA排序图分别对应图4c和图4d,枯水期转换前后的RDA排序图分别对应图4e和图4f。

图4 洪湖浮游植物细胞密度与环境因子的冗余分析Fig.4 Redundancy analysis of phytoplankton cell density and environmental factors in the Honghu Lake
丰水期稳态转换前后两个排序轴环境因子信息的累积百分比分别为84.37%和76.98%,平水期稳态转换前后分别为78.33%和89.63%,而枯水期转换前后分别为68.46%和75.41%。丰水期稳态转换前,浮游植物细胞密度的显著影响因子有透明度、水温和pH;丰水期稳态转换后,显著影响浮游植物细胞密度的环境因子有透明度、水温、溶解氧浓度、高锰酸盐指数、总氮浓度和氨氮浓度(p<0.01);平水期稳态转换前,浮游植物细胞密度的显著影响因子为水温、pH、溶解氧浓度、透明度、氨氮浓度和高锰酸盐指数;平水期稳态转换后,浮游植物细胞密度的显著影响因子为高锰酸盐指数和溶解氧;枯水期稳态转换前,浮游植物细胞密度的显著影响因子为pH、溶解氧浓度、总氮浓度和高锰酸盐指数;枯水期稳态转换后,浮游植物细胞密度的显著影响因子为透明度、pH、总磷浓度、高锰酸盐指数、总氮浓度和氨氮浓度。
3 讨 论
浮游植物的生长和繁殖不仅受水温、透明度、光照、盐度等非生物因素的影响[19-21],还受浮游动物捕食等生物因素[22]以及地理空间和土地利用类型[23-24]等的影响。水温可以影响浮游植物的新陈代谢,改变浮游植物的水生环境[25-26]。丰水期稳态转换后,洪湖平均水温为27.1 ℃,而蓝藻门藻细胞密度在该时期的占比高达84.20%,这是由于蓝藻的DNA 和光合作用系统的热稳定性形成了高温适应机制[27],蓝藻的最适生长温度为25~35 ℃,高于其他藻类[28],同时蓝藻门藻类对高温的耐受能力强于其他藻类[2],在高温环境中,蓝藻大量增殖导致在丰水期格局转变后蓝藻门藻细胞密度具有非常高的占比。枯水期的平均水温低于10 ℃,喜低温的硅藻、金藻占比增加,但受总氮浓度和水体透明度的限制,枯水期藻细胞密度维持在较低水平。
随着水体透明度的极显著下降,导致光照条件变差,不利于浮游植物对营养物质的吸收,抑制了浮游植物的生长,从而使洪湖富营养化问题更加严重,致使洪湖出现严重的富营养化趋势。此外,总氮浓度和温度的极显著升高为蓝藻门藻类提供了大量繁殖的环境,使得蓝藻门在稳态转换后出现了大量的优势种。
自2016 年洪湖围网完全拆除后,近年来洪湖的水质没有得到根本性改善,水环境质量持续恶化,水生植物面积衰退,出现严重的富营养化趋势,呈现出水质恶化与水生植被衰退的恶性循环[29]。在长期的围网养殖过程中,过量营养元素投放导致洪湖水体富营养化、底泥恶化,随着风浪对湖泊的扰动,底泥中的氮磷元素重新释放到水体中。2016 年洪湖遭受了特大洪涝灾害,大量客水过境带来了凤眼莲(Eichhornia crassipes)、喜旱莲子草(Alternanthera philoxeroides)等外来入侵物种,挤占了洪湖原生植物的生存空间,植株死后腐烂变质,加剧了水体的富营养化,严重污染水质,同时也带来了入侵蓝藻——拟柱孢藻(Cylindrospermopsis raciborskii)。拟柱孢藻具有对低光强极强的耐受能力,能够利用不同的氮源,格局转变后洪湖水体的透明度降低、氨氮和总氮浓度增加,这些条件为拟柱孢藻的生长繁殖提供了有利条件。稳态转换后形成的高氮低磷环境,促使拟柱孢藻大量繁殖并产生拟柱孢藻毒素,这种蓝藻毒素水溶性很高,可长时间停留在水体中,威胁水生动植物和人类的健康[30],因此,拟柱孢藻的大量繁殖在一定程度上加剧了洪湖的生态功能退化。此外,洪湖湖滨带植被面积呈逐年减少的趋势,这进一步造成洪湖生态系统功能退化。以上这些因素都是导致丰水期、平水期和枯水期洪湖浮游植物在2016发生格局转变的主要原因。
4 结 论
洪湖浮游植物细胞密度在2016年发生稳态转换,主要因为在长期围网养殖过程中,过量营养元素的投放导致洪湖水体富营养化、底泥恶化,加之2016年大洪水期间大量客水过境带来的入侵物种挤占原生植物的生存空间,而且入侵蓝藻——拟柱孢藻大量繁殖产生拟柱孢藻毒素,加剧了洪湖生态功能退化,从而使得浮游植物群落结构发生稳态转换。
2010—2019 年,在洪湖共发现浮游植物7 门91 属,其中绿藻门种类最为丰富。洪湖浮游植物细胞密度在丰水期稳态转换后最高,平均数量为1.07×108cells/L。在水温偏低的枯水期稳态转换前,浮游植物细胞密度占比最大的为硅藻门;在水温偏高的丰水期稳态转换后,蓝藻门的数量占比拥有绝对优势。
在不同阶段影响洪湖浮游植物细胞密度的主要影响因子不同,在丰水期稳态转换前为透明度、水温和pH,稳态转换后主要影响因子增加了溶解氧浓度、高锰酸盐指数、总氮浓度和氨氮浓度,减少了pH;在平水期稳态转换前为水温、pH、溶解氧浓度、透明度、氨氮浓度和高锰酸盐指数,稳态转换后仅有高锰酸盐指数和溶解氧浓度;在枯水期稳态转换前为pH、溶解氧浓度、总氮浓度和高锰酸盐指数,稳态转换后主要影响因子增加了透明度、总磷浓度和氨氮浓度,减少了溶解氧。
