2023年版WHO基本药物示范目录特点分析及启示
2024-04-10韩雨倍刘文臣杨才君
韩雨倍 刘文臣 陈 琛 杨才君 方 宇
1.西安交通大学药学院 陕西西安 710061 2.西安交通大学药品安全与政策研究中心 陕西西安 710061
2023年7月21日,世界卫生组织(World Health Organization, WHO)发布了第23版基本药物示范目录(Model List of Essential Medicines, EML)与第9版儿童基本药物示范目录(Model List of Essential Medicines for Children, EMLc),此次更新的EML药物数量达502种,EMLc药物数量达361种。WHO基本药物目录作为国际公认的基本药物目录范本,对于指导各个国家制定和优化本国的基本药物目录和相关制度,具有十分重要的指导作用。为此,本文重点剖析了WHO最新版EML和EMLc的调整依据、目录构成与特点等,旨在对我国基本药物目录的更新完善提供借鉴与参考。
1 资料与方法
在WHO官方网站中进行检索,关键词为“Essential medicines”“EML”“EMLc”“Procedure”“Expert Committee”等,收集WHO基本药物示范目录工作程序(修订版)、第23版EML、第9版EMLc、第24次基本药物遴选和使用专家委员会报告等文件。
采用文本分析法,梳理WHO调整更新目录的现行工作程序;采用描述性分析方法,从EML、EMLc中归纳出新版目录的变化,分析其呈现的特点和趋势,进而对我国基本药物目录的调整更新提供启示。
2 结果与分析
2.1 WHO基药目录的调整流程与申请证据
WHO对药品调入与调出EML/EMLc的全过程都遵循“基于证据、公开透明与程序严格”的原则,这一程序受到公众审查与问责制的严格要求和制约。[1]更新基本药物示范目录的工作流程如图1所示。[2]
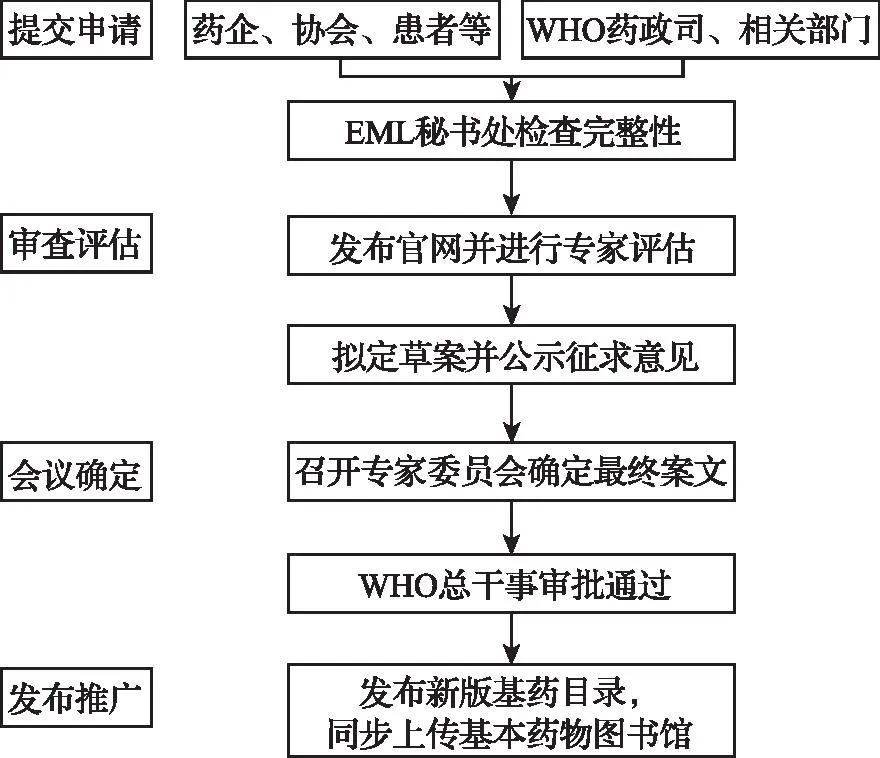
图1 WHO调整EML/EMLc的工作流程
向EML秘书处提交申请的制度是申报制,任何药品制造商、非政府组织、专业协会等相关主体均可递交用于评估药物的申请材料,不仅需要包含建议纳入或删除该药物(适应证、剂型)的摘要说明、药品的国际非专利名称(International non-patent name,INN)即通用名等基本信息,还要提供完整的、基于证据的纳入或调出该药物(适应证、剂型)的证据材料(表1)。

表1 药品申请纳入或调出WHO EML/EMLc的证据材料
2.2 新版WHO EML/EMLc的更新特点
2.2.1 整体情况
WHO基本药物遴选和使用专家委员会第24次会议于2023年4月24—28日在瑞士日内瓦举行。此次专家委员会共审议了85份申请,包括52份关于增加药物或药物类别的提案,9份关于22种目前所列药物增列适应证的提案,9份关于目前所列药物增列剂型的提案,6份关于删除13种药物、剂型或适应证的提案,9份关于对第22版EML与第8版EMLc进行其他修改的提案。最终做出如下变更决定:在EML中增加24种药物、19种药物新剂型,在EMLc中增加12种药物、48种药物新剂型,且对已在目录内的16种药物增加其他适应证。另外,分别从EML与EMLc中各调出了3种药物,还有32种药物、药物类别或药物剂型纳入、变更或删除的申请没有被采纳。这些变更使第23版EML中的药物总数达到502种(第22版为479种),第9版EMLc中的药物总数达到361种(第8版为350种)。

表2 WHO第23版EML新增分节情况
2.2.2 广泛纳入创新药物
将治疗多发性硬化症、传染病和心血管疾病等病症的重要新药纳入目录是第23版EML调整的最大亮点之一,也被称为“里程碑式的公共卫生决定”。专家委员会根据提交的证据材料进行评估,决定这些新药是否作为新增基药,保证新药的进入既能对全球公共卫生产生影响,同时不会影响中低收入国家的卫生预算。
多发性硬化症是一种慢性、难以根治的神经系统进展性疾病,目前全球约280万人被确诊,而且多发于15~40岁的青壮年,给家庭、社会与国家带来沉重的疾病负担,然而在第23版EML之前并未纳入治疗多发性硬化症的药物。克拉屈滨、醋酸格拉替雷和利妥昔单抗被新列入治疗多发性硬化症的补充目录中,同时附有不同的给药途径、推荐适应证与价格。其中,利妥昔单抗的适应证为复发或耐药的滤泡性中央型淋巴瘤,其治疗多发性硬化症为超说明书使用,但经评估,有充分的证据支持了该药针对这一适应证的安全性和有效性,取得了专家委员会的共识,同意其进入EML[5]。
另外,第23版EML新增了四种治疗传染病的新药,如表3所示。
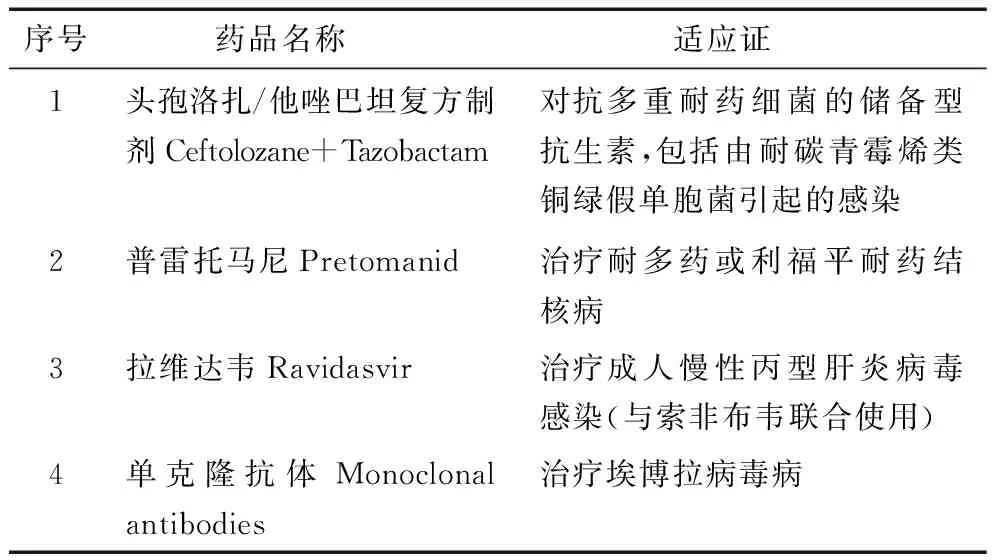
表3 WHO第23版EML新增治疗传染病药物
2.2.3 重视临床获益证据
近年来WHO专家委员会对循证医学与临床获益证据的重视程度越来越高,使其成为决定药品是否能纳入EML的关键因素。
例证1:利司扑兰。利司扑兰是第一个用于2个月以上的脊髓性肌萎缩症(SMA)患者的口服药物,但专家委员会仍不建议将其纳入EML,因为现有证据只能证明利司扑兰对5岁以下患儿有运动功能的改善,其在成人中疗效不明显,只有少数患者接受长期治疗,临床获益和潜在危害的总规模和长期持续时间仍然不确定。
玛丽的“本我”和“超我”正是处于这样一种博弈的循环中,“本我”已经千疮百孔,“超我”又是面目全非。正是因为玛丽那无处发泄的“本我”,“超我”处于极度的崩溃状态。
例证2:多奈哌齐。多奈哌齐用于治疗阿尔茨海默病引起的痴呆症,虽有中等确定性证据表明其与患者认知结果评分的短期改善有关,但缺乏证明长期临床认知改善的材料,而且目前临床试验的患者都较年轻,年龄结构很可能影响了试验结果的普遍性。因此,委员会认为该药的总体利弊对比还需更多临床试验证据加持,暂不考虑纳入EML。
例证3:托利帕单抗。对于抗肿瘤药物的遴选,专家委员会采纳并使用了肿瘤药物工作组的建议,要求必须满足至少4~6个月生存期延长的获益阈值,还要考虑欧洲肿瘤内科学会临床获益量表(ESMO Magnitude of Clinical Benefit Scale, ESMO-MCBS)评分,即药物在治愈性条件下的评分应为A或B级,在非治愈性条件下的评分应为4或5级,才能考虑将抗肿瘤药物纳入EML。[1]专家委员会对晚期鼻咽癌一线治疗的托利帕单抗进行评估时发现,生存获益目前是适度的,但由于ESMO-MCBS的评分仅为3分且随访短暂,因此该药暂未被纳入EML。
2.2.4 药品价格仍是重要的考量标准
尽管WHO声明“治疗的绝对费用/价格不能作为将符合选定标准的药物排除在EML之外的理由”,但由于基本药物的选择需考虑全球各国的经济状况与卫生体系可承受能力,因此由药物价格直接导致的不可负担性也成为药品被暂时拒绝纳入EML的原因。这一特点多见于抗肿瘤创新药等高价药物。
例证1:奥希替尼。奥希替尼是转移性非小细胞肺癌(NSCLC)或表皮生长因子受体(EGFR)突变阳性的局部晚期患者的一线治疗用药。委员会根据目前数据认定,尽管奥西替尼的生存期相较厄洛替尼、吉非替尼和阿法替尼(EML中第一代和第二代酪氨酸激酶抑制剂)有显著改善,但其价格昂贵,导致许多中低收入国家难以负担,并且如果将其列入EML可能会使已经列入EML且用于该适应证的较便宜药物被替代,反而会加剧卫生不平等。因此,专家委员会暂时拒绝了奥希替尼进入EML的申请,但要求继续跟踪评估奥西替尼的数据,并鼓励采取一些措施提升奥希替尼在中低收入国家的可负担性,如通过药品专利池(Medicines Patent Pool)谈判公共卫生许可协议等。
例证2:免疫检查点抑制剂。程序性死亡受体1(PD-1)和程序性死亡配体1(PD-L1)免疫检查点抑制剂是主要的新兴抗肿瘤免疫治疗药物,现有证据已证明这类免疫检查点抑制剂比传统铂类化疗更具有临床意义的生存获益,并可能改善生活质量,如帕博利珠单抗的总生存期可维持5年以上,而且对于目前随访数据较短、剂量和治疗持续时间数据不完整的阿替利珠单抗和西米普利单抗等也被认为具有治疗选择的可用性。然而这几种免疫检查点抑制剂却相继在2021年、2023年被拒绝纳入EML,主要原因是专家委员会认为免疫检查点抑制剂的价格高昂,导致其可负担的全球诊断测试机会是有限的。另外,全球非小细胞肺癌的高患病率,意味着提供免疫检查点抑制剂治疗的机会成本会对卫生系统带来巨大冲击。专家委员会也建议尽快解决有效抗肿瘤药物价格过高的问题,找到提高可负担性的措施[6]。
2.2.5 审慎遴选儿童药
EML与EMLc间存在双跨情况,即EMLc中的部分药品也有成人适应证,本次评估中专家委员会针对EMLc进行修改,考虑到儿童用药的年龄适宜性,进行临床获益性、公共卫生性证据等方面的审查,增加适合儿童某年龄段的剂型、扩展适应证,删除不可用的或不适合儿童的药品,以及对暂被拒绝的药物提出建议、跟踪审查。
例证1:针对可佐证某抗肿瘤药物对某病患儿有显著临床效益(如改善患儿的无进展生存期和总生存期)的情形,将该适应证添加到EMLc中已有的药物中。如EMLc补充目录的环磷酰胺、地塞米松、甲氨蝶呤等9种药物增加变性大细胞淋巴瘤(Anaplastic large cell lymphoma, ALCL)的新适应证;阿糖胞苷、免疫球蛋白、长春碱等7种药物增加朗格汉斯细胞组织细胞增多症(Langerhans’cell histiocytosis, LCH)的新适应证;利妥昔单抗增加伯基特淋巴瘤(Burkitt lymphoma)的新适应证[4]。
例证2:将即用治疗食品纳入EMLc核心目录。即用治疗食品(饼干或糊状食品)用于治疗6个月至5岁儿童的严重急性营养不良,系统综述表明,儿童使用即用治疗食品能显著增加体重和恢复营养。将其列入EMLc核心目录,反映出对儿童群体的特殊体质的重视,以期解决低收入国家儿童营养不良的问题。
例证3:删除EMLc补充目录中的氯丙嗪和氟哌啶醇。这是由于数据显示精神分裂症和其他慢性精神病在12岁以下儿童中很少见,且氯丙嗪等药物用于治疗儿童精神病的现有证据不足以支持其继续保留在EMLc中[6]。
3 对完善我国基本药物目录的启示
第一版WHO EML于1977年发布,40多年来世界各国一直将其作为制定本国基本药物目录的权威循证指南,尤其对于中低收入国家,参考WHO EML制定国家基本药物目录(National Essential Medicine Lists, NEML)并指导其国家采购决策、医保报销是必要的,因为WHO EML所列药品均为基于现状和可预测未来的公共健康状况,且是根据证据评估而挑选出来的疗效最佳、安全性最高、可及性最好的药物。我国基药目录急需借鉴WHO的经验进行优化更新,具体建议如下。
3.1 兼顾国际经验与中国特色
我国现有两大药品目录,即国家基本药物目录与国家基本医疗保险、工伤保险和生育保险药品目录(以下简称医保目录),分别承担着用药可及与用药可负担两方面作用。然而WHO及澳大利亚、泰国、印度等只有一个既能保证用药需要又能报销的药品目录,这意味着WHO的EML、其他国家的NEML和我国NEML设立的目的并不完全一致。因此,我国基本药物制度和目录的调整优化,既要参考国际经验,更要结合中国人群的疾病特点和临床用药需求,不断充实和完善具有中国特色的基本药物目录。比如,对于我国而言,临床价值高、临床应用中证据积累多的中成药应支持其进入基药目录。
3.2 适度加快目录更新频率
我国于2009年9月正式建立国家基本药物制度,并将基本药物制度作为国家药物政策的核心组成部分。但截至目前,我国只推出了2009年版、2012年版、2018年版共三版目录,原则上应3年一调,但已有5年多未更新。建议应建立国家基本药物目录的灵活动态调整机制,遵从3年更新一版目录的要求,实现对目录品种的调入、调出两方面的平衡,完善目录的种类和数量,以达到《国家基本药物目录管理办法(修订草案)》[7]提到的“满足疾病防治基本用药需求,适应现阶段基本国情和保障能力,剂型适宜,价格合理,能够保障供应,可公平获得的药品”的定位要求。
3.3 不断优化基药遴选程序
以往我国仅采用专家打分制进行非公开的基药目录遴选,其透明度和科学性不够。建议参考WHO遴选程序,增加工作程序的透明度,如每一阶段工作(确定药品备选库、评估打分)完成后进行公示;另外建议严格遴选专家库成员,专家库成员须涵盖临床药学、公共卫生、药物经济学、循证医学等学术背景的人员,也可考虑纳入更多基层医务人员代表,这是因为基药的使用更多在医疗机构,处于临床一线的医务人员对临床首选药纳入目录的需求、临床已淘汰药品应从目录中剔除等情况更为了解,因此其意见可作为重要参考,但要注意避免利益冲突。
3.4 落实基本药物调整原则
2021年《国家基本药物目录管理办法(修订草案)》[7]第五条、第十二条分别对基本药物的遴选原则与调整因素作出规定,同年发布的《药品临床综合评价管理指南(2021年版试行)》作为能评价药品临床价值的工具也成为新版基药目录调整的重要参考。以上文件对于基本药物的遴选原则已作出精准定位,对于基本药物的定位实现了从“满足基本需求的药”到“满足临床合理用药需求的药”的转换。建议我国在调整基药目录的过程中参考WHO的做法,加快落实政策文件中的要求,基于证据评估与临床综合评价的结果,列出药品调入与调出的原因,形成循证决策依据,促进我国基本药物目录对于临床合理用药、保障用药需求的指导作用。
3.5 推动单列儿童基本药物目录的进程
2021年《国家基本药物目录管理办法(修订草案)》[7]提出将单列儿童用药,由于我国尚未形成儿童基本药物目录,在考虑儿童基药的选择时,建议第一版目录可参考WHO EMLc中的药物,因为EMLc不仅列出了药品规格、剂型、用法用量等常规信息,还列出了分年龄段的使用说明与限制的信息,具有重要参考意义;同时也应考虑纳入我国临床实践指南中适用于儿童的药品、《中国国家处方集·化学药品与生物制品卷(儿童版)》中推荐的药品、医保目录中适用于儿童的药品等。
3.6 强化基药目录与医保目录的衔接
根据2018年8月国务院办公厅印发的《关于完善国家基本药物制度的意见》(国办发〔2018〕88号),“医保部门按程序将符合条件的基本药物目录内的治疗性药品优先纳入医保目录范围或调整甲乙分类”[8];在2020年2月国家卫健委等六部门印发的《关于加强医疗机构药事管理促进合理用药的意见》(国卫医发〔2020〕2号)[9]指出,要推动各级医疗机构形成以基本药物为主导的“1+X”用药模式,其中“1”指基本药物,“X”的顺序是医保药物、通过一致性评价药品、非基药和非医保药物。以上文件均表明了基药目录是医保目录的基石,对医保目录的优化完善具有重要的指导和参考作用。因此,应注重阐明我国两个目录的作用、区别与联系,不断促进两项制度的有序运行、两个目录的有效衔接:基本药物目录应涵盖临床与公共卫生必需的药物,侧重点在保障用药供应与指导临床合理用药;而医保目录是保障公民基本医疗需求并控制药品费用的依据,两目录既有重叠也有区分。建议基药目录调整时需要注意对已纳入医保目录但尚未进入基药目录的这类药品进行重点评估,如有证据支撑其具有临床必需、价格合理、安全有效等特点,应当及时纳入基药目录中;另一方面,医保目录也应优先纳入基药目录内的药品。
总之,我国应充分借鉴国际经验,因地制宜,加快制定和完善科学、规范、透明的基药目录遴选程序,定期开展目录调整工作,及时发布符合临床用药需求、与医保目录相衔接的基药目录,为进一步提升人民群众对安全、有效、经济和高质量药品的可获得、可负担和合理使用,进一步促进医药卫生资源的合理配置提供强大支撑。
作者声明本文无实际或潜在的利益冲突。
