HPLC-MS/MS 法测定磷酸特地唑胺中基因毒性杂质含量
2024-04-10黎龙香郑康乐王学明
黎龙香, 郑康乐, 王学明
(江西科睿药业有限公司, 江西 赣州 341000)
磷酸特地唑胺(tedizolid phosphate)是一种新型噁唑烷酮类抗生素,属于前药,通过在体内水解释放出特地唑胺发挥抗菌作用[1]。 磷酸特地唑胺是由Cubist Pharmaceuticals LLC 公司开发,于2014 年6 月20 日获得FDA 批准上市[2]。 临床上用于革兰氏阳性菌所致的急性细菌性皮肤和皮肤组织感染(ABSSSI)。 与已上市药物利奈唑酮相比, 磷酸特地唑胺对耐甲氧西林金黄色葡萄球菌、甲氧西林敏感金黄色葡萄球菌等耐药菌的活性大幅度提高[3]。
江西科睿药业有限公司注射用磷酸特地唑胺于2023 年4 月获得中华人民共和国国家食品药品监督管理总局(CFDA)批准生产。 TDZA010、TDZA046 是由磷酸特地唑胺中间体、起始物料与三氯氧磷反应生成,均具有卤代烷烃致癌警示结构[4],杂质信息见表1。
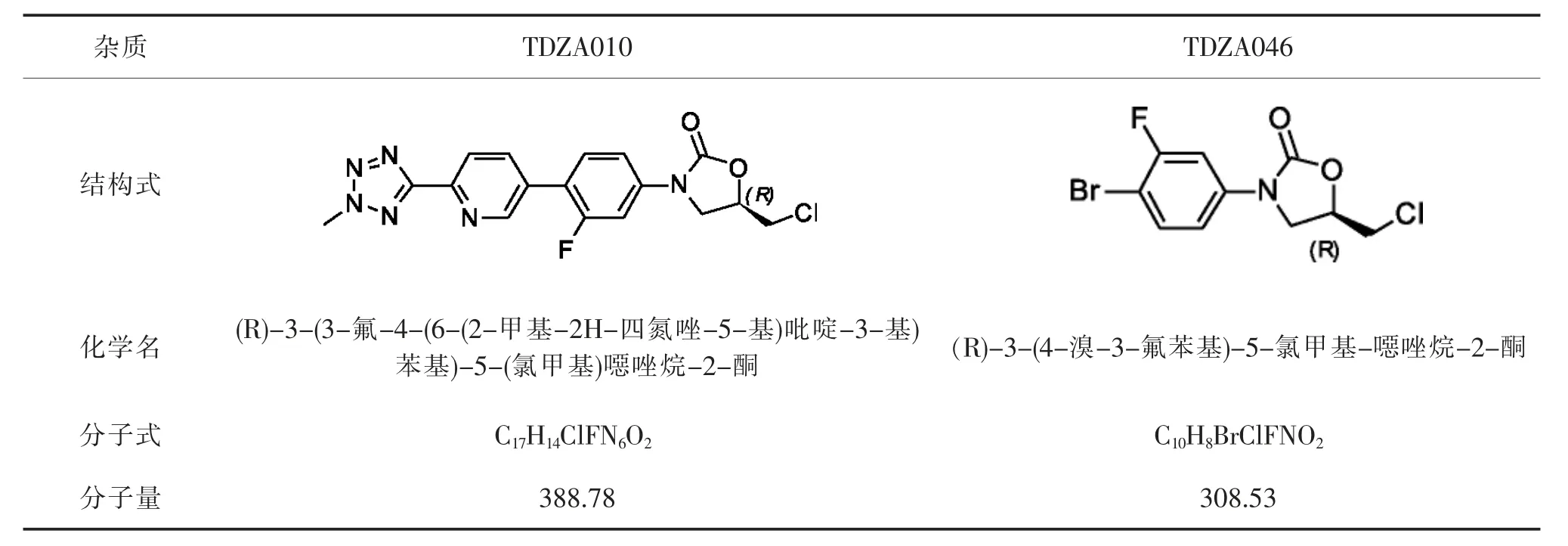
表1 磷酸特地唑胺基因毒性杂质信息Tab. 1 Genotoxic impurities information of tedizolid phosphate

表2 洗脱程序Tab. 2 Elution procedure
参照ICH M7 《评估和控制药物中DNA 反应性(致突变)杂质以限制潜在的致癌风险》中基于TTC 的可接受摄入量1.5 μg/d[5]被视为具有保护作用的终生每日暴露量。 这就允许致突变杂质的日摄入量可以高于终生暴露时的情况,而其风险水平仍与每日或非每日治疗方案相持平。 磷酸特地唑胺每天最大使用剂量为200 mg,治疗周期不超过一年。基于非终生暴露(LTL)原则:治疗期1~12 个月时,潜在基因毒性的每日可接受摄入量为20 μg/d。 计算得到TDZA010、TDZA046 的控制限度为不得超过100×10-6(20 μg/d/(200 mg/d)=100×10-6)。
目前,仅查询到姚松梅[6]建立了高效液相色谱法(HPLC)测定磷酸特地唑胺原料药中有关物质TDZA010 的分析方法, 该方法TDZA010 定量限均为45 ng·mL-1,运行时间为60 min;未见对磷酸特地唑胺中基因毒性杂质TDZA046 分析方法的研究报道。 为保证本品临床用药的安全性,本文建立一种同时测定磷酸特地唑胺中基因毒性杂质TDZA010、TDZA046 的质谱定量测定方法,并参照《中国药典》2020 年版四部通则9101[7]和ICH Q2[8]要求进行方法学验证。
1 实验部分
1.1 仪器与试剂
1.1.1 仪器
Agilent 1260 高效液相色谱仪(安捷伦公司);Agilent G6125C(安捷伦公司);Waters XEVO G2-XS Qtof (沃特世公司);XPE 105 DR 电子天平(梅特勒-托利多公司)。
1.1.2 试剂
TDZA010 对照品(自制,批号:1920343304,含量98.8%);TDZA046 对照品 (自制, 批号:1920421002,含量99.6%);磷酸特地唑胺(自制,批号:20201103、20201223、20201227、20210105)。
乙酸铵(色谱纯,山东西亚化学工业有限公司);氨水(色谱纯,广东光华科技股份有限公司);乙腈(质谱纯,Fisher 公司)。
1.2 实验方法
1.2.1 色谱条件
色谱柱为Waters Acquity BEH C18(2.1 mm×100 mm,1.7 μm);以20 mmol 醋酸铵溶液(取醋酸铵1.54 g,加水1000 mL 使其溶解,用氨水调节pH 至8.0)为流动相A,以乙腈为流动相B,按表1 进行线性梯度洗脱; 柱温为40 ℃; 流速为0.4 mL·min-1;进样体积为10 μL。
1.2.2 质谱条件
采用ESI 离子源正离子模式, 毛细管电压:4000 V;气体温度:300 ℃;气体流速:11.0 L·min-1;喷雾器压力:1.0×105Pa;裂解电压:135 V。
1.2.3 电喷雾离子化扫描图
电喷雾离子化正离子扫描检测条件下,分别以TDZA010、TDZA046 的[M+H]+质荷比为m/z =389.1 及m/z= 310.0 作为定量离子(图1) 。

图1 TDZA010、TDZA046 质谱图Fig. 1 Mass spectrogram of TDZA010、TDZA046
1.2.4 溶液配制
空白溶液/溶剂:流动相A。
对照品储备1 溶液: 取TDZA010 对照品、TDZA046 对照品各约10 mg,精密称定,置于100 mL容量瓶中,加溶剂溶解并稀释至刻度,摇匀。
对照品储备2 溶液: 精密量取对照品储备1溶液1 mL,置于20 mL 容量瓶中,用溶剂稀释至刻度,摇匀。
对照品溶液:精密量取对照品储备2 溶液1 mL,置于25 mL 容量瓶中,用溶剂稀释至刻度,摇匀。
供试品溶液:取磷酸特地唑胺约50 mg,精密称定,置于25 mL 容量瓶中,加溶剂溶解并稀释至刻度,摇匀。
供试品加标溶液:取磷酸特地唑胺约50 mg,精密称定,置于25 mL 容量瓶中,加对照品溶液溶解并稀释至刻度,摇匀。
2 结果与讨论
2.1 测定条件的选择
2.1.1 质谱条件的选择
由于使用的质谱仪为单四级杆质谱仪,只能使用SIM 模式进行定量检测, 在电子喷雾源ESI正离子模式下可得到TDZA010 加氢峰m/z 389.1,TDZA046 加氢峰m/z 310.1, 因此确定m/z 389.1、m/z 310.1 为定量离子进行实验。
2.1.2 溶剂及流动相A 的选择
由于磷酸特地唑胺在中性、 酸性溶液中难溶,仅在碱性溶液中易溶,所以考虑碱性水溶液作为溶剂,但质谱采用的是ESI 正离子模式,碱性过强会抑制化合物的电离从而影响方法的灵敏度,因此选择弱碱性pH=8.0 的20 mmol 乙酸铵溶液作为溶剂及流动相A。
2.1.3 色谱柱的选择
由于本实验中供试品溶液浓度较大,TDZA010、TDZA046 与磷酸特地唑胺需完全分离,以保证方法的回收率符合要求。 通过考察不同规格的色谱柱, 最终确定Waters Acquity BEH C18(2.1 mm×100 mm,1.7 μm)色谱柱进行本次研究,该色谱柱可以满足分离度要求并快速分析。
2.2 专属性
分别取1.2.4 项下空白溶液、 对照品溶液、供试品溶液及供试品加标溶液, 按拟定条件进样,记录色谱图,结果见图2 及表3。 结果表明,基因毒性杂质TDZA010、TDZA046 的保留时间分别为6.8 min、7.9 min 左右, 空白溶液和供试品溶液不干扰TDZA010、TDZA046,表明方法专属性良好。
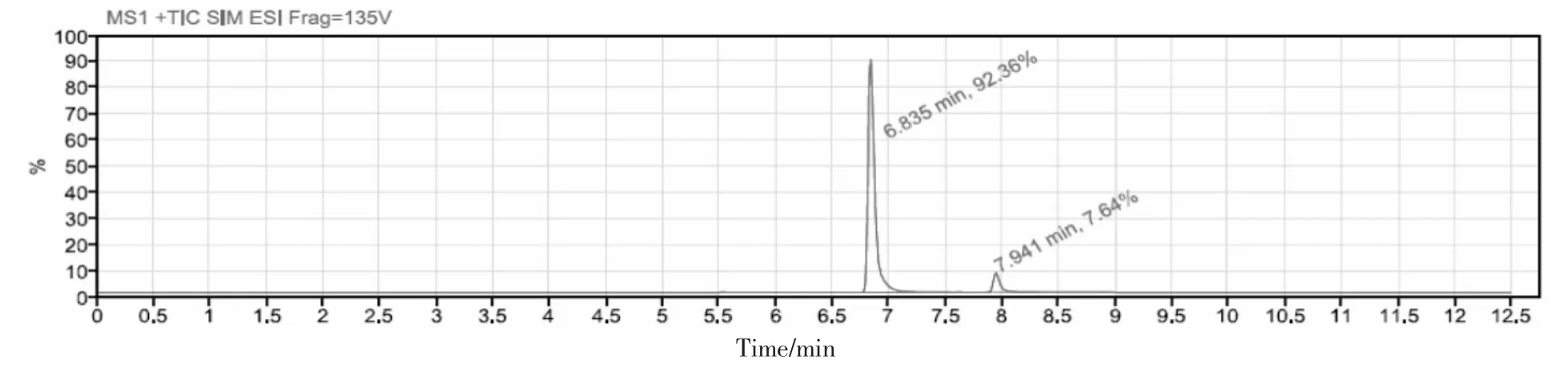
图2 供试品加标溶液色谱图Fig. 2 Chromatogram of sample spiking solution
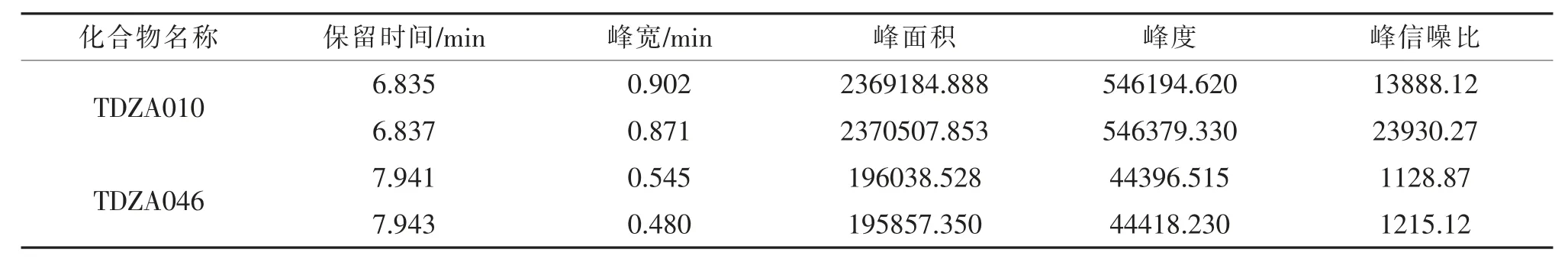
表3 供试品加标溶液结果Tab. 3 Results of sample spiking solution
2.3 系统精密度
取1.2.4 项下对照品溶液按拟定条件连续进样6 次, 记录色谱图, 结果见表4。 表4 表明,TDZA010、TDZA046 保留时间的RSD 均为0.1%,峰面积RSD 分别为0.5%、1.6%,表明方法系统精密度良好。

表4 系统精密度结果Tab. 4 Results of system precision
2.4 检测限与定量限
取1.2.4 项下对照品溶液, 用溶剂逐级稀释,按拟定条件进样检测,记录色谱图,信噪比S/N 约为3 作为检测限溶液, 信噪比S/N 约为10 作为定量限溶液。 结果表明,TDZA010、TDZA046 检测限均为1 ng·mL-1,定量限均为3 ng·mL-1,表明方法灵敏度高。
2.5 线性与范围
线性考察溶液-1(限度的30%):取1.2.4 项下对照品储备2 溶液0.3 mL,置于25 mL 容量瓶中,用溶剂稀释至刻度,摇匀。
线性考察溶液-2(限度的50%):取1.2.4 项下对照品储备2 溶液0.5 mL,置于25 mL 容量瓶中,用溶剂稀释至刻度,摇匀。
线性考察溶液-3(限度的80%):取1.2.4 项下对照品储备2 溶液0.8 mL,置于25 mL 容量瓶中,用溶剂稀释至刻度,摇匀。
线性考察溶液-4(限度的100%):取1.2.4 项下对照品储备2 溶液1.0 mL,置于25 mL 容量瓶中,用溶剂稀释至刻度,摇匀。
线性考察溶液-5(限度的120%):取1.2.4 项下对照品储备2 溶液1.2 mL,置于25 mL 容量瓶中,用溶剂稀释至刻度,摇匀。
线性考察溶液-6(限度的150%):取1.2.4 项下对照品储备2 溶液1.5 mL,置于25 mL 容量瓶中,用溶剂稀释至刻度,摇匀。
取上述线性系列溶液, 按拟定条件进样,记录色谱图,以浓度为横坐标,峰面积为纵坐标,绘制标准曲线,以最小二乘法进行线性回归,结果见表5。 结果表明,TDZA010、TDZA046 在限度的30%~150%范围内线性关系良好, 皮尔逊相关系数(r)均大于0.99。

表5 线性与范围考察结果Tab. 5 Results of linearity and range
2.6 准确度
回收率考察溶液-1(限度的80%):取磷酸特地唑胺约50 mg,精密称定,分别置于25 mL 容量瓶中,精密加入1.2.4 项下对照品储备2 溶液0.8 mL,加溶剂稀释至刻度,摇匀,平行配制3 份。
回收率考察溶液-2(限度的100%):取磷酸特地唑胺约50 mg,精密称定,分别置于25 mL 容量瓶中, 精密加入1.2.4 项下对照品储备2 溶液1.0 mL,加溶剂稀释至刻度,摇匀,平行配制6 份。
回收率考察溶液-3(限度的150%):取磷酸特地唑胺约50 mg,精密称定,分别置于25 mL 容量瓶中, 精密加入1.2.4 项下对照品储备2 溶液1.5 mL,加溶剂稀释至刻度,摇匀,平行配制3 份。
按1.2.4 项下方法配制对照品溶液及供试品溶液,取上述溶液按拟定条件进样,记录色谱图,计算回收率及回收率RSD(n=12),结果见表6、表7。 表6、表7 结果表明,TDZA010 回收率在89.8%~105.3%之间,TDZA046 回收率在90.3%~102.5%之间,RSD 分别为5.3%、4.6%,表明方法回收率良好。
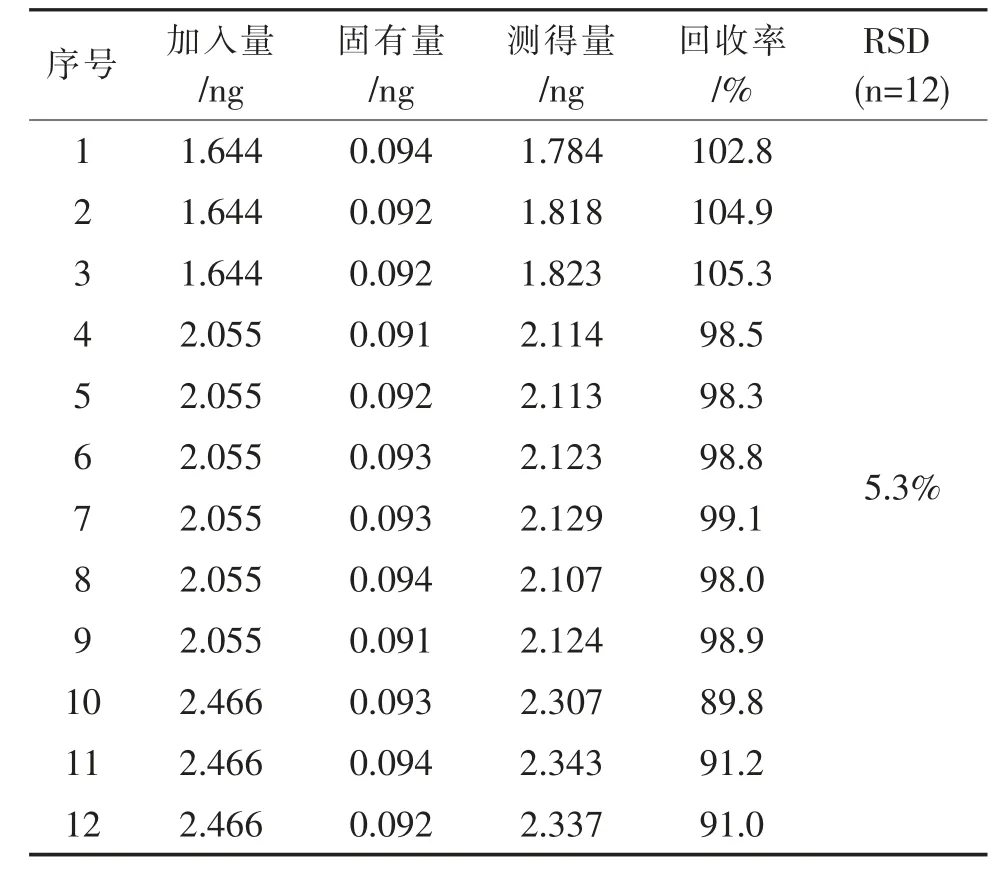
表6 TDZA010 回收率考察结果Tab. 6 Results of TDZA010 recovery
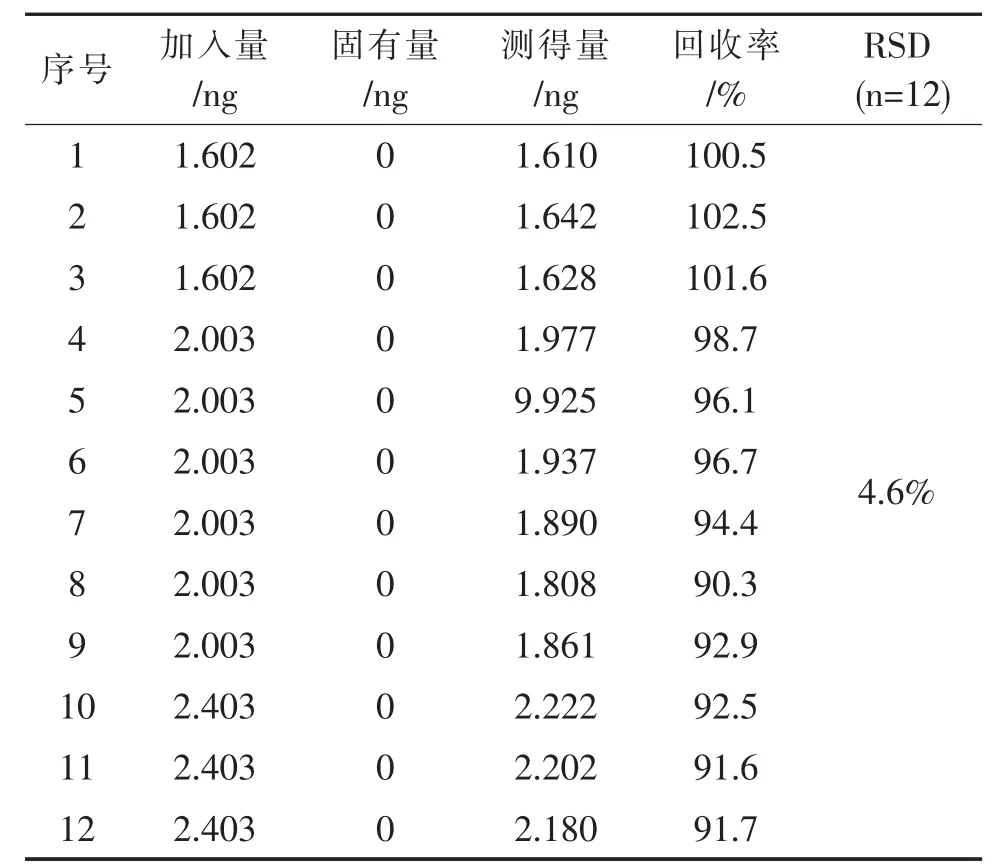
表7 TDZA046 回收率考察结果Tab. 7 Results of TDZA046 recovery
2.7 重复性
取6 份2.6 项下回收率考察溶液-2。 按拟定条件进样,记录色谱图,计算6 份回收率,考察溶液中TDZA010、TDZA046 检测结果的RSD, 结果见表8。 结果表明,6 份考察溶液TDZA010、TDZA046 的重复性RSD 分别为0.4%、3.3%,表明方法重复性良好。
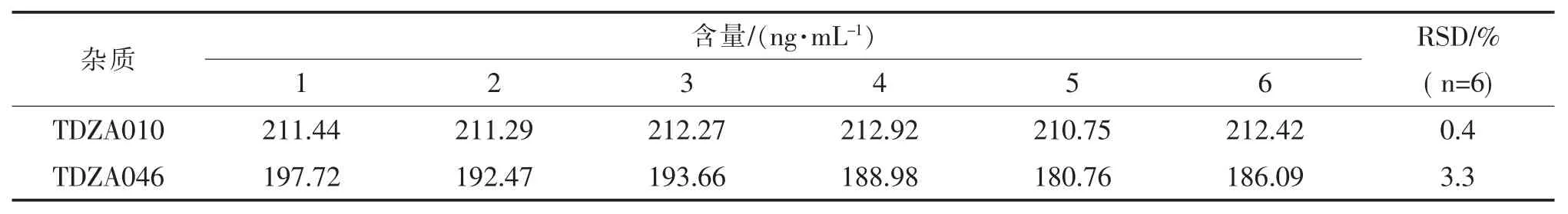
表8 重复性考察结果Tab.8 Results of repeatability
2.8 耐用性
按1.2.4 项下溶液配制方法配制空白溶液、对照品溶液、供试品溶液、供试品加标溶液,微小改变色谱条件或者质谱条件参数,耐用性考察的条件如下:
柱流速-1: 仅将1.2.1 色谱条件流速改为0.41 mL·min-1;
柱温-1:仅将1.2.1 色谱条件柱温改为39 ℃;
柱温-2:仅将1.2.1 色谱条件柱温改为41 ℃;
毛细管电压-1: 仅将2.1.2 质谱条件毛细管电压改为3950 V;
毛细管电压-2: 仅将1.2.2 质谱条件毛细管电压改为4050 V。
取空白溶液、对照品溶液、供试品溶液、供试品加标溶液按上述各改变条件测试, 记录色谱图, 计算正常条件和微调参数后TDZA010、TDZA046 回收率及回收率RSD,考察结果见表9。结果表明,TDZA010 耐用性检测结果回收率在92.1%~97.0%之间,TDZA046 耐用性检测结果回收率在81.9%~89.2%之间, 回收率RSD 分别为0.1%、3.0%,表明方法的耐用良好。
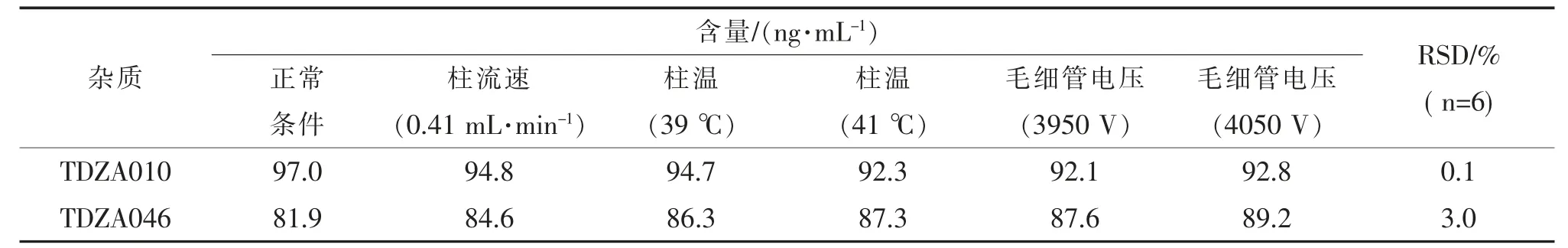
表9 耐用性考察结果Tab.9 Results of robustness
2.9 样品测定
取3 批工艺验证磷酸特地唑胺样品 (批号:20201223、20201227、20210105), 按1.2.4 项下溶液配制方法配制对照品溶液、供试品溶液。 取上述对照品溶液、 供试品溶液按拟定条件进样,记录色谱图, 按外标法计算TDZA010、TDZA046 的含量,样品测定结果见表10。表10 表明,3 批磷酸特地唑胺中只有2 批样品检出TDZA010,但远小于拟定控制限度,TDZA046 均未检出。 为保证产品质量, 将TDZA010、TDZA046 订入磷酸特地唑胺放行质量标准进行周期性检测。
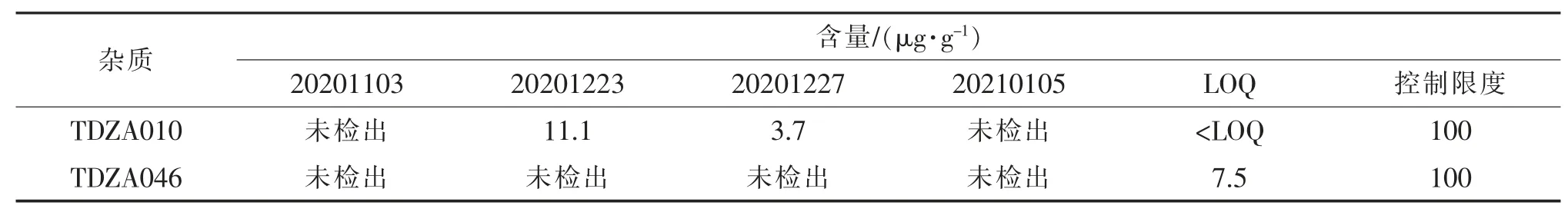
表10 样品测定结果Tab.10 Results of sample determination
3 结论
本研究建立了高效液相色谱-串联质谱联用方法同时测定磷酸特地唑胺中基因毒性杂质TDZA010、TDZA046 的含量,该方法精密度高、重复性好、定量准确,可为后期测定该类生产工艺的磷酸特地唑胺卤代烷烃类基因毒性杂质含量提供参考。
