一种可快速检测大肠杆菌O157:H7 的纸基传感器的制备与应用
2024-04-10王晓颖施锦辉王金娟戴晗祎郭骁驹王晓惠
◎ 王晓颖,施锦辉,王金娟,戴晗祎,郭骁驹,王晓惠
(1.南通海关综合技术中心,江苏 南通 226004;2.江南大学食品学院,江苏 无锡 214122;3.南通市如皋生态环境监测站,江苏 如皋 226500)
食源性致病菌是引发公共卫生安全事件的重要因素之一,其在食品的制造、销售、处理和消费等过程中都有传播的可能性[1]。在食源性致病菌中,大肠埃希氏菌是易导致出血性腹泻和肠炎的致病菌,O157:H7 则是典型的菌属,该致病菌通常存在于未经加工的蔬菜、肉制品中,若摄入被大肠杆菌O157:H7污染的食品,会对人体造成较大伤害[2],因此需要建立一类适用于现场快速检测的方法来对食品进行筛查,尽量减少致病菌带来的危害。
大肠杆菌O157:H7 的检测方法有传统的培养法、分子生物学检测、免疫学方法[3]、生物传感器法和核酸适配体法等。传统的检测方法的检测周期长、对检测人员经验要求高,免疫学和分子生物学检测方法的操作复杂、无法满足现场快速检测的要求,因此如何在低成本、高效、快速的前提下进行检测成为亟待解决的问题。本研究制备了一种基于适配体的快速检测纸基传感器,用于大肠杆菌O157:H7 的检测。该传感器有较好的特异性和重复性,可在15 min 内快速检测出大肠杆菌O157:H7 并应用于实际样品检测中。
1 材料与方法
1.1 材料与试剂
硝酸镓;99.99%六水合硝酸锌;硝酸铬;氨水(28 wt%);盐酸;异丙醇;氢氧化钠;超纯水;N,N-二甲基甲酰胺(DMF);N-羟基丁二酰亚胺(NHS);1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC);3-氨丙基三乙氧基硅烷(APTES);无水乙醇;羟基化聚乙二醇羧酸(HO-PEG12-COOH);PBS 缓冲液(0.01 mol·L-1,pH=7.4);Tris-HCl 缓冲液(10 mmol·L-1,pH=7.2);功能化核酸适配体及其互补序列;whatman1号定性滤纸;吸水棉;底板;大肠埃希氏菌O157:H7(ATCC35150);麦氏比浊管;琼脂平板。
1.2 仪器设备
CP-225D 天平,德国赛多利斯;便携式pH 计,梅特勒-托利多仪器上海有限公司;XPDHG-9246A数显鼓风干燥箱,上海析谱仪器有限公司;马弗炉,英国CARBOLITE;DF-101S 集热式磁力搅拌器,上海力辰邦西仪器科技有限公司;Milliq Academic 超纯水机,美国密理博公司;KQ-50E 超声波清洗器,昆山市超声仪器有限公司;水热反应釜,力辰科技;TG-16 离心机,上海屹谱;Talos F200 透射电子显微镜,赛默飞;D8 ADVANCE X 射线衍射仪,布鲁克AXS;RF-6000 荧光分光光度计,日本岛津公司;Zeta 电位分析仪,PALS 美国布鲁克公司;WFH-204B手提式紫外分析仪,杭州齐威仪器有限公司。
1.3 实验方法
1.3.1 材料合成
本文采用一步水热法[4]合成红色长余辉纳米材料ZnGa2O4:Cr3+,首先用超纯水分别配制2 mol·L-1硝酸镓、1 mol·L-1硝酸锌、1 mmol·L-1硝酸铬溶液,再移取1 mL 硝酸镓、2 mL 硝酸锌、4 mL 硝酸铬的水溶液于烧杯中混合均匀,加超纯水定容至30 mL,定容过程中用氨水调节溶液pH 至9.0。随后,将混合溶液于室温搅拌0.5 h 使其预反应,预反应结束后将溶液转移到聚四氟乙烯内衬反应釜(内衬体积50 mL)中,封好后将反应釜放入220 ℃烘箱中(事先预热),水热反应约10 h。反应结束后,待反应釜自然冷却到室温,将产物分散于0.01 mol·L-1盐酸中,充分混合后离心收集,加入过量异丙醇离心洗涤3 次,最后用超纯水洗涤1 次,于真空干燥箱中干燥备用。
1.3.2 适配体选择
参考文献[5]合成修饰过的大肠杆菌O157:H7 适配体及DNA 互补链,用以修饰长余辉材料的适配体的5'端均修饰了羧基,3'端修饰了生物素,其余适配体5'端均用生物素进行了修饰,所有适配体和DNA 互补链均委托上海生工生物工程有限公司合成,所合成的DNA 序列见表1。

表1 适配体或DNA 序列表
1.3.3 适配体功能化材料
(1)羟基化修饰。将200 mg 红色长余辉纳米材料放入5 mmol·L-1氢氧化钠溶液中并超声分散,在室温条件下搅拌24 h,而后放入离心机中2 700 r·min-1离心分离5 min,将离心产物依次用超纯水(自制)洗涤3 次,洗涤所得产物于真空干燥箱中,在10-2Pa、50 ℃条件下干燥6 h,收集备用。
(2)氨基化修饰。取羟基化的红色长余辉材料100 mg,超声分散于40 mL DMF 中,边磁力搅拌边向溶液中加入APTES,加入量约为40 μL;滴加结束后将其置于80 ℃下恒温搅拌12 h,2 700 r·min-1离心3 min,分离收集底部沉淀;用DMF 洗涤沉淀3 次,无水乙醇洗涤2 次,最终产物在室温下真空干燥。
(3)适配体功能化长余辉纳米探针。通过酰胺缩合反应实现长余辉纳米颗粒与核酸适配体的偶联。具体方法是将5 mg 氨基功能化的长余辉纳米材料与4 nmol 的5'端修饰了COOH 和3'端修饰了生物素的大肠杆菌O157:H7 的适配体1、8 nmol 的NHS、16 nmol的EDC 混合于0.01 mol·L-1的PBS 溶液(pH 在7.4左右)中,室温下避光搅拌。接着将4 μmol 的HO-PEG12-COOH、8 μmol的NHS、16 μmol的EDC加入上述溶液中,于室温下避光搅拌反应8 h,3 000 r·min-1离心5 min以分离除去未反应的适配体,将沉淀用10 mmol·L-1Tris-HCl 缓冲液(pH=7.2)洗涤3 次即可得到适配体功能化的长余辉纳米颗粒,再将其置于缓冲溶液中分散存储备用。
(4)材料表征。将长余辉材料粉末置于X 射线衍射仪中扫描获取XRD 图谱,将长余辉材料极少量分散于水溶液中进行超声,再放入荧光分光光度计测得激发光谱和发射光谱,将固体粉末和水溶液分别放于紫外灯254 nm 条件下照射,可观察到荧光现象。将功能化修饰前后的长余辉材料分散于纯水中,然后置于Zeta 电位分析仪中测得材料的电位变化。
1.3.4 纸基传感器的制作
将whatman1 号定性滤纸裁剪成如图1 所示形状,滤纸分成同等大小的3 份并进行折叠(图2),用3 对圆形超强磁铁将3 层滤纸吸附住进行部分封闭,将折叠好的滤纸放入加热融化的石蜡液中,浸没后立刻取出,待冷却后将滤纸放入烘箱低温加热使石蜡均匀渗透到滤纸间隙中。如图1 所示,圆形区域未被石蜡浸润的为亲水区,其余已被石蜡浸透的部分为疏水区。将3 mg·mL-1适配体1 功能化的长余辉探针固定在第一层的亲水区,4 nmol·L-1适配体2 固定在第二层的亲水区,7 nmol·mL-1适配体1 的DNA 互补链固定在第三层的亲水区,固定结束后将纸基置于37 ℃烘箱内加热8 h,在最后一层底部粘合吸水垫和底板,最后密封干燥保存。检测原理如下。当溶液中含有大肠杆菌O157:H7 时,目标致病菌与功能化的长余辉探针结合进入第二层,第二层的适配体2 又与目标致病菌相结合,未结合的长余辉探针则随着毛细作用进入第三层与适配体1 的DNA 互补链相结合,待反应结束后在紫外灯254 nm 下照射激发纸基,则第二层与第三层均有红色荧光;若溶液中不含目标致病菌,则长余辉探针直接与第三层的适配体1 DNA 互补相结合,紫外灯激发后第二层无荧光现象,第三层有红色荧光。

图1 滤纸展开形状图

图2 滤纸折叠方式图
1.3.5 致病菌检测
对购买的标准菌株大肠杆菌O157:H7 进行活化,在培养基中37 ℃培养24 h,用接种环取适量细菌于透明玻璃管中,摇匀后与麦氏比浊管进行比对,配制成109CFU·mL-1浓度的菌液,而后将菌液稀释,摇匀后吸取1 mL 菌液置于培养基中,37 ℃培养24 ~48 h,用平板计数法来确定细菌的浓度。将不同浓度的菌液滴加进第一层亲水区,向下渗透一段时间后,用紫外灯照射不同的检测层以观察荧光现象确定检测结果,并将其与无菌水样品检测结果进行对照。
2 结果与分析
2.1 材料结构表征
由图3 可知,将X 射线衍射仪所得材料图谱与标准图谱JCPDS:86-0415 对比可知,所有衍射峰均与标准图谱相符合,这表明所制备的红色长余辉纳米材料具有典型的ZnGa2O4晶相结构。由图4 可知,纳米粒子的平均粒径为8.6 nm,尺寸差别较小,颗粒呈不规则状,近圆形,分散性较好。
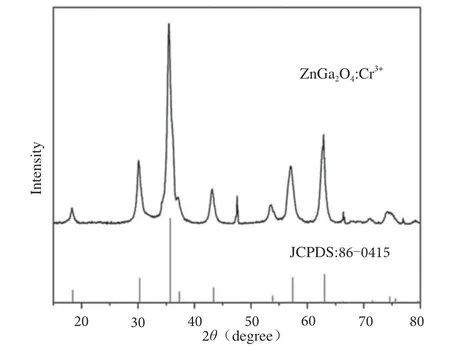
图3 ZnGa2O4:Cr3+长余辉材料的XRD 图谱
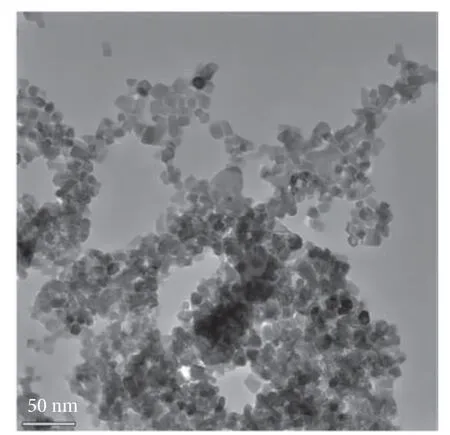
图4 ZnGa2O4:Cr3+在透射电镜下的形貌特征图
2.2 光学特性表征
由图5 可知,合成的红色长余辉纳米材料可在217 ~298 nm 的紫外光条件下激发;由图6 可知,该材料在发射峰684 nm 处,处于红色光区域。由图7 可知,用手提式紫外分析仪在254 nm 条件下照射超声后的长余辉纳米粒子溶液,可见溶液呈现明显的红色。
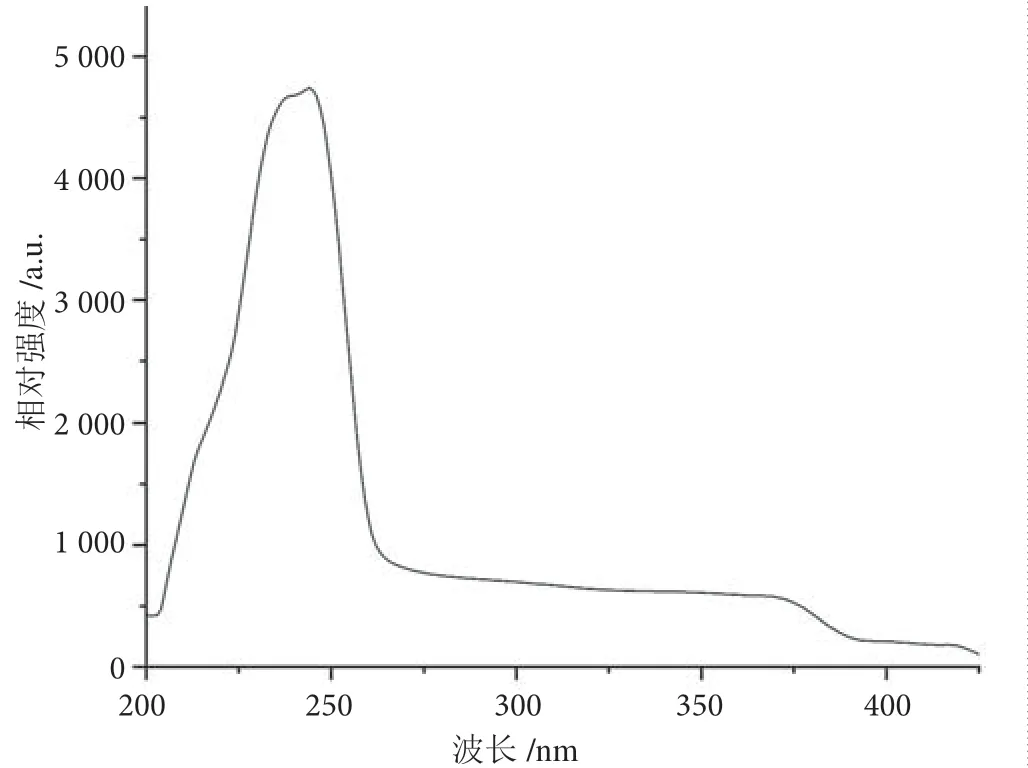
图5 ZnGa2O4:Cr3+的激发光谱图
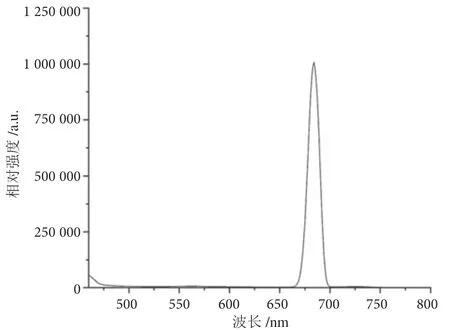
图6 ZnGa2O4:Cr3+的发射光谱图

图7 红色长余辉材料固体粉末和水溶液在紫外灯激发后的余辉现象图
2.3 适配体功能化
由图8 可知,对长余辉材料(PLNPs)、氨基化的长余辉材料(PLNPs-NH2)、与适配体连接的长余辉材料(PLNPs-适配体1)分别进行ζ 电位的测定,氨基功能化后的长余辉材料ζ 电位由+6.29 mV 增加到+10.86 mV,而与适配体连接后的ζ 电位则减少到-12.93 mV,此时纳米颗粒带少量负电荷,证明纳米材料适配体功能化成功。
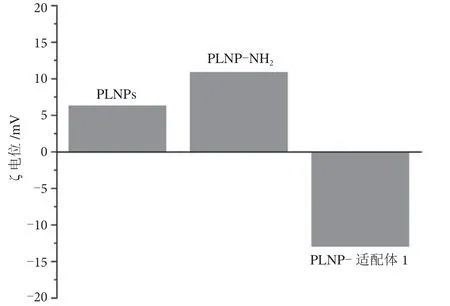
图8 长余辉材料功能化修饰前后ζ 电位的变化图
2.4 菌液验证
将7 种不同浓度的菌液分别滴加到纸基传感器,15 min 后用紫外灯照射观察。菌液的浓度依次为7.5×106CFU·mL-1、7.5×105CFU·mL-1、7.5×104CFU·mL-1、7.5×103CFU·mL-1、7.5×102CFU·mL-1、7.5×101CFU·mL-1、0 CFU·mL-1,当菌液浓度大于等于7.5×103CFU·mL-1时,传感器第二层和第三层均能看到明显的红色荧光,当菌液浓度小于7.5×103CFU·mL-1时,传感器第二层无荧光现象,第三层仍有明显的红色荧光。这表明此传感器最小检出浓度为7.5×103CFU·mL-1。
用纸基传感器对浓度为104CFU·mL-1的金黄色葡萄球菌菌液、7.5×103CFU·mL-1的大肠杆菌O157:H7和104CFU·mL-1的金黄色葡萄球菌的混合液分别进行检测。由图9 可知,滴加金黄色葡萄球菌菌液的传感器只有第三层有红色荧光,而滴加混合菌液的传感器第二层和第三层均有红色荧光,这表明该传感器可以特异性识别大肠杆菌O157:H7。

图9 金黄色葡萄球菌菌液和混合菌液检测结果图
3 结论
本研究基于适配体功能化的长余辉探针制备了一种能快速检测大肠杆菌O157:H7 的纸基传感器,该传感器可同时测定3 个样品,特异性高、成本低、操作方便且环境友好,能在15 min 内直观地读取检测结果,对大肠杆菌O157:H7 的最小检出浓度为7.5×103CFU·mL-1,在应对大批量样品的现场快速筛查方面有较好的应用前景。
