糖调节受损患者血清25(OH)D和免疫相关因子对亚临床动脉粥样硬化影响的研究
2024-04-09王晓梅金涛王霞俞淑静费大东
王晓梅 金涛 王霞 俞淑静 费大东
(1.枣庄市立医院内分泌科,枣庄 277100;2.枣庄市立医院高血压门诊,枣庄 277100)
糖调节受损(impaired glucose regulation,IGR)是机体分泌的内源性胰岛素无法满足正常糖代谢需求,进而出现糖代谢紊乱或功能受损的疾病,其作为2型糖尿病的早期阶段主要包括糖耐量减低和空腹血糖受损等[1-2]。研究表明,IGR是糖尿病和心血管疾病的危险因素,引发血管并发症,增加冠心病、心肌梗死等心血管事件发生率,威胁患者生命安全[3]。动脉粥样硬化(atherosclerosis,AS)是IGR患者出现血管病变的病理基础,大血管中膜可出现厚度增加或斑块形成等特征,但亚临床AS未见显著症状,临床诊断难度大,因而寻找替代指标,对减缓动脉血管损伤,降低心血管发病率及改善患者生活质量等具有重要意义[4-5]。维生素D是常见的甾醇激素,可通过血液循环进入肝脏,并经相应酶催化后生成25-羟基维生素D[25-hydroxyvitamin D,25(OH)D],可维持机体钙磷平衡、骨钙代谢及骨骼生长发育等生理作用[6],ANGELLOTTI等[7]证实,糖尿病患者中血清25(OH)D异常低表达,而其高表达可诱导维生素D受体和血管内皮生长因子,促进平滑肌细胞增殖、分化,改善内皮功能,抑制AS的形成。研究发现,IGR是免疫炎症性疾病,肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和IL-6等可介导炎症反应参与血管病理过程,与AS的发生、发展相关[8],但二者与亚临床AS的作用研究相对较少,因而本研究探讨IGR患者血清25(OH)D和免疫相关因子异常表达与亚临床AS的相互作用,为临床提供依据。
1 资料与方法
1.1 资料
1.1.1 研究对象 本研究符合伦理原则,经枣庄市立医院伦理委员会审核并批准(批件号:zzslyykyll201901901),选取2019年12月至2021年4月枣庄市立医院收治的142例IGR患者,根据经颈动脉超声检查和臂踝脉搏波传导速度分组,即仅IGR患者为对照组(n=86),男性45例,女性41例;年龄28~63岁,平均年龄(45.43±6.91)岁;身体质量指数(BMI)20.17~28.91 kg/m2,平均(25.54±2.08) kg/m2;并发亚临床AS为观察组(n=56),男性26例,女性30例;年龄32~64岁,平均年龄(47.31±6.01)岁;BMI 21.51~29.75 kg/m2,平均BMI(25.63±2.10) kg/m2。两组患者性别(χ2=0.472,P=0.492)、年龄(t=1.666,P=0.098)和BMI(t=0.251,P=0.802)差异均无统计学意义。所有患者均严格控制饮食,尽量低油、低糖饮食,定期监测血糖等。
纳入标准:①所有患者均符合IGR[9],即空腹血糖<6.1 mmol/L,口服葡萄糖耐量试验:服用糖后2 h的血糖范围:7.8~11.1 mmol/L;②年龄超过18岁,小学以上学历,能沟通交流者;③可应用颈动脉超声区分亚临床AS;④病例资料齐全,配合治疗、采集样本,患者和家属知情同意本研究。
排除标准:①存在明显指征确认为糖尿病疾病者;②肝、肾等器官衰竭者;③入院前未给予任何药物治疗,包括降糖药和抗生素等;④合并脑血管疾病、恶性肿瘤及内分泌系统疾病者;⑤近3个月服用肾上腺皮质激素、合并患有内分泌代谢疾病或不配合者。
1.1.2 试剂与仪器 离心机(德国IKA公司,G-L型号);全自动生化分析仪(美国BECKMAN公司,DXC-800型号),配套的试剂盒购自北京荣志海达生物科技有限公司以及上海酶研生物科技有限公司;酶标仪测(美国Thermo公司,热电FC型);彩色多普勒超声(美国GE公司VIVID7型号);动脉硬化检测仪(上海涵飞医疗器械有限公司AF900型)。
1.2 方法
1.2.1 血清25(OH)D和免疫相关因子 采集IGR患者空腹肘静脉血,使用离心机分离样品,上清液即为血清产物,具体参数:3 500 r/min、温度4 ℃、半径为8 cm,时间15 min,冷冻保存,统一检测。使用全自动生化分析仪测定血清25(OH)D浓度,酶标仪测定血清TNF-α和IL-6。
1.2.2 颈动脉内终末厚度和臂踝脉搏波传导速度 应用美国GE公司VIVID7型号彩色多普勒超声仪,采用血管超宽频探头,频率为7.5~11.0 MHz,体位为平卧,分别检测颈动脉、颈内动脉和颈动脉分叉部等3个位置的内中膜厚度,取平均值,颈动脉内中膜厚度(intima-media thickness,IMT)<1.1 mm定义为未发生AS或形成斑块。应用动脉硬化检测仪测定臂踝脉搏波传导速度,若传导速度>1 700 cm/s,则为亚临床AS[10]。
1.2.3 基线资料采集 研究人员自行设计调查问卷,收集患者性别、年龄、收缩压、舒张压,学历、血液学指标(高效液相色谱法测定糖化血红蛋白;沉淀法测定三酰甘油、总胆固醇、高密度脂蛋白和低密度脂蛋白)。
1.2.4 诊断效能 以1.2.2中标准为金标准,以血清25(OH)D和免疫相关因子为检验变量,以是否发生亚临床AS为状态标量,进行ROC检测,以AUC>0.5为有预测价值。
1.3 统计学方法 采用SPSS25.0软件进行统计学分析,计量资料均经方差齐性检测,以±s表示,行t检验;计数资料以百分率(%)表示,行χ2检验;Pearson法测定IMT与血清25(OH)D和免疫相关因子的相关性;采用多因素Logistic回归分析亚临床AS发生的影响因素,用ROC曲线分析血清25(OH)D和免疫相关因子对亚临床AS的预测价值,P<0.05代表差异有统计学意义。
2 结果
2.1 两组患者血清25(OH)D和免疫相关因子比较 观察组患者血清25(OH)D水平明显低于对照组,观察组患者TNF-α和IL-6水平明显高于对照组(P<0.05),见表1。
表1 两组患者血清25(OH)D和免疫相关因子比较(±s)Tab.1 Comparison of serum 25(OH)D and immunerelated factors between two groups (±s)
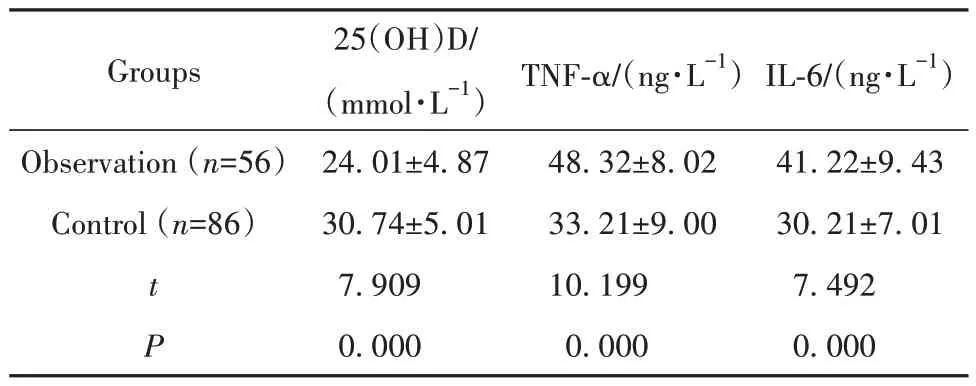
表1 两组患者血清25(OH)D和免疫相关因子比较(±s)Tab.1 Comparison of serum 25(OH)D and immunerelated factors between two groups (±s)
Groups TNF-α/(ng·L-1)IL-6/(ng·L-1)Observation (n=56)Control (n=86)t P 25(OH)D/(mmol·L-1)24.01±4.87 30.74±5.01 7.909 0.000 48.32±8.02 33.21±9.00 10.199 0.000 41.22±9.43 30.21±7.01 7.492 0.000
2.2 IMT与血清25(OH)D和免疫相关因子相关性分析 观察组患者IMT为(1.31±0.11)mm,对照组患者IMT为(0.81±0.10)mm,IMT与血清25(OH)D呈负相关(r=-0.428,P<0.001),IMT与血清TNF-α和IL-6呈正相关(r=0.574,0.577,P<0.001)。见图1~3。
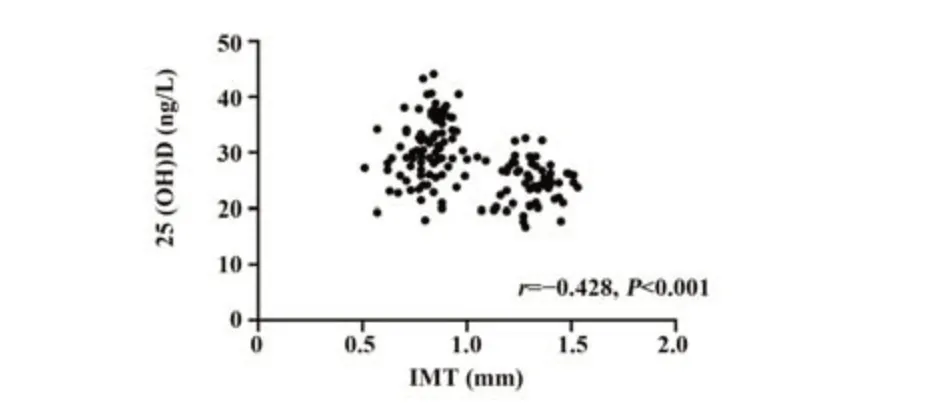
图1 IMT与血清25(OH)D的相关性Fig.1 Correlation between IMT and serum 25(OH)D
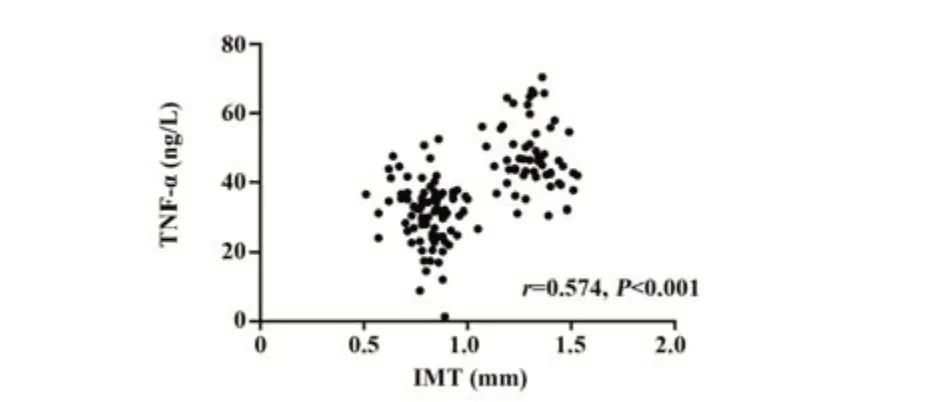
图2 IMT与血清TNF-α的相关性Fig.2 Correlation between IMT and serum TNF-α

图3 IMT与血清IL-6的相关性Fig.3 Correlation between IMT and serum IL-6
2.3 单因素分析和多因素Logistic回归分析 以差异有统计学意义的指标为自变量,以是否发生亚临床AS为因变量,行Logistic回归分析,指标间不存在共线性关系,结果表明,血清25(OH)D(OR=0.520,95%CI:0.401~0.675)、血清TNF-α(OR=1.667,95%CI:1.131~2.457)和血清IL-6(OR=1.478,95%CI:1.213~1.802)等是亚临床AS发生的影响因素。见表2、表3。
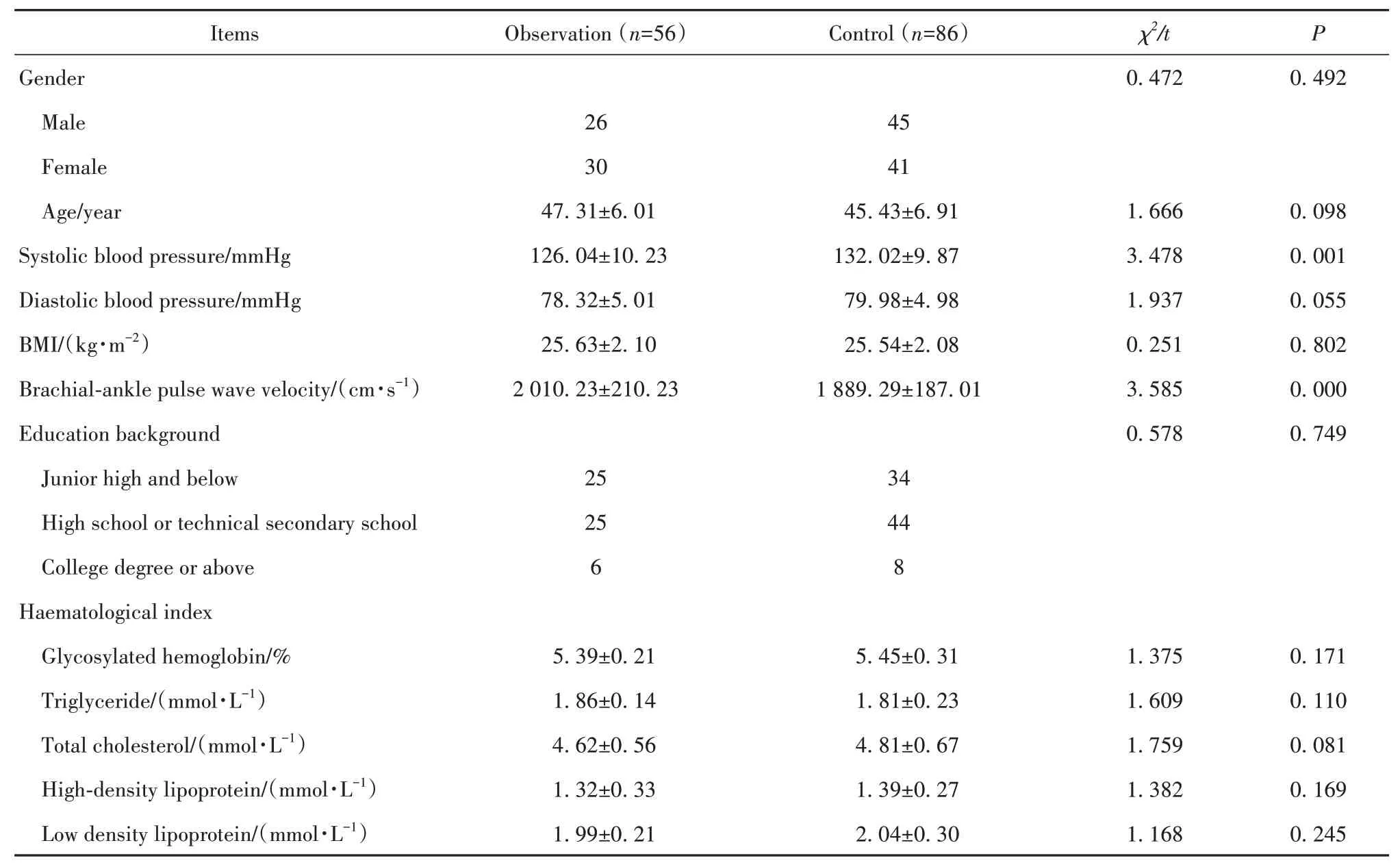
表2 单因素分析Tab.2 Univariate analysis
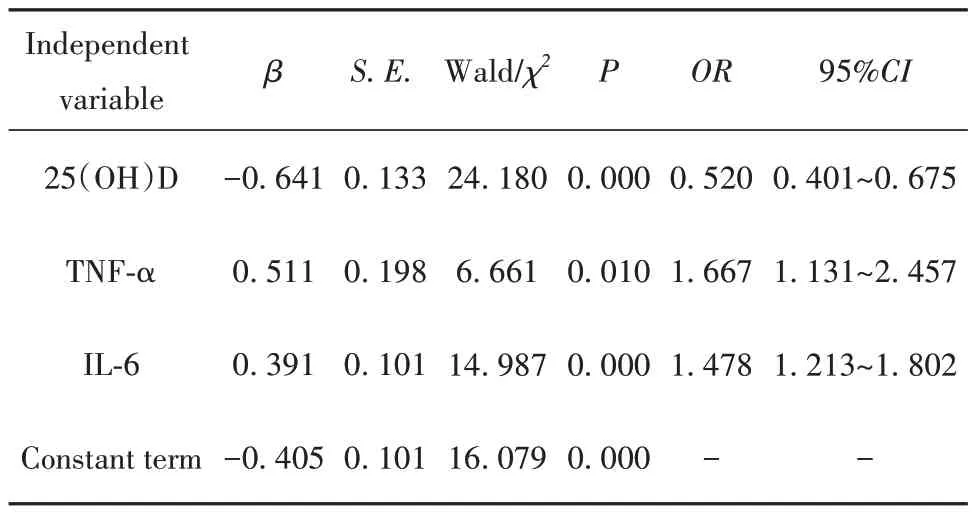
表3 Logistic回归分析结果Tab.3 Results of Logistic regression analysis
2.4 血清25(OH)D和免疫相关因子对亚临床AS的预测价值 以血清25(OH)D、IL-6和TNF-α为检验变量,以是否发生亚临床AS为状态标量,绘制ROC曲线,结果显示血清25(OH)D最佳截断值为28.32 mmol/L,其对应的敏感度为69.64%,特异度为70.93%,AUC为0.803(95%CI:0.749~0.855);血清TNF-α临界值为40.56 ng/L,其对应的敏感度为71.43%,特异度为72.09%,AUC为0.761(95%CI:0.717~0.823);血清IL-6截断值为36.13 ng/L,其对应的敏感度为60.71%,特异度为60.47%,AUC为0.627(95%CI:0.566~0.702);回归分析对应的敏感度为85.71%,特异度为81.40%,AUC为0.889(95%CI:0.830~0.915)。见图4。
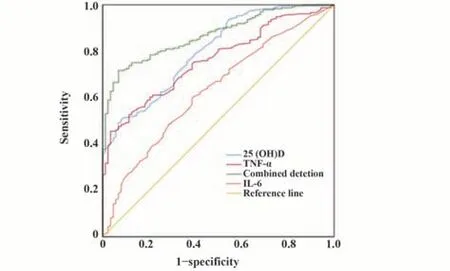
图4 血清25(OH)D和免疫相关因子对亚临床AS的预测价值Fig.4 Predictive diagnostic efficacy of serum 25(OH)D and immune-related factors for subclinical AS
3 讨论
IGR是2型糖尿病的缓冲期,即空腹血糖较正常水平偏高,但尚未达到糖尿病标准,该阶段需严格控制饮食、增加运动量,否则极有可能病情恶化,约10%IGR患者可转变成糖尿病[11]。研究表明,血管病变是IGR的主要并发症,主要包括大血管病变和微血管病变等,而AS是大血管病变的病理基础,可侵袭机体心脑血管、外周动脉等血管,严重威胁患者生活质量[12-13]。亚临床AS是AS的前期状态,隐匿性强,无法通过症状和体征及时发现,临床常通过超声和IMT数值判断,但指标存在滞后性,易延误病情[14]。临床实践显示,血清指标具有采集便捷、费用低廉及客观性等优势,已成为临床预测疾病的常规方式,且循证医学和预实验显示血清25(OH)D和免疫相关因子在亚临床AS患者中异常表达,但具体如何影响尚未阐明。
众多研究表明,维生素D与糖尿病的发生、发展密切关联,且给予糖尿病患者适量的维生素D可有效增强胰岛素敏感性,恢复胰岛B细胞功能,并纠正血糖代谢,降低大血管病变发生概率[15]。LATIC等[16]荟萃分析显示,维生素D主要在肠道钙吸收和骨矿化中发挥生理作用,其代谢可能与AS的发病机制和治疗有关。本研究结果表明,观察组患者血清25(OH)D明显低于对照组,IMT与血清25(OH)D呈负相关,而血清25(OH)D是亚临床AS发生的保护因素(P<0.05),证实血清25(OH)D的低水平可促进亚临床AS进展,其可通过抑制细胞周期蛋白依赖激酶2表达,刺激血管平滑肌的增殖、分化,减少血栓形成[17];且药理实验显示,25(OH)D可作用于Ca2+/CaM信号通路,以阻止自噬抑制细胞钙化及小鼠AS斑块钙化的形成[18]。进一步比较诊断效能,血清25(OH)D最佳截断值为28.32 mmol/L,其对应的敏感度为69.64%,特异度为70.93%,AUC为0.803(95%CI:0.749~0.855),提示血清25(OH)D能够用于诊断AS。杨小霞等[19]研究亦证实,血清25(OH)D水平与2型糖尿病合并颈动脉粥样硬化相关,可能参与了大血管病变的发生发展。
研究发现,IGR是自然免疫和低炎症性疾病,胰岛素抵抗和胰岛素分泌障碍是其发病的关键因素,炎症反应可激活机体免疫系统,诱导胰岛素抵抗发生,介导胰岛B细胞的凋亡,促进IGR的恶化,而IGR又可促进AS的进程[20]。病理研究显示,炎症反应可增加内皮细胞通透性,单核细胞附着在血管壁上形成巨噬细胞、泡沫细胞等,同时血小板在血管壁上聚集和黏附,形成脂质斑块[21-22]。IL-6和TNF-α等作为免疫炎症因子可参与血管病变过程,其过表达可刺激血管平滑肌细胞分泌细胞黏附因子,诱导平滑肌细胞分化,同时其可影响胰岛受体活性,降低葡萄糖转运功能,造成脂质代谢紊乱,促进AS的发生。本研究数据表明,观察组患者TNF-α和IL-6水平明显高于对照组,提示免疫相关因子可促进亚临床AS的发生。血清TNF-α临界值为40.56 ng/L,其对应的敏感度为71.43%,特异度为72.09%,AUC为0.761(95%CI:0.717~0.823);血清IL-6截断值为36.13 ng/L,其对应的敏感度为60.71%,特异度为60.47%,AUC为0.627(95%CI:0.566~0.702),证实血清IL-6和TNF-α可应用于亚临床AS的发生,但诊断效能偏低,因而联合多种血清标志物,以提高疾病的检出率。本研究将血清25(OH)D和免疫相关因子进行Logistic回归分析,回归分析敏感度显著高于单独的血清指标的诊断效能,值得临床进一步研究并推广。
综上,血清25(OH)D和免疫相关因子单独和联合回归检测可有效预测亚临床AS的发生,上述指标与颈动脉内中膜厚度相关,且血清25(OH)D和免疫相关因子是亚临床AS发生的预测指标。
