2型糖尿病合并骨质疏松症患者血清Chi3L1 NEFAs 与糖脂代谢及骨密度的相关性
2024-04-07马洪川陈华玲杨进红
朱 瑞, 马洪川, 陈华玲, 杨进红
(湖北省洪湖市人民医院, 湖北 洪湖 433200)
2型糖尿病(T2DM)和骨质疏松症之间存在密切联系,T2DM本身存在的糖脂代谢异常能够促进骨质疏松的发生及发展[1]。T2DM合并骨质疏松患者的早期症状不明显,而中晚期则表现出疼痛、畸形、骨折等症状,严重影响其日常生活[2]。寻找合适的生物指标对于T2DM患者合并骨质疏松的预防及治疗具有重要意义。壳多糖酶3样蛋白1(Chi3L1)产生于成骨细胞的分化过程,在骨形成过程中呈现高表达[3]。研究显示,骨质疏松症患者血清Chi3L1水平降低[3]。游离脂肪酸(NEFAs)与胰岛素抵抗及血管疾病之间关系密切。研究发现,T2DM患者血浆NEFAs水平经常性升高,且NEFAs水平可能与骨折的发生有关[4-5]。骨质疏松骨标本中可观察到大量的脂质沉积,且T2DM本身存在的糖脂代谢异常能够促进骨质疏松的发生及发展。因此,寻找合适的生物指标,探讨其与糖脂代谢及骨密度的相关性,对于T2DM患者合并骨质疏松的预防及治疗具有重要意义,目前已有研究分析血清指标与糖尿病患者骨质疏松的关系,但尚无统一标准,而Chi3L1、NEFAs在T2DM合并骨质疏松症方面的临床价值尚不清楚,因此,本研究主要探讨T2DM合并骨质疏松患者Chi3L1、NEFAs与糖脂代谢及骨密度的相关性,为T2DM患者合并骨质疏松的预防及治疗提供参考。
1 资料与方法
1.1一般资料:本研究经过本院伦理委员会批准,选取2020年1月至2023年4月在我院收治的110例T2DM患者作为研究对象,根据其是否发生骨质疏松,将T2DM患者分为骨质疏松组(38例)和非骨质疏松组(72例)。纳入标准:①符合T2DM诊断标准[6];②骨质疏松组符合骨质疏松症诊断标准[7];③临床资料完整;④本人或亲属知情同意本研究并且签署同意书。排除标准:①近期有外科手术史;②原发性骨质疏松者;③代谢异常相关疾病者;④合并恶性肿瘤患者;⑤自身免疫疾病患者;⑥近3周降脂药及其他可能造成影响的药物使用者。
1.2临床资料收集:收集110例T2DM患者的临床资料,主要包括性别、年龄、身体质量指数(BMI)、糖尿病病程、握力水平、贫血史、维生素D代谢情况、吸烟史、糖尿病药物使用情况等。
1.3观察指标:①血清Chi3L1、NEFAs水平检测:采集T2DM患者入院时晨起空腹静脉血3~5mL,离心分离10min收集上层血清,于-80℃下保存,待后续检测。采用酶联免疫吸附法检测血清Chi3L1水平,所用试剂盒为Chi3L1试剂盒(上海科艾博生物技术有限公司,货号:CB10771-Hu)。采用酶标仪比色法检测NEFAs含量,所用酶标仪为普朗酶标分析仪(北京普朗新技术有限公司,货号:DNM-9606)。②糖代谢和骨密度指标检测:糖代谢指标:采用迈瑞全自动生化分析仪(贝登医疗,货号:BS-280)检测T2DM患者三酰甘油(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)水平,采用罗氏电化学发光分析仪(北京东方迈润医疗器械有限公司,货号:Cobas e601)检测空腹胰岛素(FINS)水平,采用高效液相色谱仪(海能未来技术集团股份有限公司,货号:K2025)检测糖化血红蛋白(HbAlc)水平,采用稳态血糖仪(上海卓光仪器有限公司,货号:GR60)检测空腹血糖(FPG)水平,并计算胰岛素抵抗指数(HOMA-IR)。③骨密度检测:测定T2DM患者全髋、股骨颈及第2~4腰椎的骨密度,检测前均进行校正,确保数据准确,并计算所有部位的骨密度平均值。

2 结 果
2.1骨质疏松组和非骨质疏松组Chi3L1和NEFAs水平比较:骨质疏松组中Chi3L1水平显著低于非骨质疏松组,而NEFAs水平显著高于非骨质疏松组(P<0.001)。见表1。

表1 骨质疏松组和非骨质疏松组Chi3L1和NEFAs水平比较
2.2骨质疏松组和非骨质疏松组糖代谢指标、骨密度比较:骨质疏松组患者的HbAlc、HOMA-IR均显著高于非骨质疏松组(P<0.05),骨密度显著低于非骨质疏松组(P<0.05);而两组间TC、TG、HDL-C、LDL-C、FINS及FPG相比较,差异无统计学意义(P>0.05)。见表2。

表2 骨质疏松组和非骨质疏松组糖代谢指标骨密度比较
2.3糖尿病合并骨质疏松者血清Chi3L1和NEFAs水平与糖脂代谢、骨密度的相关性:血清Chi3L1水平与HbAlc及HOMA-IR均呈现负相关性,与骨密度呈现正相关性(P<0.05);NEFAs水平与HbAlc及HOMA-IR均呈现正相关性,骨密度呈现负相关性(P<0.05)。见表3。
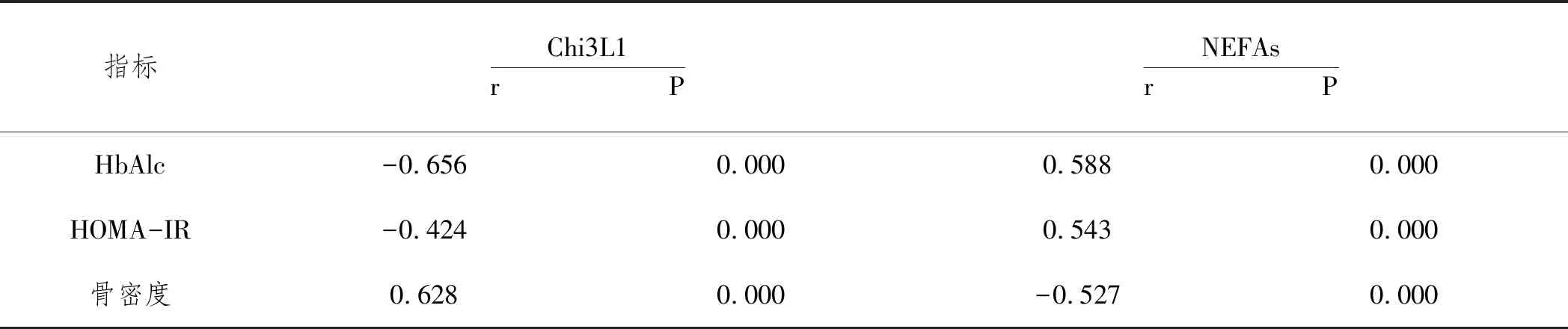
表3 血清Chi3L1和NEFAs水平与糖脂代谢骨密度的相关性
2.4骨质疏松组与非骨质疏松组一般资料比较:与非骨质疏松组相比,骨质疏松组T2DM患者握力水平低患者比例升高(P<0.05);两组间性别、年龄、BMI、糖尿病病程、贫血、吸烟史、维生素D代谢异常及糖尿病药物相比较,差异无统计学意义(P>0.05)。见表4。
表4 骨质疏松组与非骨质疏松组一般资料比较
2.5影响T2DM患者发生骨质疏松的多因素分析:以T2DM患者是否发生骨质疏松为因变量(是=0,否=1),以Chi3L1、NEFAs水平、握力水平、HbAlc、HOMA-IR及骨密度为自变量进行Logistic回归分析,结果显示,NEFAs、Chi3L1均是T2DM患者发生骨质疏松的影响因素(P<0.05),见表5。

表5 影响T2DM患者发生骨质疏松的多因素Logistic回归分析
3 讨 论
2型糖尿病(T2DM)属于临床上常见病之一,会导致患者出现糖尿病肾病、骨髓血管破坏、视网膜病、脑卒中等并发症。骨质疏松症则是T2DM的慢性并发症之一,主要由成骨细胞和破骨细胞之间的平衡被破坏引起。T2DM患者伴随骨质疏松的发病率在35%左右,且年龄越大,发病率越高。T2DM合并骨质疏松患者骨密度降低,早期症状不明显,而到了病情发展的中晚期,会表现出疼痛、畸形、骨折等症状,严重影响患者的日常生活[2]。
壳多糖酶3样蛋白1(Chi3L1)是成骨细胞分化过程中分泌的一种蛋白,Chi3L1作为一种生物标志物,参与多种疾病的发生发展[8],包括癌症、糖尿病、动脉粥样硬化、中风和精神分裂症等。研究发现,Chi3L1在骨形成过程中密集表达,在骨骼建模、重塑和骨骼发育中发挥重要作用[9]。有研究显示,骨质疏松症患者血清Chi3L1水平降低[10],本研究显示,骨质疏松组中Chi3L1水平显著低于非骨质疏松组,与先前的研究相一致,提示Chi3L1低水平与T2DM患者合并骨质疏松症的发生及发展有关。分析原因,Chi3L1在成骨细胞中具有骨骼结构完整性的功能,Chi3L1能够促进骨形成,抑制破骨细胞的发生,并预防与年龄相关的骨质疏松症,而Chi3L1的缺失会导致成骨细胞分化及骨形成的延迟。游离脂肪酸(NEFAs)是具有不同长度和饱和度的脂肪碳链的羧酸,与肥胖、胰岛素抵抗及血管疾病之间都有着密切联系[11]。本研究显示,骨质疏松组中NEFAs水平显著高于非骨质疏松组,提示NEFAs高水平与T2DM患者合并骨质疏松症的发生及发展有关。分析原因,①T2DM是一种伴随胰岛素抵抗、炎症及氧化应激的疾病,而NEFAs水平与胰岛素抵抗密切相关,T2DM患者血浆NEFAs水平经常性升高;②成骨细胞具有NEFA受体,在外周细胞中发挥重要作用,NEFAs水平可能与骨折风险有关[12]。
本研究还显示,骨质疏松组患者的HbAlc、HOMA-IR水平均显著高于非骨质疏松组,而骨密度则显著低于非骨质疏松组,提示上述指标与T2DM患者发生骨质疏松有密切联系。Pearson相关性分析的结果显示,血清Chi3L1水平与HbAlc、HOMA-IR均呈现负相关性,与骨密度呈现正相关性,NEFAs水平与HbAlc及HOMA-IR均呈现正相关性,与骨密度呈现负相关性,提示Chi3L1及NEFAs参与了糖脂代谢及骨质疏松的发生过程。T2DM患者握力水平低的T2DM患者发生骨质疏松的风险更大,提示T2DM患者日常要注意临床指标的异常变化。多因素分析结果提示,NEFAs、Chi3L1均是T2DM患者发生骨质疏松的影响因素,提示Chi3L1及NEFAs可作为生物学指标,用于评估T2DM患者是否发生骨质疏松。
综上所述,在T2DM合并骨质疏松患者中,Chi3L1呈现低水平、NEFAs呈现高水平,且此二者与糖脂代谢及骨密度间存在显著相关性,有望成为评估T2DM患者是否发生骨质疏松的生物标志物。此外,本研究所选择样本量较少,可能造成统计结果的偏差,今后将进行前瞻性的大样本研究,进一步证实血清Chi3L1及NEFAs在评估T2DM患者合并骨质疏松方面的临床价值。
