野生和养殖绿鳍马面鲀肌肉品质及肠道菌群的比较
2024-04-04李晓璐杨懋勋李向丽
李晓璐,刘 妍,*,杨懋勋,赵 珂,李向丽
(1.中山火炬职业技术学院健康产业学院,广东 中山 528436;2.广东药科大学广东湛江海洋医药研究院,广东 东莞 523808;3.四川农业大学资源学院,四川 成都 611130)
绿鳍马面鲀(Thamnaconus septentrionalis,ThS)作为我国第二大深海经济鱼类广泛分布于我国北部与东部海域,因其鱼肉纤维细腻、鱼皮胶原蛋白含量高、味道鲜嫩甘美,长期以来深受我国四川、重庆和沿海地区消费者的喜爱。在过去十年中,绿鳍马面鲀的人工繁育和养殖技术迅猛发展,工厂化养殖规模也在逐渐扩大[1-2]。但经市场调研发现,消费者依然更加偏爱食用野生绿鳍马面鲀(WildThamnaconus septentrionalis,WThS),且鲜活的WThS在珠三角的水产交易市场经济价值更高。存在这种消费倾向的原因可能是WThS 的产量较养殖绿鳍马面鲀(CulturedThamnaconus septentrionalis,CThS)低,但不排除有CThS 的肌肉品质较WThS 发生了改变的原因。肌肉品质的差异除由遗传因素所致外,极大可能还与绿鳍马面鲀肠道微生物菌群结构有关[3]。有研究表明,野生鱼生活的自然水体与养殖鱼生活的人工水体环境中有机质含量和种类、生物群体结构和密度、水体盐度和温度、水流速度等因素均有差异,这会导致养殖鱼的肠道菌群结构不同于野生鱼,并影响其肌肉品质[4-7]。还有研究表明,在人工饲养过程中使用不同的饲料及采用不同的养殖模式均会改变鱼类的肌肉品质并影响其肠道微生物的种类和丰富度[8-12]。本研究比较了野生绿鳍马面鲀和人工绿鳍马面鲀的肌肉品质差异及二者肠道微生物结构的不同,研究结果可以为绿鳍马面鲀养殖技术的改进、饲料配方的开发和遗传育种技术的优化提供基础数据。
1 材料与方法
1.1 材料与设备
1.1.1 材料与试剂
试验用WThS来自东海(浙江宁波,中国),CThS来自渤海(山东威海,中国),由广东省中山市鹏海水产品贸易有限公司分别从浙江省宁波市和山东省威海市运至广东省中山市。选用健康且体表无损伤的WThS(单条质量为(360.2±65.0)g,体长为(20.9±1.1)cm)和CThS(单条质量为(381.3±71.1)g,体长为(22.3±1.3)cm)各10尾,用于肌肉品质和肠道微生物的检测。
盐酸、氢氧化钠、氧化镁、三氯乙酸、无水乙醚、石油醚,成都市科隆化学品有限公司;乙醇,山东安捷高科消毒科技有限公司;硫酸钾、硫酸铜、硫酸、柠檬酸钠,天津市大茂试剂厂。所用试剂均为分析纯。
组织基因组DNA 提取试剂盒(TaKaRa Mini-BEST Universal Genomic DNA Extraction Kit Ver.5.0),宝生生物工程(大连)有限公司。
1.1.2 仪器与设备
SMS TA.XT plus 物性测试仪,英国SMS 公司,NanoDrop One超微量分光光度计,美国Thermofisher公司;Illumina MiSeq高通量测序仪,美国Illumina公司。
1.2 方法
1.2.1 样品处理
选取健康WThS 和CThS 各10 尾,用75%乙醇擦拭绿鳍马面鲀鱼体表3次,在无菌条件下用解剖刀解剖鱼体取出肠道,用生理盐水冲洗干净肠道外表面黏稠的组织液,取肠道及内容物放置于1.5 mL 离心管中,随即进行液氮速冻并保存于-80 ℃冰箱储存备用[13]。将解剖后的鱼体去皮后取背肌鱼块(3.0 cm×1.5 cm×1.0 cm),用无菌棉签拭干后立刻进行肌肉质构测定试验。
1.2.2 肌肉质构、理化指标测定及营养指标测定与评价
肌肉质构测定:采用SMS TA.XT plus物性测试仪和P/36R探头进行TPA测试[12],测试前速度1.0 mm/s,测试速度0.9 mm/s,测试后速度2.0 mm/s,形变量30%,触发力8 g,两次压缩之间的停留时间为5 s,每组样品平行测定10次。结果去极值后取平均值。
肌肉理化指标测定:将去皮背肌鱼块充分搅拌制成糜状后进行各项指标测定。pH、持水力:参照NY/T 1333—2007[14]中的方法进行测定;水分活度:参照GB 5009.238—2016[15]中的方法进行测定;挥发性盐基氮含量:参照GB 5009.228—2016[16]中的方法进行测定。
肌肉营养指标测定与评价:参照GB 5009.3—2016[17]、GB 5009.4—2016[18]、GB 5009.6—2016[19]、GB 5009.5—2016[20]、GB 5009.168—2016[21]和GB 5009.124—2016[22]中的方法分别进行水分、灰分、粗脂肪、粗蛋白、脂肪酸和氨基酸含量的测定。氨基酸含量单位为:mg/gmd。根据鸡蛋蛋白标准计算化学评分(Chemistry score,CS)和每克氮氨基酸评分标准计算氨基酸评分(Amino acid score,AAS)[23]。
1.2.3 DNA提取、扩增和Illumina MiSeq高通量测序
对20 个肠道样品使用组织基因组DNA 提取试剂盒(TaKaRa MiniBEST Universal Genomic DNA Extraction Kit Ver.5.0)进行DNA 抽提,DNA 的浓度与纯度使用NanoDrop One 超微量分光光度计测定。对浓度与纯度合格的DNA,细菌16S rRNA V3~V4 区和真菌ITS1~ITS2 区的基因序列分别用338F(5-ACTCCTACGGGAGGCAGCAG-3)和806R(5-GGACTACHVGGGTWTCTAAT-3)、ITS1F(5-CTTGGTCATTTAGAGGAAGTAA-3)和ITS2R(5′-GCTGCGTTCTTCATCGATGC-3)引物进行PCR 扩增[24]。委托生工生物工程(上海)股份有限公司进行Illumina MiSeq System高通量测序。
用Fastp v 0.23.2质控过滤WThS和CThS肠道样本的16S rRNA V3~V4区和ITS1-ITS2区去除质量较低的序列,并用Flash v1.2.11将成对序列进行拼接获得目标片段。细菌和真菌分别获得1 383 767和1 000 395条有效序列,占比均达99%以上。其中细菌样本序列数为37 227~72 562,共498 747 513 bp;真菌样本序列数为33 877~70 245,共31 389 721 632 bp。细菌与真菌的平均序列碱基长度分别为417.22 bp 和351.24 bp。然后使用Qiime 2 再次降噪质控后进行Beta 和Alpha 多样性计算及序列聚类。对代表运算分类单元的序列,将RDP 分类器的贝叶斯算法导入Qiime 2 进行分类学分析和注释,并采用主坐标分析(PCoA)比较细菌和真菌的群落结构差异。
1.2.4 数据处理
采用Excel 2010 处理数据,使用SPSS 23.0 进行单因素方差分析(One-way ANOVA),比较变量间不同组之间得分差异大小时采用Duncan 氏法,试验结果以表示。
2 结果与分析
2.1 绿鳍马面鲀肌肉质构和理化指标
由表1和表2可知,CThS肌肉的胶黏性、内聚性、咀嚼性、剪切力、pH和持水力均小于WThS,且差异显著(P<0.05)。肌肉的持水力与很多因素相关,比如其与肌肉的pH、胶黏性、多不饱和脂肪酸的含量均呈正相关。WThS 肌肉的水分活度和挥发性盐基氮含量小于CThS,表明宰杀后的WThS肌肉持鲜和抗腐能力优于CThS,且腥臭味更小。

表1 野生和养殖绿鳍马面鲀肌肉质构指标Table 1 Muscle texture index of wild and cultured Thamnaconus septentrionalis

表2 野生和养殖绿鳍马面鲀肌肉理化指标Table 2 Physicochemical properties of wild and cultured Thamnaconus septentrionalis
2.2 绿鳍马面鲀肌肉营养指标
肌肉干物质含量越高,营养价值也越高。由表3可知,WThS肌肉的水分含量小于CThS,灰分和粗蛋白含量均显著大于CThS(P<0.05),表明WThS肌肉矿物质含量较高。CThS 肌肉粗脂肪含量显著高于WThS(P<0.05)。

表3 野生和养殖绿鳍马面鲀肌肉营养成分Table 3 Muscle nutrients of wild and cultured Thamnaconus septentrionalis单位:%湿基
2.3 绿鳍马面鲀肌肉脂肪酸和氨基酸评价
WThS 和CThS 肌肉脂肪酸和氨基酸组成及含量见表4,必需氨基酸评价见表5。

表5 野生和养殖绿鳍马面鲀肌肉必需氨基酸评价Table 5 Evaluation of essential amino acids in the muscle of wild and cultured Thamnaconus septentrionalis
2.3.1 脂肪酸评价
由表4可知,WThS和CThS肌肉脂肪酸在组成及含量上均有差异。WThS肌肉测出25种脂肪酸,含饱和脂肪酸(Saturated fatty acids,SFA)7种、单不饱和脂肪酸(Monounsaturated fatty acids,MUFA)6种、多不饱和脂肪酸(Polyunsaturated fatty acids,PUFA)12 种。而CThS 肌肉测出19 种脂肪酸,含SFA 5 种、MUFA 5种、PUFA 9 种。且WThS 肌肉中TPUFA>TSFA>TMUFA,CThS肌肉中TSFA>TPUFA>TMUFA。WThS肌肉中TPUFA 显著高于CThS(P<0.05),而TSFA 和TMUFA 显著低于CThS(P<0.05)。WThS 必需脂肪酸含量显著高于CThS(P<0.05)。C20:4ω6(ARA)、C20:5ω3(EPA)、C22:6ω3(DHA)、C18:2ω6(亚油酸)和C18:3ω3(亚麻酸)含量WThS 均大于CThS。试验结果表明,无论是WThS 还是CThS 均能为人体提供优质的必需脂肪酸(亚油酸、亚麻酸)和多不饱和脂肪酸,食用绿鳍马面鲀有利于人体健康。同时结果也显示WThS 具有更好的脂肪酸组成和比例。因此,需进一步改进CThS的人工养殖方式或饲料配方以使其营养价值更接近于WThS。
2.3.2 氨基酸评价
由表4 可知,WThS 和CThS 肌肉中有18 种氨基酸,包括8 种人体必需氨基酸(EAA)、2 种半必需氨基酸(SEAA)以及4 种具有鲜味的氨基酸。这与陈涛等[25]的研究结果一致。谷氨酸在WThS 和CThS 的肌肉中含量最高,而胱氨酸含量最低。试验结果表明,绿鳍马面鲀肌肉氨基酸组成和比例与大黄鱼组成近似[26],与同为深海经济鱼类的带鱼则完全不同[27]。评估食物氨基酸的营养价值高低,是通过食物必需氨基酸总量占氨基酸总量的比例来决定的[28],WThS 和CThS 肌肉TEAA/TAA 分别为42.15%和41.17%,均超过了40.00%,因此WThS 和CThS 的肌肉都是优质蛋白质来源[29]。WThS 肌肉的氨基酸总量、必需氨基酸总量、非必需氨基酸总量以及鲜味氨基酸总量均高于CThS。其中WThS 的鲜味氨基酸总量高于CThS可能是消费者更偏向于食用WThS的重要原因。
F(Fischer)值是支链氨基酸(Branched chain amino acids,BC)与芳香族氨基酸(Aromatic amino acids,AC)的摩尔比值,人类正常F 值范围为3.0~3.5,肝脏受损时,F值范围为1.0~1.5[30],WThS的F值大于CThS且在人类的健康范围内,而CThS 的F 值也接近人类的健康值。
AAS和CS从两个角度反映了蛋白质构成和利用率的关系。由表5 可知,从CS 评分角度来看,WThS除蛋氨酸+半胱氨酸较少,缬氨酸、色氨酸接近1 外,其余氨基酸都大于1;CThS除缬氨酸和色氨酸外其余氨基酸都大于1;WThS和CThS的ASS均高于1,说明无论是WThS 还是CThS 的肌肉都富含人体所需的8种必需氨基酸,其不仅组成平衡且大部分的含量符合FAO/WHO提出的理想氨基酸模式[31]。以CS评价,WThS 的第1 限制性氨基酸为蛋氨酸+半胱氨酸;CThS第1限制性氨基酸为色氨酸,第2限制性氨基酸均为缬氨酸。而以AAS评价,WThS和CThS第1限制性氨基酸均为缬氨酸。第1 和第2 限制性氨基酸的种类存在差异,推测这可能与试验用的WThS和CThS生活的海域纬度(威海37.5°N、宁波29.86°N)不同等因素有关。
2.4 马面鲀肠道菌群样本序列统计
序列经Qiime2降噪,拼接及去嵌合体后使用q2-vsearch聚类ASVs为运算分类单元(OTUs),细菌和真菌分别鉴定出1 382和953个OTUs,并分别使用Silva和Unite数据库对16S rRNA基因和ITS基因进行物种注释。绿鳍马面鲀的肠道样本细菌共有27 个门、40个纲、73 个目、251 个科、523 个属;真菌共有5 个门、11个纲、38个目、121个科、392个属。由图1可知,样本所测得的运算分类单元数量随着有效序列增多逐渐上升,然后趋于平缓,达到测序的极限,再进行更多的测序也无法获得更多种类的操作分类单元。说明本试验的测序样本数深度和相对丰度合理,测序深度能够涵盖样品中大多微生物种群,较好地反映了WThS和CThS肠道微生物组成。

图1 野生和养殖绿鳍马面鲀肠道细菌(A)和真菌(B)稀释曲线Fig.1 The rarefaction curves of enteric bacteria(A)and fungi(B)of wild and cultured Thamnaconus septentrionalis
将WThS和CThS的细菌和真菌样本序列按最小样本序列数抽平后分别进行OTUs 比较分析(图2)。WThS包含931个细菌OTUs和613个真菌OTUs,CThS包含976 个细菌OTUs 和737 个真菌OTUs。WThS 和CThS共有525个细菌OTUs和397个真菌OTUs;WThS特有406个细菌OTUs和216个真菌OTUs;CThS特有451个细菌OTUs和340个真菌OTUs。

图2 野生和养殖绿鳍马面鲀肠道细菌(A)和真菌(B)运算分类单元的分布维恩图Fig.2 Venn diagram of OTUs enteric bacteria(A)and fungi(B)distribution between wild and cultured Thamnaconus septentrionalis
2.5 马面鲀肠道微生物的多样性分析
样本多样性的丰富度和均匀度可以用Rankabundance 曲线反映。曲线水平跨度越大,表明样本的物种相对丰度越高,曲线越平滑,表明样本的均匀度越大。由图3 可知,绿鳍马面鲀肠道中细菌菌群相对于真菌菌群物种组成较丰富,均匀程度更高,而真菌菌群某一类或几类真菌在数量上占有绝对优势;WThS 肠道的细菌与真菌相较于CThS 物种相对丰度更高可能与WThS 食物更加多样,生活环境多变有关。
由表6可知,绿鳍马面鲀肠道中细菌的种类比真菌多,这可通过Chao指数和Ace指数反映出来[32]。其次,WThS 肠道中细菌和真菌的Shannon 指数、Ace 指数、Chao指数以及PD指数高于CThS,Simpson指数低于CThS,但这5 个指数的差异并不显著,说明WThS的物种丰富度和多样性略高于CThS。另外,WThS和CThS肠道样品细菌与真菌的Coverage指数均接近1,说明本试验中的取样方法高效地覆盖了绿鳍马面鲀的肠道样本文库[33],对该肠道样本的微生物相对丰度和多样性的反映真实有效。
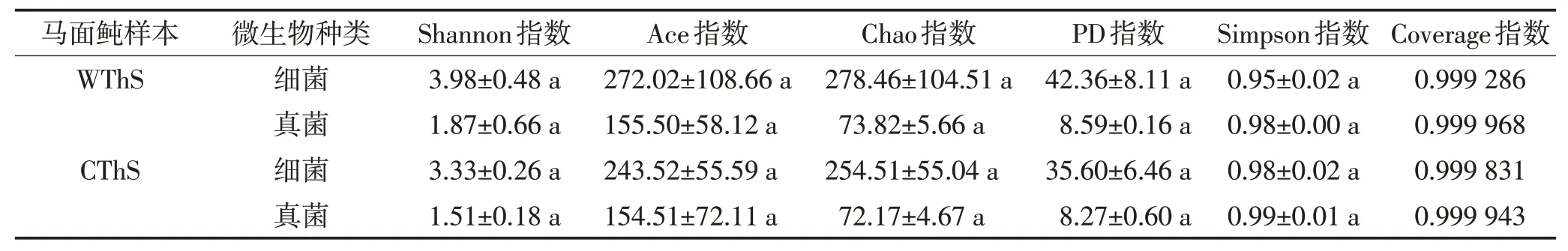
表6 野生和养殖绿鳍马面鲀肠道微生物Alpha多样性的统计分析Table 6 Alpha diversity analyses of the gut microbiota between wild and cultured Thamnaconus septentrionalis
WThS 和CThS 肠道样本组间的微生物群落多样性构成差异分析可以利用β多样性指数的PCoA 反映。由图4可知,细菌和真菌菌群结构总体差异均大于50%,说明WThS 和CThS 肠道微生物菌群结构存在明显的差异。

图4 野生和养殖绿鳍马面鲀肠道细菌(A)和真菌(B)的Beta多样性分析Fig.4 Beta diversity estimates for the gut bacteria(A)and fungi(B)between the wild and cultured Thamnaconus septentrionalis
由图5 可知,在门水平,变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteriota)和拟杆菌门(Bacteroideta)为绿鳍马面鲀肠道中的优势细菌门。其中,CThS的肠道内变形菌门、厚壁菌门和放线菌门相对丰度高于WThS,拟杆菌门、梭菌门(Fusobacteriota)相对丰度低于WThS(图5A 和图5B)。绿鳍马面鲀中优势真菌门分别为子囊菌门(Ascomycota)、毛霉门(Mucoromycota)及担子菌门(Basidiomycota),其中子囊菌门具有绝对优势。CThS的肠道内毛霉门相对丰度低于WThS,担子菌门、壶菌门相对丰度高于WThS(图5C和图5D)。
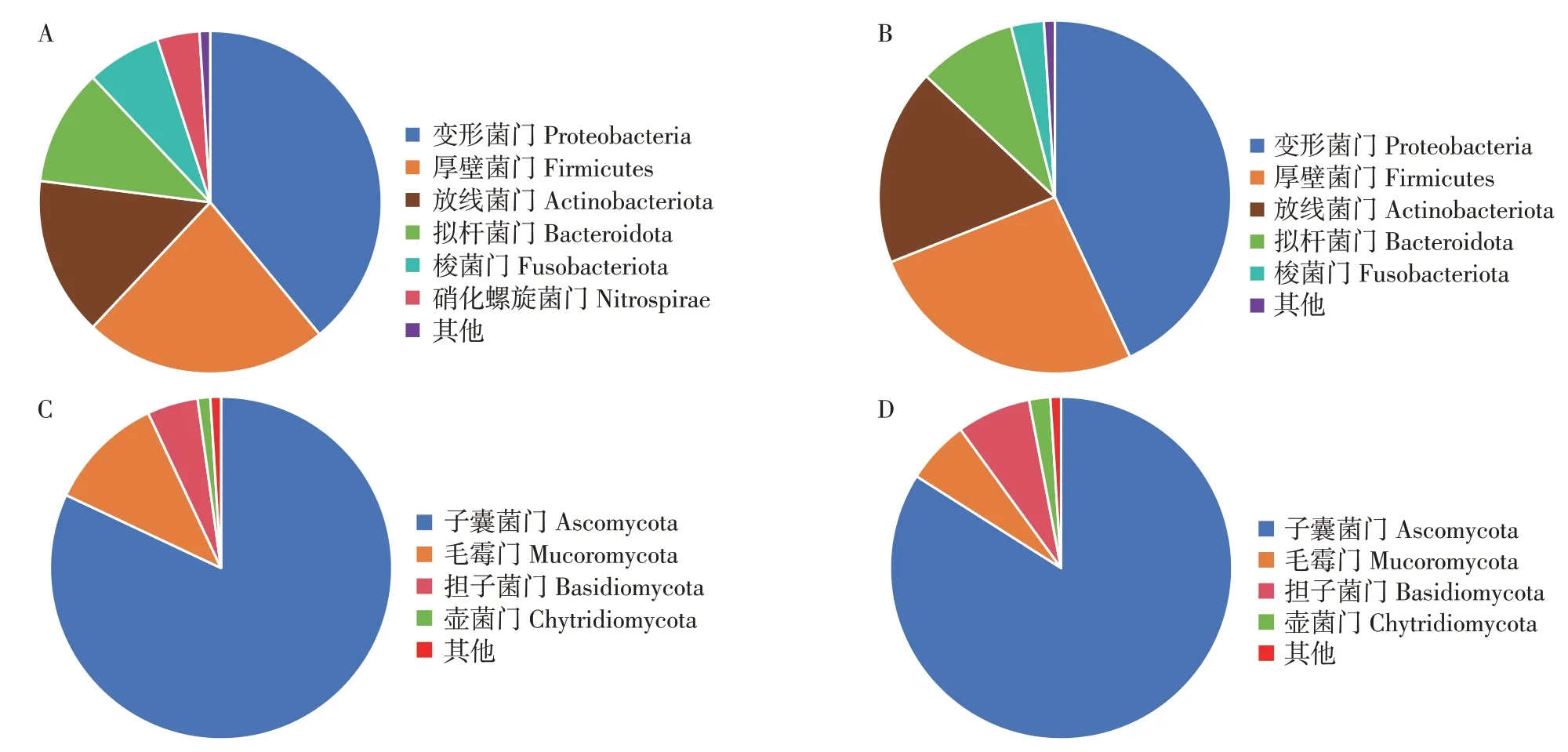
图5 野生和养殖绿鳍马面鲀肠道菌群在门水平上的组成和相对丰度Fig.5 Composition and relative abundance of the intestinal microbial flora in the wild and cultured Thamnaconus septentrionalis at phylum level
由图6可知,从属水平的相对丰度来看,WThS肠道优势细菌属包含:优杆菌属(Eubacterium)(15.3%)、支原体-f-未分级(Norank-f-Mycoplasmataceae)(8.7%)、乳酸杆菌属(Lactobacillus)(6.9%);CThS 肠道的优势细菌属分别是:优杆菌属(Eubacterium)(17.5%)、短波单胞菌属(Brevundimionas)(11.2%)、乳酸杆菌属(Lactobacillus)(10.8%)。黄杆菌属(Flavobacterium)和不动杆菌属(Acinetobacter)在CThS 肠道中相对丰度高于WThS肠道,而支原体-f-未分级相对丰度低于WThS 肠道。酵母属(Saccharomyces)(83.19%)、曲霉属(Aspergilus)(2.81%)、假丝酵母(Candida)(2.50%)是WThS肠道中的优势真菌属;而CThS 肠道中的优势真菌属是酵母属(Saccharomyces)(73.32%)、曲霉属(Aspergilus)(6.26%)、根霉属(Rhizopus)(3.12%)。在WThS和CThS肠道中相对丰度最高的细菌均为优杆菌属(Eubacterium),真菌均为酵母属(Saccharomyces)。
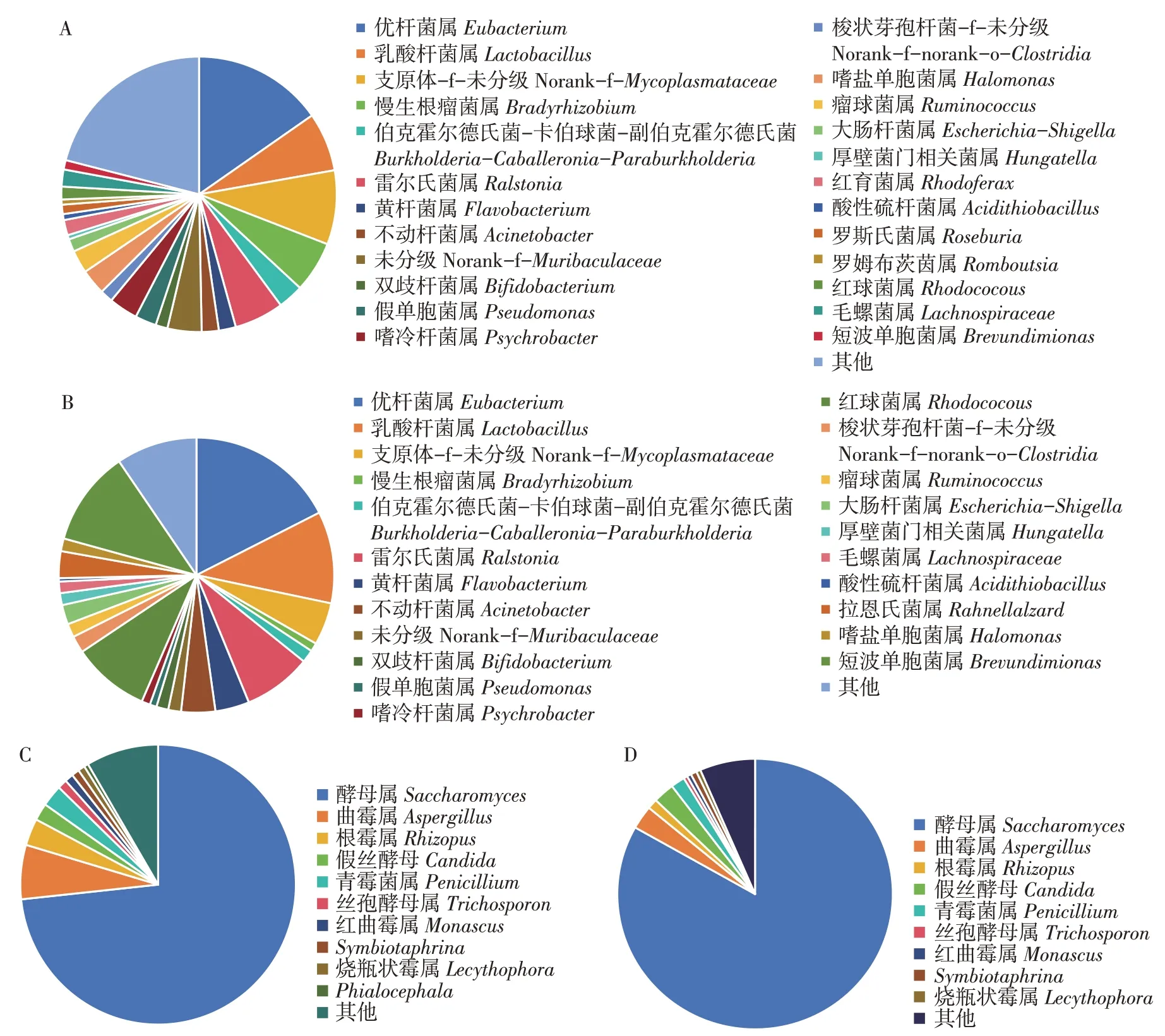
图6 野生和养殖绿鳍马面鲀肠道菌群在属水平上的组成和相对丰度Fig.6 Composition and relative abundance of the intestinal microbial flora in the wild and cultured Thamnaconus septentrionalis at genus level
3 讨论
3.1 野生和养殖绿鳍马面鲀肉质比较
试验检测了WThS 和CThS 肌肉的理化指标、常规营养成分与组成以及氨基酸、脂肪酸的组成与含量。咀嚼性和剪切力可用来代表鱼肉的嫩度,CThS肌肉的咀嚼性和剪切力显著低于WThS(P<0.05),所以CThS 的肌肉较WThS 肌肉更柔嫩。但WThS 肌肉胶黏性和内聚性显著高于CThS(P<0.05),且硬度与弹性也更高,通常肉的硬度、弹性和内聚性越高,肉质口感越爽弹[34]。WThS肌肉的pH和持水力和CThS相比也更大(P<0.05),所以WThS 的肌肉更为多汁、鲜嫩和表面干爽。WThS 肌肉中挥发性盐基氮的含量更低。两者的水活度无显著性差异。综上可知,WThS的肌肉弹爽多汁,而CThS的肌肉更软嫩。
WThS 肌肉的粗蛋白含量和灰分含量均显著高于CThS(P<0.05),但CThS 肌肉的粗脂肪含量显著高于WThS(P<0.05),蛋白质含量和肌肉营养成正比,灰分代表了肌肉中的矿物质[35],WThS肌肉的粗蛋白含量高、矿物质含量高,所以营养价值高,鱼肉品质好。
WThS 脂肪酸的组成成分有25种,多于CThS(19种)。WThS 肌肉中C20∶4ω6(ARA)、C20∶5ω3(EPA)、C22∶6ω3(DHA)、C18∶2ω6(亚油酸)和C18∶3ω3(亚麻酸)等多不饱和脂肪酸的总量显著大于CThS(P<0.05)。必需脂肪酸的含量与肌肉的营养价值高低一定程度上呈正相关,同时亚油酸和亚麻酸也是鱼类肌肉重要的风味物质。鱼类肌肉的品质和风味还与氨基酸的组成和比例有直接关系[36]。WThS 和CThS 的肌肉均测出18种氨基酸,其中Glu 的含量最高。WThS 必需氨基酸占总氨基酸的42.15%,必需氨基酸与非必需氨基酸之比为86.76%,天冬氨酸、甘氨酸、谷氨酸和丙氨酸4种鲜味氨基酸总量均大于CThS;WThS 和CThS 肌肉中的氨基酸符合FAO/WHO 建议的必需氨基酸占总氨基酸40%、必需氨基酸与非必需氨基酸之比为60%以上的标准[31];WThS和CThS肌肉的第一限制性氨基酸种类不同。试验结果表明,虽然WThS的必需脂肪酸、必需氨基酸和鲜味氨基酸均高于CThS,但CThS的营养价值也很高,所以绿鳍马面鲀是优质鱼类。
3.2 绿鳍马面鲀门水平下肠道菌群结构
肠道微生物的组成与宿主的物种类型、生活环境、食性差异、遗传因素等密切相关[37-38]。本试验的Alpha 和Beta 多样性分析结果表明,WThS 与CThS 肠道微生物的物种多样性、丰富度、均匀度和群体结构均存在差异。例如,虽然在门水平上细菌与真菌在WThS和CThS肠道中的优势菌门基本相同,但是在野生和养殖两种环境下不同菌门的比例结构却存在较大的差异,由此可推断,不同生长环境改变了绿鳍马面鲀的肠道环境,同时影响了肠道微生物的菌群结构。这在异齿裂腹鱼(Schizothorax oconnori)、异育银鲫(Carassius auratus gibelio)等的野生群体和养殖群体中已有相同的报道[39-40]。本试验中,两组绿鳍马面鲀肠道中均以变形菌门为优势细菌门,子囊菌门为优势真菌门。已有研究表明,变形菌门、厚壁菌门是鱼类肠道微生物中的主要菌群[41-42],本试验的结果与其一致,表明绿鳍马面鲀具有典型的鱼类肠道微生物的特征。
本试验中,CThS 的厚壁菌门的相对丰度高于WThS,而拟杆菌门的相对丰度低于WThS,虽然差异不显著,但有研究表明,这两类菌的相对丰度与脂肪和蛋白质的代谢相关,厚壁菌门的菌群相对丰度在肥胖人士中较高,而拟杆菌门的菌群丰度则较低[43-44]。这可能是WThS 的蛋白质含量更高,脂肪含量更低的原因。
大多数肠道菌群研究都集中在细菌上,但其实肠道菌群还包括真菌。迄今为止,只有少数宏基因组学研究试图描述肠道真菌生态的特征,并且通常样本量小难以得出明确的结论。目前研究表明,人类健康的肠道中,真菌主要有子囊菌门(70%)和担子菌门(30%),本研究中无论是野生还是养殖的健康绿鳍马面鲀肠道真菌也以子囊菌门和担子菌门为主,这可能和绿鳍马面鲀是杂食性鱼类有关系,因为有研究表明肠道真菌的定殖和饮食有较大的关系[45]。
3.3 绿鳍马面鲀属水平下肠道菌群结构
分析结果显示,厚壁菌门的优杆菌属是WThS和CThS肠道的优势细菌属。优杆菌属是肠道微生物群的核心菌属之一,对机体营养代谢和维持肠道平衡有重要的作用。优杆菌属产生的短链脂肪酸,是肠道上皮组织的特殊营养和能量组分,在肠道健康中发挥着重要作用,例如短链脂肪酸不仅可以增强胃肠道运动机能,还可以保护肠道黏膜屏障从而降低肠道炎症水平[46]。CThS体内的优杆菌属相对丰度高于WThS,此具有进一步研究的价值。乳酸杆菌属在WThS 中占6.9%,CThS 中占10.8%。乳酸杆菌同样隶属于厚壁菌门,其被认为在促进动物生长、平衡肠道生态系统和提高免疫力方面起着至关重要的作用[47]。CThS乳酸杆菌的相对丰度高于WThS,这可能与其食物结构有关。Liu 等[48]研究发现,饲料的蛋白质水平会影响建鲤(Cyprinus carpiovar.jian)肠道中乳酸菌含量,低蛋白组中乳酸菌含量显著低于其他各组。本试验中,CThS 以配合饲料作为主要的食物来源,蛋白含量较高,高含量的乳酸杆菌可能有助于配合饲料中蛋白的吸收[49]。
本试验结果显示,黄杆菌属[50]、不动杆菌属[51]作为常见的致病菌在WThS与CThS肠道中也存在明显差异,在CThS中黄杆菌属、不动杆菌属的相对丰度比WThS高,一定程度上说明CThS可能会对由不动杆菌属引起的疾病较为敏感。需要重视的是,CThS 和WThS 肠道中不动杆菌属主要为洛菲不动杆菌,且CThS 肠道中不动杆菌属含量显著高于WThS。在养殖业中,洛菲不动杆菌容易产生耐药性,且容易出现多重耐药现象[52],因此在后续养殖管理中,需要加强对养殖水环境以及鱼体内不动杆菌属等细菌病原的检测,从而预防和控制绿鳍马面鲀养殖中相关疾病的暴发。
真菌在属水平上的分析结果显示,酵母属属于子囊菌门,其在WThS 和CThS 肠道中相对丰度均最高。WThS 肠腔中富含与环境相关的酵母属菌,WThS 和CThS 酵母属相对丰度的显著差异可能与野生环境和养殖环境的差异有关。
4 结论
比较了WThS 和CThS 的肌肉品质,并通过高通量测序评估了WThS 和CThS 肠道微生物群落的结构,鉴定出绿鳍马面鲀肠道的优势菌群。结果表明,WThS肌肉较CThS更为多汁鲜嫩,且必需氨基酸和必需脂肪酸含量更高。绿鳍马面鲀肠道优势细菌群是变形菌和厚壁菌,优势真菌群是子囊菌和担子菌,但养殖环境让绿鳍马面鲀的肠道菌群在门水平和属水平下均发生改变,在养殖过程中致病菌不动杆菌属和黄杆菌属在CThS肠道中相对丰度显著增加时需加以重视。本研究结果可为绿鳍马面鲀遗传育种的优化、养殖模式的科学化和新型饲料的开发等后续科学研究提供理论依据;今后希望进一步研究CThS 与WThS 肉质之间的差异与其肠道微生物菌群之间的关系。
