香芹酚乳液的稳定性和抑菌性研究
2024-04-03吴晨光李兆丰顾正彪班宵逢洪雁程力李才明
吴晨光,李兆丰,2,3,4,顾正彪,2,3,班宵逢,2,3,洪雁,2,3,程力,2,3,4,李才明,2,3*
1(江南大学 食品学院,江苏 无锡,214122)
2(江南大学,食品科学与技术国家重点实验室,江苏 无锡,214122)
3(江南大学,江苏省食品安全与质量控制协同创新中心,江苏 无锡,214122)
4(江南大学,白马未来食品研究院,江苏 无锡,214122)
植物精油是植物体内的次生代谢产物,主要来自于植物的花、根、叶、树皮、果实、种子等,挥发性高,具有强烈的芳香气味[1]。植物精油中的化学成分比较复杂,主要包括酚类、烯类、脂类、萜类、醛酮类等化合物及其衍生物。其中,酚类、萜类和醛酮类物质是主要的抑菌成分,正是由于这些生物活性物质的存在,使其具有良好的抑菌效果,并且,植物精油从天然产物中提取,与化学合成抑菌剂相比,具有广泛的抑菌特性以及对人体较小的危害,是合成抑菌剂的优良替代品[2]。
但是植物精油对高温、紫外等环境敏感,生物活性物质容易挥发,并且植物精油亲水性较差,在水溶液中的溶解度较低,导致其在实际应用中受限[3]。
乳液递送体系可将精油包埋,使精油分子得到有效的保护、提高植物精油的水溶解性和生物利用度[4]。SYED等[5]利用吐温80和阿拉伯胶制备了香叶醇和香芹酚精油乳液,表明其对蜡状芽胞杆菌和大肠杆菌均有良好的抑菌活性。MAURIELLO等[6]利用乳清分离蛋白和吐温80分别作为乳化剂制备了香芹酚乳液,发现乳液中香芹酚含量越高,其最小抑菌浓度越低,抑菌活性越强。目前研究中,需在乳液体系中添加较多的乳化剂来稳定乳液,而乳化剂的增加会影响乳液的抑菌性,同时精油的负载量也受到限制[7]。因此,如果能够以较少的乳化剂制备出精油负载量较高的乳液,将节省乳液的制备成本,精油的利用率也将大大提升。
在本研究中,使用吐温80、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)作为乳化剂,使用无水乙醇作为助乳化剂,制备不同的香芹酚乳液,探究乳化剂的添加量对乳液粒径、多分散指数(polydispersity index,PDI)以及Zeta电位的影响,同时,探究不同精油含量下香芹酚乳液的稳定性和抑菌性差异。
1 材料与方法
1.1 实验材料
香芹酚(carvacrol,CA,>99%),广州日化化工有限公司;大肠杆菌(ATCC 25922)、金黄色葡萄球菌(ATCC 6538)、沙门氏菌(ATCC 14028)、枯草芽孢杆菌(CMCC 63501),上海鲁微科技有限公司;无水乙醇、吐温80、SDS、胰蛋白胨、大豆蛋白胨、氯化钠、琼脂粉以及其他常用分析纯化学试剂,国药化学试剂有限公司。
1.2 仪器与设备
C-MAG HS 10型加热磁力搅拌器、T18型高速剪切机,德国IKA有限公司;SCIENTZ 150型高压均质机,宁波新芝生物科技股份有限公司;SK-O180-E型圆周(线性)摇床,大龙兴创实验仪器有限公司;GI54T型高压灭菌器,美国致微公司;BPH-9042型精密恒温培养箱,上海一恒科学仪器有限公司;ZetaSizer nano ZS型纳米粒度及Zeta电位仪,英国马尔文公司;SW-CJ-2FD型洁净工作台,苏净集团苏州安泰空气技术有限公司;UV-3600 plus型紫外可见近红外分光光度计,日本岛津公司;DHR-3型流变仪,美国沃特世公司。
1.3 实验方法
1.3.1 香芹酚精油乳液的制备
使用吐温80和SDS作为乳化剂,并将CA和无水乙醇混合成香芹酚乙醇混合液(carvacrol ethanol solution,CES),其中CES中CA的含量分别为100%、75%、50%、25%(质量分数)。分别将CES和乳化剂添加到一定量去离子水中,在室温下以300 r/min的转速磁力搅拌20 min,然后使用高速剪切机在1.0×104r/min下高速剪切2 min,得到粗乳液,在300 Bar压力下,使用高压均质机循环均质3次,得到香芹酚精油纳米乳液。其中吐温80的添加量为10、30、50、70、90 g/L,SDS的添加量分别为1、3、5、7、9 g/L,CES的添加量分别为100、150、200、300、400 g/L。
1.3.2 乳液的平均粒径、PDI、Zeta电位测定
使用纳米粒度及Zeta电位仪测定香芹酚精油乳液的粒径、PDI及Zeta电位。仪器参数设置为固定角度90°、散射角为173°、相对折射率为1.590、吸收率为0.001、平衡时间120 s、测量温度为25 ℃,测量前用去离子水将样品稀释100倍[8]。
1.3.3 乳液流变行为测定
使用流变仪对香芹酚精油乳液的流变特性进行测定。实验使用4 cm平板,间距为0.5 mm,在25 ℃下,测定不同剪切速率(0.01~100 s-1)下乳液的表观黏度变化[9]。
1.3.4 贮藏稳定性测定
将乳液分别在4 ℃和25 ℃下贮藏,在0、15、30、45 d测定乳液的平均粒径。
1.3.5 抑菌性测定
1.3.5.1 细菌菌悬液的制备
取100 μL细菌菌种接种于50 mL TSB培养基中,于37 ℃摇床中培养12 h,并使用平板计数法进行计数。
1.3.5.2 抑菌圈大小的测定
参考黄旭华等[10]的方法并作出修改进行抑菌圈大小的测定,操作均在无菌条件下进行。取直径为35 mm的一次性塑料培养皿,倾注加入加热融化的TSA培养基2 mL,均匀摊布,使其凝固,作为底层。将加热融化的TSA培养基放冷至45~50 ℃,加入供试菌菌悬液,使菌浓度在105~106CFU/mL,并将牛津杯置于凝固的TSA培养基上方中心位置,在每个平板中分别加入3 mL含菌悬液的TSA培养基,使其环绕在牛津杯外侧,均匀摊布,作为菌层。待菌层凝固后,取出牛津杯,在孔中加入100 μL相同精油浓度的抑菌溶液,将培养皿放入恒温培养箱,培养24 h后,采用十字交叉法测量抑菌圈大小,重复3次,以无菌水作为空白对照。
1.3.5.3 最小抑菌浓度的测定
按照琼脂稀释法测定香芹酚精油和香芹酚乳液的最小抑菌浓度(minimum inhibitory concentration,MIC)。分别将香芹酚和乳液稀释到一定浓度,然后与等量的双倍琼脂培养基混合,制备香芹酚质量浓度为5~0.009 8 mg/mL的梯度平板,取菌浓度约为107CFU/mL的菌悬液2 μL接种于平板表面,最后将平板放入37 ℃恒温培养箱中培养24 h,观察有无菌体生长[11]。
1.3.6 抗氧化活性的测定
DPPH自由基清除能力测定参考梁尚云[12]的方法并稍作修改。配制200 μmol/L DPPH-乙醇溶液,取2 mL稀释后的样品,加入2 mL DPPH-乙醇溶液并混合均匀,避光反应30 min,在517 nm下测定吸光度值。DPPH自由基清除率的计算如公式(1)所示:

(1)
式中:A0,无水乙醇与DPPH-乙醇溶液混合后的吸光度值;A1,样品与无水乙醇混合后的吸光度值;A2,样品与DPPH-乙醇溶液混合后的吸光度值。
1.4 数据处理
采用Excel 2016软件处理数据的平均值和标准误差;采用SPSS 22.0软件进行数据的显著性分析,其中P<0.05视为显著,程序选择:Duncan;采用Origin Pro 2017进行图像绘制。
2 结果与分析
2.1 香芹酚乳液的粒径、PDI和Zeta电位
2.1.1 吐温80添加量对香芹酚乳液粒径、PDI、Zeta电位的影响
当CES的添加量为100 g/L时,不同吐温80含量下制备的香芹酚乳液的粒径、PDI及Zeta电位如表1所示。香芹酚乳液的粒径随着吐温80含量的增加,香芹酚乳液的粒径和PDI变化均是先减小后增大,当吐温80含量为50 g/L时,粒径最小。其原因可能是当吐温80含量较低时,精油未被完全包埋,无法形成小液滴,增加吐温80的含量,使得乳液粒径减小,而继续增加吐温80的含量,乳液中过多的乳化剂会形成胶束,从而导致粒径和PDI的增大[13]。Zeta电位一般用来表示乳液分散体系的稳定性,由于乳液液滴间存在静电斥力,Zeta电位绝对值越高表示乳液体系越稳定[14]。当吐温80含量为10~50 g/L时,香芹酚乳液的Zeta电位绝对值会随着吐温80含量的增加增大,而吐温80含量为50~90 g/L时,Zeta电位变化不明显。因此,选择50 g/L的吐温80含量进行后续的研究。
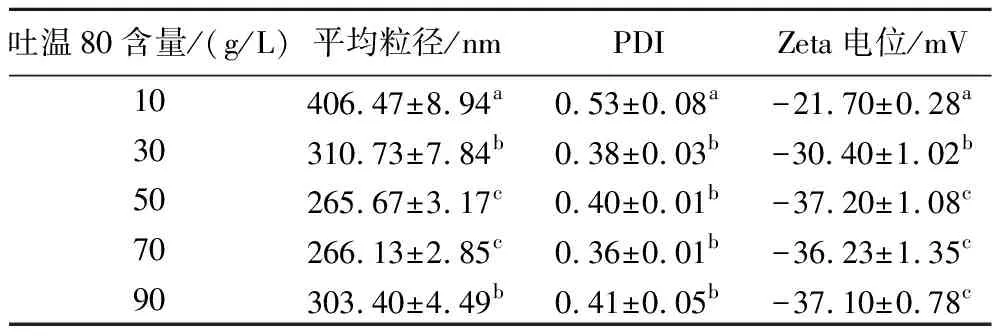
表1 吐温80添加量对香芹酚乳液的平均粒径、PDI和Zeta电位的影响
2.1.2 CES中CA含量对香芹酚乳液粒径、PDI、Zeta电位的影响
当吐温80的含量为50 g/L、CES的添加量为100 g/L时,CES中不同CA含量下制备的香芹酚乳液的粒径、PDI及Zeta电位如表2所示。无水乙醇常作为助溶剂进行精油乳液的制备,不添加无水乙醇的香芹酚乳液粒径和PDI较大,随着CES中CA含量的降低,乳液的粒径和PDI变化均为先减小后增大,而Zeta电位绝对值却逐渐降低。其原因可能是适量无水乙醇的加入降低了乳液体系的界面张力,增强了香芹酚的水溶解性,使得乳液的粒径和PDI降低,但当CES中无水乙醇含量较高时,阻碍了乳液界面膜的形成,使得乳液的粒径增大、Zeta电位绝对值降低[15]。因此,选择75%(质量分数)CA含量的CES[即m(香芹酚)∶m(无水乙醇)=3∶1)]进行后续研究。
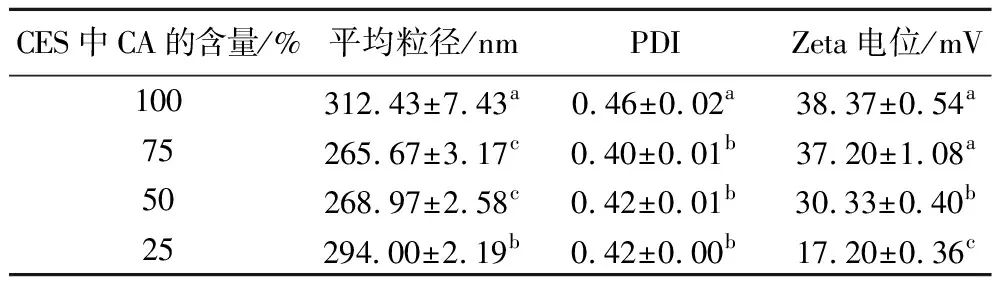
表2 CES中CA的含量对香芹酚乳液的平均粒径、PDI和Zeta电位的影响
2.1.3 SDS添加量对香芹酚乳液粒径、PDI、Zeta电位的影响
当吐温80的含量为50 g/L、CES的添加量为100 g/L时,不同SDS含量下制备的香芹酚乳液的粒径、PDI及Zeta电位如表3所示。从测定结果可以看出,SDS的加入使得香芹酚乳液的粒径和PDI降低,Zeta电位绝对值增加。并且香芹酚乳液的平均粒径和PDI会随着SDS含量的增加而降低,而Zeta电位绝对值则随着SDS含量的增加先增大后减小,当SDS含量为5 g/L时,Zeta电位绝对值最高。其原因可能是SDS的加入降低了界面张力,并能够在液滴上形成保护层,增强液滴间的静电斥力,使得乳液粒径和PDI降低、Zeta电位绝对值增加,但过多的SDS会和吐温80形成胶束,减弱了液滴间的静电斥力,使得降乳液的Zeta电位绝对值降低[16]。因此,选择5 g/L的SDS含量进行后续的研究。

表3 SDS添加量对香芹酚乳液的平均粒径、PDI和Zeta电位的影响
2.1.4 CES添加量对香芹酚乳液粒径、PDI、Zeta电位的影响
以吐温80作为乳化剂或以吐温80和SDS作为复合乳化剂制备不同CES含量的香芹酚乳液,其平均粒径、PDI和Zeta电位测量结果见表4。只使用50 g/L的吐温80作为乳化剂,可以稳定香芹酚乳液,但当CES含量达到250 g/L时,会迅速出现破乳现象,乳液极不稳定。吐温80体系中,香芹酚乳液粒径会随着CES含量的增加而不断增大,PDI值为0.39~0.41,均在0.3以上,说明体系分散不均匀,乳液粒径大小不均一[17]。其原因可能是在50 g/L的吐温80含量下,随着CES含量的增加,吐温80不足以完全覆盖乳液液滴,乳液由于聚结而不稳定,导致其粒径增大[18]。而SDS的添加可显著降低香芹酚乳液的平均粒径和PDI,并且将CES含量提高到了400 g/L,而当CES含量提高到500 g/L时,乳液过于黏稠,无法进行均质过程。使用50 g/L的吐温80和5 g/L的SDS共同稳定香芹酚乳液,平均粒径和PDI都会随着CES含量的增加而减小,当CES含量为400 g/L时,平均粒径和PDI最小。其原因可能是SDS和吐温80疏水链之间存在相互作用,形成了更加刚性的胶束,使得疏水性的香芹酚分子更稳定地包裹在胶束中,从而增加了香芹酚的溶解度,提高了香芹酚乳液的稳定性[19]。

表4 CES添加量对香芹酚乳液的平均粒径、PDI和Zeta电位的影响
在吐温80体系中,Zeta电位绝对值会随着CES含量的增加而增大。其原因可能是香芹酚所含有的一些阴离子基团以及非离子表面活性剂吐温80会在油水界面上产生负电荷,当香芹酚含量增加时,过多的阴离子基团暴露在油水界面导致电位绝对值的增加[20]。而吐温80/SDS(T/S)稳定的香芹酚乳液,Zeta电位绝对值均处于较高的值,其原因可能是SDS为阴离子表面活性剂,带负电荷,SDS的加入增强了乳液液滴之间产生的静电斥力,使得吐温80/SDS体系的乳液更加稳定[21]。但是,Zeta电位只能表示香芹酚乳液测试时的稳定性,并不能说明乳液的长期稳定性[22]。因此,有必要探究其贮藏稳定性。
2.2 贮藏稳定性
吐温80体系和吐温80/SDS体系的香芹酚乳液在4 ℃和25 ℃下的贮藏45 d的粒径变化如图2所示。通过测定结果可以发现,吐温80体系的香芹酚乳液贮藏在4 ℃下时,贮藏30 d后粒径会有明显的增加,而在25 ℃下贮藏15 d后粒径迅速增加,由此可见,吐温80体系的香芹酚乳液更适合在低温下贮藏。粒径增加的原因可能是乳液在高压均质过程中吸收了过多的能量,形成了小液滴,维持了乳液的稳定性,但在贮藏过程中受到奥斯特瓦尔德熟化的作用,小液滴聚集成大液滴,导致粒径的增大[23-24]。而吐温80/SDS体系的香芹酚乳液在4 ℃、25 ℃下贮藏45 d,其粒径无明显变化,表明吐温80/SDS体系的香芹酚乳液贮藏稳定性良好,可见SDS的加入增强了香芹酚乳液的贮藏稳定性。
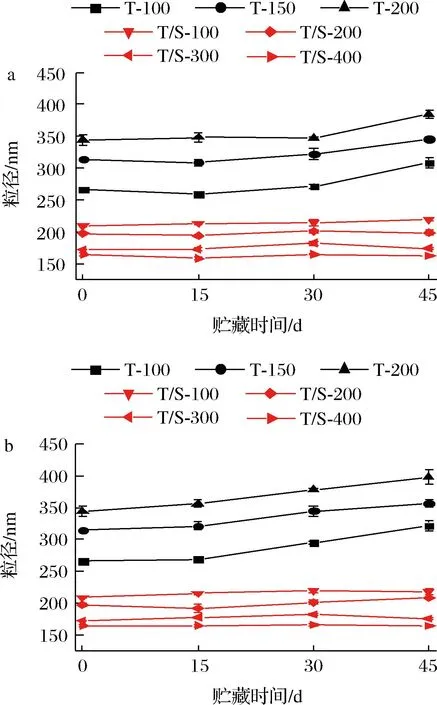
a-4 ℃;b-25 ℃
2.3 乳液的流变特性
乳液的流变行为不仅影响乳液的适用性,还关系到乳液的稳定性[25]。因此,研究不同香芹酚乳液的流变性质至关重要。
以50 g/L吐温80和5 g/L SDS稳定的香芹酚乳液的流变行为如图3所示。通过测定结果可以发现,随着剪切速率的增加,所有乳液的表观黏度逐渐降低,表明所有体系的香芹酚乳液存在剪切变稀行为,在较高的剪切速率下,乳液内部结构被破坏,乳液的表观黏度变化逐渐平稳。在吐温80/SDS体系中,香芹酚乳液的表观黏度也会随着CES含量的增加而增大。尤其是当CES含量由300 g/L提高到400 g/L时,乳液表观黏度急剧增加,其原因可能是香芹酚的含量较高时,发生了连续相的转变,界面面积增加,界面之间的相互作用增强,从而导致乳液表观黏度的增加[26]。因此,后续选择表观黏度适中、CES含量较高的香芹酚乳液T/S-300进行研究。
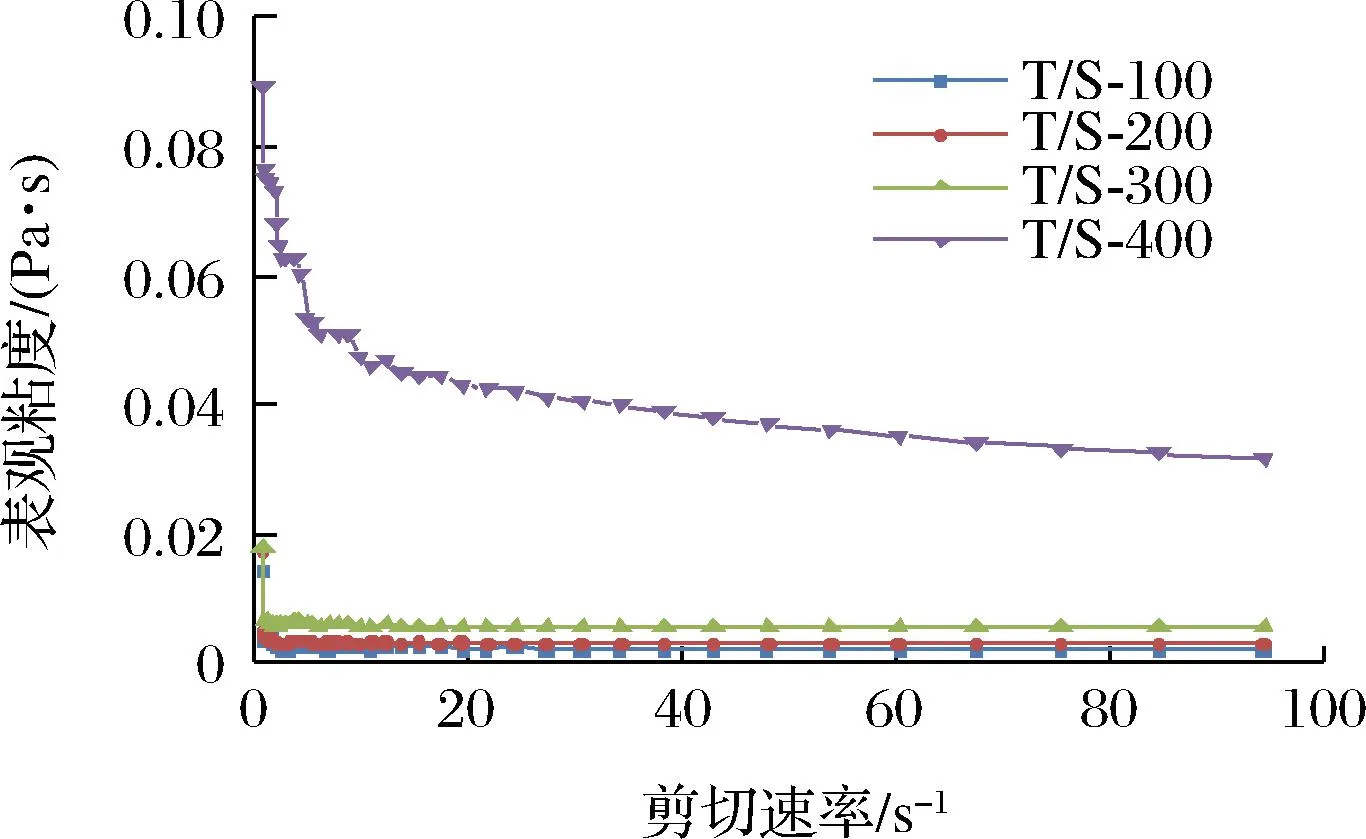
图3 香芹酚乳液的流变行为
2.4 抑菌圈大小
吐温80体系和吐温80/SDS体系的香芹酚乳液对金黄色葡萄球菌、大肠杆菌、沙门氏菌和枯草芽孢杆菌的抑菌圈大小如表5所示。通过测量结果可以发现,所有的香芹酚乳液对4种供试菌均有良好的抑菌活性,并且香芹酚乳液的抑菌性都会随着CES含量的增加而增强,其原因可能是在较低的精油含量下,精油被大量的乳化剂包裹,使得香芹酚的释放受到了限制,导致香芹酚乳液抑菌性的减弱[27]。

表5 香芹酚乳液对供试菌的抑菌圈大小 单位:mm
虽然2种体系的抑菌性都会随着精油含量的增加而增强,但是2种体系之间的抑菌性也存在一定的差异。通过比较相同CES含量下不同香芹酚乳液的抑菌圈大小,可以发现,SDS的加入使得乳液对金黄色葡萄球菌、大肠杆菌、沙门氏菌和枯草芽孢杆菌的抑菌性得以增强。其原因可能是SDS能够渗透到微生物的细胞膜中,干扰与细胞膜相关的功能蛋白,导致微生物的细胞膜破裂和部分生物功能丧失[28]。
2.5 MIC
MIC是指抑菌剂能抑制微生物生长的最低浓度,可用来评价抑菌剂抑菌的强弱,数值越小,表示其抑菌性越强[29]。为了比较纯精油和乳液的抑菌性差异,测定了香芹酚纯精油和香芹酚乳液T/S-300对金黄色葡萄球菌、大肠杆菌、沙门氏菌和枯草芽孢杆菌的MIC,如表6所示。结果显示,香芹酚纯精油和香芹酚乳液对金黄色葡萄球菌的MIC相同,而香芹酚纯精油对大肠杆菌、沙门氏菌、枯草芽孢杆菌的MIC分别是乳液的2、4、2倍,表明香芹酚制备成乳液后抑菌活性有了明显的增强。可能是香芹酚制备成乳液后改善了精油的水溶解性,使得乳液中的活性物质能够更快地与微生物细胞膜结合,从而破坏细胞膜导致细胞死亡[30]。PILONG等[31]也得出了相同结论,与丁香油相比,丁香油纳米乳液对金黄色葡萄球菌、大肠杆菌和铜绿假单胞菌的抗菌活性更强。

表6 香芹酚和香芹酚乳液对供试菌的MIC 单位:mg/mL
2.6 抗氧化活性
DPPH自由基清除能力可作为评价物质抗氧化活性的重要指标[32]。香芹酚纯精油和香芹酚乳液的DPPH自由基清除率如图4所示。通过测定结果可以看出,香芹酚乳液的DPPH自由基清除能力明显强于香芹酚纯精油,在1、2、3、4、5 mg/mL的香芹酚含量下,香芹酚乳液的DPPH自由基清除率分别增强了12.88%、12.18%、7.13%、6.56%、7.90%,香芹酚含量较低时,抗氧化活性提升更为明显。这是由于香芹酚制备成乳液后克服了香芹酚水溶性差的缺点,有助于充分发挥其活性作用,从而提升了香芹酚清除自由基的能力[33]。

图4 香芹酚和香芹酚乳液的DPPH自由基清除能力
3 结论
本文使用吐温80和SDS作为复合乳化剂进行香芹酚乳液的制备,与单一乳化剂制备的香芹酚乳液相比,既增大了精油负载量,又减小了乳液的平均粒径,贮藏稳定性更好。通过流变行为的测定,发现吐温80/SDS体系的香芹酚乳液当CES含量达到400 g/L时,会发生连续相的转变,表观黏度急剧增加。通过抑菌圈直径测定了不同乳液的抑菌性,结果显示,乳液的抑菌性会随着CES含量的增大而增强,而吐温80/SDS体系的香芹酚乳液抑菌性更强。通过比较香芹酚乳液和纯精油的最小抑菌浓度和抗氧化活性,发现香芹酚乳液的抑菌性和抗氧化活性明显强于香芹酚。本研究使用吐温80和SDS复合乳化剂增大了精油负载量,并提高了香芹酚精油乳液的稳定性和抑菌性,但目前尚未进行抑菌机理的探究和食品保鲜的应用,下一步将进行抑菌机理的探究,并将乳液应用到果蔬、谷物类、肉类等食品保鲜中。
