猪微小RNA-15b前体突变对其生物学加工过程及前体脂肪细胞分化的影响
2024-04-02孙文阳潘红梅陈四清郭宗义
龙 熙 孙文阳 潘红梅 张 亮 陈四清 涂 志 郭宗义
(重庆市畜牧科学院,重庆 402460)
微小RNA(microRNA,miRNA)是动物内一类内源性的单链非编码RNA,长度22个碱基左右。miRNA与Argonaute(AGO)蛋白结合形成的RNA诱导沉默复合体(RNA-induced silencing complex,RISC)可以通过种子序列与靶基因mRNA的3′非编码区(UTR)结合,从而发挥降解mRNA或抑制翻译的功能,在转录后水平上抑制基因的表达[1-3]。miRNA广泛分布于动物体内,几乎参与了动物体内所有的生物学过程,具有重要的生物学功能[4-5]。动物体内经典的miRNA生物学加工过程主要有4步:1)在细胞核内RNA聚合酶Ⅱ的作用下,miRNA基因转录形成miRNA初级转录本(pri-miRNA)[6];2)pri-miRNA随后被“微处理器(microprocessor)”[由核糖核酸酶Ⅲ Drosha及其辅酶DiGeorge综合征关键区域8(DGCR8)构成)]剪切形成“发卡”状的miRNA前体(pre-miRNA)[7-8]];3)pre-miRNA被转运至细胞质被另外一种核糖核酸酶Ⅲ Dicer剪切成小的双链RNA[9];4)小双链miRNA装载进入AGO蛋白,AGO蛋白会选择其中一条单链RNA最终形成RISC,另一条被释放[10-11]。
miRNA介导的基因表达沉默是一种重要的表观遗传调控方式,广泛参与调控家畜的胚胎发育、肌肉生长、脂肪沉积、繁殖和免疫反应等过程[12-13]。miRNA的生物学加工过程(表达)受到了精密调控,种子序列、成熟体或前体部位的突变都可能会影响其加工过程,甚至影响其功能发挥[14-15]。一些miRNA或其靶基因3′ UTR miRNA结合位点的突变与家畜能量代谢和生产性能的改变密切相关。微小RNA-378(miR-378)被报道在动物脂肪组织中高表达,参与调控脂肪细胞的能量代谢和脂质合成[16-17],其表达量与家畜的背膘厚度显著相关[18];有研究报道,猪miR-378种子序列上1个A>G的突变能够抑制脂肪细胞的脂肪合成[19]。特克塞尔羊肌肉生长抑制素(myostatin,MSTN)基因3′ UTR发生1个G>A突变,产生了1个能与微小RNA-1(miR-1)和微小RNA-206(miR-206)结合的位点,肌肉组织中高表达的miR-1和miR-206与突变的3′ UTR结合抑制了MSTN的表达,从而使特克塞尔羊表现出优良的产肉性能[20]。由此可见,miRNA基因突变对农业动物营养代谢和生产性能的影响是非常值得研究的。
微小RNA-15b(miR-15b)是调控细胞增殖凋亡和细胞周期的重要基因,在许多癌变组织中异常表达[21-24]。猪miR-15b位于3号染色体,与微小RNA-16-1(miR-16-1)成簇排列。miR-15b可以通过抑制叉头框蛋白O1(Forkhead box protein O1,FOXO1)的表达,促进猪前体脂肪细胞的成脂分化[25]。本研究发现,猪miR-15b前体(pre-miR-15b)基因位点第58位碱基发生了1个C>T突变(+58C>T),通过构建miR-15b野生型和突变型过表达载体,转染猪原代前体脂肪细胞,探究此突变对miRNA生物学加工过程、miR-15b成熟体表达量以及猪前体脂肪细胞分化和脂肪合成的影响,从而揭示miRNA基因突变改变农业动物机体能量代谢和生产性能的潜在可能性,为今后农业动物miRNA基因突变的功能研究提供新的思路。
1 材料与方法
1.1 试验材料
1.1.1 试验动物和样品采集
本试验随机选取500头长白猪、500头杜洛克猪(重庆市黔江区69猪场)和300头荣昌猪(重庆市荣昌区国家级荣昌猪保种场)用于pre-miR-15b基因多态性、基因型及等位基因频率分析。采用耳号钳夹取试验猪耳组织块,用生理盐水洗净后置于盛有75%乙醇的离心管中,带回实验室于-20 ℃保存备用。选取3头3日龄荣昌猪(重庆市荣昌区国家级荣昌猪保种场)用于猪原代前脂肪细胞的分离:将3头仔猪用新洁尔灭洗净后窒息处死,再用75%的乙醇擦洗干净后移至细胞间,取后颈部皮下白色脂肪组织。本研究的所有动物试验均得到了重庆市畜牧科学院实验动物伦理委员会的许可(审批编号:XKY-No.20220105)。
1.1.2 主要试剂
DNA提取试剂盒(TIANamp Genomic DNA Kit)购自天根生化科技(北京)有限公司;PCR反应体系(TaKaRa Ex Taq®)、T载体(pMD®19-T simple Vector)、miRNA表达质粒(pmR-mCherry)、mRNA反转录试剂盒(PrimeScriptTMRT Master Mix)和荧光定量试剂盒(TB Green®Premix Ex TaqTM)购自宝生物工程(大连)有限公司;大肠杆菌(Escherichiacoli)Top10感受态细胞(Top10 Competent Cell)购自康为世纪生物科技股份有限公司;限制性核酸内切酶XhoⅠ、BamHⅠ和T4 DNA连接酶购自NEB公司;胶回收试剂盒(E.Z.N.A.®Gel Extraction Kit)、普通质粒提取试剂盒(E.Z.N.A.®Plasmid Mini Kit)和去内毒素质粒提取试剂盒(E.Z.N.A.®Endo-Free Plasmid Mini Kit)购自Omega公司;1×Hank’s平衡盐溶液(HBSS)缓冲液、胎牛血清、牛血清白蛋白、地塞米松、胰岛素和3-异丁基-1-甲基黄嘌呤(IBMX)购自Sigma公司;胶原蛋白酶D购自Roche公司;DMEM/F12购自Hyclone公司;转染试剂LipofectamineTM2000和Trizol Reagent购自Invitrogen公司;miRNA反转录试剂盒(miScript®Ⅱ RT Kit)、miRNA荧光定量试剂盒(miScript®SYBR®Green PCR Kit)购自QIAGEN公司。
1.1.3 主要仪器
振荡水浴锅(Thermo Scientific),Centrifuge 5804 R冷冻离心机(Eppendorf),常温离心机(Thermo Scientific);SW-CJ-1C型超净工作台(江苏净化设备有限公司);荧光显微镜(奥林巴斯),普通PCR仪与7900 HT荧光定量PCR仪(Applied Biosystems)。
1.2 试验方法
1.2.1 猪pre-miR-15b基因多态性分析
采用TIANamp Genomic DNA Kit提取猪耳组织基因组DNA。参照miRBase数据库中pre-miR-15b的序列(登录号:MI0002419),利用Ensembl数据库的BLASTN工具将此序列对比到猪参考基因组(Sscrofa 11.1)上,并下载以pre-miR-15b为中心上下游各延伸200 bp的miR-15b初级转录本(pri-miR-15b)部分序列,用Primer 3.0在该pri-miR-15b序列上设计pre-miR-15b基因片段扩增引物(基因分型引物),引物序列如下:miR-15bFx-F,5′-GGTTCTCTCGTCCTTGTTTTTG-3′;miR-15bFx-R,5′-AGAGCGGAACAAGTATGTCAGT-3′。扩增片段长度为275 bp,引物由苏州金唯智生物科技有限公司合成。以基因组DNA为模板,miR-15bFx-F和miR-15bFx-R为引物,用TaKaRa Ex Taq®对pre-miR-15b基因片段进行扩增。PCR反应程序为:94 ℃预变性3 min;94 ℃变性30 s,59 ℃退火30 s,72 ℃延伸30 s,共35个循环;72 ℃延伸10 min。PCR产物经琼脂糖凝胶电泳检测,合格的PCR产物送至苏州金唯智生物科技有限公司进行Sanger测序。测序结果利用MEGA5和Chromas进行基因多态性分析。
1.2.2 pre-miR-15b二级结构及其自由能预测
野生型和突变型pre-miR-15b的二级结构及自由能使用RNAfold(http://rna.tbi. univie.ac.at/cgi-bin/RNAWebSuite/RNAfold.cgi)进行预测。
1.2.3 miR-15b表达载体的构建
参照miRBase数据库pre-miR-15b的序列(登录号:MI0002419),利用Ensembl数据库的BLASTN工具将此序列对比到猪参考基因组(Sscrofa 11.1)上,并下载以pre-miR-15b为中心上下游各延伸300 bp的pri-miR-15b部分序列,用Primer 3.0在该pri-miR-15b序列上设计pri-miR-15b基因片段扩增引物(表达载体构建引物),引物序列如下:miR-15bPc-F,5′-CTCGAGCACATAAGTGGGAAGAAGAAGACA-3′;miR-15bPc-R,5′-GGATCCCAGGAAAAGGACTAT TGCAAGATAA-3′(下划线部分分别为XhoⅠ和BamHⅠ的酶切位点)。引物由苏州金唯智生物科技有限公司合成,扩增片段长度为559 bp(包含pre-miR-15b基因片段、miR-16-1前体(pre-miR-16-1)及部分上下游侧翼片段,侧翼区的存在可以保证miRNA被Drosha识别和剪切)。采用miR-15bPc-F和miR-15bPc-R对野生型和突变型猪的pre-miR-15b及其侧翼区进行PCR扩增,PCR产物用2%琼脂糖凝胶电泳检测,并对目的片段进行胶回收,具体操作按照E.Z.N.A.®Gel Extraction Kit说明书进行。将胶回收的DNA片段与T载体进行连接,随后将重组T载体转化入Top10感受态细胞,转化后的感受态细胞37 ℃培养45 min(菌体复苏),再均匀的涂抹在LB固体培养基(含氨苄西林)上,37 ℃培养12~16 h。待LB固体培养基长出菌落后,挑单菌落进行培养,再利用miR-15bPc-F和miR-15bPc-R引物进行菌液PCR,PCR产物经琼脂糖凝胶电泳鉴定出阳性克隆,阳性克隆的菌液送至苏州金唯智生物科技有限公司进行Sanger测序,经Sanger测序确保插入的DNA片段无误后,对阳性克隆的菌液进行扩大培养,并使用E.Z.N.A.®Plasmid Mini Kit提取质粒。用XhoⅠ和BamHⅠ分别对插入野生型和突变型pre-miR-15b片段的T载体和pmR-mCherry进行双酶切,胶回收野生型和突变型pri-miR-15b目的片段(559 bp)和pmR-mCherry酶切片段(约4 700 bp),再用T4连接酶将野生型和突变型pri-miR-15b DNA片段分别与pmR-mCherry酶切片段进行连接,随后依次进行转化、涂板、挑单菌落培养和质粒提取(方法同上);对提取出的质粒进行XhoⅠ和BamHⅠ双酶切,酶切产物经琼脂糖凝胶电泳检测,依据DNA条带数量和大小判定阳性克隆,分别将成功插入野生型和突变型pre-miR-15b DNA片段的重组质粒命名为pmR-miR-15bW和pmR-miR-15bM。将鉴定为阳性克隆的菌液扩大培养,采用E.Z.N.A.®Endo-Free Plasmid Mini Kit提取质粒,用于细胞转染试验。
1.2.4 猪前脂肪细胞的分离培养
参照Sun等[26]的方法对猪前脂肪细胞进行分离,具体方法如下:用眼科剪刀将1.1.1中获取的猪脂肪组织充分剪碎,加入含有1 mg/mL Ⅰ型胶原酶的HBSS,置于振荡水浴锅中消化45 min(37 ℃,200 r/min),将消化液转移至超净台,加入与消化液等体积的含血清的F12培养基终止消化,用70 μm细胞筛过滤2次,滤液转移至10 mL离心管中2 000 r/min离心10 min,弃上清加10 mL磷酸盐缓冲液(PBS)清洗细胞,重复清洗3次,清洗后的细胞接种于细胞培养皿中培养。
1.2.5 细胞转染
将分离的猪前脂肪细胞传代至24孔板,待细胞长至80%左右进行转染。用LipofectaminTM2000将600 ng的pmR-miR-15bW、pmR-miR-15bM和pmR-mCherry分别转染细胞进行miR-15b的过表达试验,每组设置5个生物学重复,转染的具体操作参照LipofectaminTM2000说明书。细胞培养48 h后提取RNA。
1.2.6 总RNA提取、miRNA的反转录与实时荧光定量PCR(RT-qPCR)
采用Trizol提取细胞的总RNA,具体操作参照其说明书。采用miScript®Ⅱ RT Kit对总RNA进行反转录(此试剂盒在反转录miRNA成熟体的同时也可以反转录pre-miRNA),并采用miScript®SYBR®Green PCR Kit在7900 HT荧光定量PCR仪上进行RT-qPCR,对miR-15b、微小RNA-16(miR-16)及pre-miR-15b的表达量进行检测(每个基因设置3个技术性重复),各基因RT-qPCR qPCR引物见表1,具体反应体系和反应程序详见试剂盒说明书。以pmR-mCherry自带的红色荧光蛋白基因为内参(此基因与插入基因共用一个启动子,可以消除转染效率的微弱差异引起的数据误差),采用2-ΔΔCt法计算各目的基因的相对表达量。

表1 RT-qPCR引物序列
1.2.7 前脂肪细胞的成脂诱导分化及成脂分化相关基因表达量的检测
在诱导分化前先进行miR-15b的过表达试验,方法和试验分组同1.2.5,转染24 h后更换为普通F12培养液,继续培养24 h后进行成脂诱导分化。采用鸡尾酒法进行诱导,先用诱导液Ⅰ(包含1 mmol/L地塞米松、5 mg/mL胰岛素和0.5 mmol/L IBMX)培养2 d,然后更换为诱导液Ⅱ(包含5 mg/mL胰岛素)培养4 d(每2 d更换1次诱导液),分别收集各组诱导前后的细胞提取总RNA。用PrimeScript®RT Master Mix将mRNA反转录为cDNA,随后利用TB Green®Premix Ex TaqTM进行RT-qPCR,检测成脂分化相关基因固醇调节元件结合蛋白-1c(SREBP-1c)、过氧化物酶体增殖物激活受体γ(PPARγ)和脂肪细胞蛋白2(aP2),以及miR-15b靶基因FOXO1相对表达量(每个基因设置3个技术性重复),各基因引物序列见表2,具体反应体系和反应程序详见试剂盒说明书。以β-肌动蛋白(β-actin)为内参基因,采用2-ΔΔCt法计算各目的基因的相对表达量。
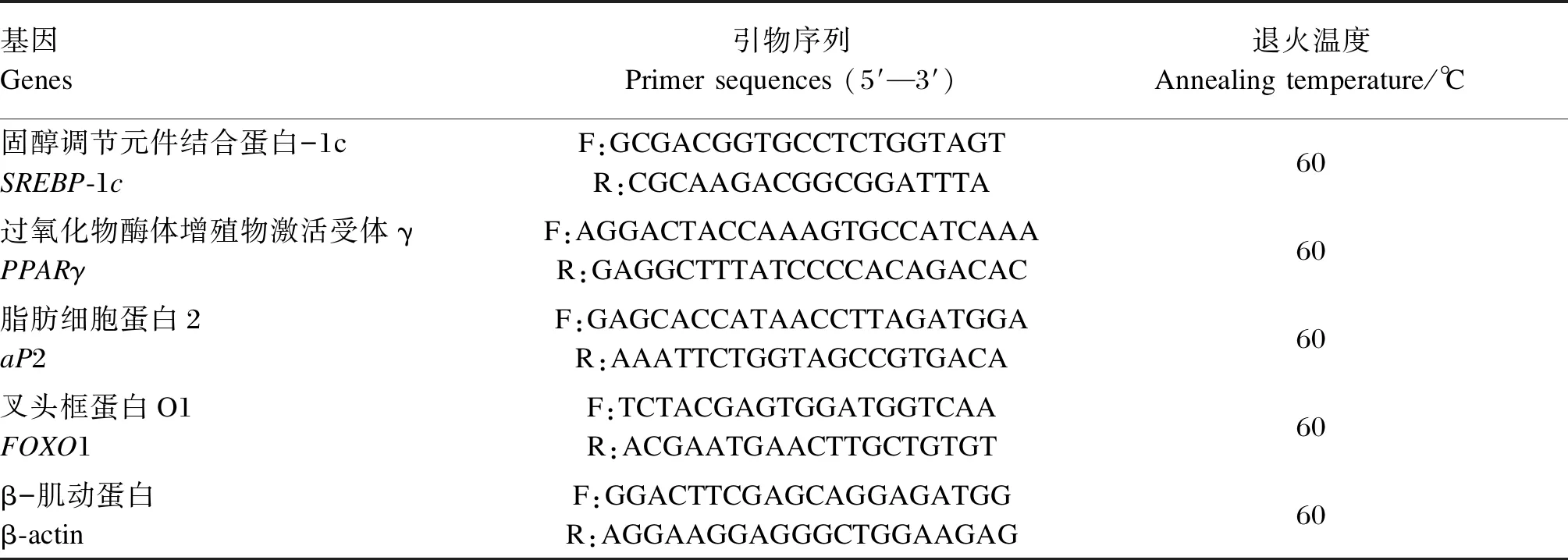
表2 引物序列
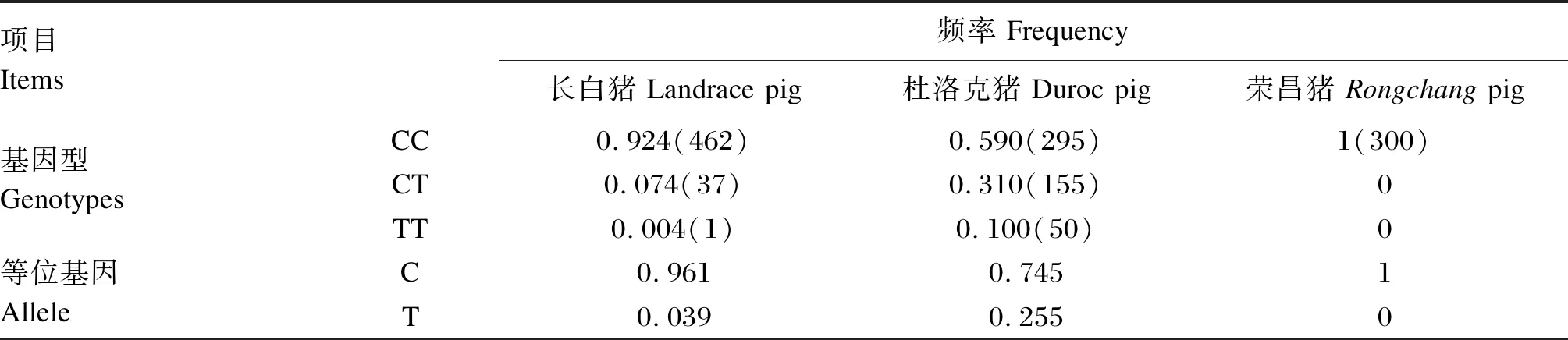
表3 3个品种猪pre-miR-15b基因型和等位基因频率
1.2.8 分化后脂肪细胞的油红O染色
向培养皿中加入PBS漂洗2次分化后的细胞,加入4%多聚甲醛固定40 min;采用PBS漂洗2次,加0.3%油红O染色40 min;再用PBS漂洗2次,随后置于显微镜下观察。
1.3 数据统计分析
采用SPSS 19.0统计软件中的独立样品t检验进行组间各基因相对表达量的差异显著性分析,P<0.05为差异显著,P<0.01为差异极显著。
2 结 果
2.1 猪pre-miR-15b基因多态性及不同品种基因型和等位基因频率分析
以3个品种猪(长白猪、杜洛克猪和荣昌猪)基因组DNA为模板,PCR扩增pre-miR-15b基因片段,Sanger测序结果发现pre-miR-15b第58位碱基发生了1个C>T突变(+58C>T),与猪参考基因组(Sscrofa 11.1)进行序列比对,发现CC基因型为野生型pre-miR-15b(pre-miR-15bW),TT基因型为突变型pre-miR-15b(pre-miR-15bM)(图1)。3个品种猪pre-miR-15b基因型频率和等位基因频率见表1,+58C>T只发现于长白猪和杜洛克猪,而荣昌猪群体中未发现此突变。
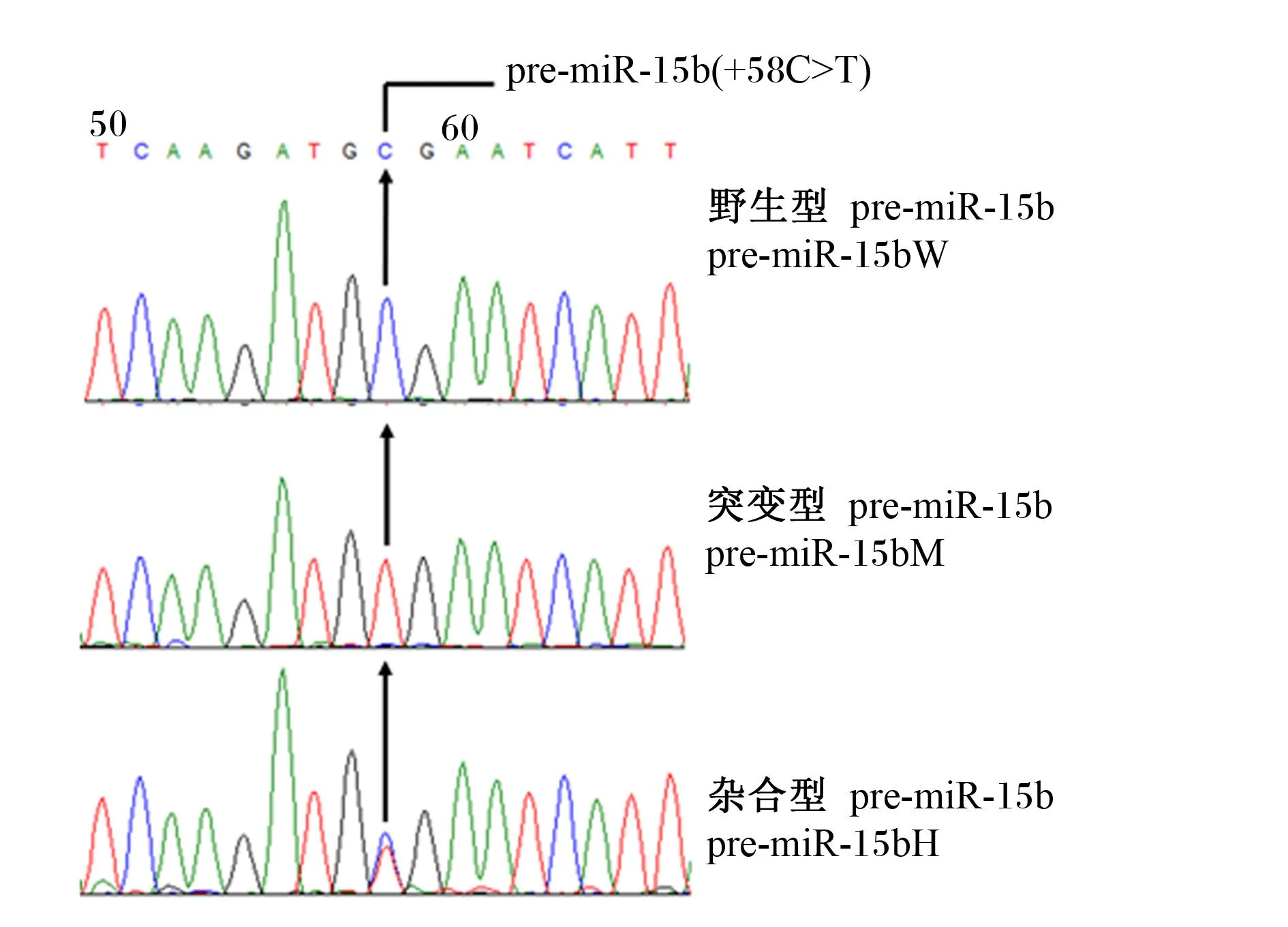
图1 猪pre-miR-15b基因序列的C>T突变
2.2 +58C>T对pre-miR-15b二级结构和热力学稳定性的影响
为了探究+58C>T对pre-miR-15b二级结构和热力学稳定性的影响,利用RNAfold对pre-miR-15bW和pre-miR-15bM的二级结构及自由能进行预测,结果发现+58C>T导致pre-miR-15bM二级结构出现了一个A-U碱基互补配对,替代了pre-miR-15bW的A-C碱基对,从而使自由能降低了14.38%,二级结构更加稳定(图2)。结果还发现,+58C>T极大地降低了pre-miR-15b第39位和第58位碱基的熵值(图3)。
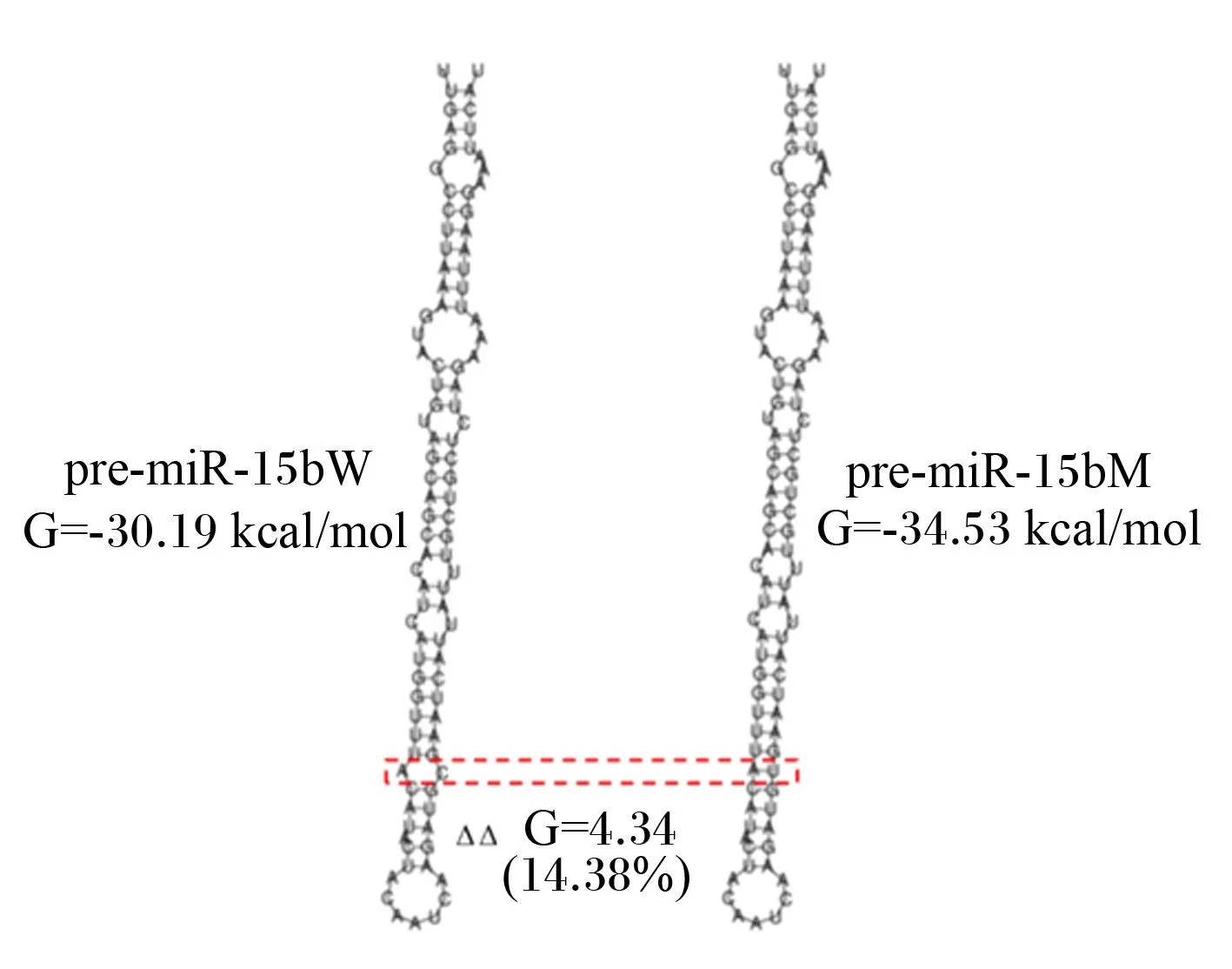
pre-miR-15bW:野生型pre-miR-15b;pre-miR-15bM:突变型pre-miR-15b;G:自由能 free energy;1 kcal≈4.184 kJ。

图3 pre-miR-15bW(左)和pre-miR-15bM(右)各位点的熵值
2.3 +58C>T对miR-15b成熟体表达量的影响
本试验分别构建了野生型(pmR-miR-15bW)和突变型(pmR-miR-15bM)miR-15b过表达载体(miR-16-1与miR-15b同簇表达,所以此片段同时包含了miR-16-1基因片段)(图4)。分离、培养猪原代前脂肪细胞,分别进行pmR-miR-15bW、pmR-miR-15bM及pmR-mCherry(对照组)质粒的细胞转染试验,每种处理设置5个生物学重复。利用RT-qPCR检测各细胞内miR-15b和miR-16的相对表达量,结果发现pmR-miR-15bM组细胞miR-15b和miR-16的表达量均极显著低于pmR-miR-15bW组(P<0.01),说明+58C>T阻碍了miR-15b的加工过程,降低了其表达量。
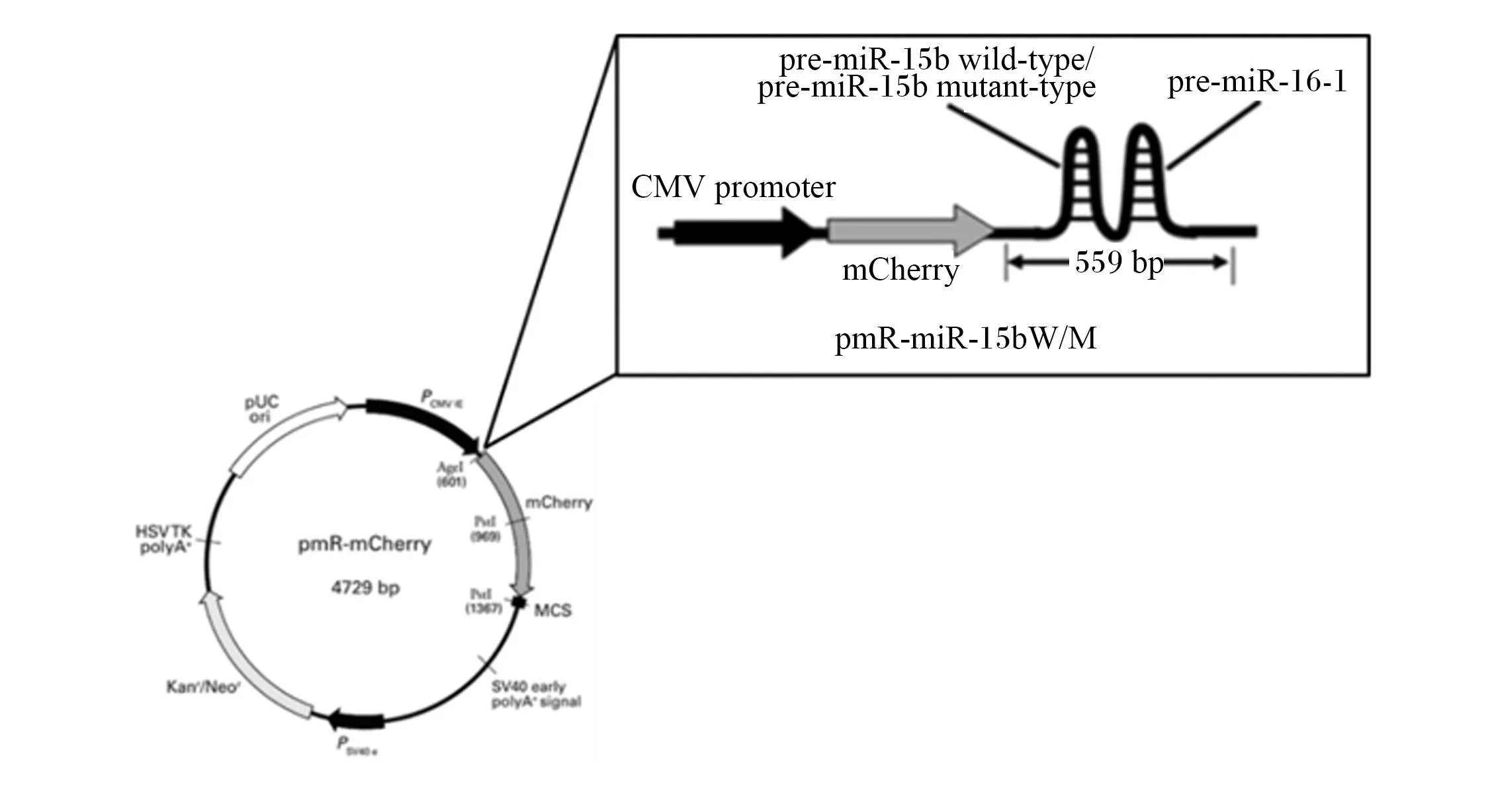
pre-miR-15b wild-type:野生型pre-miR-15b;pre-miR-15b mutant-type:突变型pre-miR-15b;pUC ori:复制起始点 replication origin;CMV promoter:巨细胞病毒启动子。
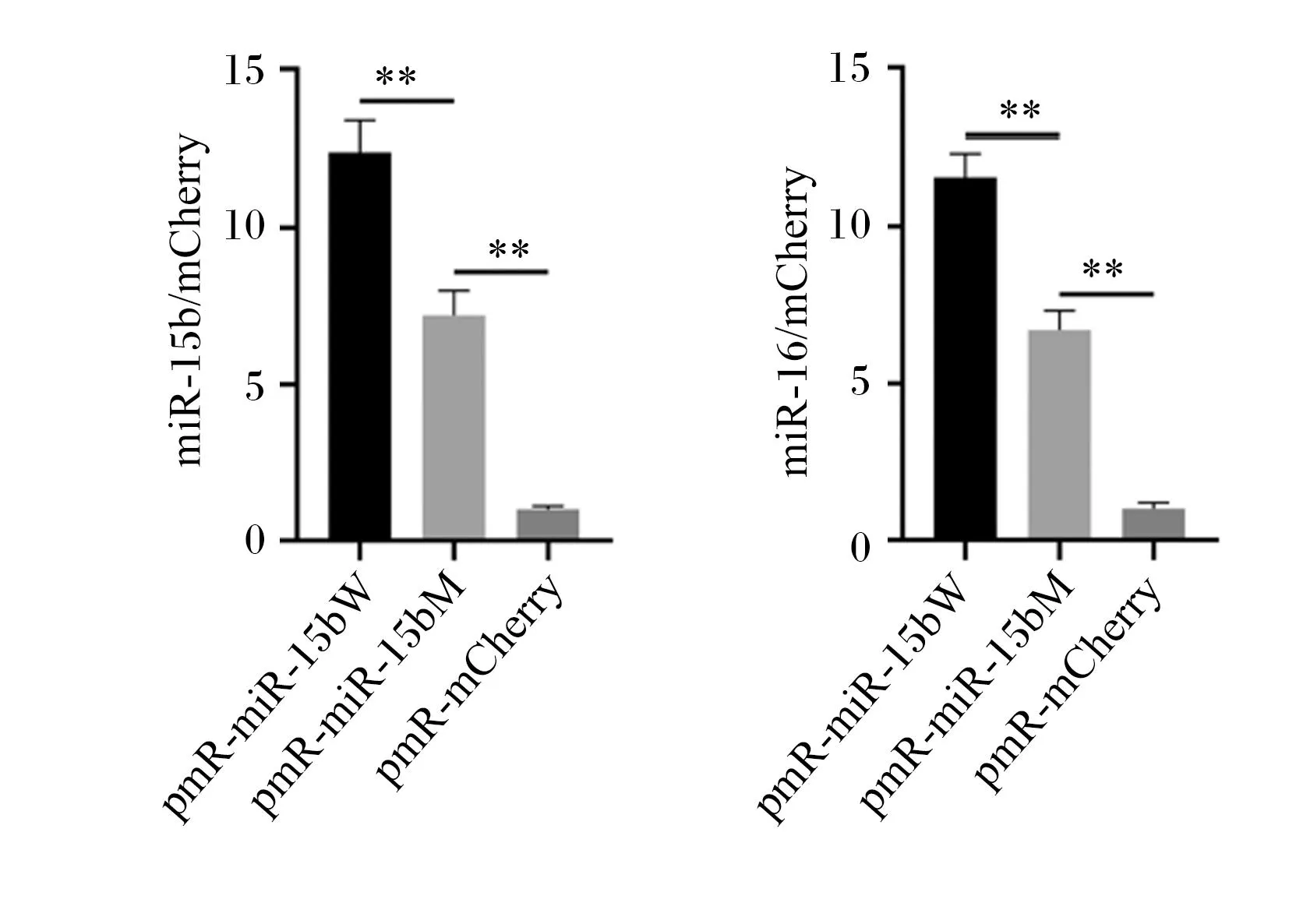
pmR-miR-15bW:野生型miR-15b过表达载体;pmR-miR-15bM:突变型miR-15b过表达载体;*:P<0.05;**:P<0.01。图7~图9同 the same as Fig.7 to Fig.9.
2.4 +58C>T对miR-15b生物学加工过程的影响
为了探究+58C>T具体影响miR-15b生物学加工过程中的哪一过程,设计了pri-miR-15b-F1、pre-miR-15b-F2和pre-miR-15b-R这3个引物(图6),利用RT-qPCR检测分别转染了pmR-miR-15bW、pmR-miR-15bM及pmR-mCherry质粒的猪前体脂肪细胞中pri-miR-15b和pre-miR-15b的相对表达量。利用引物pri-miR-15b-F1及pre-miR-15b-R检测猪前体脂肪细胞中pri-miR-15b的相对表达量,发现pmR-miR-15bW组与pmR-miR-15bM组没有显著差异(P>0.05)(图7),说明+58C>T并未影响miR-15b基因的转录过程。利用引物pre-miR-15b-F2及pre-miR-15b-R检测pri-miR-15b与pre-miR-15b两者总的表达量,发现pmR-miR-15bW组极显著高于pmR-miR-15bM(P<0.01)(图7),这说明+58C>T阻碍了pri-miR-15b到pre-miR-15b的加工过程,从而降低了miR-15b成熟体的表达量。
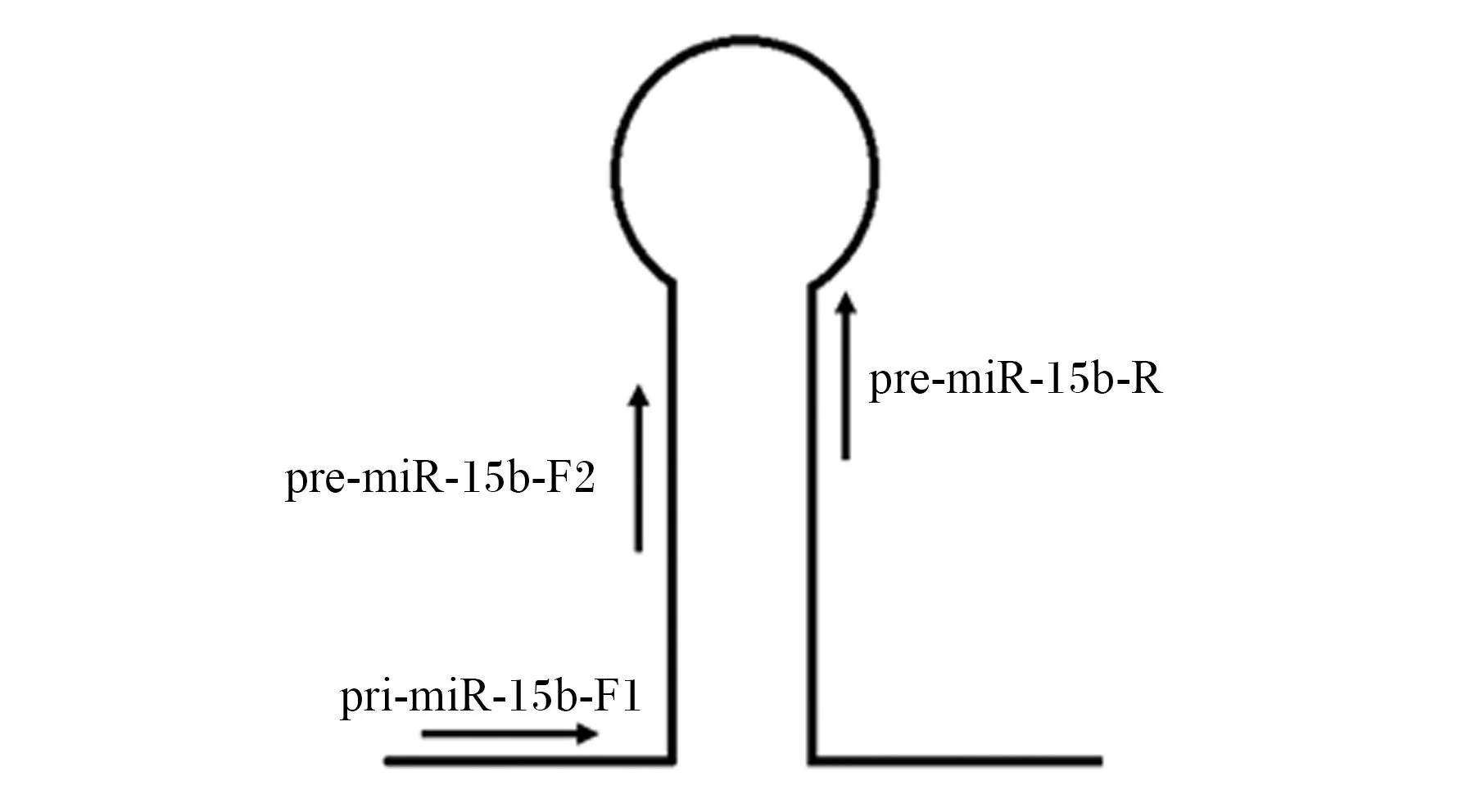
图6 pre-miR-15b定量引物设计图示

图7 pri-miR-15b和pre-miR-15b的相对表达量
2.5 +58C>T对猪前体脂肪细胞成脂分化的影响
为了探究+58C>T对猪前体脂肪细胞成脂分化的影响,将猪前体脂肪细胞分别转染pmR-miR-15bW、pmR-miR-15bM及pmR-mCherry后,再诱导前体脂肪细胞分化,随后利用RT-qPCR,以β-actin为内参,检测不同组细胞分化前后成脂分化相关基因(SREBP-1c、PPARγ和aP2),以及miR-15b靶基因FOXO1的相对表达量。结果表明:诱导分化前,3组细胞SREBP-1c、PPARγ和aP2相对表达量均无显著差异(P>0.05)(图8-A~图8-C);而pmR-miR-15bM组FOXO1相对表达量极显著高于pmR-miR-15bW组(P<0.01),且这2组都极显著低于pmR-mCherry组(P<0.01)(图8-D)。诱导分化后,3组细胞SREBP-1c、、PPARγ和aP2相对表达量较分化前均表现出上调表达趋势,pmR-miR-15bW组SREBP-1c和PPARγ相对表达量均显著高于pmR-miR-15bM组(P<0.05),pmR-miR-15bW组和pmR-miR-15bM组SEBP-1c、PPARγ和aP2相对表达量都极显著高于pmR-mCherry组(P<0.01)(图8-A~图8-C);3组细胞FOXO1相对表达量较分化前均表现出下调表达趋势,pmR-mCherry组FOXO1相对表达量极显著高于其他2组(P<0.01)(图8-D)。用油红O对成脂分化后3组细胞内的脂滴进行染色,结果发现pmR-miR-15bW组脂滴含量明显高于pmR-miR-15bM组,且这2组脂滴含量均明显高于pmR-mCherry组(图9)。

图9 油红O染色结果
3 讨 论
miRNA的生物学加工过程直接影响miRNA成熟体的表达量,且受到时空性的精密调控,这种动态调节使miRNA能够灵活精确的调控其靶基因的表达[27]。miRNA基因序列的突变,包括pri-miRNA、pre-miRNA和miRNA成熟体(种子序列)上的突变都有可能影响其加工过程,或者影响miRNA与靶基因mRNA的结合,从而影响miRNA的生物学功能[15]。有研究发现,人微小RNA-125a(miR-125a)种子序列上的1个G>U突变通过降低miR-125a初级转录本(pri-miR-125a)与DGCR8结合,阻碍了pri-miR-125a到miR-125a前体(pre-miR-125a)的加工过程,降低了miR-125a的表达量,减弱了其对靶基因的翻译抑制作用[14]。还有研究发现,人微小RNA-96(miR-96)种子序列上+13G>A和+14C>A 2个位点的突变可导致听力丧失,这2个突变增加了miR-96前体(pre-miR-96)的热力学稳定性,体外细胞水平试验发现这2个突变极大程度影响了miR-96的加工过程,降低miR-96成熟体表达量,且影响miRNA对靶基因转录后的抑制作用[28]。此外,一些发生在miRNA成熟体外的突变也能够影响miRNA的加工过程和功能发挥。微小RNA-126(miR-126)初级转录本(pri-miR-126)上1个A>G突变(距miR-126成熟体3′末端24 bp)阻碍了pri-miR-126到miR-126前体(pre-miR-126)的加工过程,导致miR-126成熟体表达量下降,进而影响了其对靶基因的翻译抑制作用[29]。体内和体外验证试验发现,人miR-15a/miR-16-1簇上的1个C>T突变(位于pre-miR-16-1 3′末端下游7 bp)导致细胞内miR-15a与miR-16-1成熟体表达量明显降低,且可能与慢性淋巴细胞白血病的发生相关[30]。此外,还有研究在一种易感B细胞淋巴瘤的新西兰黑鼠家系中发现pre-miR-16-1 3′端的侧翼区发生了1个A>T突变,突变个体淋巴组织内miR-16-1表达量下降,推测此突变可能与B细胞淋巴瘤的发生相关[31]。
本研究在猪pre-miR-15b基因位点第58位碱基发现了1个C>T突变,此突变降低了pre-miR-15b二级结构的热力学稳定性,通过构建野生型和突变型miR-15b过表达载体,分别转染猪原代前体脂肪细胞进行miR-15b的过表达试验,探究此突变对pre-miR-15b和miR-15b成熟体表达的影响。结果发现,此突变并没有改变pri-miR-15b的表达量,而使pre-miR-15b和miR-15b的表达量降低,据此推测此突变可能阻碍了pri-miR-15b到pre-miR-15b的生物学加工过程。经典的pri-miRNA二级结构是一种“茎环结构”,其5′端和3′端各包含1条RNA单链,还包含1个碱基互补配对的双链RNA茎结构(33~35 bp)和终端的1个环结构[32](图6)。动物体内pri-miRNA到pre-miRNA的过程主要依靠“microprocessor”的剪切实现的,“microprocessor”由Drosha及其辅酶DGCR8构成[32-33]。Drosha可以帮助“microprocessor”识别pri-miRNA经典的茎环结构,并像“分子尺”一样从单链RNA与双链RNA的交汇点向双链RNA方向量取11 bp进行剪切,Drosha还可以识别pri-miRNA 5′端和3′端RNA单链上的一些特异碱基序列(UG)来提高剪切的精确性,所以Drosha对于pri-miRNA的识别和精确剪切至关重要[32-33]。DGCR8具有稳定和激活Drosha的作用,DGCR8还可与pri-miRNA的双链RNA茎结构结合,提高“microprocessor”的剪切效率;此外DGCR8还能够识别pri-miRNA末端环结构上特异的碱基序列(UGU)提高“microprocessor”剪切的精确性[32,34]。本研究中,+58C>T没有改变pri-miR-15b的“单链RNA-双链RNA”结构,也没有影响Drosha识别的特异碱基,而是将pri-miR-15b双链茎结构上引入了1个A-U配对(没有突变时为A-C)(图2),因此推测+58C>T可能通过影响了DGCR8(而不是Drosha)与pri-miR-15b的结合,从而降低了“microprocessor”对pri-miR-15b的剪切效率,减少了pre-miR-15的生成,最终降低miR-15b的表达量。本研究还发现,+58C>T同时影响了与miR-15b同簇miR-16-1的表达,但是其具体作用机理还需进一步研究。
农业动物miRNA突变或者靶基因与miRNA结合位点的突变都可能与一些生产性状的改变相关,例如生长性能[35]、脂肪沉积[19]和肌纤维的构成[36],但目前关于此类的研究报道甚少。本研究的体外细胞试验发现,+58C>T改变了猪脂肪细胞内miR-15b与miR-16成熟体的表达量;又有研究报道,miR-15b可以通过抑制其靶基因FOXO1促进猪前体脂肪细胞的成脂分化[25],因此推测+58C>T可能会影响前体脂肪细胞的分化。通过诱导转染不同基因型miR-15b表达载体的前体脂肪细胞成脂分化,结果发现此突变减弱了miR-15b对FOXO1 mRNA的降解作用,因此导致突变组细胞内FOXO1相对表达量显著高于野生组,高水平表达的FOXO1抑制了前体脂肪细胞的分化,具体表现为成脂分化相关基因表达量降低,脂肪细胞脂滴合成减少。但是,以上研究结果只是建立在体外细胞水平,今后还需在体内水平进一步探究此突变对猪脂肪沉积相关性状的影响。此外,本研究还发现,+58C>T存在于长白和杜洛克2个外种猪种,而本土品种荣昌猪中确没有发现此突变。众所周知,长白猪和杜洛克猪属于瘦肉型品种,而荣昌猪属于脂肪型品种,此突变是否与这些品种间脂肪代谢和脂肪沉积相关性状的差异有关,值得进一步研究。
4 结 论
本研究发现了猪pre-miR-15b基因位点发生了1个+58C>T突变,体外细胞水平试验发现,此突变阻碍了pri-miR-15b到pre-miR-15b的生物学加工过程,降低了猪前体脂肪细胞miR-15b的表达量,在一定程度上抑制了猪前体脂肪细胞成脂分化和脂肪合成。
