动物肌内脂肪沉积的影响因素及其分子机制
2024-04-02韦洋洋蒋钦杨黄艳娜
李 银 韦洋洋 蒋钦杨 黄艳娜
(广西大学动物科学技术学院,南宁 530004)
按照沉积位置的不同,动物脂肪组织主要可分为4种类型:腹部、皮下、肌间和肌内脂肪组织。肌内脂肪(intramuscular fat,IMF)被定义为在肌肉内部和肌纤维之间沉积的脂肪,主要存在于肌纤维束之间和肌纤维束内的肌纤维间隙中,其来源于肌肉中的前脂肪细胞。决定IMF含量的关键因素是IMF细胞的数量和体积,IMF的增长速率取决于肌肉的生长速率[1]。脂肪的生成经历了脂肪前体的摄取-脂肪酸(fatty acids,FA)合成-细胞膜脂质合成-脂肪沉积几个过程,这些过程涉及到一系列酶、激素、营养和遗传等因素的参与和调控。
IMF含量是肉类质量评价的重要指标,对肉的各项品质性状起着关键作用。畜牧业生产的目的是提供质量高且稳定的肉类,随着社会生产力的发展和生活水平的提高,消费者对肉品质的需求和追求发生转变,美味多汁且口感良好的肉产品更受消费者的青睐。IMF含量对肉的嫩度、风味、多汁性等有积极影响[2],在保证动物的生长性能和瘦肉率的前提下,增加IMF的含量成为畜牧生产行业面临的挑战。因此,对影响IMF沉积的因素进行研究有助于更好地调控肉类质量,满足消费者对美味多汁且口感良好肉产品的需求。
1 调控IMF沉积的关键转录因子
转录因子是通过与DNA结合形成转录激活复合物或转录抑制复合物来调节基因表达的蛋白质因子,可以促进或抑制转录的发生,从而改变基因的表达水平。脂肪生成受到多种转录因子的调控,包括过氧化物酶体增殖物激活受体(peroxisome proliferator-activated receptors,PPARs)和CCAAT/增强子结合蛋白(CCAAT/enhancer binding proteins,C/EBPs),这2种转录因子的基因被认为是脂肪细胞分化的关键基因,特别是PPARγ和C/EBPα的协同作用在维持脂肪细胞基因的表达中起着重要作用。除此之外,Krüppel样转录因子(Krüppel-like transcription factors,KLF)在脂肪细胞分化、代谢及IMF沉积中也发挥着重要作用。
1.1 PPARs
PPARs是一类核受体家族蛋白质,也是调节配体激活后基因表达的转录因子,共有3个亚型:PPARα(NR1C1)、PPARβ/δ(NR1C2)和PPARγ(NR1C3),它们在脂质的沉积和动员、葡萄糖代谢、形态发生和炎症反应中起关键作用。PPARα在肝脏和棕色脂肪组织中的表达最高,诱导肝脏中FA氧化和生酮作用,并调节肝脏中葡萄糖的产生[3],PPARα主要通过影响FA转运、酯化和氧化来介导其功能;PPARβ/δ在各种组织中普遍表达,参与FA氧化,但也有调节血糖水平的作用;PPARγ主要在脂肪组织(尤其是白色脂肪组织)和免疫系统中表达,参与FA转运和脂质合成,是诱导脂肪细胞分化和脂肪代谢的重要调节因子[4]。PPARγ是一种配体激活的转录因子,其配体是FA,PPARγ的激活可以刺激C/EBPα缺陷的细胞进行脂肪生成,然而C/EBPα对于PPARγ缺陷细胞的脂肪生成并无促进作用[5],这进一步突显了PPARγ在脂肪生成调控中的关键地位。PPAR信号通路与哺乳动物的肉质显著相关,激活PPARγ可以显著促进猪IMF细胞的分化,当IMF细胞经过PPARγ激活剂处理后,IMF细胞中脂质代谢相关基因硬脂酰辅酶A去饱和酶(stearoyl-CoA desaturase,SCD)、乙酰辅酶A羧化酶1(acetyl-CoA carboxylase 1,ACC1)、脂肪酸合成酶(fatty acid synthetase,FAS)、脂肪甘油三酯脂肪酶(adipose triglycerides lipase,ATGL)、激素敏感脂酶(hormone-sensitive triglyceride lipase,HSL)的表达均上调,而腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)信号通路也被显著激活[6]。Wang等[7]的研究表明,二花脸猪背长肌中PPARγ的mRNA表达与IMF沉积呈正相关,在其他品种猪中也有同样发现[8]。通常来说,过表达PPARγ通过激活下游脂肪合成相关基因的高表达和下调抑制脂肪生成的基因,从而促进IMF沉积。
1.2 C/EBPs
C/EBPs转录因子家族的成员在促进脂肪细胞分化方面起着重要作用,该家族包含6个成员,其中3个家族成员(C/EBPα、C/EBPβ和C/EBPδ)在脂肪形成过程起着重要作用。盘道兴等[9]对不同品种猪PPARγ、C/EBPα基因表达量与IMF含量的相关性进行了分析,结果表明,PPARγ、C/EBPα基因的表达量与IMF含量呈正相关。C/EBPβ参与调控脂肪细胞特异性基因的表达,促进早期脂肪细胞分化过程,可以通过直接结合其启动子激活C/EBPα和PPARγ基因的转录[10]。C/EBPβ和C/EBPδ在脂肪细胞分化过程中迅速被诱导,并负责激活脂肪调节因子C/EBPα和PPARγ2,它们共同激活分化脂肪细胞中表达的大多数基因[11]。
1.3 KLF
KLF是一类具有转录调控功能的蛋白质,得名于它们与果蝇Krüppel基因类似的DNA结合结构域,可充当转录激活剂或抑制因子。目前,哺乳动物中已知的KLF有18种(分别命名为KLF1~18),KLF基因家族在脂质代谢中起着重要作用。对促进脂肪细胞分化的KLF基因的研究显示:KLF7的敲低会导致山羊肌内和皮下脂肪前细胞中成脂标志物的表达下降,从而抑制脂滴的积聚,并且KLF1、KLF5、KLF6、KLF8、KLF11、KLF12、KLF16、KLF17和C/EBPα及固醇调控元件结合蛋白1(sterol-regulatory element binding protein 1,SREBP1)启动子区存在KLF7转录结合位点[12];在山羊肌内前脂肪细胞中,类维生素A X受体α(retinoid X receptor α,RXRα)增强KLF8启动子的活性,通过直接结合KLF8启动子上调其表达,起到促进IMF细胞分化的作用[13];KLF8是PPARγ和C/EBPα的上游调节因子,KLF8的过表达增强了PPARγ2和C/EBPα启动子的活性[14]。对抑制脂肪细胞分化的KLF基因的研究显示:在猪IMF细胞中,KLF3基因过表达会抑制PPARγ、C/EBPα及脂肪型脂肪酸结合蛋白(adipocyte fatty-acid binding protein,A-FABP/FABP4)的表达水平,显著减少甘油三酯(triglycerides,TG)的沉积,并且KLF3被miR-32-5p靶向负调控,从而促进IMF沉积[15]。KLF4在不同物种中可能具有不同的作用。林森[16]研究指出,在山羊的肌内前体脂肪细胞分化的早期阶段,KLF4具有抑制作用。杜宇等[17]研究表明,miR-106b-5p通过靶向调控KLF4抑制山羊IMF细胞的分化。然而,在小鼠3T3-L1细胞中,KLF4与早期生长应答因子2(early growth response 2,EGR2/Krox20)结合起来,通过激活C/EBPβ来促进脂肪生成,并且C/EBPβ通过反馈抑制机制抑制KLF4的表达[18]。研究还发现,山羊IMF细胞分化受到KLF11的负调控作用,可能是通过抑制PPARγ和C/EBPβ基因的表达来实现的[19]。山羊IMF细胞中干扰或过表达KLF12可能会促进或抑制脂滴的积聚,通过上调或下调脂蛋白脂酶(lipoprtein lipase,LPL)和C/EBPα的表达来实现。此外,KLF12的干扰或过表达会导致KLF8和KLF11的表达水平分别被抑制或上调[20]。另外,山羊中的KLF16可能通过与KLF8的拮抗作用来抑制分化标志基因PPARγ、PPARα和C/EBPβ的表达,从而阻止肌内前体脂肪细胞的分化[21]。由此可见,大多数KLF基因与PPARs、C/EBPs存在着密切的相互作用。此外,在不同动物中,KLF可能发挥着相反的作用,如在牛的脂肪沉积过程中,KLF4、KLF5、KLF6、KLF8、KLF9、KLF10、KLF11、KLF12、KLF13、KLF14和KLF15发挥正面作用,KLF2、KLF3和KLF7发挥负面作用[22]。与脂质生成有关的KLF亚型见图1。
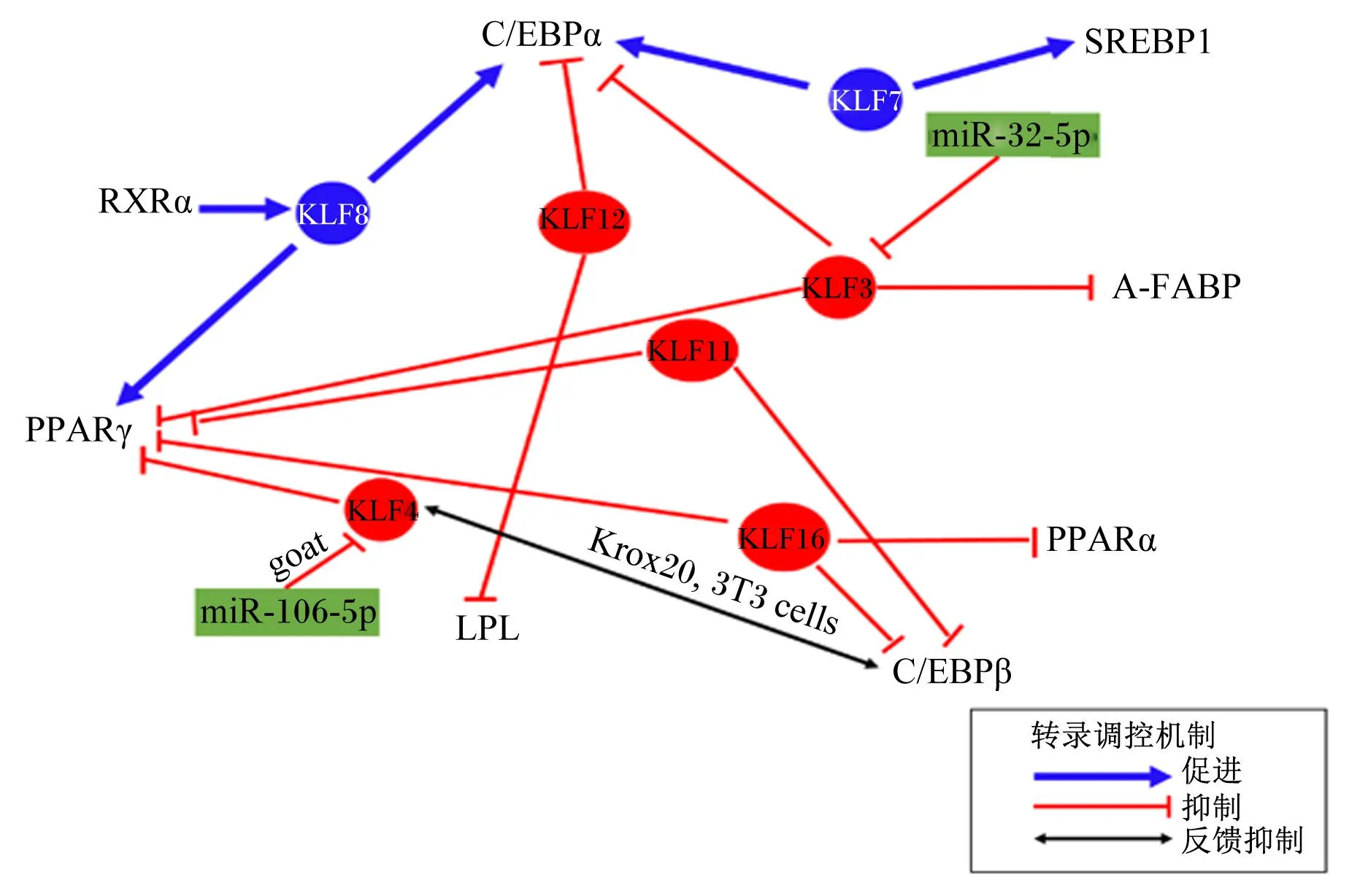
KLF7:Krüppel样转录因子7 Krüppel-like transcription factor 7;KLF8:Krüppel样转录因子8 Krüppel-like transcription factor 8;KLF3:Krüppel样转录因子3 Krüppel-like transcription factor 3;KLF4:Krüppel样转录因子4 Krüppel-like transcription factor 4;KLF11:Krüppel样转录因子11 Krüppel-like transcription factor 11;KLF12:Krüppel样转录因子12 Krüppel-like transcription factor 12;KLF16:Krüppel样转录因子16 Krüppel-like transcription factor 16;C/EBPα:CCAAT/增强子结合蛋白α CCAAT/enhancer binding protein α;C/EBPβ:CCAAT/增强子结合蛋白β CCAAT/enhancer binding protein β;PPARα:过氧化物酶体增殖物激活受体α peroxisome proliferator-activated receptor α;PPARβ:过氧化物酶体增殖物激活受体β peroxisome proliferator-activated receptor β;RXRα:类维生素A X受体α retinoid X receptor α;SREBP1:固醇调控元件结合蛋白1 sterol-regulatory element binding protein 1;A-FABP:脂肪型脂肪酸结合蛋白 adipocyte fatty-acid binding protein;LPL:脂蛋白脂酶lipoprtein lipase;goat:山羊。
2 调控IMF沉积的非编码RNA
传统的生物基因表达调控主要以DNA为模板,通过转录生成mRNA分子,再通过翻译将mRNA翻译成蛋白质来实现,这被称为中心法则。除了编码蛋白质的mRNA之外,还存在着许多非编码RNA,非编码RNA是一类不编码蛋白质的RNA分子,包括长链非编码RNA(lncRNA)、微小RNA(miRNA)、环状RNA(circRNA)等。这些非编码RNA可以通过各种不同的方式,如转录调控、后转录修饰、核内转运、蛋白质结构调整等,对基因表达进行调控,从而影响生物学过程,具有重要意义。
2.1 lncRNA
lncRNA是一种长度超过200个核苷酸的非编码RNA,不具备蛋白质编码能力。研究发现,lncRNA在调节脂肪生成和脂质积累过程中扮演重要角色,其中一种机制是充当miRNA海绵,从而影响脂肪代谢。lncRNA被发现可以通过与miRNA结合降低miRNA的活性,减少miRNA对其靶标基因的抑制作用,这种机制被称为lncRNA充当miRNA海绵。除此之外,越来越多的证据表明,lncRNA可以通过竞争性内源性RNA(ceRNA)的方式调控脂肪沉积过程。
例如,Zhang等[23]发现,肌内脂肪相关lncRNA(IMFNCR)促进IMF细胞分化,深入分析表明,IMFNCR是miR-128-3p和miR-27b-3p的分子海绵,PPARγ是miR-128-3p和miR-27b-3p的直接靶标,IMFNCR作为ceRNA来吸附miR-128-3p和miR-27b-3p,导致PPARγ表达增强,从而促进鸡IMF细胞分化。牛IMF生成相关lncRNA(BIANCR)的敲低抑制了细胞增殖并促进了肌内前脂肪细胞的凋亡,此外,BIANCR敲低通过调节细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)1/2信号通路抑制IMF生成[24]。Wang等[25]研究发现,一种名为IMFlnc1的lncRNA通过海绵miR-199a-5p上调小窝蛋白-1(caveolin-1,CAV-1)的表达促进猪IMF细胞脂肪生成。另外,Yi等[26]发现,一种名为LncIMF2的lncRNA能促进猪肌内前脂肪细胞的增殖与分化,同时LncIMF2也作为miR-217的分子海绵,影响miR-217靶基因的表达。Jiang等[27]证明,miR-381a-3p通过抑制靶基因心脏型脂肪酸结合蛋白(heart fatty acid binding protein,H-FABP/FABP3)的表达来抑制猪IMF脂滴的形成和沉积,而lncRNA4789在ceRNA调控机制中解除了这种抑制作用,而且还证明了ceRNA调控机制主要是通过PPAR信号通路实现的。Sun等[28]使用lncRNA高通量测序等方法,鉴定出与脂肪合成密切相关的lnc_000414,发现该lncRNA靶向PPARγ、KLF9、信号转导和转录活化蛋白2(signal transducer and activator of transcription factor 2,STAT2)、脂联素(adiponectin,ADP)和Smad同源物4(Smad homolog 4,SMAD4),并且通过调节细胞周期相关因子的表达抑制猪IMF细胞的增殖。进一步地,Sun等[29]又通过对脂肪型八眉猪和瘦型约克郡猪IMF细胞的RNA序列进行分析,发现了一种新的lncRNA(lncIMF4),敲低lncIMF4通过减弱自噬促进猪IMF细胞脂肪生成。此外,Wang等[30]发现了一种名为IMF相关lncRNA(IRLnc)的新型功能性非编码RNA,它通过调节转录因子核受体亚家族4组A成员3(nuclear receptor subfamily 4 group A member 3,NR4A3/NOR1)基因的表达来影响猪IMF的分解,因为IRLnc沉默能够显著降低NR4A3的蛋白表达,而NR4A3通过降低胰岛素敏感性调节儿茶酚胺代谢从而减少IMF分解。此外,lncRNA还参与调控主要的脂肪生成转录因子,如PPARγ和C/EBPα,从而影响脂肪生成的过程[31]。不同lncRNA对动物IMF沉积的作用见表1。

表1 不同lncRNA对动物IMF沉积的作用
2.2 miRNA
miRNA是一类内源性非编码RNA,在真核生物中普遍存在,大小通常在18~24个核苷酸,它们通过转录调控的方式来影响基因表达,miRNA可以与靶基因的mRNA结合,导致mRNA降解或抑制其翻译,是脂肪细胞脂肪生成过程中重要的转录调节因子。miRNA通过与目标mRNA的3′-非翻译区(UTR)结合来调节基因表达,并与PPARγ、C/EBP转录因子直接或间接作用来调控细胞分化,在动物IMF的生成中发挥重要作用。miRNA对IMF沉积的调控作用可分为负调控和正调控2种。负调控方面,miRNA通过下调PPARγ相关基因的表达抑制IMF的沉积。不同的miRNA通过靶向负调控KLF3[32-33]、KLF12[20]、KLF13[34]、H-FABP[27]、线粒体甘油-3-磷酸酰基转移酶(mitochondrial glycerol-3-phosphate acyltransferase,GPAM)[35]、C1q/肿瘤坏死因子相关蛋白6(C1q and tumor necrosis factor related protein 6,CTRP6)[36]等基因的表达,下调C/EBPα、PPARγ、A-FABP、FAS、LPL、H-FABP、SREBP1、ATGL等基因的表达,从而抑制脂肪的沉积。正调控方面,miRNA通过上调C/EBPα和PPARγ等关键脂肪生成基因的表达来促进IMF的沉积。不同的miRNA通过靶向负调控KLF4[17]、膜联蛋白A6(annexin A6,ANXA6)[37]等基因的表达来上调PPARγ、C/EBPα、A-FABP等基因的表达,从而促进脂肪的沉积。不同miRNA对动物IMF沉积的作用见表2,可以发现,大多数miRNA对畜禽脂肪的促进或抑制作用都是通过靶向负调控其靶基因来实现的。

表2 不同miRNA对动物IMF沉积的作用
2.3 circRNA
circRNA是一种共价闭环结构,富含miRNA结合位点,因此具有ceRNA的功能。它通过与miRNA结合的互补序列抑制这些miRNA的功能,从而消除对靶基因表达的抑制,并成为增强靶基因转录的关键调节因子。大量研究表明,circRNA在哺乳动物脂肪代谢调控中起着重要作用。例如,Du等[40]研究了与山羊IMF细胞和肌内前脂肪细胞分化相关的差异circRNA,发现2种circRNA--circ_0005870和circ_0000946,在山羊肌内前脂肪细胞的早期分化中起重要作用。此外,chi_circ_0006511在山羊肌内前脂肪细胞的早期分化中也发挥着积极作用,chi_circ_0006511的过表达促进了原代山羊肌内前脂肪细胞的脂质积累,脂肪相关基因PPARγ、C/EBPα、C/EBPβ、SREBP1、LPL的mRNA表达水平显著上调,并且是通过新型miR-87/脂肪酸转位酶(CD36)轴正向调控肌内前脂肪细胞的分化[41]。另外,circPPARA是一种新发现的circRNA,它通过吸附miR-429和miR-200b来调节猪IMF的沉积,circPPARA的表达与IMF含量呈强正相关,circPPARA的过表达可显著增强猪肌内前脂肪细胞的分化,并抑制其增殖;相反,circPPARA沉默则抑制猪肌内前脂肪细胞分化并促进增殖[42]。Qi等[43]通过比较确山黑猪和大白猪中背最长肌的表达谱,鉴定出2种ceRNA调控网络,包括circSETBP1/ssc-miR-149/PIK3CD和circGUCY2C/ssc-miR-425-3p/CFL1,在调节猪IMF细胞的增殖和分化中发挥关键作用。Yousuf等[44]筛选出参与猪IMF沉积的新型候选circRNA(circRNA_23437和circRNA_08840),其中,circRNA_23437包含12个,circRNA_08840包含5个与差异表达基因相互作用的miRNA结合位点,ssc-mir-370被鉴定是这2个关键circRNA的共同miRNA结合位点。这些发现进一步强调了circRNA在调控畜禽IMF沉积过程中的重要性,并且表明了circRNA主要作为分子海绵,通过ceRNA调控网络控制IMF细胞的增殖和分化。
3 调控IMF沉积的关键信号通路
通过调节转录因子、酶的活性和与其调控的基因的相互作用,信号通路可以对基因表达产生广泛的影响,从而影响脂质代谢过程。
3.1 AMPK信号通路
AMPK是细胞和全身能量平衡的关键调节因子,磷酸化和调节许多与营养代谢有关的蛋白质,可以促进葡萄糖摄取和FA氧化。AMPK的激活是由高AMP/ATP比例引起的,并且激活后,它的主要作用是刺激细胞通过FA氧化等方式产生ATP来恢复能量储存,同时抑制能量消耗途径,如脂肪生成、TG合成和糖异生,激活的AMPK通过磷酸化和抑制FA合成的限速酶乙酰辅酶A羧化酶(acetyl-CoA carboxylase,ACC)来进一步抑制脂肪生成,通过调节ATGL和HSL的活性来影响脂肪分解[45],此外,AMPK可通过抑制在脂质代谢稳态中起重要作用的CD36来抑制FA氧化[46]。据报道,AMPK在脂肪细胞中有抗脂解的作用,激活AMPK可抑制前脂肪细胞的分化,并且通过降低C/EBPβ的表达来进一步抑制PPARγ、C/EBPα和晚期脂肪生成标志物如FAS、A-FABP和SREBP-1c的表达,从而抑制脂肪生成[47]。研究表明,AMPK可能是促进肉牛大理石花纹生成的分子靶标,AMPK活性与肉牛背长肌IMF含量呈负相关[48]。胎儿阶段是骨骼肌发育和肌内前脂肪细胞形成的关键时期,而AMPK在该阶段的脂肪生成中发挥着关键作用。研究发现,在胎羊肌肉和3T3-L1细胞中,激活AMPK能够显著抑制PPARγ的表达,相反,抑制AMPK会增强PPARγ的表达,这表明AMPK的活性与胎羊肌肉和3T3-L1细胞中的脂肪生成呈负相关[49]。此外,多个IMF相关基因在PPAR和AMPK信号通路中显著富集,表明AMPK/PPAR信号通路与脂质代谢紧密关联,对调节猪IMF含量起着至关重要的作用[50]。热应激会导致猪肌内前体脂肪细胞的脂肪生成受到抑制,在表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)干预后能够促进脂肪生成,研究发现EGCG通过介导AMPK-沉默调节蛋白1(sirtuin 1,SIRT1)-PPARγ辅激活因子-1α(PPARγ coactivator-1α,PGC-1α)号通路来改善细胞的抗热应激能力,从而调节脂肪沉积和脂肪代谢,AMPK被抑制后,SIRT1、PGC-1α、ATGL、HSL和LPL的mRNA表达水平显著下调,PPARγ、脂肪酸结合蛋白2(fatty acid-binding protein 2,FABP2)、CEBPα和FAS的mRNA表达水平显著上调[51]。
3.2 Wnt/β-连环蛋白(β-catenin)信号通路
Wnt信号通路是一种高度保守且广泛存在于多细胞生物中的信号传导路径,起着重要的发育和生理功能调控作用。在激活的Wnt信号通路中,核心转录因子β-catenin在细胞质中积累并转移到细胞核,与转录因子相互作用,激活下游基因的转录。Wnt信号被认为是调节脂肪生成的主要因子,Wnt信号被视为一种分子开关,在被激活时通过抑制PPARγ和C/EBPα的表达来抑制脂肪生成[52]。研究表明,Wnt/β-catenin信号通路与牛背最长肌IMF含量有关,Wnt信号阻断诱导脂肪生成PPARγ和C/EBPα基因,从而抑制脂肪生成,β-catenin的下调促进PPARγ的表达,从而促进骨髓间充质干细胞(BMSCs)的成脂分化[53]。一项关于公牛和去势牛的研究发现,Wnt/β-catenin信号通路在牛的IMF沉积中发挥作用,分泌型卷曲相关蛋白4(secreted frizzled-related protein 4,SFRP4)具有抑制Wnt信号传导的功能,去势后,SFRP4和成脂基因表达上调,Wnt/β-catenin信号通路基因被抑制,导致背最长肌中IMF沉积增加[54]。除了通过规范通路,Wnt家族成员还可以通过激活非规范通路来发挥作用,非规范Wnt途径与规范途径相反,通过拮抗Wnt/β-catenin信号通路来促进脂肪生成[55]。
3.3 磷脂酰肌醇3-激酶(phosphoinositide 3-kinase,PI3K)/蛋白激酶(protein kinase B,Akt)信号通路
PI3K/Akt信号通路是一条关键的细胞信号转导通路,对于细胞增殖、存活、代谢和生长等多个生物学过程起着重要的调控作用。该信号通路是由PI3K和Akt组成的。PI3K是一种进化上保守的信号转导酶家族,各种刺激能够激活PI3K,导致其脂质产物在细胞膜中的瞬时积累。此外,PI3K具有2种主要活性,即丝氨酸/苏氨酸(Ser/Thr)激酶活性和磷脂酰肌醇激酶活性。Akt是一种Ser/Thr激酶,Akt在PI3K下游被激活,从而实现脂质的合成。激活的Akt能够诱导SREBP-1和SREBP-2蛋白的合成,以及关键脂质生物合成调控酶FAS的表达[56]。研究表明,过表达孤儿G蛋白偶联受体39(G protein-coupled receptor 39,GPR39)可促进磷酸化Akt(pAkt)蛋白表达,GPR39通过促进Akt磷酸化激活了PI3K/Akt信号通路,激活的PI3K/Akt信号通路可以增强猪肌内前脂肪细胞的增殖和分化[57]。在骨骼肌生长和IMF沉积中,PI3K/Akt信号通路在介导胰岛素样生长因子1受体(insulin-like growth factor 1 receptor,IGF1R)方面发挥着重要作用,miRNA可以通过靶向信号转导通路调节组织发育和功能,如miR-100靶向IGF1R的3′-非翻译区抑制IGF1R,从而介导下游的反应[58]。
4 调控IMF沉积的关键代谢酶和蛋白
通常情况下,酶的数量变化与基因的转录水平之间存在一定的相关性,酶是由基因编码的蛋白质分子,具有催化特定化学反应的功能。基因转录是指基因的DNA序列被转录成为RNA分子的过程,而酶的数量则是指这些RNA分子被翻译成蛋白质的数量。因此,基因转录水平的增加(表达增加)或减少通常会导致相应酶的数量发生变化,从而影响IMF沉积过程。不过,除此之外,转录后调控也可能在调节基因的酶合成和活性中起到关键作用。
4.1 SCD和FAS
SCD在调节脂质沉积中起着重要作用,它能催化饱和脂肪酸(saturated fatty acids,SFA)转化为单不饱和脂肪酸(monounsaturated fatty acids,MUFA),其编码基因是调节脂质沉积的关键基因。研究发现,SCD的表达与SCD蛋白水平呈正相关,SCD蛋白水平较高的猪IMF含量更高,表明转录和翻译水平之间存在一种保守的趋势[59]。上调SCD的表达会增加IMF的含量,Smith等[60]的研究发现,SCD的表达与大理石花纹脂肪细胞分化密切相关,而谷物饲料会增加SCD的表达,使得细胞内MUFA(尤其是油酸)水平提高,从而脂肪细胞分化增加。在离体条件下,SCD-1的表达水平在IMF细胞中特异性高于皮下脂肪前体细胞,这一发现表明,SCD-1可能是影响肉品质的重要候选基因之一[61]。另外,研究还发现,在减少蛋白质饮食的影响下,IMF组织中的FA含量增加与SCD表达的组织特异性激活有关,减少蛋白质饮食显著增加了肌肉中SCD蛋白的表达和活性,但在皮下脂肪组织中并没有观察到这种变化[62]。这些结果表明SCD-1在IMF细胞中的特异性高表达可能与肉品质有关,并且减少蛋白质摄入可能通过调节SCD的活性来影响IMF含量。然而,需要进一步研究来深入了解这一过程的机制和潜在的生理影响。FAS是脂肪合成过程中的关键酶,它负责将乙酰辅酶A与丙酰辅酶A逐渐连接并进行反复的加成和减成反应,最终合成长链FA。FAS是调节长链FA从头生物合成的关键酶,其表达水平与脂肪组织积累和FA的组成密切相关。魏伍川等[63]发现,FAS的表达与鸡肉脂肪性状紧密相关,在很大程度上决定鸡肉的风味、嫩度及多汁性。Jeong等[64]通过相关性分析发现,FAS的表达与牛IMF含量呈正相关。FAS在湖羊背最长肌中的表达有助于IMF沉积[65]。刘作华等[66]发现,FAS和HSL的mRNA比值与IMF含量呈显著正相关,表明FAS和HSL基因在IMF沉积中共同发挥作用,与陈杰等[67]的研究结论一致。然而,在哈萨克羊和新疆细毛羊这2个羊品种中得到的结论相反,在哈萨克羊肌肉中,FAS和HSL的mRNA比值与IMF含量呈显著负相关,而在新疆细毛羊肌肉中FAS和HSL的表达与IMF含量之间没有明显的相关性[68],这可能与不同物种之间IMF积累模式的差异有关。
4.2 ATGL、HSL和LPL
ATGL、HSL和LPL是脂解过程中最重要的关键酶,负责将TG水解为甘油和游离脂肪酸(free fatty acids,FFAs),因此ATGL和HSL、LPL的表达水平与IMF的含量密切相关。ATGL主要定位于脂滴表面,在催化TG的裂解生成二酰基甘油和FA方面发挥作用,随后HSL将二酰基甘油水解为单酰基甘油和FA。Gong等[69]表明,ATGL的表达增加与山羊IMF沉积增加相一致。HSL是一种细胞内脂肪酶,因其活性受激素的调控而得名,是脂解反应的限速酶,能够水解广泛底物,例如TG、二酰基甘油、单酰基甘油、胆固醇酯和视黄醇等脂质底物[70],并将由脂肪组织释放出的FFAs运输到其他组织中。HSL在IMF的水解中发挥关键作用,在牛和猪中均发现HSL的活性与IMF含量呈负相关[66,71]。LPL是由脂肪细胞、骨骼肌细胞、心肌细胞和巨噬细胞等其他一些组织细胞合成与分泌的一种糖蛋白,IMF含量的增加主要是由于TG含量的增加,而LPL是水解富含TG的脂蛋白的限速酶,该酶结合并水解脂蛋白TG为甘油和FFAs,促进肌肉组织中IMF细胞和肌细胞对FA的摄取,在脂蛋白和FFAs代谢中起关键作用。LPL被认为是调节脂肪代谢的必需候选基因,PPARγ可激活LPL等脂肪细胞标志物的表达。Zappaterra等[59]通过分析FAS、SCD和LPL的mRNA及蛋白表达水平发现,它们均与IMF含量呈正相关。另有研究也表明,LPL的mRNA表达水平与鸡IMF沉积呈显著正相关[72-73]。
4.3 脂肪酸结合蛋白(fatty acid-binding proteins,FABPs)
FABPs是一类小分子质量的细胞内蛋白质,能够结合和运输FFAs,并调节其在细胞内的转运、储存和代谢,还通过调节脂质酶活性、FA的转运和诱导FA与代谢途径相关的酶的表达,参与调节脂质合成、氧化和存储等过程。A-FABP和H-FABP是IMF沉积的候选基因。A-FABP通常被认为是脂肪运输、利用和储存的候选基因,主要在脂肪细胞中表达,可以在肌肉脂肪细胞分化过程中增强TG的沉积。Chen等[74]发现,莱芜黑猪和鲁来黑猪背长肌组织中的A-FABPmRNA表达水平与IMF含量呈正相关,但莱芜黑猪A-FABPmRNA表达水平高于鲁来黑猪,并且A-FABP蛋白表达水平与脂肪细胞数量和脂质含量之间存在正相关,表明莱芜黑猪与杂交种(鲁来黑猪)相比,可以转运更多的FA进入细胞内。此外,A-FABP的多态性也与IMF显著相关,Wang等[75]通过检测A-FABP的多态性,发现在拜城油鸡的腿肌中AA基因型的IMF含量显著高于AG基因型,观察到A-FABPmRNA的表达与IMF含量之间呈明显的正相关关系。同样,在湖羊和鸭上的研究也发现A-FABP的表达能够促进IMF沉积[65,76]。H-FABP的遗传变异及其在肌肉组织中的表达与IMF和FA组成显著相关,是调节IMF沉积的候选者。研究表明,H-FABP基因可作为标记辅助选择的遗传标记,改善猪的IMF,并且H-FABP和MEF2激活基序和含有转录调控因子的SAP结构域(MASTR)的联合作用是导致IMF沉积的原因[77]。对北京黑猪的研究发现,H-FABP存在错义突变c.681A>G,该基因的不同基因型与肉色亮度(L*)值和IMF含量之间存在显著的相关性,并且H-FABP的错义突变可能通过影响FA的转运而调控IMF[78]。H-FABP在其他畜禽中也有类似作用,Lang等[79]研究发现,H-FABP影响欧拉羊发育早期的IMF含量,随着年龄增长,雄性欧拉羊IMF含量持续增加,且不同年龄间差异显著。这种趋势在雄性哈萨克绵羊身上也有体现,在第30~90天,H-FABP的表达水平与IMF含量呈高度正相关[80]。然而,Wang等[81]的研究发现,拜城油鸡胸肌和腿肌中H-FABP丰度与IMF含量之间存在显著的负相关关系,该研究还发现,和田黑鸡心脏、胸部和腿部肌肉以及三黄鸡心肌和胸肌中H-FABPmRNA表达与IMF含量也呈负相关,表明相对增加的H-FABPmRNA表达提高了脂肪代谢活性,促进了脂肪分解[82]。在如皋鸡和鹿苑鸡的研究中也观察到了类似的结果[83],这可能是不同物种引起的差异,并且脂肪在不同脂肪沉积中的分布可能受到不同机制的控制,也可能受到不同基因的控制。
5 小结与展望
综上所述,关于影响动物IMF沉积的转录因子、信号通路、关键代谢酶以及非编码RNA等的分子机制,已经取得了一系列的研究进展,这些研究为深入理解IMF沉积的机制提供了重要线索。然而,尽管已经取得了显著的进展,但由于IMF关键发育时期特异性和品种的差异,以及基因、营养、管理、环境等各因素之间的互作,IMF分化沉积调控方面仍存在一些需要进一步研究和探索的关键问题和挑战,如:了解脂肪合成途径中的关键酶和基因的调控机制,以及探究不同部位(如肌内脂肪、皮下脂肪、内脏脂肪)的脂肪沉积调控机制差异,增加有益的脂肪沉积和减少不必要的脂肪沉积;进一步研究FA合成和氧化代谢之间的交互作用,并探索调节这些代谢通路的分子机制;了解如何通过调控FA合成和氧化的平衡,增加IMF沉积;挖掘新的调控IMF沉积的关键基因和分子调控,构建更广阔和清晰的调控网络,以期为IMF沉积的调控提供更精准的方法。
