酒类产品中γ-氨基丁酸的测定及其膳食风险评估
2024-04-02刘娜唐睿艺佘城陶滔闵宇航李航
刘娜,唐睿艺,佘城,陶滔,闵宇航,李航
1(四川省食品检验研究院,四川 成都,610000)
2(国家市场监管重点实验室(白酒监管技术),四川 成都,610000)
γ-氨基丁酸是一种天然氨基酸,存在于天然的食物及酵母菌、乳酸菌等微生物的发酵过程中。在人体内主要起到抑制神经递质的作用,研究表明适量摄入γ-氨基丁酸可改善睡眠、缓解焦虑,通过影响巨噬细胞活化反应来调节机体免疫力,还可刺激脑垂体分泌生长激素来促进儿童长高[1-3]。但过量摄入会引起神经中枢的明显抑制,出现疲惫、迟钝等症状[4-5]。国家卫生部颁布的2009年第12号公告中,将γ-氨基丁酸作为“三新食品”,同时规定了食用量不得超过500 mg/d,欧洲食品安全局也规定了γ-氨基丁酸的膳食摄入量上限为550 mg/d。目前市面上出现多种富含γ-氨基丁酸的功能性食品,包含保健食品、酒类,饮料等,而国家尚未将γ-氨基丁酸作为日常监督检测的对象,因此这类产品的食用安全性存在一定的隐患。
酒是通过粮食、水果等含糖食物经过微生物发酵而成,几千年来在历史上承担着社会交际、文化传承及身体保健等角色,被国人赋予崇高的意义。目前研究趋向于通过筛选菌种、优化工艺等方式来提高产品中γ-氨基丁酸的含量[6-9]。而针对酒类产品中γ-氨基丁酸的测定方法以及膳食风险评估研究尚处于空白。因此建立典型酒类产品中γ-氨基丁酸含量的测定的通用方法,对典型的酒类产品中γ氨基丁酸的含量进行测定,并基于测得含量开展膳食暴露评估非常有必要。
目前,国内外γ-氨基丁酸的测定方法,主要有氨基酸分析仪测定[10]、比色法[11]、薄层色谱法[12]、电泳法[13]、离子色谱法[14]、液相法[15]、液相色谱串联质谱法[16]。薄层色谱法、比色法操作繁琐、灵敏度较低、易受到游离氯、色素等干扰,电泳法、高效液相色谱法则需要衍生,氨基酸分析仪测定法及离子色谱法选择性较弱,对样品和测定条件具有较高的要求。同时考虑到部分酒类产品在发酵过程中,天然产物较多,容易产生干扰,本文采用操作简单、选择性强、灵敏度高的高效液相色谱串联质谱技术建立典型酒类产品中γ-氨基丁酸的通用检测方法。对产品中γ-氨基丁酸的含量进行测定,并基于含量开展膳食暴露评估,为国家制定相关法律法规提供技术及数据支撑。
1 材料与方法
1.1 材料与试剂
γ-氨基丁酸,北京曼哈格生物科技有限公司;乙腈、乙酸铵(均为色谱纯),美国KnoWLES公司;白酒样品,四川省食品检验研究院日常抽检及企业送检;其他酒类,各大超市及网络商城。
1.2 仪器与设备
岛津30A-4000 Q TRAP超高效液相色谱-串联质谱,美国AB SCIEX公司;ME204分析天平,梅特勒公司;涡旋仪,海道尔夫。
1.3 试验条件
1.3.1 样品前处理
精密称取试样1 g(精确至0.01 g)于15 mL聚丙烯离心管中,加入适量水混匀后超声提取2 min,将全部试样转移至10 mL容量瓶中,用水定容至刻度,再根据样品中γ-氨基酸含量用水进行适当稀释,过0.22 μm水系微孔滤膜后,用高效色相色谱-串联质谱仪进行定性和定量分析。
1.3.2 标准溶液的制备
精密称取γ-氨基丁酸标准品10 mg于小烧杯中,加少量水溶解后转移至10 mL容量瓶中,并用水定容至刻度,制成质量浓度为1 mg/mL的标准储备液;再分别精密吸取一定量的标准储备液,用水稀释成质量浓度为1~200 ng/mL的标准工作液,得到γ-氨基丁酸标准工作系列。
1.3.3 色谱条件
色谱柱:Agilent Zorbax HILIC(2.1 mm×100 mm,3.5 μm);流动相:A相为5 mmol/L乙酸铵,B相为乙腈,洗脱梯度为0.00~0.50 min,90% B;0.50~4.00 min,90%~70% B;4.00~4.1 0 min,70%~50% B;4.10~5.00 min,50% B;5.00~5.10 min,50%~90% B;5.10~7.50 min,90% B;流速0.40 mL/min;柱温35 ℃;进样量2 μL。
1.3.4 质谱条件
离子源:电喷雾电离源(electron spray ionization,ESI);扫描模式:正离子扫描;检测模式:多反应监测(multiple reaction monitoring,MRM);离子源温度450 ℃;离子化电压5 500 V;喷雾气压275.8 kPa,辅助加热气压275.8 kPa。
1.4 膳食风险评估
本文参照文献的评价方法[17-18],通过计算γ-氨基丁酸的危害熵(hazard quotient,HQ)来评估其膳食暴露风险,当HQ>1时,表明γ-氨基丁酸的膳食暴露风险较大,当HQ<1时,表明其膳食暴露风险较小。当同时测定多种产品时,根据风险最大化原则,以HI来表示多种产品中γ-氨基丁酸的总风险熵,当HI>1时,表明γ-氨基丁酸的膳食暴露风险较大,当HI<1时,表明其膳食暴露风险较小。HQ和HI的计算分别如公式(1)和公式(2)所示:
(1)
(2)
式中:“理论含量”采用酒类中γ-氨基丁酸测定的平均含量;“平均膳食量”参照《中国居民饮料、乳类、茶水和酒消费状况调查报告》[19]中中国居民2013—2014年酒类消费水平,白酒、啤酒、黄酒、葡萄酒的每日平均膳食量分别按照0.085 8、0.370、0.178、0.080 0 L计算;平均体重按60 kg计算;ADI为每日允许摄入量(acceptable daily intake)。
2 结果与分析
2.1 提取条件的优化
一般理化分析中化合物的提取条件包括提取溶剂、提取方式和提取时间这3个要素。γ-氨基丁酸为小分子氨基酸,极性较强,易溶于水,因此选择水作为主体提取溶剂,向水中分别加入30%、50%、70%、100%(体积分数)的乙腈,以期能进一步去除杂质。结果表明,当样品中加入100%乙腈时,黄酒、果酒产生明显沉淀,而γ-氨基丁酸的提取率为10%,而其他浓度的乙腈提取液对样品的性状没有明显影响,γ-氨基丁酸的提取率均>95%。综合考虑成本和环境,本实验选择纯水作为样品的提取溶剂。在选择提取方式时,本实验考察了涡旋提取(3 000 r/min)和超声提取2种方式,将加入提取液的样品混匀后,涡旋和超声时间分别设置为2、5、10、20 min,结果表明涡旋和超声提取2种方式没有明显差异,提取率均大于95%,且随着提取时间的延长,提取效果并没有提高,这与样品的性状有关,酒类本身就是属于易溶于水的液体样品,因此提取方式简单且提取效率高。
2.2 质谱条件的优化
将质量浓度为100 μg/L的γ-氨基丁酸标准溶液注入质谱仪,进行正负2种离子模式的一级质谱扫描并进行对比,发现γ-氨基丁酸在负离子模式条件下响应很低,因此选择正离子模式作为检测模式。对化合物进行二级扫描时,在选择了响应最强的2个离子作为分别定量和定性离子的基础上,多筛选了一个定性离子作为辅助定性,以进一步排除干扰,防止假阳性。同时在MRM条件下优化去簇电压和碰撞能。γ-氨基丁酸优化后的质谱条件见表1。
2.3 色谱条件的优化
2.3.1 色谱柱的优化
在色谱分离系统中,色谱柱对于目标化合物的分析尤其重要,主要影响目标化合物的出峰时间、分离度、峰型等参数。本实验对比了Acclaim RSLC C18(2.1 mm×100 mm,2.2 μm)、Agilent HILIC Plus(2.1 mm×100 mm,3.5 μm)、Waters BEH Amide(2.1 mm×50 mm,1.7 μm)、Waters HSS T3(2.1 mm×100 mm,3.5 μm)4种不同类型的色谱柱,图谱见图1。由图1可知,γ-氨基丁酸在Acclaim RSLC C18和Waters HSS T3上几乎不保留,而在Agilent HILIC和Plusaters BEH Amide色谱柱上具有较好的保留且峰型较好。这是由于γ-氨基丁酸极性很强,在普通C18色谱柱上不保留,需要选择在能改善强极性物质在反相色谱系统中保留行为的亲水色谱柱,本实验选择Agilent HILIC Plus(2.1 mm×100 mm,3.5 μm)作为分析色谱柱。

图1 γ-氨基丁酸在不同色谱柱中的保留行为
2.3.2 流动相的优化
对于质谱中的ESI离子源来说,流动相很大程度决定目标化合物的离子化效率,从而影响化合物的响应。本实验先考察了反相色谱系统中甲醇和乙腈这2种常见有机洗脱剂,发现在以甲醇作为有机相洗脱剂时,γ-氨基丁酸在Agilent HILIC Plus(2.1 mm×100 mm,3.5 μm)色谱柱上的保留很弱,而在乙腈体系中保留较好,因此本实验选择乙腈作为有机相洗脱溶剂。同时本实验考察了水、甲酸水、甲酸铵、乙酸铵4种常见的ESI正模式水相洗脱剂。实验结果表明,以纯水作为水相时,γ-氨基丁酸拖尾严重且响应差,加入甲酸后峰型得到改善,而加入甲酸铵和乙酸铵,响应提高10倍以上,且其中甲酸铵效果比乙酸铵好。分别考察了2、5、10、20 mmol/L甲酸铵浓度,结果表明γ-氨基丁酸在5 mmol/L比2 mmol/L体系中的响应明显增强,而继续增大甲酸铵浓度,响应没有明显增加,考虑到盐浓度增大会增加分析系统的堵塞风险,因此本实验选择5 mmol/L甲酸铵(A)-乙腈(B)作为流动相,分析系统的洗脱梯度为:0.00~0.50 min,90% B;0.50~4.00 min,90%~50% B,4.00~4.10 min,50%~90% B,4.10~7.50 min,90% B。γ-氨基丁酸质谱离子提取图见图2。
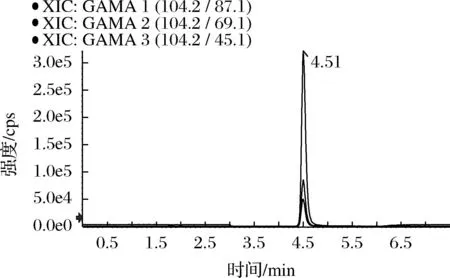
图2 γ-氨基丁酸的离子提取图
2.4 基质效应的考察
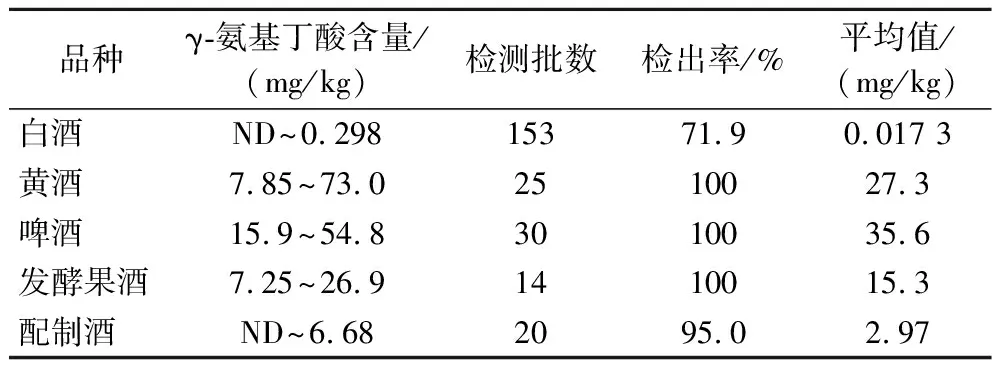
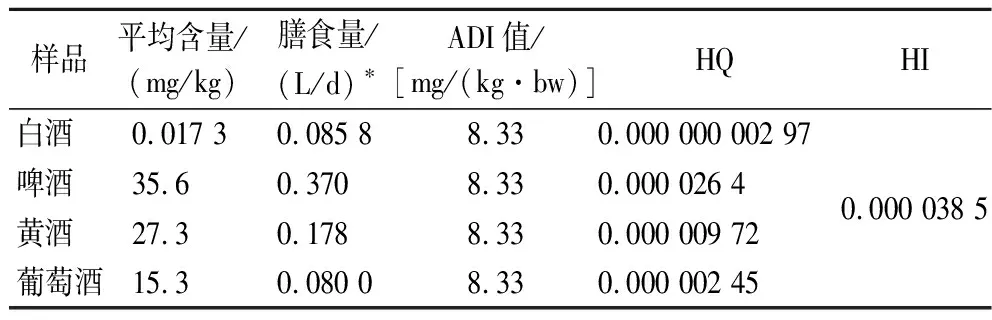
基质效应是影响检测结果准确性和重复性的重要因素,分为基质增强效应和基质抑制效应,而一般消除基质效应的方式有基质标曲法[20]、净化法[21]及稀释法[22]。由于大部分酒中含有γ-氨基丁酸且含量较高,本实验采用稀释法来考察γ-氨基丁酸的基质效应。试验参照文献方法[22-23],采用阳性样品,将其稀释至较弱基质效应浓度,以每份样品重复测定6次的平均值作为阳性样品的实际值。定义样品中γ-氨基丁酸的测定值与实际值之比为K,当K=1时,认为没有基质效应,当K<1时,说明存在基质抑制效应,当K>1时,说明存在基质增强效应,当0.8 图3 不同酒类中γ-氨基丁酸在不同稀释倍数下的K值 将γ-氨基丁酸标准工作系列溶液注入高效液相-串联质谱仪进行测定,以目标化合物定量离子的峰面积为纵坐标,质量浓度为横坐标得到线性回归方程和相关系数,以加标基质中γ-氨基丁酸色谱峰响应的3倍信噪比计算检出限,10倍信噪比计算定量限。各指标详见表2。 表2 γ-氨基丁酸线性范围、相关系数、检出限及定量限 本实验选择不含γ-氨基丁酸的白酒样品作为加标回收考察基质,分别加入3个浓度水平(1-LOQ、2-LOQ、10-LOQ)的γ-氨基丁酸标准溶液,进行加标回收试验,每个添加水平独立制备6个平行样品。计算γ-氨基丁酸的加标回收率及相对标准偏差(relative standard deviation,RSD),结果见表3,酒类中γ-氨基丁酸在3个加标水平下的回收为96.17%~98.17%,RSD为3.08%~5.11%,数据的准确性和重复性较好。 表3 γ-氨基丁酸加标回收率(n=6) 本实验选取242批了市面上常见的酒类产品,包括白酒(153批)、黄酒(25批)、发酵型果酒(14批)、啤酒(30批)、配制酒(20批),其中白酒样品和部分其他酒类来自于日常抽检和企业送检的样品,产地主要来自于四川、云南等地。其他酒类主要购于网络平台,产地来自于全国各地,其中黄酒包括绍兴黄酒、房县黄酒、客家黄酒等具有代表性的黄酒品类;啤酒主要包括国外常见的品牌以及种类,配制酒包括保健酒及配制果酒、露酒。不同样品含量范围见表4。 表4 不同酒类产品中γ-氨基丁酸含量分布 由表4可知,γ-氨基丁酸在绝大部分酒类产品中都存在,其中白酒中γ-氨基丁酸含量及检出率都最低,这可能是由于白酒经过发酵后存在蒸馏的过程,会导致γ-氨基丁酸大幅度损失。而黄酒、啤酒、发酵型果酒中γ-氨基丁酸检出率达到100%,其中不同啤酒中γ-氨基丁酸含量差异不大且都处于较高水平,平均含量达到了35.6 mg/L;而黄酒中γ-氨基丁酸含量差异较大,最高可达73 mg/L,其是一瓶标称酒龄10年的黄酒,明显高于平均水平,其中黄酒γ-氨基丁酸的含量与黄酒酒龄是否存在关联有待继续研究。20批配制酒中γ-氨基丁酸的含量值跨度较大,可能因为其既可是内源性的,也可能来自于人为添加,而目前酒类产品中γ-氨基丁酸的测定属于国家的监管盲区,需要引起关注。 根据国家卫生部颁布的2009年第12号公告的规定,γ-氨基丁酸食用量不得超过500 mg/d,以中国居民平均体重60 kg计算,估算γ-氨基丁酸的ADI为8.33 mg/(kg·bw),根据风险最大化原则,以1.3节中242份不同酒类产品中γ-氨基丁酸的含量为研究对象,按照1.3节的计算方法对酒类中γ-氨基丁酸膳食暴露进行平时评估,结果见表5。由于《中国居民饮料、乳类、茶水和酒消费状况调查报告》中并没有列出居民配制酒的消费水平,因此只计算了白酒、啤酒、黄酒、葡萄酒4种酒类的HQ值。由表5可知,γ-氨基丁酸在4种酒类中的HQ和HI值都很低,远远小于临界值1,表明酒类中γ-氨基丁酸使用安全性很高。 表5 不同酒类产品中γ-氨基丁酸HQ及HI值 本文建立了高效液相色谱-串联质谱仪测定酒类产品中γ-氨基丁酸的方法,样品经过水直接超声提取,提取试剂便宜且安全环保,相比于常见的液相色谱法及电泳法,无需衍生,操作简单;而质谱灵敏度高、选择性强,采用第三对离子辅助定性,更进一步排除干扰,相对于紫外法和薄层色谱法,具有较强的专属性和适用性,可用于各种酒类产品中γ-氨基丁酸的测定。同时通过测定市面上常见的酒类产品中γ-氨基丁酸的含量并对其进行膳食风险评估,为国家制定相关的法律法规,如何利用好γ-氨基丁酸这把双刃剑提供了数据支撑。但本文并未涉及保健食品中γ-氨基丁酸的测定,而目前市面上已出现多种声称富含γ氨基丁酸的保健产品,特别是标称能增加儿童身高的产品,其含量需要引起相关部门及学者的关注。同时,本实验只关注了部分典型酒类中γ-氨基丁酸的膳食暴露风险,日常膳食中还有许多富含γ-氨基丁酸的食物,需要进一步完善相关数据。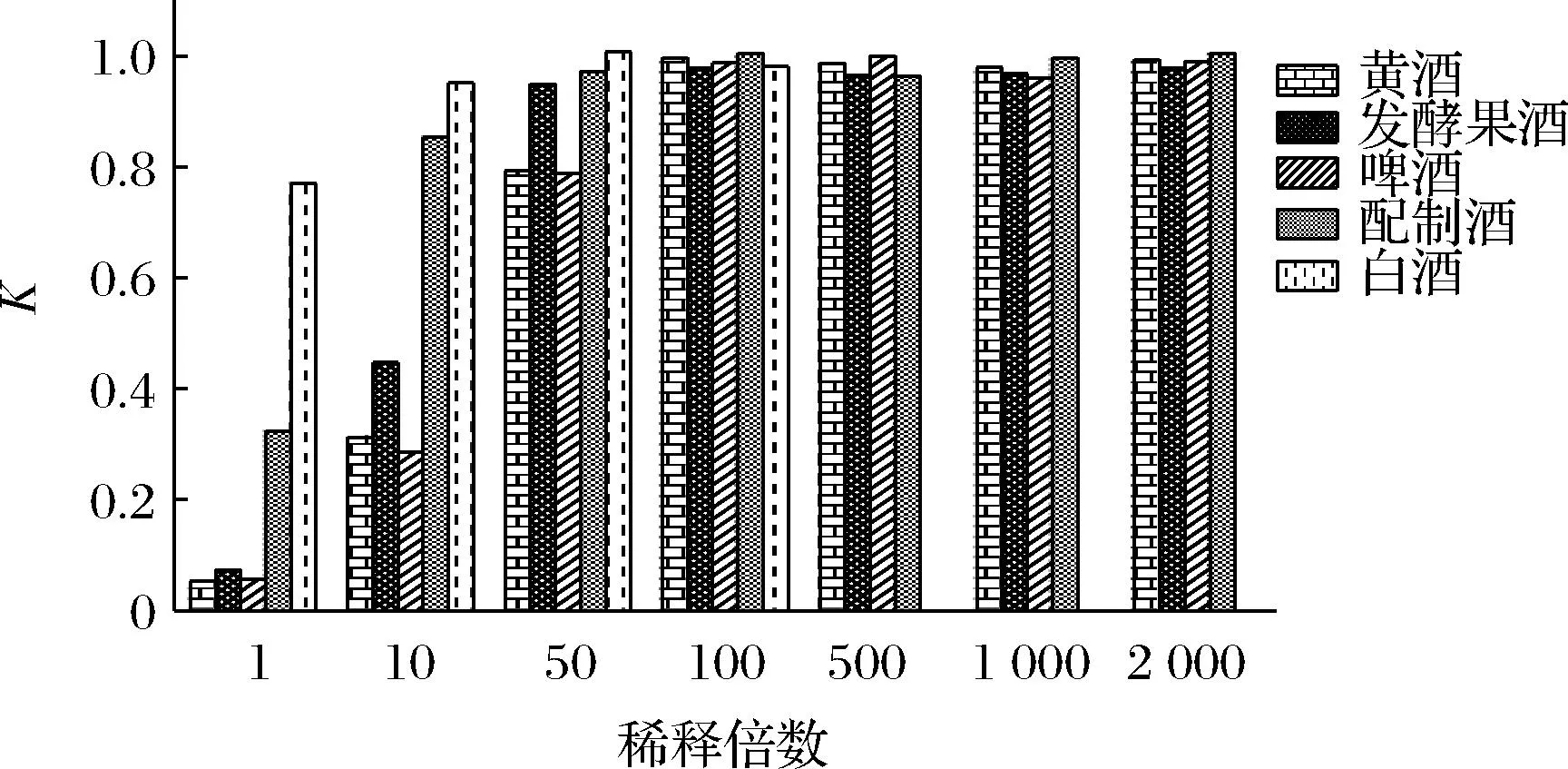
2.5 线性范围、检出限(limit of detection,LOD)和定量限(limit of quantitation,LOQ)

2.6 方法回收率

3 实际样品测定及膳食风险评估
3.1 实际样品测定
3.2 膳食风险评估
4 结论
