一氧化氮处理对杏果实采后抗坏血酸-谷胱甘肽循环及贮藏品质的影响
2024-04-02张洁仙刘雪艳单晴姜丽巍吴斌魏佳
张洁仙,刘雪艳,单晴,姜丽巍,吴斌,魏佳
1(新疆农业大学 食品科学与药学学院,新疆 乌鲁木齐,830052)
2(新疆农业科学院农产品贮藏加工所,新疆 乌鲁木齐,830091)
3(新疆农产品加工与保鲜重点实验室,新疆 乌鲁木齐,830091)
杏(PrunusarmeniacaL.)具有较高的营养价值和抗氧化能力,已成为世界上最受欢迎的水果之一[1]。通常情况下,杏果实采后具有较高的呼吸强度和乙烯释放,会导致果实采后品质质量的损失,从而限制了杏果实的运输、商业化和营养价值的维持。因此,为防止后熟、维持果实感官和营养品质,需要探究一种高效的方法以延长果实的保质期并增加水果的市场价值。
近年来,NO处理作为一种可以更高效地提高果实采后品质的策略已被广泛应用。NO具有氧化还原活性,可以通过扩散方式透过细胞膜,在细胞之间具有生物学作用。另外,NO作为抗氧化剂与活性氧(reactive oxygen species,ROS)通路密切相关,在氧化应激期间淬灭ROS并减少脂质过氧化,两者都可以调节参与植物应激反应、初级代谢,进而维持果实采后的衰老[2]。已经证明NO可以诱导甜瓜[3]、桃[4]和番茄[5]等果实中的ROS系统,这与延缓果实衰老的能力高度相关。过量的ROS与DNA、蛋白质和脂质反应以触发细胞膜的脂质过氧化,最终导致细胞死亡[6]。然而,在植物中存在完善ROS清除系统,其可调节ROS平衡并维持细胞的正常氧化还原状态。抗坏血酸-谷胱甘肽(ascorbic acid-glutathione,AsA-GSH)循环作为常见的ROS清除系统,有利于保持ROS稳态[6]。AsA-GSH循环主要包括抗坏血酸过氧化物酶(ascorbate peroxidase,APX)、单脱氢抗坏血酸还原酶(monodehydroascorbate reductase,MDHAR)、脱氢抗坏血酸还原酶(dehydroascorbate reductase,DHAR)和谷胱甘肽还原酶(glutathione reductase,GR)4种抗氧化酶,以及抗坏血酸(AsA)、脱氢抗坏血酸(dehydroascorbic acid,DHA)、还原型谷胱甘肽(GSH)和氧化型谷胱甘肽(oxidized glutathione,GSSG)。研究发现,NO处理梨果实后,提高了AsA和GSH含量,增强了APX、GR、MDHAR和DHAR的活性,延缓梨的衰老[7]。APX、GR、MDHAR、DHAR酶活性增强,保持了桃果实贮藏过程中较高的抗氧化能力[8]。以上结果表明,NO与AsA-GSH循环存在密切联系。然而,NO能否通过果皮和果肉AsA-GSH循环延缓杏果实采后的品质的下降还尚未进一步明确。
因此,本研究旨在研究NO处理对杏果实采后呼吸强度和品质参数的影响;通过测定AsA-GSH循环相关指标及关键酶活性,分析AsA-GSH循环在杏果实果皮和果肉的不同变化;阐明杏果实采后常温下贮藏品质变化与AsA-GSH循环存在的关系。
1 材料与方法
1.1 材料
吊干杏(PrunusarmeniacaL.cv ‘Diaogan’)于2021年7月8日在新疆阿克苏市四团商业果园采收,杏果实采收期为绿色成熟阶段(可溶性固形物含量≥11%),采收后运回新疆农业科学院,预冷24 h后进行处理。选择大小均匀、色泽均一,无机械损伤和病虫害的杏果实,进行后续实验。
NO标准气体(≥95%,纯度),乌鲁木齐鑫天意标准气体有限公司;磷酸氢二钠、磷酸氢二钠、乙二胺四乙酸、聚乙烯吡咯烷酮,天津市福晨化学试剂厂;三氯乙酸,天津市致远化学试剂有限公司;还原性谷胱甘肽,瑞禧生物国产/进口有限公司;以上试剂均为分析纯。
1.2 仪器与设备
GY-4果实硬度计,浙江艾德堡仪器有限公司;Check Point III O2/CO2分析仪,阿美特克(上海)有限公司;UV-2600紫外可见分光光度计,日本岛津公司;高速冷冻离心机,德国Eppendorf公司。
1.3 实验方法
1.3.1 样品处理
采用30 μL/L的NO对杏果实进行3 h的熏蒸处理,同时做CK(不熏蒸)空白对照组,每个处理3组平行试验[试验处理时温度为室温,(25±1.0) ℃]。NO处理时将杏果实置于熏蒸罐(100 cm×75 cm×75 cm)中,先抽真空,再注入氮气使罐内压力等于大气压力,然后使用气体进样针注入NO标准气体,立即拔出注射器针口,同时打开风扇,使NO气体在密封箱中均匀分布。熏蒸结束,将果实分装于盒盖上带有均匀小孔的保鲜盒中(尺寸为21 cm×15 cm×8.5 cm),每盒500 g左右杏果实,放置在常温、避光[温度为(25±1.0)℃,相对湿度为(80±5)%]条件下贮藏,定期取样测定相关指标,指标平行3次,将样品果皮果肉分开后用液氮冷冻后置于-80 ℃冰箱中,用于后期其他指标的测定。
1.3.2 指标的测定
1.3.2.1 硬度的测定
采用GY-4型果实硬度计对每个处理随机选取的6个杏果实进行测定,检测部位为果实赤道处,探头直径为3 mm,重复3次。硬度以N表示。
1.3.2.2 可溶性固形物(total soluble solid,TSS)和可滴定酸(titratable acid,TA)含量的测定
随机选取杏果实,榨汁后过滤,采用PR-PAL-1型数显糖度计测定,各处理重复3次,取其平均值,TSS含量用%表示。
TA的测定参照曹建康等[9]的方法。TA采用氢氧化钠滴定法测定,以苹果酸计(折算系数0.067),单位:%。
1.3.2.3 呼吸强度的测定
使用Check Point III O2/CO2分析仪测定密闭盒内CO2体积分数,呼吸强度以每小时每千克果实累积释放的CO2质量所表示,呼吸强度以mg/(kg·h)表示。
1.3.2.4 H2O2含量的测定
H2O2含量以μmol/g表示,按照WANG等[10]的方法进行测定,略有修改。称取冻样(2.0 g)添加到3.0 mL冷丙酮(4 ℃)中,冰浴研磨匀浆,4 ℃下以10 000×g离心15 min。取上清液1.0 mL与0.1 mL 10%(体积分数)四氯化钛-盐酸溶液和0.2 mL氢氧化铵(13.38 mol/L)混合,然后在25 ℃下反应5 min。离心混合物以获得沉淀。用冷丙酮洗涤2次后,向沉淀中加入3.0 mL 2 mol/L盐酸,在吸光度415 nm下记录。
1.3.2.5 AsA和DHA含量的测定
AsA和DHA含量根据ZHU等[11]和伊丽达娜·迪力夏提等[12]的方法,略有改动。将冷冻样品(1.0 g)在5 mL 6%(体积分数)三氯乙酸中于4 ℃研磨1 min。将匀浆在10 000×g下于4 ℃离心10 min。收集上清液以确定AsA和DHA的含量。
AsA+DHA(总抗坏血酸)含量的测定:向1.0 mL粗酶液中加入0.5 mL 60 mmol/L二硫苏糖醇-乙醇溶液,用磷酸氢二钠-氢氧化钠混合液将溶液pH调至7~8,置于室温下10 min,然后加入0.5 mL 20% 三氯乙酸,将pH调至1~2,在543 nm处测其吸光值。
AsA的测定:取1 mL上清液加入1 mL 5%三氯乙酸、1 mL乙醇摇匀,再依次加入0.5 mL 0.4%(体积分数)正磷酸-乙醇、1.0 mL 0.5%(体积分数)二苯甲酮-乙醇、0.5 mL 0.03%(体积分数)三氯化铁-乙醇。将溶液置于30 ℃下反应90 min,然后在543 nm下测定其吸光值。AsA和DHA含量表示为mmol/g。
DHA含量:总抗坏血酸含量减去AsA含量即为DHA的含量。每个样品重复测定3次。
1.3.2.6 GSH和GSSG含量的测定
根据WANG等[10]和伊丽达娜·迪力夏提等[12]的方法测定了GSH和GSSG的含量稍作修改。将1.0 g冷冻样品在2 mL 5%(体积分数)偏磷酸中研磨,然后在10 000×g,4 ℃下离心10 min。
GSH+GSSG含量测定:300 μL粗酶液加入2.5 mL反应液,其中包含500 μL反应液A[50 mmol/L七水磷酸氢二钠、20 mmol/L磷酸二氢钠、10 mmol/L乙二胺四乙酸、0.2 mmol/L二硫代二硝基苯甲酸、0.02%(体积分数)牛血清蛋白]、500 μL反应液B[1 mmol/L乙二胺四乙酸、50 mmol/L咪唑和0.02%(体积分数)牛血清白蛋白]、500 μL反应液C[5%(体积分数)磷酸氢二钠,pH 7.5]和100 μL 9 mmol/L还原型烟酰胺腺嘌呤二核苷酸磷酸,以6%(体积分数)偏磷酸(pH 2.8)代替提取液作为对照,在412 nm下测定其吸光值。
GSSG含量测定:500 μL粗酶液加入2.5 mL乙烯吡啶,25 ℃下水浴1 h,在412 nm下测其吸光度,GSSG含量表示为mol/g。
GSH含量:总谷胱甘肽含量减去GSSG含量即为GSH含量。每个样品重复测定3次。
1.3.2.7 AsA-GSH循环酶活性的提取与测定
APX、GR、DHAR和MDHAR的活性根据HUANG等[13]的方法测定。称取1.0 g果皮或果肉,加入3.0 mL预冷的50 mmol/L磷酸盐缓冲液(PBS,pH 7.8,含有2.0 mmol/L AsA、0.2 mmol/L EDTA和2.0 g/L的交联聚乙烯吡咯烷酮)。在4 ℃和10 000×g下离心20 min,并收集清液以测定APX、GR、MDHAR和DHAR活性。
混合200 μL粗酶、2.0 mL 100 mmol/L PBS(含有1.0 mmol/L EDTA,pH 7.5)、500 μL 20 mmol/L H2O2和800 μL 3.0 mmol/L EDTA,以测定APX活性。GR的反应混合物由3.0 mL 100 mmol/L PBS(pH 7.5)、0.1 mL 5.0 mmol/L GSH氧化、0.2 mL粗酶液和30 μL 3.0 mmol/L烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADPH)组成。
MDHAR反应溶液包括0.2 mL粗酶液、1.7 mL 50 mmol/L PBS(pH 7.5)、200 μL 2.0 mmol/L AsA和100 μL 4.0 mmol/L NADPH。用于DHAR的2 mL反应溶液由200 μL粗酶液、1.6 μL 0.1 mmol/L 4-羟乙基哌嗪乙磺酸-氢化钾缓冲液、100 μL 20 mmol/L谷氨酸和100 μL 8.0 mmol/L二十二碳六烯酸组成。
在290 nm和265 nm处每分钟吸光度的0.01变化分别定义为一个单位(U)。APX和DHAR激活都被描述为U/g。测定340 nm处的吸光度,并将每分钟0.01的变化定义为一个单位(U)。GR和MDHAR活性均被描述为U/g。
1.4 数据分析
试验过程完全是随机进行的。每个处理由3个重复组成,结果表示为平均值±标准误差。使用GraphPad Prism 8.0.2软件作图,SPSS 20.0和LSD测试进行统计分析。
2 结果与分析
2.1 NO对杏果实采后硬度、呼吸强度、TSS和TA含量的影响
在图1-A中,杏果实在贮藏的前1 d内硬度保持不变,对照组果实的硬度随着贮藏期延长迅速下降。然而,在整个贮藏期内,NO处理的杏果实硬度的减小速度比对照缓慢。贮藏6 d,对照组的硬度仅为NO处理的61.96%(P<0.05)。
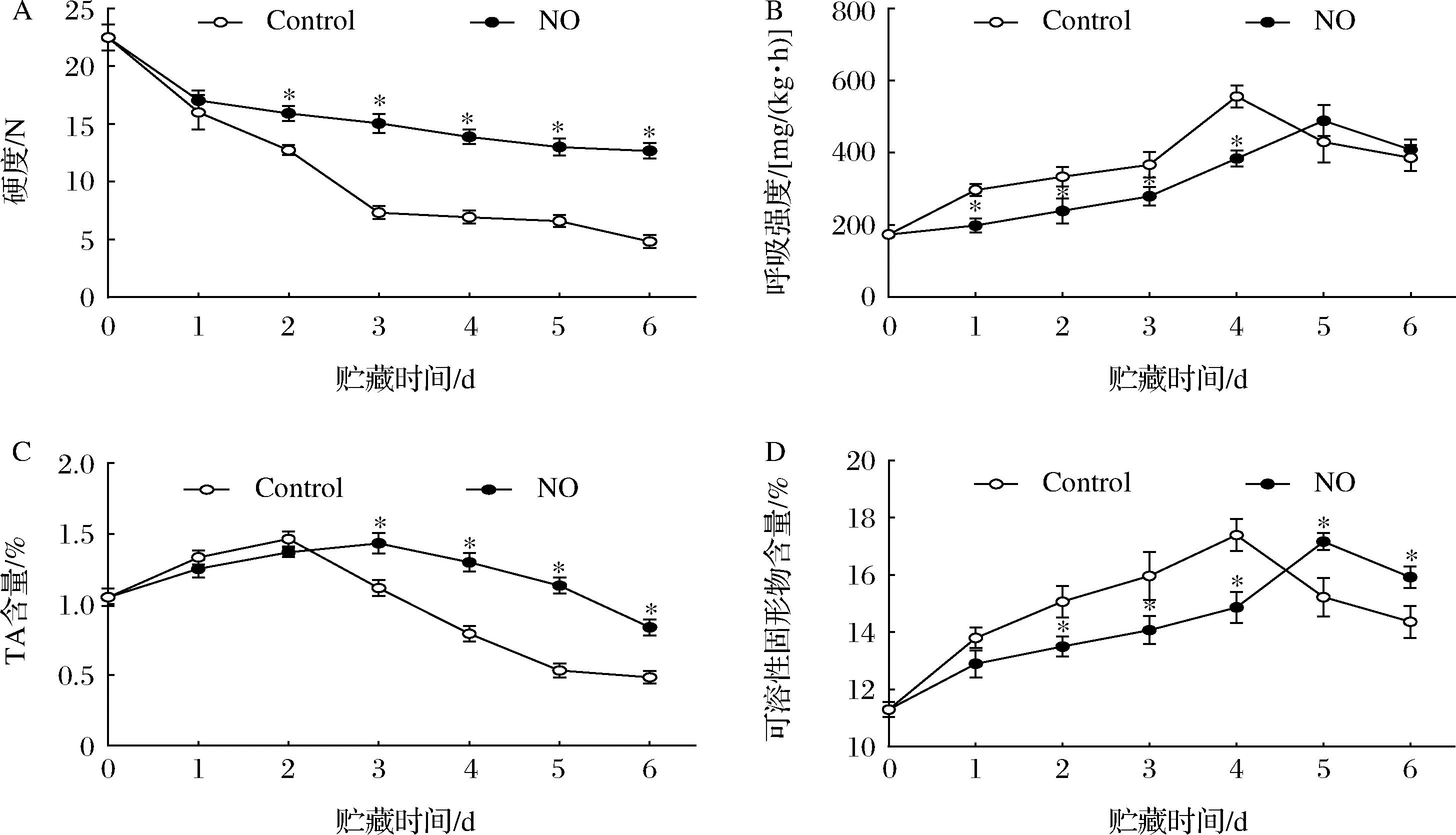
A-硬度;B-呼吸强度;C-TSS含量;D-TA含量
图1-B显示杏果实在贮藏期间6 d内呼吸强度的变化。对照果实贮藏4 d时呼吸强度出现峰值,而NO处理杏果实5 d出现最大值,NO处理显著延缓了杏果实呼吸强度峰值的出现。此后,呼吸强度随着贮藏时间的延长而急剧下降。贮藏第4天时,NO处理的杏果实呼吸强度比对照降低30.92%(P<0.05)。
在贮藏期间对照组和处理组TA含量变化均呈先上升后下降趋势(图1-C);而NO处理的杏果实在整个贮藏期内保持了比对照组更高的TA含量。在第3天和第6天时,NO处理的杏果实TA含量分别比对照高22.4%和42.1%(P<0.05)。
如图1-D所示,NO处理和对照组的杏果实TSS含量变化趋势不一致。贮藏前4 d,NO处理组TSS含量低于对照。对照组的TSS含量在第4天达到峰值,比NO处理组高了14.56%;NO处理延缓了杏果实TSS含量峰值的出现,同期比对照组高12.69%。整个贮藏期间,NO处理显著延缓了杏果实TSS含量的变化(P<0.05)。
2.2 NO处理对杏果实采后H2O2含量的影响
果皮中H2O2含量从贮藏第1天开始均存在显著差异,除第2天外(图2-A)。NO处理组显著降低H2O2含量,并在第1天和第4天达到峰值,分别比对照组H2O2含量低11.30%和30.31%。在NO处理组中,果肉H2O2的含量被显著抑制(图2-B)。第6天时,NO处理组H2O2含量比初始值低47.63%(P<0.05)。
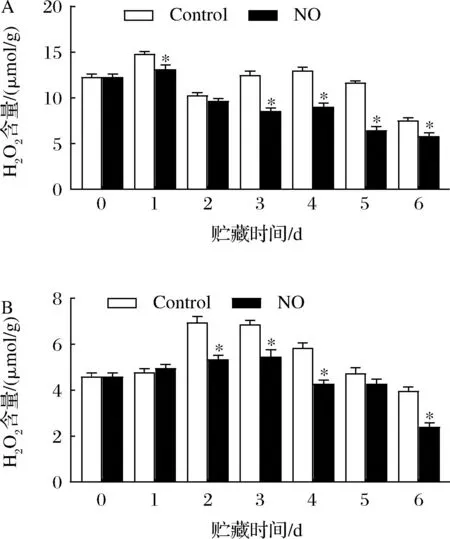
A-果皮;B-果肉
2.3 NO处理对杏果实采后AsA和DHA含量的影响
贮藏期间,杏果实果皮和果肉AsA含量变化模式一致,呈先增加随后减少趋势(图3-A、图3-B)。贮藏前期,2组果皮和果肉中AsA含量均无显著差异,在第3天时出现最大值,且对照组AsA含量比NO处理组低37.81%和41.3%。整个贮藏期间,果皮中AsA含量是果肉的3.23倍(P<0.05)。
在整个贮藏期间,果皮DHA含量显示2个峰(图3-C)。DHA含量的峰值出现在第2天和第4天,NO处理显著增加了果皮中DHA的含量(P<0.05)。在第3天和第4天,NO处理果肉中DHA含量明显增加,且是对照组的34.62%和22.65%(图3-D)。然而,除第1 天外,NO处理明显提高了杏果实不同组织中的DHA含量,NO处理组果皮果肉平均含量是对照组的1.93和1.81倍(P<0.05)。
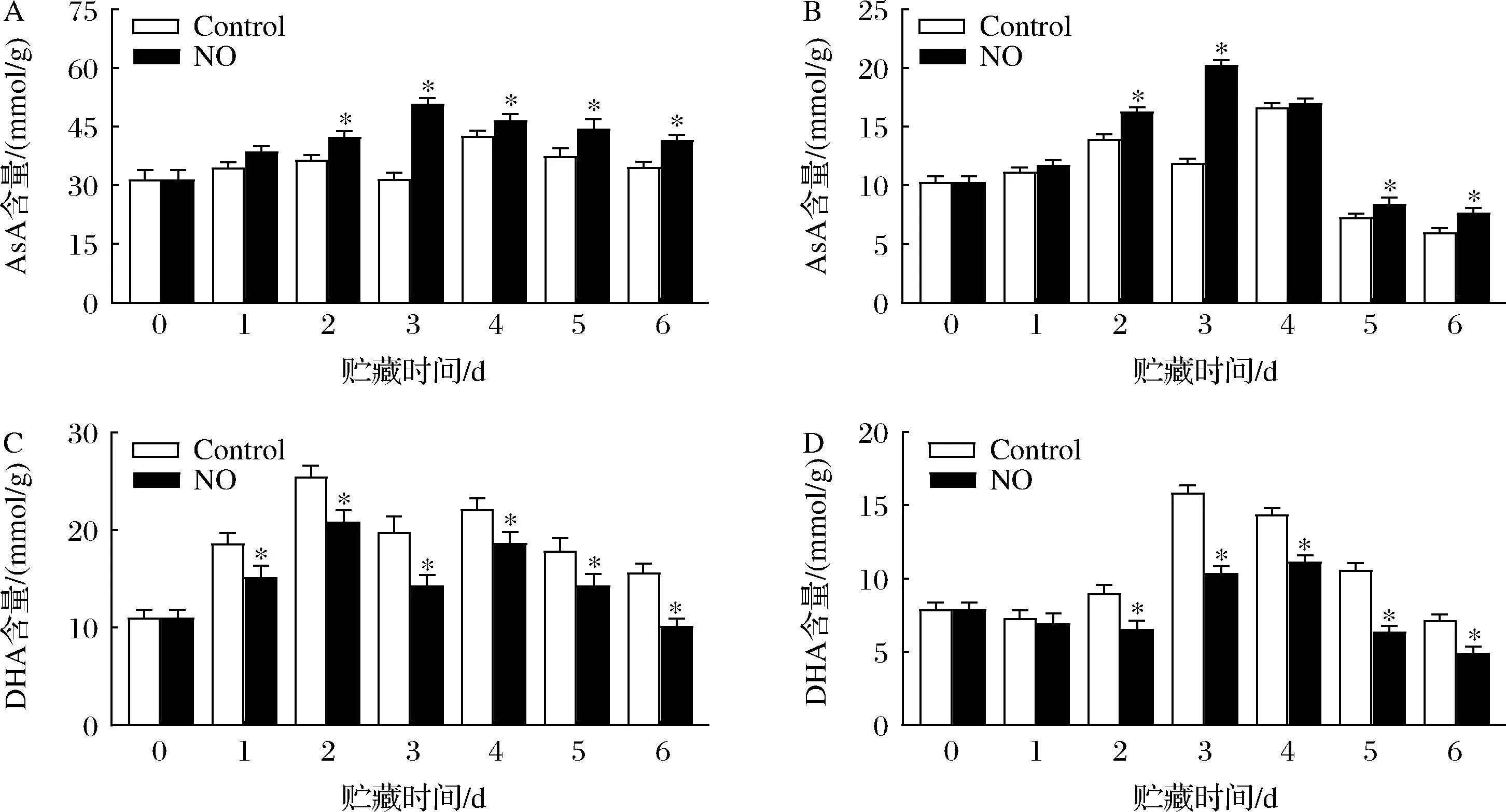
A-果皮AsA;B-果肉AsA;C-果皮DHA含量;D-果肉DHA含量
2.4 NO处理对杏果实采后GSH和GSSG含量的影响
GSH含量的变化保持增加的趋势(图4-A、图4-B)。除第1天外,NO处理显著提高了杏果实不同组织的GSH含量。在第2~5天,果皮GSH含量变化最为显著,且NO处理组GSH含量平均比对照组高1.21倍。NO处理的果肉中GSH含量在第2天出现最大值,比对照组增加了14.77%(P<0.05)。
贮藏期间,GSSG含量的变化趋势与GSH相反(图4-C、图4-D)。除第4天和第6天外,NO处理降低了果皮的GSSG含量变化。同样地,NO处理组果肉中GSSG含量在第5天显著高于对照组,比对照组高39.83%(P<0.05)。无论是对照组还是NO处理组,GSSG含量第1天均为最大值,其中果皮GSSG含量是果肉的2.05倍(P<0.05)。以上结果表明,NO处理可以保持杏果实更高的氧化还原状态。
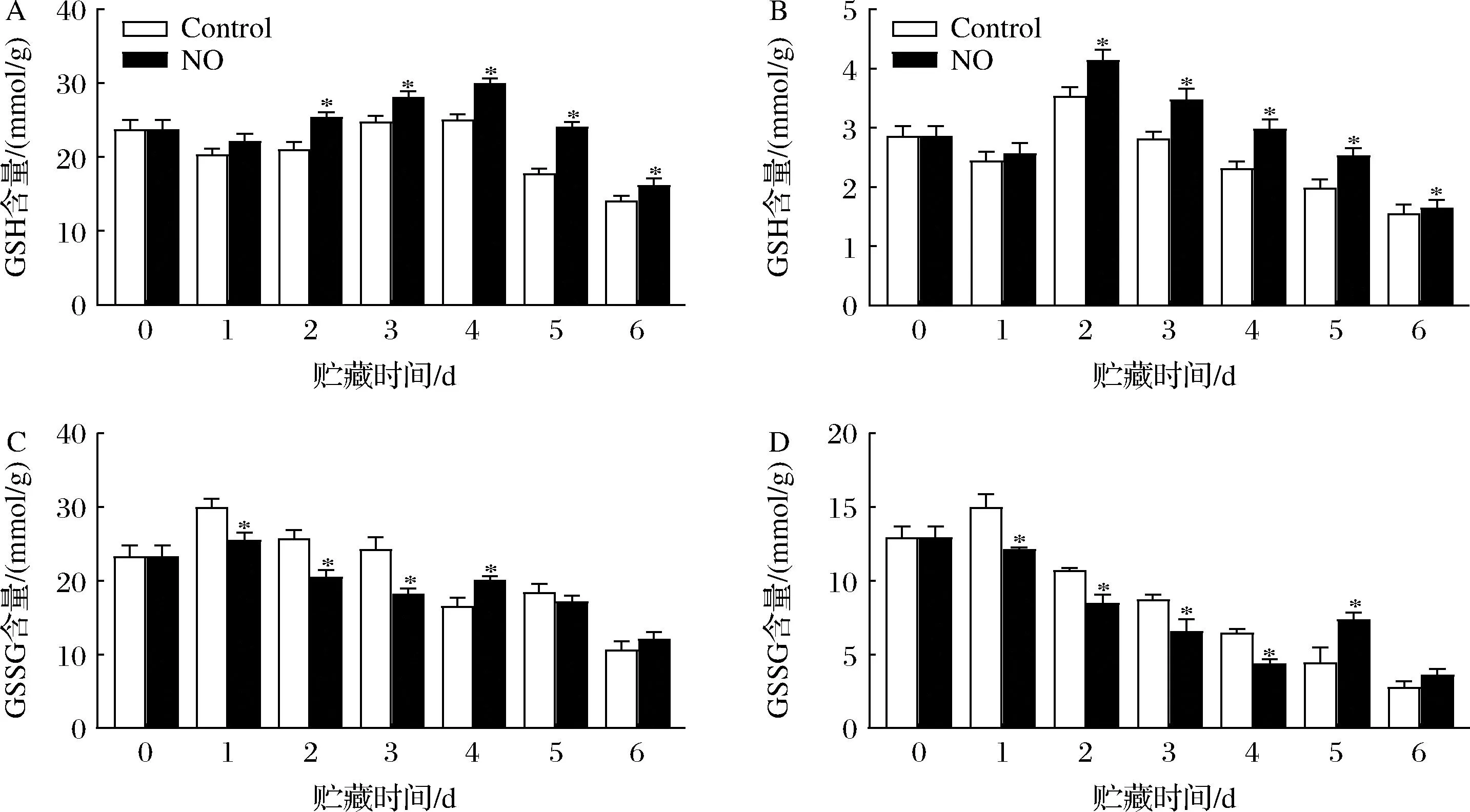
A-果皮GSH;B-果肉GSH;C-果皮GSSG含量;D-果肉GSSG含量
2.5 NO处理对杏果实采后AsA-GSH循环DHAR和APX酶活性的影响
贮藏第2~6天内,杏果实果皮DHAR活性呈稳定上升趋势,随后迅速下降(图5-A)。NO处理促进了果皮中DHAR活性的提高,在贮藏第4天和第6天时,NO处理果实的DHAR活性分别比对照组高15.79%和9.91%(P<0.05)。对照组和NO处理的果肉DHAR活性在贮藏期的前3 d内均呈上升趋势,之后下降直至贮藏结束(图5-B),但NO处理的DHAR活性在整个贮藏期内均高于对照组。贮藏6 d后,NO处理组的DHAR活性比对照组高25.77%(P<0.05)。
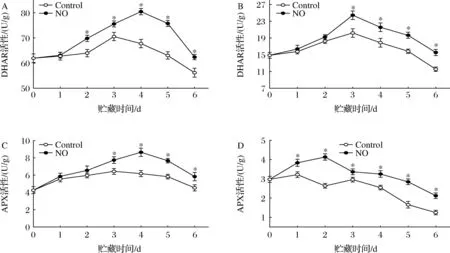
A-果皮DHAR活性;B-果肉DHAR活性;C-果皮APX酶活性;D-果肉APX酶活性
APX活性呈现先上升后下降的变化趋势(图5-C、图5-D),NO处理组维持了较高水平的APX活性。果皮中NO处理的APX活性在第4天达到峰值,是对照处理的1.45倍(P<0.05);果肉APX活性与果皮的变化相似,且NO处理组与对照组存在显著性差异,NO处理延缓了果肉中APX活性峰值的出现,与对照组相比提高了37.02%(P<0.05)。
2.6 NO处理对杏果实采后AsA-GSH循环GR和MDHAR酶活性的影响
果皮的GR活性在第2~4天增加,随后下降(图6-A)。NO处理显著提高了果皮的GR活性,并在第4天达到最大值,NO处理组比对照组高22.92%(P<0.05)。贮藏结束时,对照组果皮GR活性比NO处理组低29.51%(P<0.05);果肉中GR活性与果皮活性变化趋势一致,除第1天外,NO处理显著提高了果肉中GR的活性,且第3天达到峰值(图6-B)。
整个贮藏期间,NO处理激活了果皮MDHAR活性(图6-C)。NO处理组的果皮MDHAR活性在第2、3、5、6天与对照组相比分别增加了16.69%、14.12%、20.65%和14.50%。在果肉中,NO处理均显著促进了MDHAR活性,与对照组相比分别增加了18.56%、27.67%、26.67%、13.75%、32.99%和26.43%(图6-D)。整个贮藏期间,果皮MDHAR活性显著高于果肉(P<0.05)。
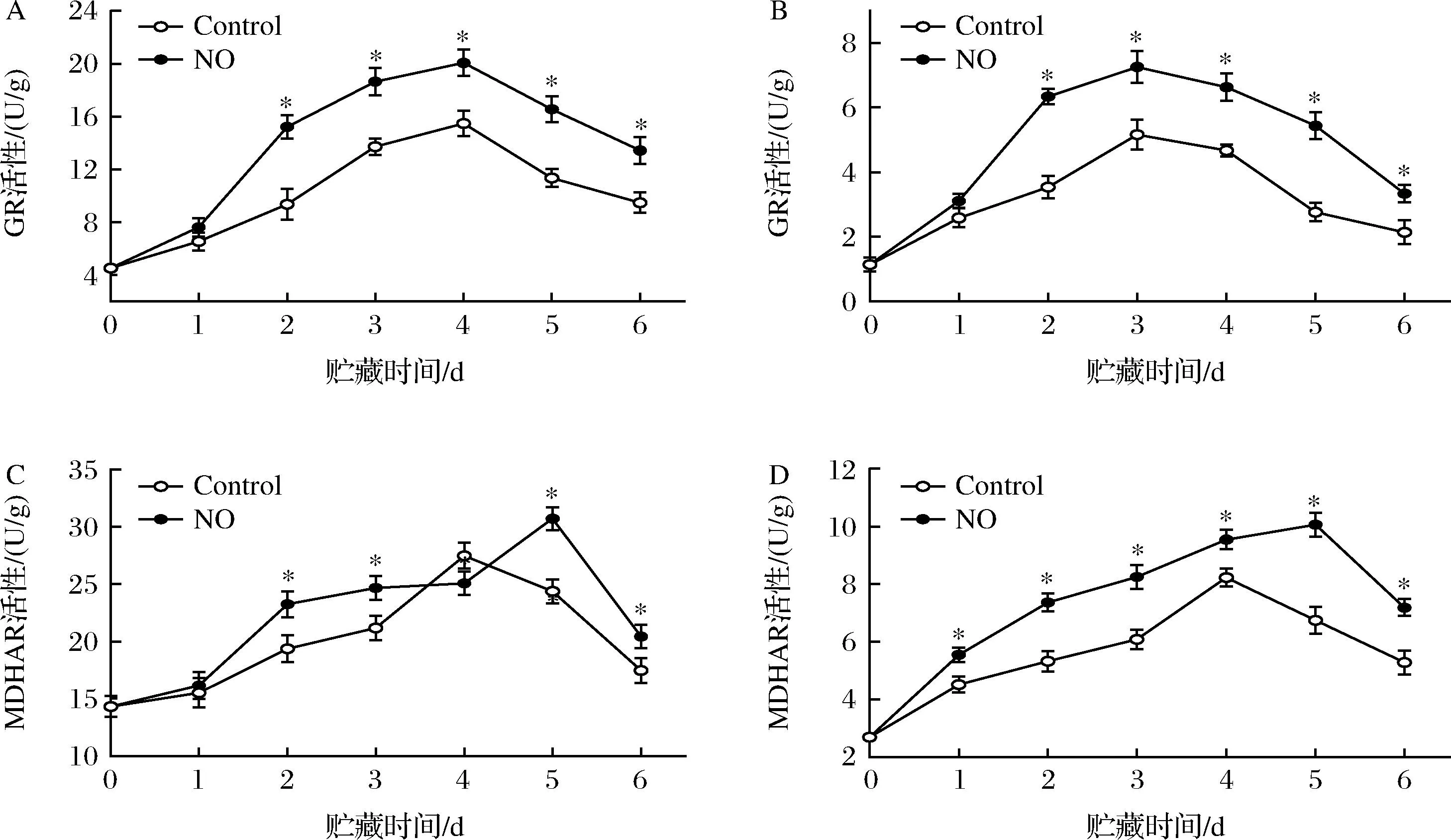
A-果皮GR活性;B-果肉GR活性;C-果皮MDHAR活性;D-果肉MDHAR活性
3 讨论
杏果实采后的成熟过程涉及一些生理反应,例如呼吸爆发、乙烯的积累和品质变化[14-15]。其中,硬度、呼吸速率以及TA、TSS含量作为衡量果实品质的重要因素,反映了贮藏期间果实采后的新鲜程度[16]。本研究发现,NO处理能显著抑制杏果实采后呼吸强度、TA和TSS含量的变化,并保持了果实的硬度,延缓贮藏期间品质的下降(图1)。近年来,外源NO在改善果实采后品质方面的研究越来越多。NO处理的桃果实在冷藏过程中TSS、TA含量均发生了变化[11]。树莓果实在NO处理下表现出TSS和TA的最小损失,以及呼吸强度的缓慢增加,保持了贮藏品质[17],表明NO在采后处理中具有潜在的应用价值。
果实衰老主要是由于过量的ROS引起的氧化损伤。植物已经发展出有效的机制来控制ROS水平,当这种平衡被破坏时,细胞内ROS水平将显著增加,导致细胞结构的不可逆氧化损伤。在此同时,植物可以通过AsA-GSH循环解毒,并在细胞氧化还原稳态中起关键作用[18-19]。本试验表明,NO处理维持了不同组织中H2O2含量的变化(图2)。对照组果皮和果肉H2O2含量在贮藏后期下降可能是因较高抗氧化酶活性而受到抑制[20]。AsA和GSH在非酶促反应中充当ROS的清除剂,是决定果实抵御采后氧化应激能力的关键标志[21]。较高水平ROS清除剂可以减少ROS的积累,维持细胞抗氧化系统的氧化还原状态。在本试验中,NO处理促进了杏果实果皮和果肉中AsA和GSH的积累,降低了DHA和GSSG的含量(图3、图4),说明NO处理可以激活果皮和果肉中的AsA-GSH循环,通过调节ROS水平,从而延缓杏果实的衰老。此外,NO的释放还可以提高抗氧化酶活性,促进AsA-GSH循环之间的转换,减少ROS积累所造成的氧化损伤[22]。先前的研究证明植物细胞中AsA-GSH循环可以通过清除过量的ROS延迟收获后衰老[5,23-24]。上述结果有力地证实了NO处理可以通过增强氧化还原稳态的转变来提高杏果实的抗氧化能力。
AsA-GSH循环的另一部分是抗氧化酶。APX、GR、DHAR和MDHAR是参与这一循环的关键酶,为促进AsA-GSH循环的再生和维持植物体内还原物质平衡发挥着至关重要的作用[10,12]。APX通过将H2O2还原成H2O,维持了细胞内自由基的代谢平衡,并与GR协同将AsA氧化为DHA。在清除ROS的过程中,DHAR将GSH氧化为GSSG,GSH被GR回收,MDHAR和DHAR可分别将MDHA和DHA还原为AsA,较高的还原电位有利于维持植物正常的细胞功能和抗氧化应激[25-26]。本研究中,NO处理杏果实果皮和果肉APX、MDHAR以及DHAR活性显著增加(图5-A、图5-B、图6-A、图6-B)。GR是AsA-GSH循环的一种潜在酶,以维持AsA-GSH循环,在ROS防御系统中发挥关键作用[6]。NO处理激活了杏果实中GR活性(图6-C、图6-D),这与桃果实的结果类似[22]。上述结果证实,AsA和GSH氧化还原状态的变化与AsA-GSH循环中关键酶活性的变化规律一致。另外,果皮中AsA-GSH循环抗氧化酶活性显著高于果肉,可能是果皮对氧化损伤的防御能力高于果肉的原因,推测主要受果实组织结构、抗氧化物质和含水量的影响。外源褪黑激素处理后增强了樱桃中AsA-GSH循环的抗氧化酶活性,维持了更好的ROS稳态,延迟了果实的衰老[10]。此外,经减压处理的桃果实表现出较高的AsA-GSH循环中关键酶活性,减轻了0 ℃贮藏果实的冷害[27]。结果表明AsA-GSH是维持杏果实采后ROS稳态和氧化还原状态的重要机制。
综上所述,30 μL/L NO较好地维持了杏果实采后的硬度以及呼吸速率、TSS、TA含量变化。NO处理通过激活了参与AsA-GSH循环的关键酶的活性,从而提高了AsA和GSH的含量,降低了DHA和GSSG的含量。以上数据表明NO处理较大程度地增强了果皮和果肉中抗氧化酶的活性,从而提高了杏果实AsA-GSH循环清除ROS的能力,维持了细胞氧化还原平衡,提升了杏果实采后的贮藏品质。此外,AsA和GSH含量的变化与APX、MDHAR、DHAR和GR活性的变化具有相似的规律,证实了参与AsA-GSH循环的酶负责AsA和GSH的再生。
