利用竹基纤维素为碳源生物转化L-乳酸的潜力研究
2024-04-02杨春柳管秀琼刘春何明雄刘林培
杨春柳,管秀琼*,刘春,何明雄,刘林培
1(四川轻化工大学 生物工程学院,四川 自贡,643000)
2(农业农村部沼气科学研究所,农业农村部可再生能源开发与利用重点实验室,生物质能技术研究中心,四川 成都,610041)
L-乳酸广泛应用于食品、医药、日化工业和其他领域[1]。由于其酸性柔和、性质稳定且酸度可调,L-乳酸常被用作食品添加剂,并且,L-乳酸还能有效抑制病原微生物的生长,防止食品变质[2]。利用L-乳酸作为前体物聚合形成的聚乳酸(polylactic acid,PLA),可生产生物降解塑料、食品绿色包装材料等,对改善日益严重的“白色污染”问题具有重大意义[3]。目前,国内外均采用微生物发酵法生产L-乳酸,但发酵基质多采用糖类、淀粉类为原料,这与“不与人争粮,不与粮争地”明显相悖,不符合可持续发展的战略要求[4]。因此,生产L-乳酸的主要瓶颈是找到一种适宜的底物发酵基质,既价格低廉又分布广泛,且不与粮食产业形成竞争。相比之下,利用农业、工业副产物资源作为生产L-乳酸的碳源,可以避免资源的浪费,并减弱废弃物燃烧带来的温室效应,例如,陈晓佩等[5]利用玉米芯生产低聚木糖废渣酶解碳源,在初始葡萄糖59.6 g/L,产L-乳酸7 g/L,糖酸转化率仅为28.9%;杨雪欣等[6]利用大豆秸秆酶水解液中的可溶性糖,添加乳酸菌发酵L-乳酸,其糖酸转化率为71.05%;WANG等[7]以芦苇制浆厂产生的芦苇锯末为原料,预处理后采用分步水解发酵工艺,在以酶解液为碳源的情况下所产生的L-乳酸含量小于5 g/L。造纸工业中,竹材因表现出较好的制浆性能而成为非木浆的主要原料[8],梁川等[9]认为竹浆纸发展空间巨大,在良好的政策背景下具有广阔的前景,但竹材在制浆备料过程中,会产生3%~5%的竹屑,通常作为燃料使用,经济价值低,也是生物质资源的浪费。竹屑废弃物中碳水化合物(纤维素、半纤维素)含量较高,且竹屑中的半纤维素可用于制备木糖[10],而利用竹屑中的纤维素作为一种新的碳源发酵产L-乳酸的研究较少。因此,本课题以竹屑为原料,利用蒸汽爆破预处理打破木质纤维素的细胞壁结构,将提取半纤维素后的竹屑采用分步糖化发酵工艺,对工艺关键参数生物转化所得L-乳酸的影响进行研究,为竹基纤维素的利用提供了高值化途径参考。
1 材料与方法
1.1 材料与试剂
竹屑,某纸业公司原料场;纤维素酶(≥700 units/g,最佳作用条件:pH 4.8、50 ℃),Sigma公司;凝结芽孢杆菌,农业农村部沼气科学研究所;3,5-二硝基水杨酸、无水葡萄糖、氢氧化钠、亚硫酸氢钠、苯酚、酒石酸钾钠均为分析纯,国药集团试剂有限公司。
1.2 仪器与设备
Agilent 1200 series高效液相色谱,安捷伦科技有限公司;THZ-98AB恒温振荡培养箱,一恒科学仪器有限公司;FE28pH计,梅特勒-托利多仪器有限公司;UV-1800紫外分光光度计,上海美谱达仪器有限公司;TESCAN VEGA3SBU扫描电子显微镜,捷克TESCAN公司;XFlash Detector 410-M能谱仪,德国布鲁克公司;MS3000E激光粒度分析仪,英国马尔文仪器有限公司。
1.3 实验方法
1.3.1 菌种活化
将在-80 ℃下保藏的凝结芽孢杆菌室温下解冻后,在超净工作台中用接种环蘸取甘油菌,划线于MRS固体培养基上,放到50 ℃恒温培养箱培养24 h;挑取MRS固体培养基上的单菌落接种于15 mL MRS液体培养基中,在50 ℃、150 r/min下培养10~12 h,为一级种子液;再吸取上述种子液10%(体积分数)接种到新鲜MRS液体培养基中,在50 ℃、150 r/min下培养12 h,得到菌悬液。
1.3.2 竹屑预处理
收集过1 mm筛孔的竹屑在烘箱温度105 ℃下烘干备用,取一定质量的竹屑废弃物调节水分至55%(质量分数)并放入密封袋中平衡水分,利用图1中的QBS-80型蒸汽爆破分析试验台[11],在爆破压力2.5 MPa、维压时间3 min条件下对竹屑进行蒸汽爆破预处理,收集爆破渣备用。
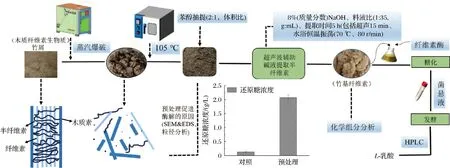
图1 竹基纤维素的制备及实验工艺流程
1.3.3 竹基纤维素的制备及实验工艺流程
将蒸汽爆破预处理后的竹屑在苯-乙醇混合液[2体积的苯及1体积的95%(体积分数)乙醇溶液]中利用索氏抽提器抽提6 h,烘干后用质量分数为8%的NaOH溶液按照料液比1∶35(g∶mL)在70 ℃、80 r/min恒温水浴振荡浸提5 h(包括超声15 min)。剩余的竹基纤维素废渣(简称“竹渣”)作为碳源用于L-乳酸的发酵试验。
1.3.4 分步水解发酵
1.3.4.1 酶解工艺的优化
固定酶解体系100 mL,称取一定质量“竹渣”于250 mL三角瓶中,添加纤维素酶(30、45、60、75、90 FPU/g),加入去离子水使总固体(total solids,TS)质量浓度为(20、50、80、110、140 g/L),再利用H2SO4或NaOH调整pH值为4.8,置于50 ℃、150 r/min摇床培养箱进行酶解反应(0、2、4、15、17…72 h)。反应结束后用高速冷冻离心机(13 500 r/min,5 min)离心酶解液,经0.22 μm滤膜过滤,适当稀释后用高效液相色谱分析可发酵糖含量。
1.3.4.2 发酵工艺的优化
“竹渣”首先按上述酶解方法进行酶解,然后将酶解液混合均匀(不过滤)用于发酵。发酵采用250 mL三角瓶,固定发酵体系150 mL,调节发酵初始pH(5.0、5.5、6.0、6.5、7.0),加入酵母粉(20 g/L)为氮源,用高压蒸汽灭菌115 ℃下灭菌15 min,待冷却后在无菌条件下接种菌株,初始接种量分别为5%、10%、15%、20%(体积分数),于50 ℃、150 r/min恒温摇床培养(0、2、4、15、17…72 h),发酵结束后在无菌条件下取样并用高速离心机(13 500 r/min,5 min)离心发酵液,经0.22 μm滤膜过滤,适当稀释后用高效液相色谱测定L-乳酸浓度。
1.3.5 纤维素酶活力的测定
纤维素酶活力的测定采用GHOSE[12]所述方法。测得滤纸酶活为193 FPU/mL。
1.3.6 预处理后样品酶水解
将蒸汽爆破预处理得到的爆破渣放入三角瓶用于酶解试验,实验条件:TS质量浓度20 g/L、酶添加量20 FPU/g、调节酶解液pH值为4.8,在50 ℃、120 r/min条件下于恒温振荡培养箱中反应24 h,过滤,测定还原糖浓度。
1.3.7 “竹渣”成分的测定
“竹渣”粉碎过筛,截取能通过0.38 mm筛孔而不能通过0.25 mm筛孔的细末备用。水分含量的测定:根据GB/T 2677.2—2011《造纸原料水分的测定》;纤维素含量的测定:参照硝酸-乙醇法[13];半纤维素含量的测定:参照范式洗涤法[14]。灰分含量测定:根据GB/T 742—2018《造纸原料、纸浆、纸和纸板 灼烧残余物(灰分)的测定(575 ℃和900 ℃)》;苯-醇抽出物测定:根据GB/T 2677.6—1994《造纸原料有机溶剂抽出物含量的测定》;酸不溶木素含量测定:根据GB/T 2677.8—1994《造纸原料酸不溶木素含量的测定》。
1.3.8 扫描电子显微镜-能谱分析
取适量蒸汽爆破预处理前后的干燥样品(0.075 mm),用离子溅射仪对竹屑纤维表面镀金制作样品。在加速电压为20 kV下对纤维的表面形态结构进行观察。利用电镜配套能谱仪进一步分析C元素分布情况。
1.3.9 粒度分布检测
取适量蒸汽爆破预处理前后的干燥样品(0.075 mm),以去离子水为分散剂,搅拌转速为13 000 r/min,测定温度为25 ℃。其d(90)表示一个样品的累次粒度分布数达到90%时所对应的粒径。
1.3.10 高效液相色谱检测
利用高效液相色谱仪测量酶解液中的可发酵糖浓度和发酵液L-乳酸浓度。色谱测定条件:HPX-87H色谱柱,柱温35 ℃,示差折光检测器检测器(differential refractive index detector,RID)40 ℃,流动相5 mmol/L H2SO4,流速0.6 mL/min,进样量20 μL,进样检测时间30 min。糖酸生物转化率[5]计算方法如公式(1)所示:
糖酸生物转化率/%=
(1)
1.4 数据处理
每个实验重复3次,结果表示为平均值±标准差,数据结果采用Origin 2021、PowerPoint 2016和 SPSS 22.0 软件进行作图及数据分析。
2 结果与分析
2.1 预处理对酶解还原糖释放量的影响
将蒸汽爆破预处理前后的竹屑原料按照1.3.6节方法进行酶解反应,结果表明,未经蒸汽爆破预处理的竹屑原料酶解还原糖释放量为(0.13±0.01) g/L,经过蒸汽爆破预处理后的竹屑原料酶解还原糖释放量为(2.07±0.10) g/L,比未经蒸汽爆破预处理的酶解还原糖释放量提高了15.9倍,两者的酶解还原糖释放量具有显著性差异。由图2-a、图2-b看出,蒸汽爆破预处理后的竹屑纤维表面由于泄压过程产生的机械剪切力而被撕裂,使纤维表面区域扩张,增大了纤维的反应表面积,利于纤维素酶酶液的渗透。从图2-c、图2-d可以看出,C元素在经过蒸汽爆破预处理之后明显分布更密集,说明预处理使更多的纤维素暴露出来,为提高酶解还原糖的释放量创造了条件。姜晓云[15]在实验过程中发现原料还原糖产量随着粒径的减小而增大,本实验也对蒸汽爆破预处理前后的竹屑进行粒径分析。如图3-a所示,蒸汽爆破预处理前后原料d(90)分别是126.209、108.999 μm;结合图3-b和图3-c可以看出蒸汽爆破预处理后的竹屑更加膨松,造成粒径d(90)差异大的原因可能是结构松散,内部空隙增加,机械强度降低[16]。以上说明蒸汽爆破预处理可以显著提高竹屑原料的酶解还原糖释放量。
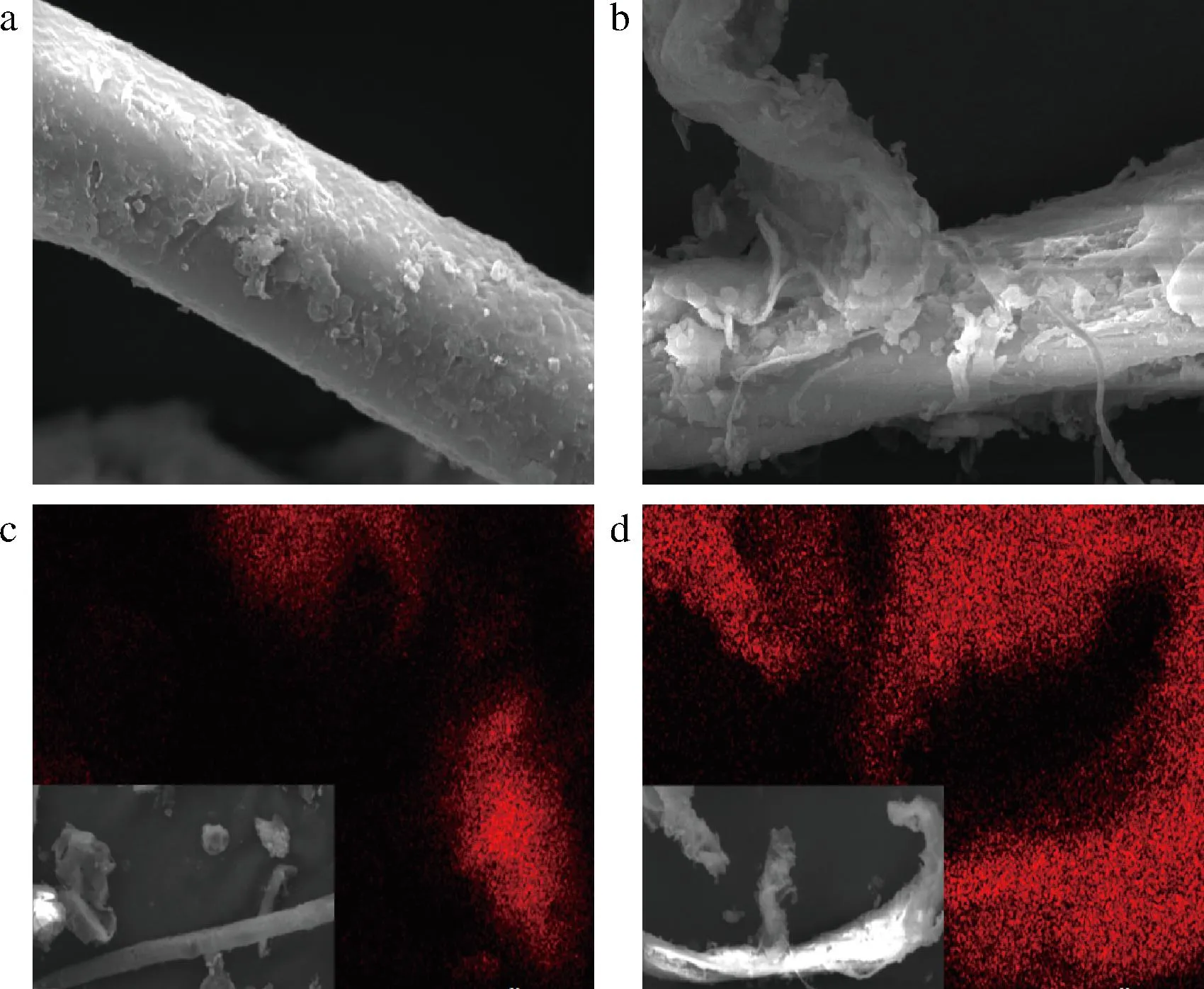
a-未经预处理竹屑原料微观形貌;b-经蒸汽爆破预处理后竹屑原料微观形貌;c-未经预处理竹屑原料C元素分布图;d-蒸汽爆破预处理后竹屑原料C元素分布图
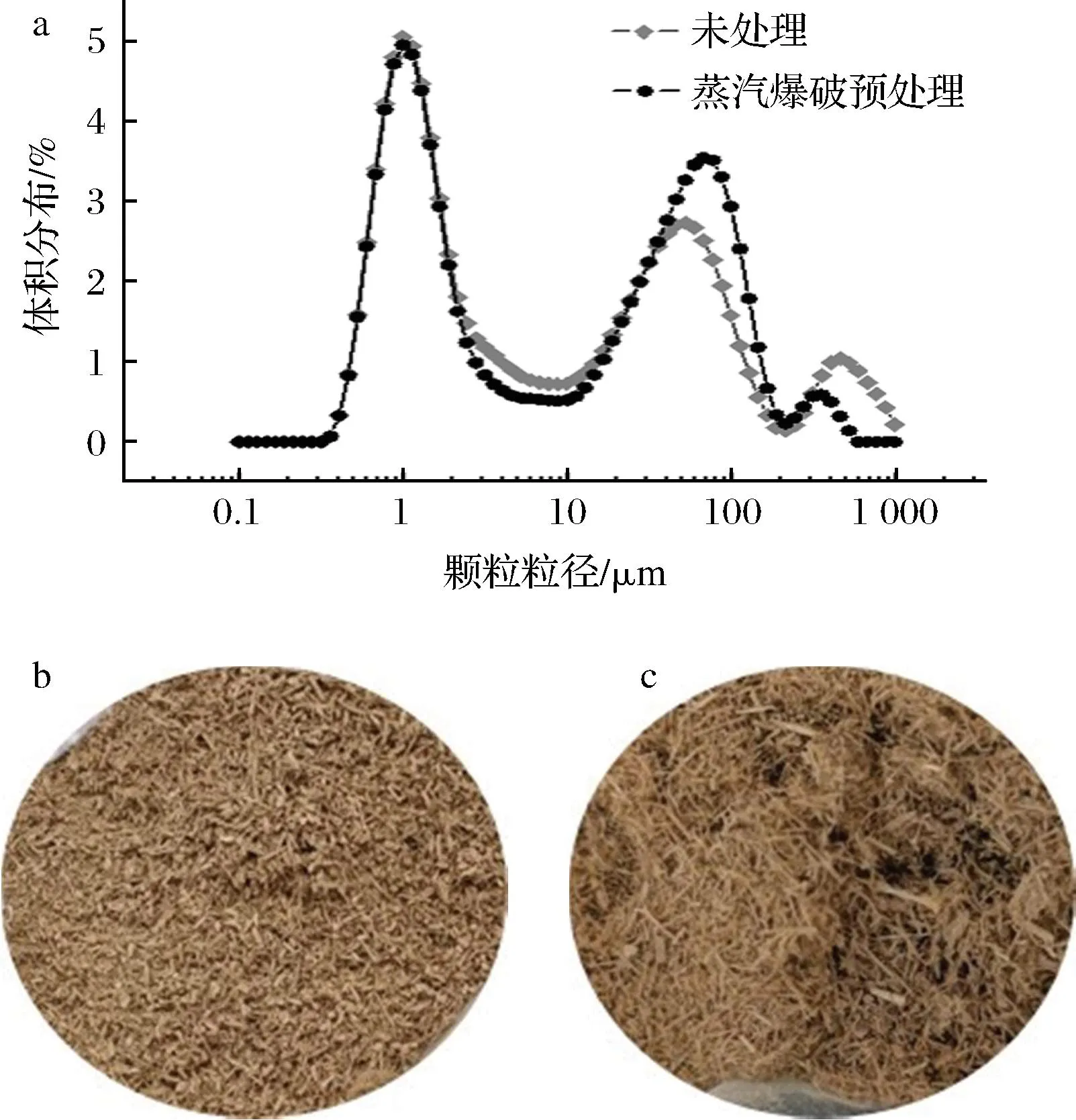
a-蒸汽爆破预处理前后竹屑粒径分析;b-未处理竹屑原料宏观形貌;c-蒸汽爆破预处理后竹屑原料宏观形貌
2.2 “竹渣”的成分分析
将“竹渣”按照1.3.7节方法进行成分分析,结果表明,“竹渣”水分占比“竹渣”试样原质量的7.84%。“竹渣”的主要化学成分是纤维素,其质量分数为73.3%,可以作为发酵产L-乳酸的底物基质,为菌株的生长代谢提供营养物质—碳源。灰分的质量分数为1.18%、苯醇抽出物的质量分数为0.59%,两者成分较低的原因可能是在超声波辅助碱液提取半纤维素后清洗“竹渣”的过程中被水带走。“竹渣”中酸不溶木素成分的质量分数为14.96%,较未经任何处理竹屑原料的酸不溶木素的质量分数降低了2.14%,何娟[17]在研究中发现木素的脱除有利于降低物料表面的疏水性和提高其纤维可及度,从而提高酶水解效率。本实验将其作为发酵产L-乳酸的底物基质。
2.3 酶解实验
2.3.1 酶解时间对酶解还原糖释放量的影响
如图4所示,随着酶解时间的延长,由大量葡萄糖基构成的链状高分子化合物纤维素糖苷键逐步断裂成小分子葡萄糖,总糖(葡萄糖+木糖)含量逐渐提高;在反应初始阶段还原糖浓度上升趋势增长快速,反应到14 h后,上升速率逐渐变缓;在酶水解前期,产率(以总糖计)快速下降后趋于平缓,其主要原因是随着酶解体系中糖浓度的增加,纤维素酶受到反馈抑制作用[18]。酶解54 h后总糖含量已无显著性变化(P>0.05)。因此,可以确定酶解糖化时间为54 h。
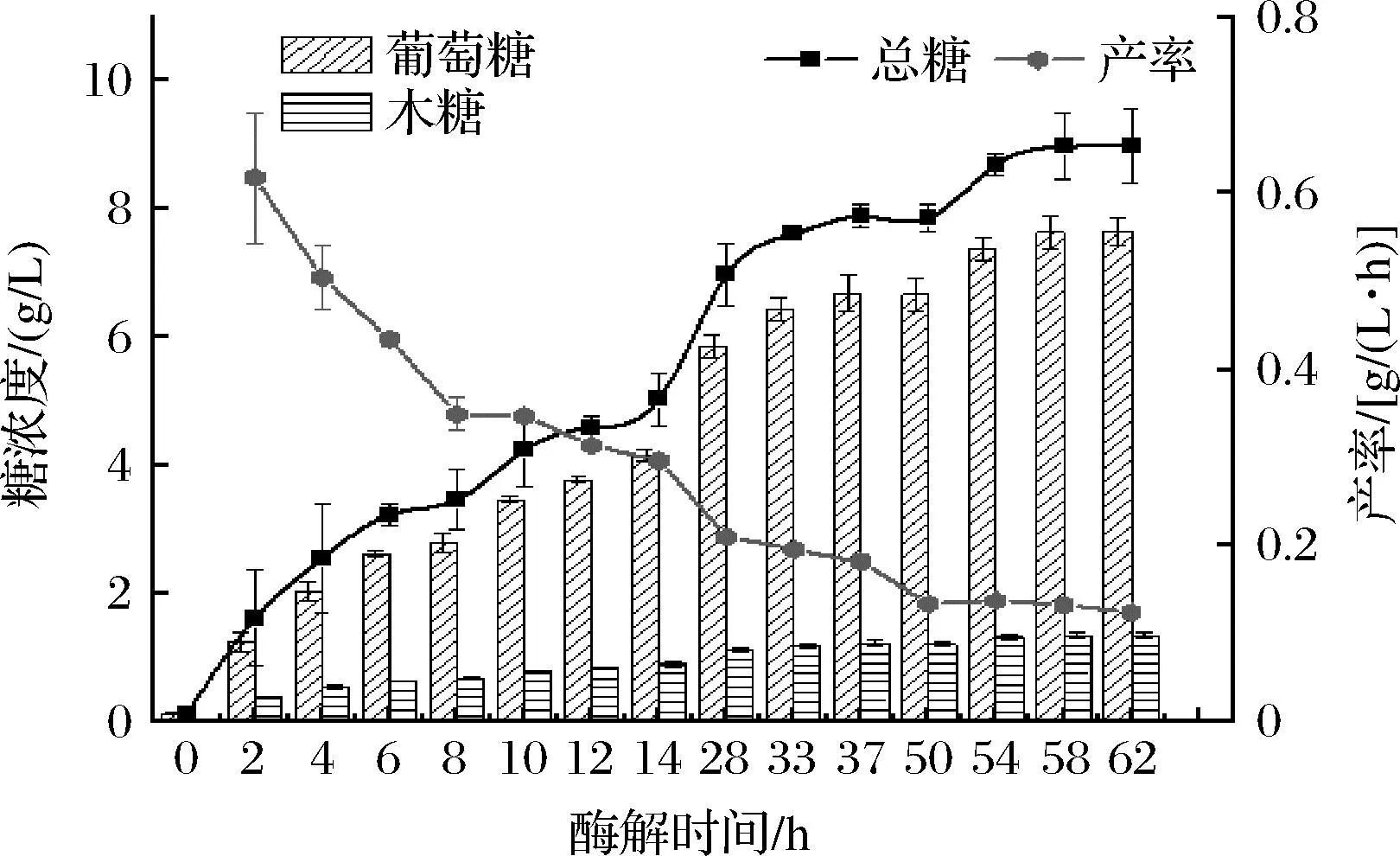
图4 酶解时间对酶解还原糖释放量的影响
2.3.2 酶添加量对酶解还原糖释放量的影响
酶液添加量对酶解还原糖释放量的影响如图5-a所示,随着酶添加量的提高,还原糖浓度呈现先上升后下降的趋势,在酶添加量60 FPU/g达到峰值。当酶添加量小于60 FPU/g,此时底物足够多,酶分子愈多,则底物转化为产物也更多,意味着底物的有效转化率随着酶添加量的增加而成直线地增加[19]。因此,在酶添加量15~60 FPU/g出现线性拟合趋势,如图5-b所示。其拟合曲线公式为:y=0.131 8x+2.970 8,R2=0.988 6。当酶量过高时,由于酶与底物结合达到饱和状态,再增加酶量会造成反馈抑制作用使酶解还原糖释放量降低。因此,可以确定酶添加量为60 FPU/g。

a-酶添加量对酶解还原糖释放量的影响;b-酶添加量15~60 FPU/g的总糖浓度线性拟合图
2.3.3 总固体浓度对酶解还原糖释放量的影响
如图6所示,随着总固体浓度的上升,释放的还原糖浓度总体呈现上升趋势。当总固体浓度增加至14%,释放还原糖的速率低于总固体浓度11%。由于反应是非均相反应,反应器中传质阻力加大,还原糖浓度增加,而产物的抑制和酶的扩散受阻更加明显。因此,底物浓度在一个适宜的范围内即可。
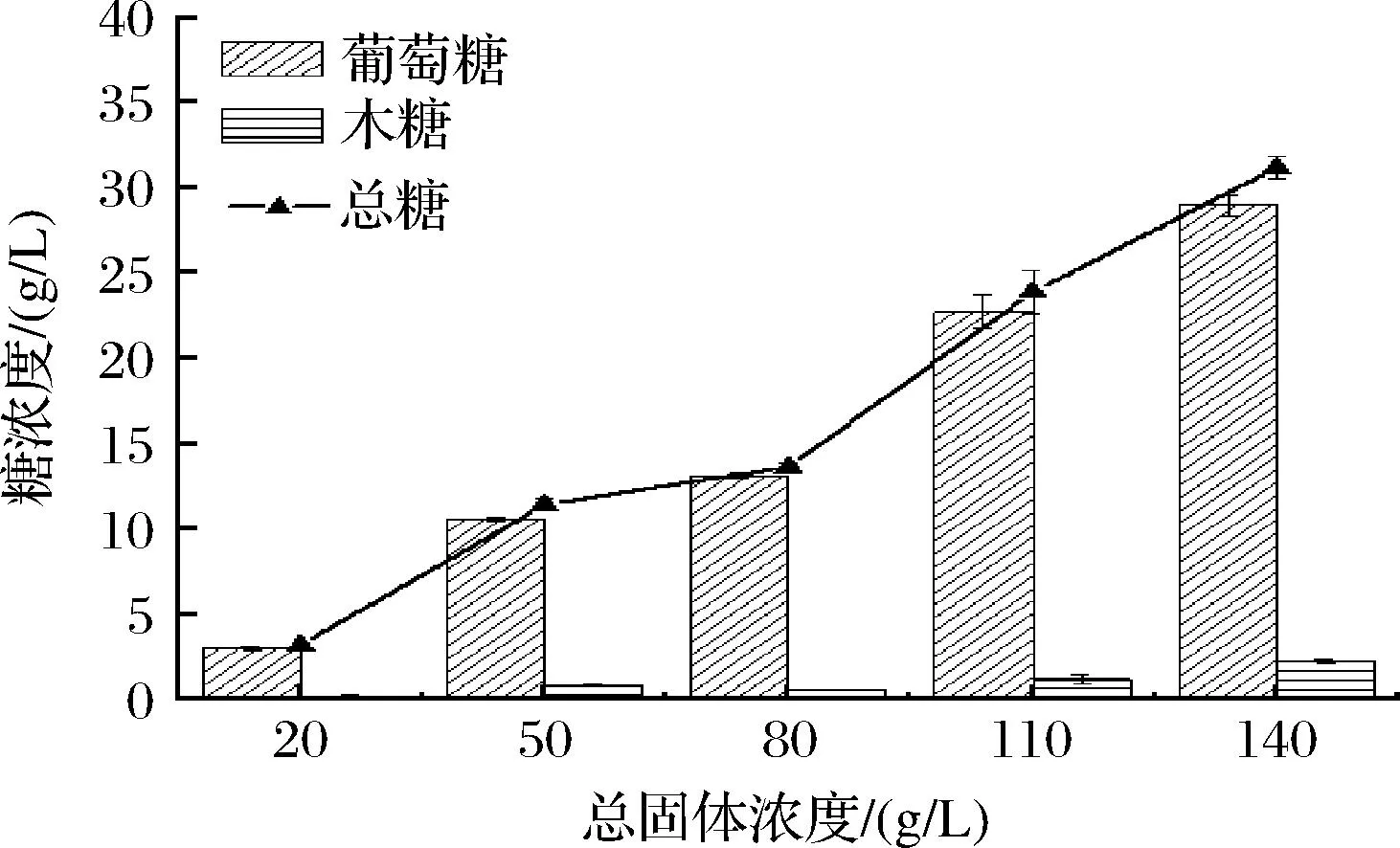
图6 总固体浓度对酶解还原糖释放量的影响
2.4 糖化液的L-乳酸发酵
2.4.1 初始接种量对产L-乳酸的影响
菌株的初始接种量对发酵影响较显著,接种量低会导致菌体生长缓慢,产酸速率低,发酵周期长;接种量过高会使菌体生长过快,造成营养物质缺乏而不利于发酵。如图7所示,在初始接种量为5%时,与其他初始接种量条件下发酵液中L-乳酸的浓度具有显著性差异(P<0.05)。因此,选择菌株的初始接种量为5%较适宜。
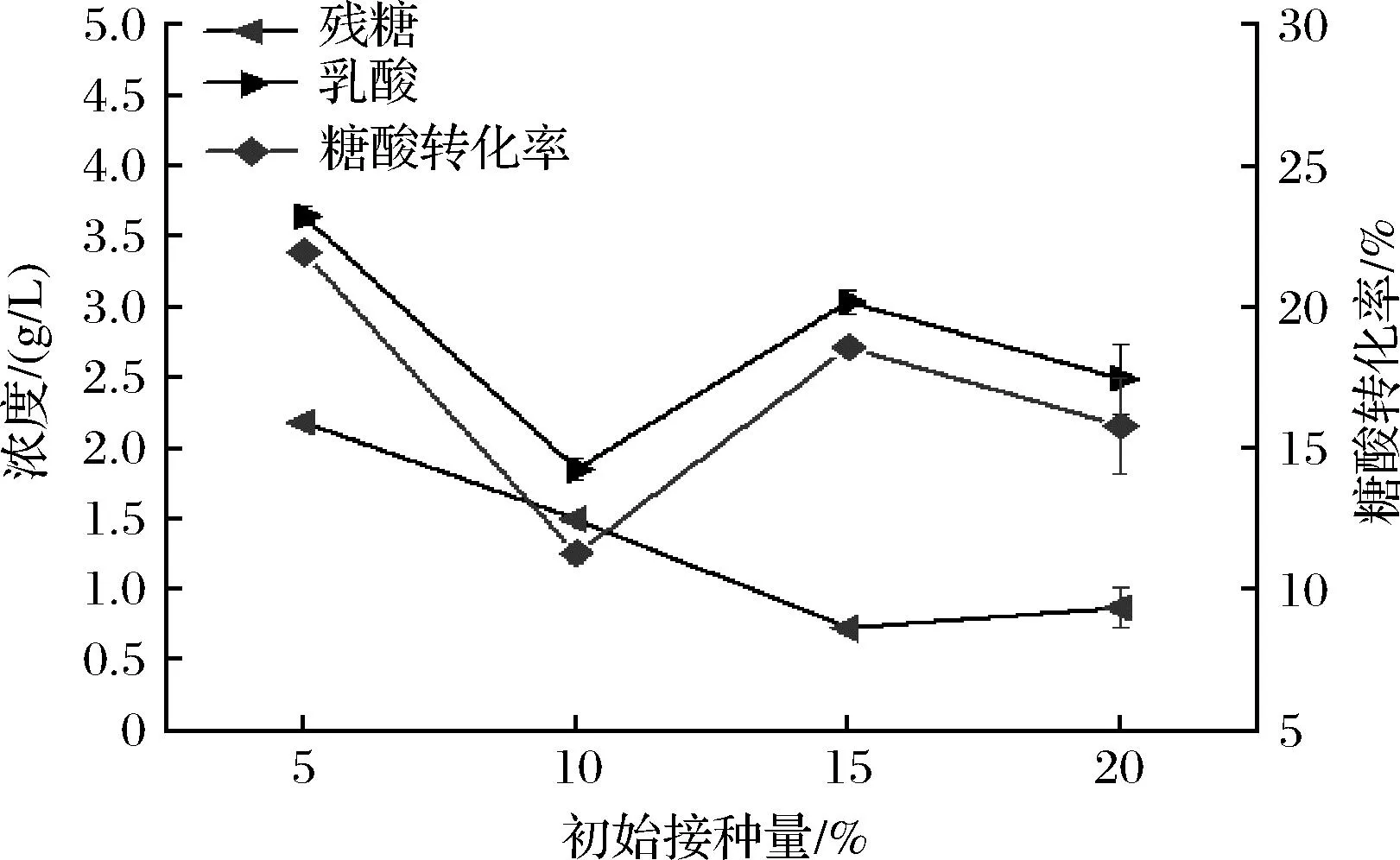
图7 初始接种量对产L-乳酸的影响
2.4.2 初始pH对产L-乳酸的影响
不同初始pH发酵环境条件下,其对发酵产L-乳酸的影响如图8所示。随着发酵初始pH的增加,L-乳酸的浓度逐渐上升;在pH 6.5时,L-乳酸浓度显著高于pH 5.0、5.5、6.0(P<0.05),而调节pH值为7.0时,与pH 6.5时发酵液中L-乳酸浓度不具有显著性差异(P>0.05),且糖酸转化率在pH 6.5时最高。由于菌体在生长代谢过程中不断产生的L-乳酸使发酵环境pH改变,进而改变生长环境中营养物质的可及性及有害物质的毒性[20]。因此,通过酸碱溶液调节发酵初始pH值为6.5较适宜。
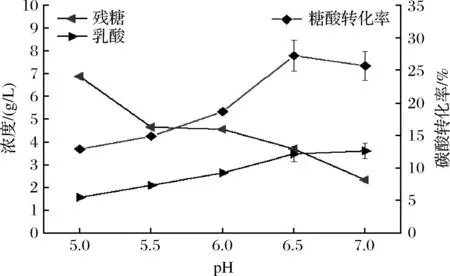
图8 初始pH对产L-乳酸的影响
2.4.3 发酵时间对产L-乳酸的影响
发酵时间对产L-乳酸的影响如图9所示。残存的糖浓度随着发酵时间的延长而下降,菌体代谢产物L-乳酸及糖酸转化率随发酵时间延长呈现先上升后下降的趋势,与张窦[21]研究结果一致。当发酵17 h时达到L-乳酸浓度峰值,其糖酸转化率也达到最大值。发酵时间超过17 h后,发酵体系中的L-乳酸浓度与糖酸转化率都开始下降。其原因是L-乳酸发酵是葡萄糖经糖酵解生成丙酮酸后还原的结果,所得产物L-乳酸还能进一步被降解[22]。因此,选择发酵时间17 h较适宜。
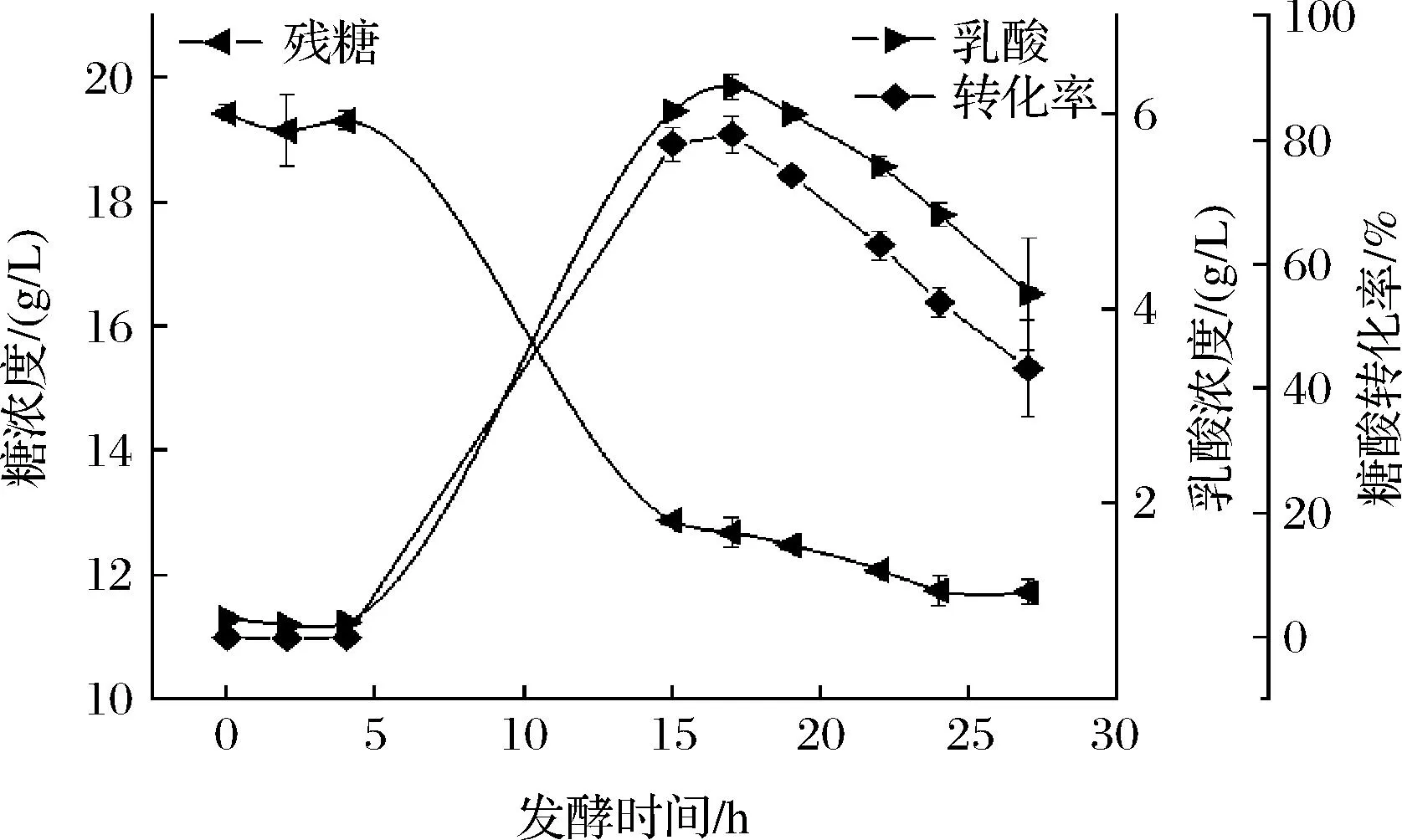
图9 发酵时间对产L-乳酸的影响
3 结论
a)蒸汽爆破法作为预处理手段可提高竹屑原料酶水解效率,通过SEM&EDS和粒度分析得出蒸汽爆破过程中纤维表面被机械撕裂和C元素的增加以及d(90)粒度分布的颗粒较小是纤维素酶酶解效率提高的主要原因。
b)竹渣主要成分是纤维素,以此为碳源研究了分步糖化发酵关键参数对酶解发酵的影响。在TS质量浓度140 g/L、酶添加量60 FPU/g、酶解54 h条件下糖化,总糖质量浓度可达31.19 g/L。将糖化液用于发酵试验,在起始糖质量浓度19.43 g/L,发酵初始pH 6.5、菌株的初始接种量5%、发酵17 h条件下,L-乳酸质量浓度可达6.28 g/L,其糖酸转化率高达80.87%。本研究结果为竹基纤维素生物转化L-乳酸提供了一定的参考依据。
