基于多重免疫组化技术探讨股骨头坏死愈胶囊治疗激素性股骨头坏死的作用机制
2024-04-02简羿马茂潇郭珈宜刘又文岳辰
简羿,马茂潇,郭珈宜,刘又文,岳辰
(1.湖南中医药大学研究生院,湖南 长沙 410208;2.河南省洛阳正骨医院/河南省骨科医院,河南 洛阳 471002)
股骨头坏死是骨科临床中常见的高致残性疾病之一,创伤、酗酒及激素滥用等是引起股骨头坏死的主要因素[1]。我国股骨头坏死患者中约有1/4为激素滥用引起[2]。对于早期激素性股骨头坏死(steroid-induced osteonecrosis of femoral head,SONFH)患者,如不能采取有效的干预措施,多数患者会在5年内发生股骨头塌陷、坏死[3]。股骨头坏死愈胶囊是平乐郭氏正骨治疗“骨蚀”的经典方剂,具有补益肝肾、活血化瘀的作用。我们团队前期研究发现,股骨头坏死愈胶囊具有改善髋关节功能、减缓SONFH发病进程、降低股骨颈骨折内固定术后股骨头坏死发生率的作用[4-5]。但股骨头坏死愈胶囊治疗SONFH的作用机制尚不清楚。多重免疫组化(multiplex immunohistochemistry,mIHC)是一项先进的病理学检测技术,在推演上下游信号通路、探索药物作用机制方面具有一定的优势[6]。目前,mIHC已被广泛应用于肿瘤、心血管疾病、肠道疾病等的机制研究[7-9]。我们前期采用mIHC成功揭示了非创伤性股骨头坏死巨噬细胞异常极化的相关机制[10]。为了探讨股骨头坏死愈胶囊治疗SONFH的作用机制,我们建立了SONFH大鼠模型,并采用mIHC进行了相关实验研究,现总结报告如下。
1 材料与仪器
1.1 实验动物
无特定病原SD大鼠100只,购自成都达硕实验动物有限公司[生产许可SCXK(川)2020-0030]。实验方案经河南省洛阳正骨医院(河南省骨科医院)伦理委员会审查通过,伦理批件号:KY2021-007-01。
1.2 实验药物
股骨头坏死愈胶囊[河南省洛阳正骨医院(河南省骨科医院)院内制剂,批号:20200209;规格:每粒装0.35 g]。
1.3 实验试剂
甲泼尼龙、苏木素(北京索莱宝科技有限公司),脂多糖(美国Sigma公司),10%中性福尔马林[康迪斯化工(湖北)有限公司],Opal多色荧光免疫组化标记试剂盒(美国Akoya Biosciences公司),CD68、CD80、Toll样受体4(Toll-like receptor 4,TLR4)、髓样分化因子初次应答基因88(myeloid differentiation primary response gene 88,MyD88)、核因子-κB(nuclear factor-κB,NF-κB)p65抗体(美国Abcam公司),CD206抗体(美国Thermo公司)。
1.4 实验仪器
HM 340E石蜡切片机、TLZ11摊片仪、ClearVue全自动封片仪(美国Thermo公司),BX51光学显微镜(日本Olympus公司),vivaCT40 Micro-CT(瑞士SCANCO Medical AG公司)。
2 方 法
2.1 分组方法
将100只大鼠称重后按体质量排序编号,从随机数字表中抄录100个连续的2位数记录在大鼠编号下方,将随机数字除以4,余数为1的随机数字对应的大鼠纳入正常对照组,余数为2的随机数字对应的大鼠纳入模型组,余数为3的随机数字对应的大鼠纳入低剂量药物治疗组,整除的随机数字对应的大鼠纳入高剂量药物治疗组。若分配不均,则继续抄录随机数字并采用余数法进行调整。
2.2 大鼠SONFH造模方法
大鼠适应性饲养1周后,将模型组、低剂量药物治疗组、高剂量药物治疗组大鼠采用改良的脂多糖联合甲泼尼龙法建立SONFH模型[11]:按照10 μg·kg-1的剂量给SD大鼠肌肉注射脂多糖,共注射2次,2次间隔7 d,第2次注射脂多糖24 h后,按照25 mg·kg-1的剂量给SD大鼠肌肉注射甲泼尼龙,每日注射1次,连续注射3 d。
2.3 治疗方法
造模结束后,低剂量药物治疗组按照0.33 g·kg-1的剂量给予股骨头坏死愈胶囊溶液(将股骨头坏死愈胶囊粉剂溶于水中)灌胃,高剂量药物治疗组按照 0.67 g·kg-1的剂量给予股骨头坏死愈胶囊溶液灌胃,正常对照组和模型组给予等量生理盐水灌胃。每日灌胃2次,连续治疗4周。药物等效剂量均按照人体与SD大鼠的体表面积进行换算。
2.4 评价方法
2.4.1Micro-CT扫描分析大鼠股骨头松质骨微结构 治疗结束后,腹腔注射3%的戊巴比妥钠麻醉大鼠,分离大鼠双侧股骨,注意避免股骨头软骨损伤。将大鼠股骨固定于4%多聚甲醛中24 h后,再置于0.9%生理盐水中浸泡24 h。采用vivaCT40 Micro-CT对大鼠股骨进行扫描,并进行三维重建。采用仪器自带软件分析股骨头松质骨的骨微结构,并提取大鼠股骨头松质骨的骨体积分数、骨小梁厚度、骨小梁数量(1 mm线段与骨小梁交点的个数)及骨小梁分离度(骨小梁之间的平均距离)等指标。
2.4.2组织切片染色观察大鼠股骨头组织病理学改变 将大鼠股骨浸入10%中性福尔马林中浸泡固定48 h,常规脱钙、脱水、石蜡包埋、切片。取股骨头组织切片,采用HE染色观察股骨头组织病理学改变,计算空骨陷窝率和骨坏死发生率:在200倍镜下随机选取10个视野,计算每个视野中骨小梁空骨陷窝数与骨小梁细胞数的比值,10个视野比值的平均值即为空骨陷窝率;当空骨陷窝率>50%,提示发生股骨头坏死,任一侧发生股骨头坏死的大鼠数量与组内大鼠数量的比值即为骨坏死发生率。
2.4.3mIHC检测巨噬细胞极化及TLR4/MyD88/NF-κB信号通路相关蛋白表达 取股骨头组织石蜡切片,脱蜡水化后,加入EDTA抗原修复液,于微波高火下修复抗原;加入抗原封闭液,室温封闭10 min;加入CD206一抗(抗体稀释比例为1∶200),4 ℃孵育过夜;PBS缓冲液漂洗后,加入Opal Polymer HRP抗鼠/兔通用型二抗,37 ℃孵育10min;PBS缓冲液避光漂洗后,加入Opal520试剂室温显色10 min。再次加入EDTA抗原修复液,于微波高火下修复抗原,按照上述步骤依次完成CD68(抗体稀释比例为1∶200)、CD80(抗体稀释比例为1∶100)、TLR4(抗体稀释比例为1∶100)、MyD88(抗体稀释比例为1∶100)、NF-κB P65(抗体稀释比例为1∶200)的标记和显色。完成所有蛋白的标记和显色后,PBS缓冲液避光漂洗,滴加DAPI染料,避光孵育5 min;双蒸水避光漂洗后,加入防淬灭剂后,封片。于荧光显微镜下观察切片,采用Qupath 0.3.4软件统计CD206、CD68、CD80、TLR4、MyD88、NF-κB P65的荧光强度,分析CD206、CD68、CD80、TLR4、MyD88、NF-κB P65的蛋白相对表达量,并计算M1型巨噬细胞、M2型巨噬细胞的占比。M1型巨噬细胞占比=CD80的相对荧光强度/CD68的相对荧光强度×100%,M2型巨噬细胞占比=CD206的相对荧光强度/CD68的相对荧光强度×100%。
2.5 数据统计
采用SPSS25.0统计软件对所得数据进行统计学分析。骨体积分数、骨小梁厚度、骨小梁数量、骨小梁分离度、空骨陷窝率、M1型巨噬细胞占比、M2型巨噬细胞占比及TLR4、MyD88、NF-κB p65蛋白相对表达量的组间比较均采用单因素方差分析,组间两两比较均采用LSD-t检验;骨坏死发生率的组间比较采用卡方检验,两两比较采用卡方分割法。检验水准α=0.05,卡方分割检验水准α’=0.012 5。
3 结 果
3.1 一般结果
模型组1只大鼠于造模后死亡,低剂量药物治疗组和高剂量药物治疗组分别有3只和2只大鼠在治疗过程中死亡。正常对照组大鼠精神状态良好、进食正常、毛发光泽无脱落,模型组、低剂量药物治疗组、高剂量药物治疗组大鼠在造模开始后第3天出现神情不振、进食减少、少量脱毛,1周后精神、进食等逐渐恢复。
3.2 大鼠股骨头松质骨微结构Micro-CT扫描分析结果
大鼠股骨近端CT片显示,正常对照组股骨头松质骨的骨小梁呈多孔网架结构,排列规律,骨小梁数量、厚度正常;模型组骨小梁明显减少、变细,稀疏,排列不规律;高剂量药物治疗组骨小梁较模型组增厚、变粗,致密,排列规律;低剂量药物治疗组大鼠股骨头松质骨微结构表现介于模型组与高剂量药物治疗组之间(图1)。正常对照组、模型组、低剂量药物治疗组、高剂量药物治疗组大鼠股骨头松质骨骨体积分数、骨小梁厚度、骨小梁数量、骨小梁分离度组间比较,差异均有统计学意义。模型组、低剂量药物治疗组、高剂量药物治疗组大鼠股骨头松质骨骨体积分数、骨小梁厚度、骨小梁数量均小于正常对照组(骨体积分数:P=0.000,P=0.000,P=0.000;骨小梁厚度:P=0.000,P=0.003,P=0.026;骨小梁数量:P=0.000,P=0.000,P=0.031),骨小梁分离度均大于正常对照组(P=0.000,P=0.001,P=0.036);低剂量药物治疗组大鼠股骨头松质骨骨体积分数、骨小梁厚度与模型组的差异均无统计学意义(P=0.052,P=0.071),骨小梁数量大于模型组(P=0.012),骨小梁离散度小于模型组(P=0.001);高剂量药物治疗组大鼠股骨头松质骨骨体积分数、骨小梁厚度、骨小梁数量大于模型组(P=0.001,P=0.011,P=0.000),骨小梁离散度小于模型组(P=0.001),骨体积分数、骨小梁厚度、骨小梁数量、骨小梁离散度与低剂量药物治疗组的差异均无统计学意义(P=0.146,P=0.414,P=0.086,P=0.146)。见表1。
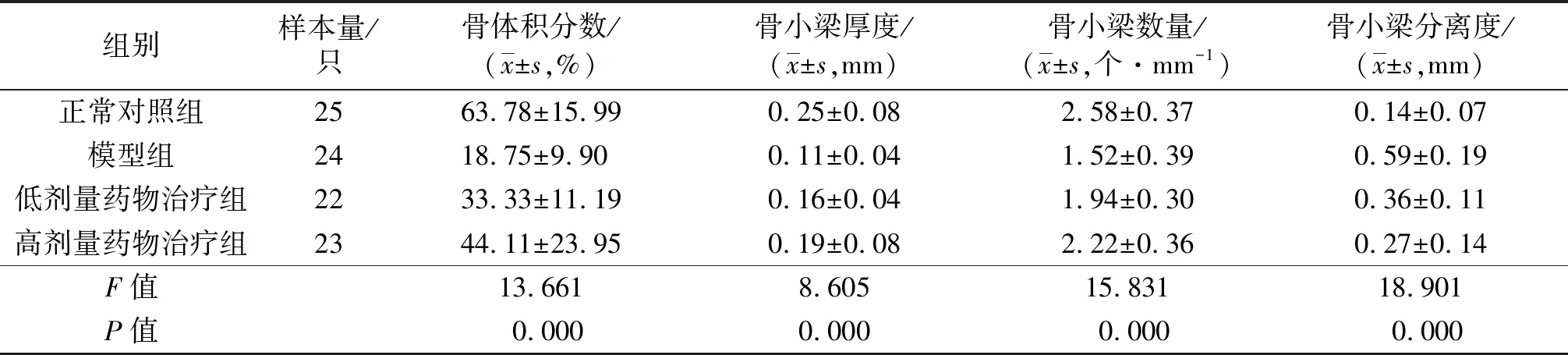
表1 4组大鼠股骨头松质骨微结构Micro-CT扫描分析结果

图1 4组大鼠股骨近端CT片
3.3 大鼠股骨头组织病理学观察结果
HE染色结果显示,正常对照组大鼠股骨头骨小梁内无明显空骨陷窝,细胞核正常;模型组、低剂量药物治疗组及高剂量药物治疗组大鼠股骨头骨小梁内出现不同程度的空骨陷窝,细胞核变小、萎缩并移动到细胞边缘,且以模型组最为明显(图2)。正常对照组、模型组、低剂量药物治疗组、高剂量药物治疗组大鼠股骨头空骨陷窝率、骨坏死发生率组间比较,差异均有统计学意义。模型组、低剂量药物治疗组、高剂量药物治疗组大鼠股骨头空骨陷窝率、骨坏死发生率均高于正常对照组(空骨陷窝率:P=0.000,P=0.000,P=0.000;骨坏死发生率:P=0.000,P=0.000,P=0.000);低剂量药物治疗组大鼠股骨头空骨陷窝率低于模型组(P=0.000),骨坏死发生率与模型组的差异无统计学意义(P=0.054);高剂量药物治疗组大鼠股骨头空骨陷窝率和骨坏死发生率均低于模型组(P=0.000,P=0.000),空骨陷窝率低于低剂量药物治疗组(P=0.049),骨坏死发生率与低剂量药物治疗组的差异无统计学意义(P=0.556)。见表2。
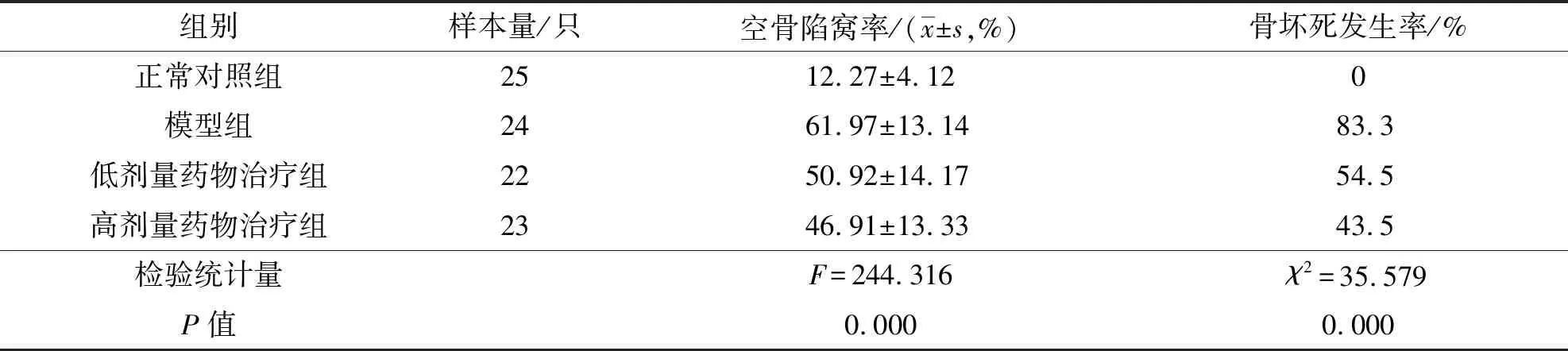
表2 4组大鼠股骨头空骨陷窝率和骨坏死发生率

图2 4组大鼠股骨头组织切片HE染色结果(×200)
3.4 巨噬细胞极化mIHC检测结果
正常对照组、模型组、低剂量药物治疗组、高剂量药物治疗组大鼠股骨头M1型巨噬细胞、M2型巨噬细胞占比组间比较,差异均有统计学意义。模型组、低剂量药物治疗组、高剂量药物治疗组大鼠股骨头M1型巨噬细胞、M2型巨噬细胞占比均高于正常对照组(M1型巨噬细胞占比:P=0.000,P=0.000,P=0.000;M2型巨噬细胞占比:P=0.000,P=0.000,P=0.000);低剂量药物治疗组大鼠股骨头M1型巨噬细胞、M2型巨噬细胞占比与模型组的差异均无统计学意义(P=0.270,P=0.533);高剂量药物治疗组大鼠股骨头M1型巨噬细胞占比低于模型组(P=0.009),M2型巨噬细胞占比高于模型组(P=0.006);高剂量药物治疗组大鼠股骨头M1型巨噬细胞占比与低剂量药物治疗组的差异无统计学意义(P=0.131),M2型巨噬细胞占比高于低剂量药物治疗组(P=0.038)。见表3、图3。

Merge表示融合图片,DAPI为4,6-二脒基-2-苯基吲哚,TLR4为Toll样受体4,MyD88为髓样分化因子初次应答基因88,NF-κB p65为核因子-κB p65。
3.5 TLR4/MyD88/NF-κB信号通路相关蛋白表达mIHC检测结果
正常对照组、模型组、低剂量药物治疗组、高剂量药物治疗组大鼠股骨头TLR4、MyD88、NF-κB p65的蛋白相对表达量组间比较,差异均有统计学意义。模型组、低剂量药物治疗组、高剂量药物治疗组大鼠股骨头TLR4、MyD88、NF-κB p65蛋白相对表达量均高于正常对照组(TLR4蛋白相对表达量:P=0.000,P=0.000,P=0.028;MyD88蛋白相对表达量:P=0.000,P=0.000,P=0.001;NF-κB p65蛋白相对表达量:P=0.000,P=0.000,P=0.001);低剂量药物治疗组大鼠股骨头TLR4、MyD88蛋白相对表达量与模型组的差异均无统计学意义(P=0.268,P=0.280),NF-κB p65蛋白相对表达量低于模型组(P=0.034);高剂量药物治疗组TLR4、MyD88、NF-κB p65蛋白相对表达量均低于模型组和低剂量药物治疗组(TLR4蛋白相对表达量:P=0.002,P=0.040;MyD88蛋白相对表达量:P=0.000,P=0.013;NF-κB p65蛋白相对表达量:P=0.000,P=0.039)。见表4、图3。
4 讨 论
SONFH属中医学“骨蚀”“骨痿”“骨痹”范畴,其主要证候为肾虚、血瘀。因此,补肾活血是SONFH的主要治则。股骨头坏死愈胶囊作为平乐郭氏正骨的经典方剂,临床实践显示其治疗SONFH效果显著。该方由鹿茸、丹参、续断、杜仲、黄芪、水蛭、鸡血藤、玄参、连翘、乳香、没药共11味药物组成。相关研究表明,杜仲的主要活性成分杜仲苷能够有效抑制SONFH发病进程[12],丹参、川芎等活血类中药的有效成分也被证实具有抑制炎症反应的作用[13-14]。但股骨头坏死愈胶囊治疗SONFH作用机制尚不清楚。
SONFH的发生与持续性慢性炎症所导致的骨再生障碍密切相关,因而SONFH的炎症反应机制也成为研究的重点[15]。相关研究发现,M1型巨噬细胞的过度激活是引起SONFH持续性慢性炎症的主要原因[16-17],而M1型巨噬细胞不能向M2型巨噬细胞极化是导致SONFH微环境内持续慢性炎症和组织破坏的关键,在股骨头坏死的进程中起着至关重要的作用[18-20]。骨组织损伤后,骨细胞和骨髓细胞释放的损伤相关模式分子将巨噬细胞招募到损伤区域,并将其极化为M1型巨噬细胞,进而促进炎症因子肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素(interleukin,IL)-1β、IL-6的分泌,启动和维持炎症反应,并导致骨修复和再生障碍[21]。而促进M1型巨噬细胞向M2型巨噬细胞极化,则能够抑制SONFH慢性炎症持续、减轻组织破坏,进而促进骨组织的再生与修复[22-23]。TLR4/MyD88/NF-κB信号通路是调控炎症反应的经典通路,在巨噬细胞的极化过程中发挥重要作用[24-25]。Adapala等[26]通过研究猪股骨头坏死模型发现,在坏死骨组织引起巨噬细胞向M1型巨噬细胞极化过程中,TLR4的表达量显著增加,且引起了依赖MyD88途径的下游信号的改变。Zhu等[27]研究发现,抑制TLR4/MyD88/NF-κB信号通路可以有效抑制炎症因子TNF-α、IL-1β、IL-6的释放,抑制炎症反应,促进坏死骨组织内的骨形成,从而延缓SONFH进展。我们采用mIHC探讨股骨头坏死愈胶囊治疗SONFH作用机制,结果显示,模型组大鼠股骨头M1型巨噬细胞占比、M2型巨噬细胞占比均显著上升,TLR4/MyD88/NF-κB信号通路蛋白表达上调;股骨头坏死愈胶囊治疗后能够显著抑制巨噬细胞向M1型极化、促进巨噬细胞向M2型极化,能够抑制TLR4/MyD88/NF-κB信号通路蛋白表达的上调;且股骨头坏死愈胶囊对巨噬细胞极化及TLR4/MyD88/NF-κB信号通路蛋白表达的影响具有一定的浓度依赖性。
本研究结果表明,股骨头坏死愈胶囊治疗SONFH,能够显著改善股骨头骨微结构、抑制骨坏死,其作用具有一定的剂量依赖性;其作用机制与调控TLR4/MyD88/NF-κB信号通路蛋白表达及巨噬细胞极化有关。
