柴胡皂苷D对紫杉醇耐药乳腺癌细胞耐药性的逆转作用研究*
2024-04-01王素娥时爱春李军涛
王素娥,时爱春,李军涛
(1.洛阳市第三人民医院肿瘤科,河南 洛阳 471002; 2.平度市人民医院肿瘤科,山东 平度 266700;3.河南省肿瘤医院乳腺科,河南 郑州 450000)
乳腺癌是女性癌症死亡的主要原因之一,全球女性发病率约为48/100 000[1]。化疗是乳腺癌的主要治疗方法,而肿瘤细胞的耐药性常导致化疗失败[2-3]。P糖蛋白(P-glycoprotein,P-gp)是一种跨膜转运蛋白,能够将结构多样且功能不相关的疏水化合物排出细胞外。它的过表达与多种癌症如淋巴瘤、结直肠癌、慢性粒细胞白血病等有关[4-6]。中医药因成本低、毒性低、靶点多等优点被长期用于治疗各种肿瘤,能逆转多重耐药(multiple drug resistance,MDR)的药理作用越来越受到关注。研究表明,柴胡有效成分对MDR肝癌细胞和慢性粒细胞白血病细胞有逆转作用[7-8]。柴胡皂苷D是主要的三萜皂苷之一,具有抗炎、抗肿瘤、改善免疫功能等药理活性[9-11]。本研究旨在研究柴胡皂苷D对紫杉醇(paclitaxel,PTX)耐药的乳腺癌细胞(MCF-7/PTX)耐药性的逆转作用及其机制。
1 材料与方法
1.1 细 胞
人乳腺癌细胞系亲本株MCF-7及其紫杉醇耐药株MCF-7/PTX,获自青旗(上海)生物技术发展有限公司。
1.2 药品、试剂与仪器
柴胡皂苷D,纯度≥98%,南京京珠生物科技有限公司产品,批号20874-52-6;紫杉醇(paclitaxel,PTX),纯度≥98%,浙江海正药业有限公司产品,批号33069-62-4;盐酸维拉帕米,P-gp抑制剂,纯度≥99%,上海吉至生化科技有限公司,批号V-90550;兔抗人P-gp单克隆抗体,美国电子生物科学公司产品,批号MA5-13854;兔抗人Yes相关蛋白(yes-associatedprotein,YAP)、兔抗人磷酸化Yes相关蛋白(phosphorylation yes-associated protein,p-YAP)和肌动蛋白(β-actin)、结合辣根过氧化物酶(horse radish peroxidase,HRP)底物的二抗山羊抗兔,均为美国赛斯特公司产品,批号依次为14074、13008、4970、7074。
噻唑蓝溴化四唑(MTT)试剂盒、罗丹明123(rhodamine 123,Rh123)试剂盒,均为美国西格玛奥尔德里奇公司产品,批号11465007001、62669-70-9;胎牛血清(fetal bovine serum,FBS)、洛斯维·帕克纪念研究所(Roswell Parkme Morial Institute,RPMI)1640细胞培养基,为美国英杰公司产品,批号12483020、11875119;二喹啉甲酸(bicinchoninic acid,BCA)蛋白质测定试剂盒,上海碧云天生物技术有限公司产品,产品批号P0010S;聚丙烯酰胺凝胶电泳制胶试剂盒,北京索莱宝科技有限公司产品,批号P1200。Bio-Rad 2550酶标仪,美国伯乐公司产品。
1.3 检测指标与方法
1.3.1 PTX对MCF-7和MCF-7/PTX细胞活性的影响
采用MTT法测定。采用不同质量分数(0、12.5、25、50、100、200 mg/L)PTX处理MCF-7/PTX细胞和MCF-7细胞48 h,检测细胞存活率,确定MCF-7/PTX细胞对PTX的耐药程度。将细胞接种在96孔板中,8×103个细胞/孔,孵育过夜;每孔细胞用调节剂处理48 h,加入5 g/L噻唑蓝溶液15 μL;孵育4 h,弃去上清液,加入150 μL二甲基亚砜;10 min后用酶标仪在570 nm处测定光密度值(OD值)。所有实验为3次独立实验。细胞存活率(%)=不同质量分数组OD值/质量分数0 mg/L OD值×100%。细胞增殖抑制率=100%-细胞存活率。细胞耐药程度=MCF-7/PTX组的半抑制浓度(half maximal inhibitory concentration,IC50)与MCF-7组的IC50的比值。IC50经Graphpad软件计算所得。
1.3.2 柴胡皂苷D的细胞毒性
采用MTT法测定。采用不同质量分数(0.125、0.25、0.50、1.00 mg/L)柴胡皂苷D处理MCF-7/PTX细胞48 h,检测细胞增殖抑制率,确定柴胡皂苷D的细胞毒性以便筛选合适的质量分数用于实验。方法同1.3.1。
1.3.3 柴胡皂苷D对MCF-7/PTX细胞MDR的逆转作用
采用MTT法测定。将MCF-7/PTX细胞常规培养于RPMI-1640细胞培养基(含有100 mL/L FBS),于37 ℃、5 mL /L CO2培养箱中孵育,选取对数生长期细胞用于实验。将细胞加入含有100 mg/L PTX的培养液干预48 h,将细胞分为PTX组、不同质量分数(0.125、0.25、0.50 mg/L)柴胡皂苷D+PTX组、5.00 mg/L维拉帕米+PTX组。显微镜下确认各组细胞生长良好且密度适宜即加入含有对应药物的培养液处理细胞,继续培养48 h,检测细胞增殖抑制率,确定柴胡皂苷D能否可以调节MCF-7/PTX细胞对PTX的敏感性。方法同1.3.1。
1.3.4 YAP、p-YAP蛋白表达
采用Western blot法测定。将MCF-7/PTX细胞分为PTX组、不同质量分数(0.125、0.25、0.50 mg/L)柴胡皂苷D+PTX组,加入细胞裂解液提取各组细胞总蛋白质,采用蛋白质测定法测定蛋白质水平。通过聚丙烯酰胺凝胶电泳分离蛋白质,电转移到聚偏氟乙烯膜上,在5 g/L脱脂牛奶中封闭2 h。将蛋白质与一抗在4 ℃下孵育过夜,缓冲液洗涤孵育一抗的聚偏氟乙烯膜3次后与结合HRP底物的二抗一起孵育显色,以β-actin作为上样对照,蛋白的相对表达量以目的蛋白与β-actin的比值表示。
1.3.5 P-gp mRNA表达
采用流式细胞术检测。将MCF-7/PTX细胞接种在6孔板上,5×105个细胞/孔,孵育过夜;不同质量分数(0.125、0.25、0.50 mg/L)柴胡皂苷D处理,收集细胞并用冰冷的PBS洗涤两次;500 μL FITC标记的单克隆抗人P-gp抗体,在4 ℃下避光30 min;孵育后,洗涤细胞并重悬于冰冷的PBS中,使用流式细胞仪检测P-gp表达,用Cell Quest软件进行分析。
1.3.6 Rh123积累和外流测定
Rh123积累测定:取MCF-7/PTX细胞在6孔板(5×105个细胞/孔)中培养,用0.50 mg/L柴胡皂苷D或5.00 mg/L维拉帕米(阳性对照)孵育48 h;去除培养基并用PBS洗涤细胞;在每个孔中加入含有5 mg/L Rh123的新培养基,孵育30、60、90、120和150 min;在每个时间点收集细胞,通过流式细胞术分析平均荧光强度。
Rh123外流测定:取MCF-7/PTX细胞在6孔板(5×105个细胞/孔)中培养,用5.0 mg/L柴胡皂苷D或5.0 mg/L盐酸维拉帕米处理48 h;细胞用PBS洗涤两次后,每孔加入5 mg/L Rh123,孵育120 min;除去培养基并用冷PBS洗涤细胞;用培养基重悬细胞0、5、15、30和60 min;在每个时间点,收集细胞并分析平均荧光强度。通过检测Rh123在细胞内的积累情况判定P-gp蛋白功能。
1.4 统计学分析
2 结 果
2.1 不同质量分数PTX对MCF-7和MCF-7/PTX细胞存活率影响
与0 mg/L PTX对比,MCF-7和MCF-7/PTX细胞存活率随着PTX质量分数的增加而降低,差异有统计学意义(P<0.01),且呈现依赖性。见表1。PTX在MCF-7和MCF-7/PTX细胞中的IC50值分别为(7.61±0.64)mg/L和(101.30±3.30)mg/L,MCF-7/PTX细胞对PTX表现出明显耐药性,所需PTX为MCF-7细胞的13.31倍。后续实验PTX选择100 mg/L作为MCF-7/PTX细胞的给药质量分数。见图1、图2。
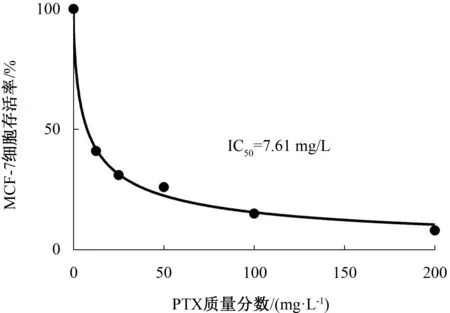
图1 不同质量分数PTX对MCF-7细胞存活率的影响
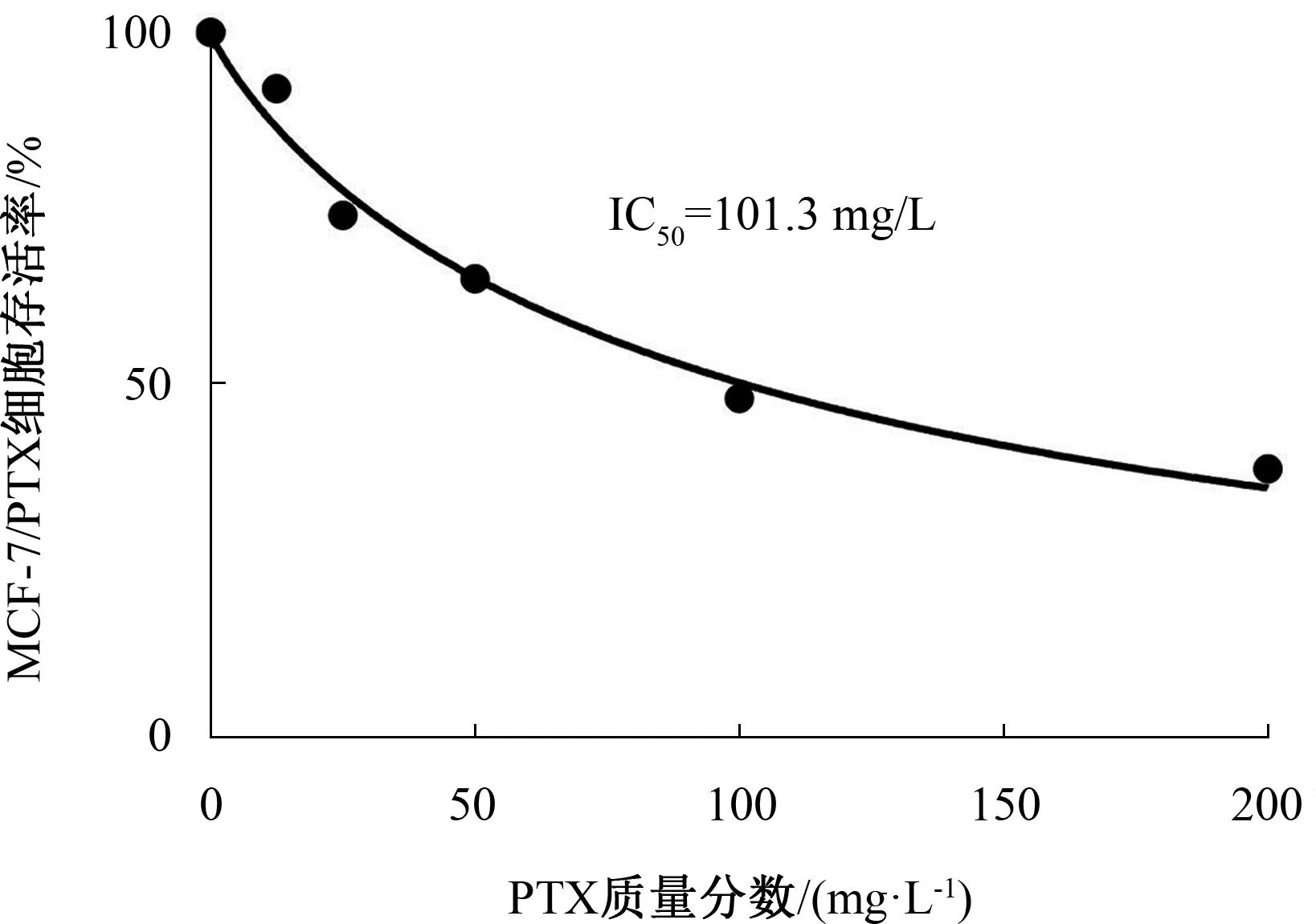
图2 不同质量分数PTX对MCF-7/PTX细胞存活率的影响
表1 不同质量分数PTX对MCF-7和MCF-7/PTX细胞存活率的影响
2.2 不同质量分数柴胡皂苷D对MCF-7/PTX细胞增殖抑制率影响
随着柴胡皂苷D质量分数的增加,MCF-7/PTX细胞增殖抑制率升高(P<0.01)。柴胡皂苷D质量分数小于0.50 mg/L时对MCF-7/PTX细胞无明显毒性,故后续实验选择0.125、0.25和0.50 mg/L柴胡皂苷D进行实验。见表2。
表2 不同质量分数柴胡皂苷D对MCF-7/PTX细胞增殖抑制率影响
2.3 柴胡皂苷D对MCF-7/PTX细胞MDR的影响
与PTX组对比,0.125、0.25和0.50 mg/L柴胡皂苷D组和维拉帕米组的MCF-7/PTX细胞IC50值降低(P<0.05或P<0.01)。见表3。
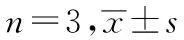
表3 柴胡皂苷D对MCF-7/PTX细胞MDR的影响
2.4 柴胡皂苷D对MCF-7/PTX细胞YAP、p-YAP蛋白表达的影响
与PTX组对比,0.125、0.25和0.50 mg/L柴胡皂苷D组MCF-7/PTX细胞YAP和p-YAP蛋白表达降低(P<0.05或P<0.01)。见表4、图3。

A.PTX组;B.0.125 mg/L柴胡皂苷D+PTX组;C.0.25 mg/L柴胡皂苷D+PTX组;D.0.50 mg/L柴胡苷皂D+PTX组图3 柴胡皂苷D对MCF-7/PTX细胞YAP和p-YAP蛋白的影响
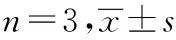
表4 柴胡皂D对MCF-7/PTX细胞YAP、p-YAP蛋白表达的影响
2.5 柴胡皂苷D对MCF-7/PTX细胞P-gp mRNA表达的影响
与PTX组对比,0.125、0.25和0.50 mg/L柴胡皂苷D组MCF-7/PTX细胞P-pg mRNA表达水平降低(P<0.01)。见表5。
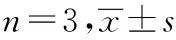
表5 柴胡皂苷D对MCF-7/PTX细胞P-gp mRNA表达的影响
2.6 柴胡皂苷D对MCF-7/PTX细胞Rh123积累水平的影响
与PTX组对比,0.50 mg/L柴胡皂苷D组和5.00 mg/L维拉帕米组MCF-7/PTX细胞在120和150 min时Rh123积累水平升高(P<0.05)。与0.50 mg/L柴胡皂D组对比,5.00 mg/L维拉帕米组MCF-7/PTX细胞在30、90、120和150 min时Rh123积累水平升高,差异有统计学意义(P<0.05)。见表6。
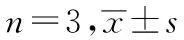
表6 柴胡皂苷D对MCF-7/PTX细胞Rh123积累水平的影响
2.7 柴胡皂苷D对MCF-7/PTX细胞Rh123外流水平的影响
与PTX组对比,0.50 mg/L柴胡皂苷D组和5.00 mg/L维拉帕米组MCF-7/PTX细胞在5、15、30和60 min时Rh123外流水平升高(P<0.01)。与0.50 mg/L柴胡皂苷D组对比,5.00 mg/L维拉帕米组MCF-7/PTX细胞在5、15、30和60 min时Rh123外流水平升高(P<0.05或P<0.01)。见表7。
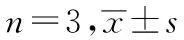
表7 柴胡皂苷D对MCF-7/PTX细胞Rh123外流水平的影响
3 讨 论
化疗是晚期乳腺癌最常见的治疗手段之一,但对于复发性乳腺癌疗效很差。肿瘤细胞的MDR是化疗的主要障碍,MDR是癌细胞对单一药物或具有相同作用机制的药物家族产生耐药反应。MDR的出现可能与细胞分化、凋亡及药物敏感性有关[12]。
肿瘤细胞可以通过广泛的抗癌药物经细胞膜P-gp主动流出获得MDR而导致化疗失败。MDR现象逆转一直是肿瘤治疗研究的热点,针对P-gp发挥作用的MDR逆转剂有维拉帕米、PSC833等,临床应用受限,因此,需要寻找低毒的新型抑制剂来满足临床应用的需要。本研究使用人乳腺癌MCF-7和MCF-7/PTX细胞评估柴胡皂苷D的逆转作用。MTT法测定表明MCF-7/PTX细胞为耐药细胞,并且柴胡皂苷D对MCF-7细胞和MCF-7/PTX细胞具有相似的细胞毒性。这表明柴胡皂苷D不是P-gp的底物。为了探索对耐药细胞的逆转作用,笔者以无细胞毒性的0.125、0.25和0.5 mg/L柴胡皂苷D处理细胞,结果显示MCF-7/PTX细胞对PTX的敏感性提高,其逆转效力与维拉帕米相似。这些结果表明柴胡皂苷D可逆转MCF-7/PTX细胞的耐药。
Rh123是一种常用的荧光染料,是P-gp特异性底物,细胞毒性较小,可间接表明P-gp泵出功能。在本研究中,笔者通过流式细胞术监测Rh123的积累,通过外流的动力学观察0.50 mg/L柴胡皂苷D对P-gp泵的抑制作用,结果显示,与PTX组对比,柴胡皂苷D处理的MCF-7/PTX细胞积累了更多Rh123,并且降低了Rh123外排速度。结果表明,柴胡皂苷D可以恢复Rh123的积累并延迟其外排,进一步表明柴胡皂苷D可能抑制P-gp外排功能。
据报道,MDR与Hippo/YAP通路的激活与P-gp过表达相关[13-14]。YAP也称为YAP1或YAP65,根据其与Yes的SH3结构域相关联的能力而鉴定[15]。在许多癌症中,YAP是可以被反复扩增的重要癌基因,参与乳腺上皮细胞的转移[16]。在这里,笔者假设柴胡皂苷D可能通过抑制Hippo/YAP通路和P-gp的基因表达机制逆转MCF-7/PTX细胞的MDR。Western Blot和流式细胞术结果显示,无细胞毒性浓度的柴胡皂苷D显著下调MCF-7/PTX细胞中的YAP蛋白和P-gp的表达。本研究还存在一定的局限性,在随后的研究中笔者会着重探索Hippo/YAP通路和P-gp之间的调控关系,并在其他亚型的乳腺癌的耐药细胞上进行验证。
综上所述,柴胡皂苷D可能是通过下调Hippo/YAP通路逆转P-gp介导的乳腺癌细胞耐药性,从而提高MCF7/PTX细胞对PTX的化学敏感性,即:柴胡皂苷D可作为P-gp介导的MDR逆转剂逆转MCF7/PTX细胞MDR表型。
