病房全程管理的内外科嵌合模式下新生儿术后不良事件的危险因素分析
2024-04-01四川大学华西医院麻醉科四川成都6004四川大学华西第二医院麻醉科四川成都60044
蒋 攀,黄 瀚 (. 四川大学华西医院麻醉科,四川 成都 6004;. 四川大学华西第二医院麻醉科,四川 成都 60044)
新生儿是围术期不良事件发生的高危人群,由于其各器官的结构和功能发育不成熟,对外界应激反应代偿能力小,特别是手术应激的作用很容易使呼吸、循环及水电解质平衡发生变化[1],因此,围术期更容易发生重要脏器损伤、感染甚至死亡等不良事件。据报道,新生儿外科手术后病死率可达46.7%[2]。目前,已有研究针对新生儿手术后并发症的相关高危因素进行分析,以期改善新生儿外科手术结局。然而,鉴于不同医院新生儿围术期管理模式不同,既往研究的结果存在较大差异[2-6]。而我院开展的基于新生儿病房全程管理的新生儿内外科嵌合模式,亦有别于传统的新生儿外科病房的管理模式。为了更好地了解基于新生儿病房全程管理的新生儿内外科嵌合模式下,新生儿外科手术后不良事件的发生率及其危险因素,本研究将分析我院新生儿术后出现的不良事件及其潜在的影响因素,以指导临床实施针对性措施,改善新生儿预后。
1 资料与方法
1.1 临床资料
回顾性选择2019 年1 月至2021 年12 月在四川大学华西第二医院接受手术治疗的272 例新生儿,经筛选最终纳入232 例。其中男151 例;剖宫产分娩155 例;早产儿72 例,低出生体质量儿55 例;急诊手术56 例,开放手术226 例。中位胎龄为267(252,275)d,中位出生体质量为2 940(2 365,3 297)g,产后1 min中位Apgar 评分为9(9,10)分。手术时新生儿中位日龄为2(1,7)d,入室时平均动脉压(mean arterial pressure,MAP)为(53.50±8.89)mmHg。中位手术时间为65(45,95)min,中位麻醉时间为130(96,165)min。本研究已获得四川大学华西第二医院医学伦理委员会审批[医学科研2022伦审批第(317)号]。
纳入标准:①出生28 d 内;②在全身麻醉下接受手术治疗。排除标准:①入院前已在外院接受手术治疗;②接受心脏手术。
1.2 数据提取
提取患儿以下信息:①人口统计学资料,包括性别、日龄、胎龄、出生体质量;②出生情况,包括分娩方式及产后1 min、5 min、10 min 的Apgar 评分;③术前诊断;④入手术室时基本情况,包括呼吸方式、生命体征;⑤手术相关指标,包括急诊手术、开放手术、手术部位、手术时间、麻醉时间、术中出入量(晶体液、胶体液、红细胞悬液、血浆、血小板为入量;出血量与尿量为出量)。
记录新生儿综合不良事件的发生情况,即出现以下任一或多项结局指标多为发生综合不良事件:术后30 d内死亡;肝功能不全、肾功能不全、呼吸暂停、低氧血症、术后再次插管、再次手术、术后感染(其中肝肾功能不全、呼吸暂停均由病房医师根据相应标准明确诊断;外周血氧饱和度低于90%诊断为低氧血症;术后出现手术部位感染、感染性休克、肺部感染均定义为术后感染,其中肺部感染有明确影像学证据)。
1.3 统计学方法
使用R 4.3.1 对数据进行统计学分析。采用Shapiro-Wilk法检验连续变量是否符合正态分布,符合正态分布的连续变量采用均数±标准差()表示;不符合正态分布的连续变量采用中位数(四分位间距)表示。分类变量以率(%)描述,采用χ2检验。当数据缺失值小于样本量10%时,采用序列平均值填补。单因素分析中正态性分布的连续变量采用t检验,偏态分布的连续变量采用Mann-Whitney秩和检验。采用多因素Logistic回归模型分析新生儿不良事件发生的危险因素。采用限制性立方样条(restricted cubic spline,RCS)判断危险因素对结局指标的影响情况。使用P值、OR值、95%CI描述回归分析及限制性立方样条结果,P<0.05为差异具有统计学意义。
2 结果
2.1 术后综合不良事件的发生情况
术后共有108 例(46.55%)新生儿发生综合不良事件,其中22 例死亡,57 例出现低氧血症,10 例发生肝功能不全,8 例肾功能不全,13 例呼吸暂停,19 例术后再次插管,7例再次手术,63例术后感染。
2.2 术后综合不良事件的单因素分析
根据是否发生综合不良事件将患儿分为有症状组与无症状组。针对综合不良事件的危险因素进行单因素分析,结果显示,2 组男性,术前诊断为坏死性小肠炎或/和消化道穿孔、早产儿、低出生体质量儿,入手术室时机控呼吸、MAP,急诊手术,胎龄,出生体质量,产后1 min Apgar 评分,术中输注红细胞悬液比较,差异均有统计学意义(P<0.05),见表1。
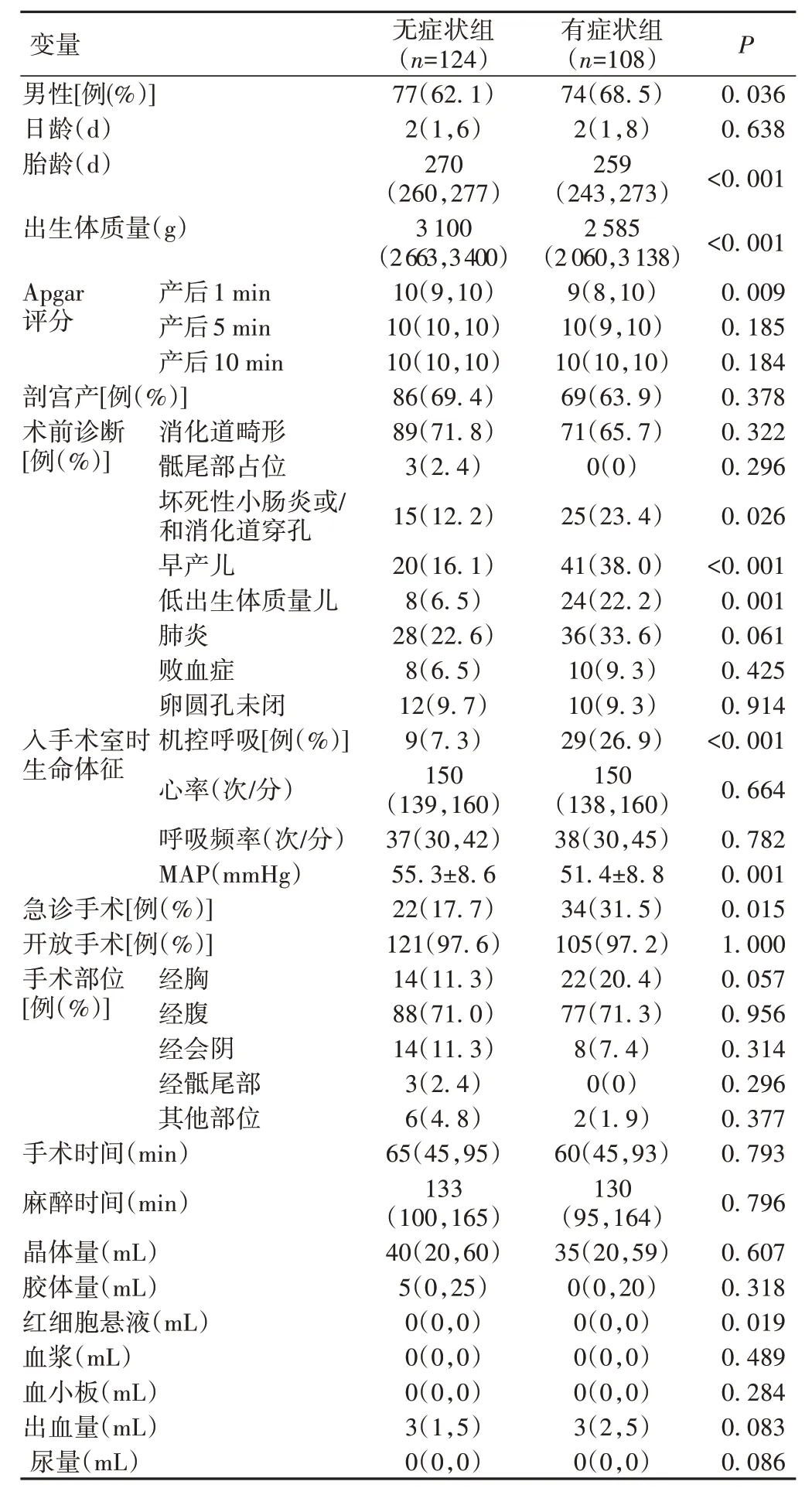
表1 围术期不良事件高危因素的单因素分析
2.3 术后综合不良事件的多因素分析
将单因素分析中P<0.1的指标纳入多因素Logistic回归分析,结果表明:胎龄过小(OR=0.972,95%CI=0.950~0.994,P=0.014)、入手术室时MAP 过低(OR=0.955,95%CI: 0.919~0.993,P=0.019)是新生儿术后发生综合不良事件的独立危险因素,见表2。利用限制性立方样条分析发现,当胎龄小于267 d 时,发生术后不良事件的风险随胎龄的减小而增加(OR=1.005,95%CI:0.992 6~1.108 7),见图1;入手术室时MAP 低于53 mmHg,发生术后不良事件的风险随MAP的降低而增加(OR=1.001 5,95%CI:0.990 5~1.012 7),见图2。

图1 胎龄与术后不良事件的相关性
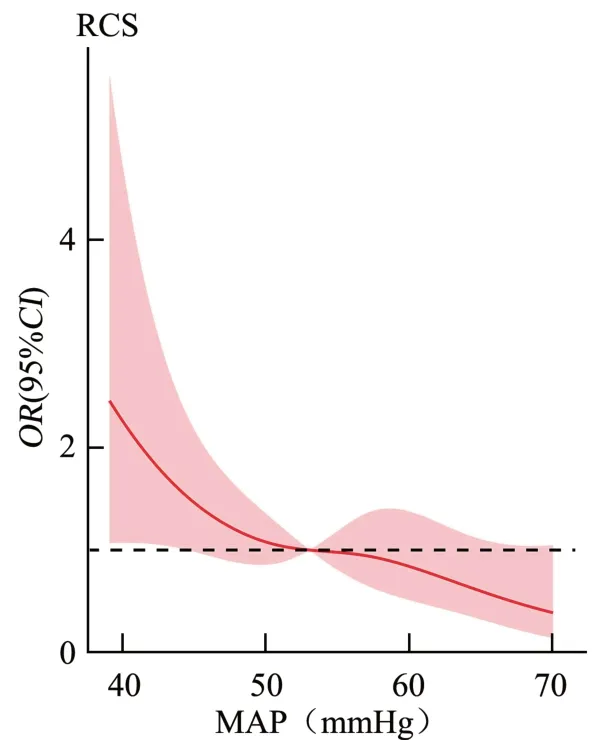
图2 MAP与术后不良事件的相关性
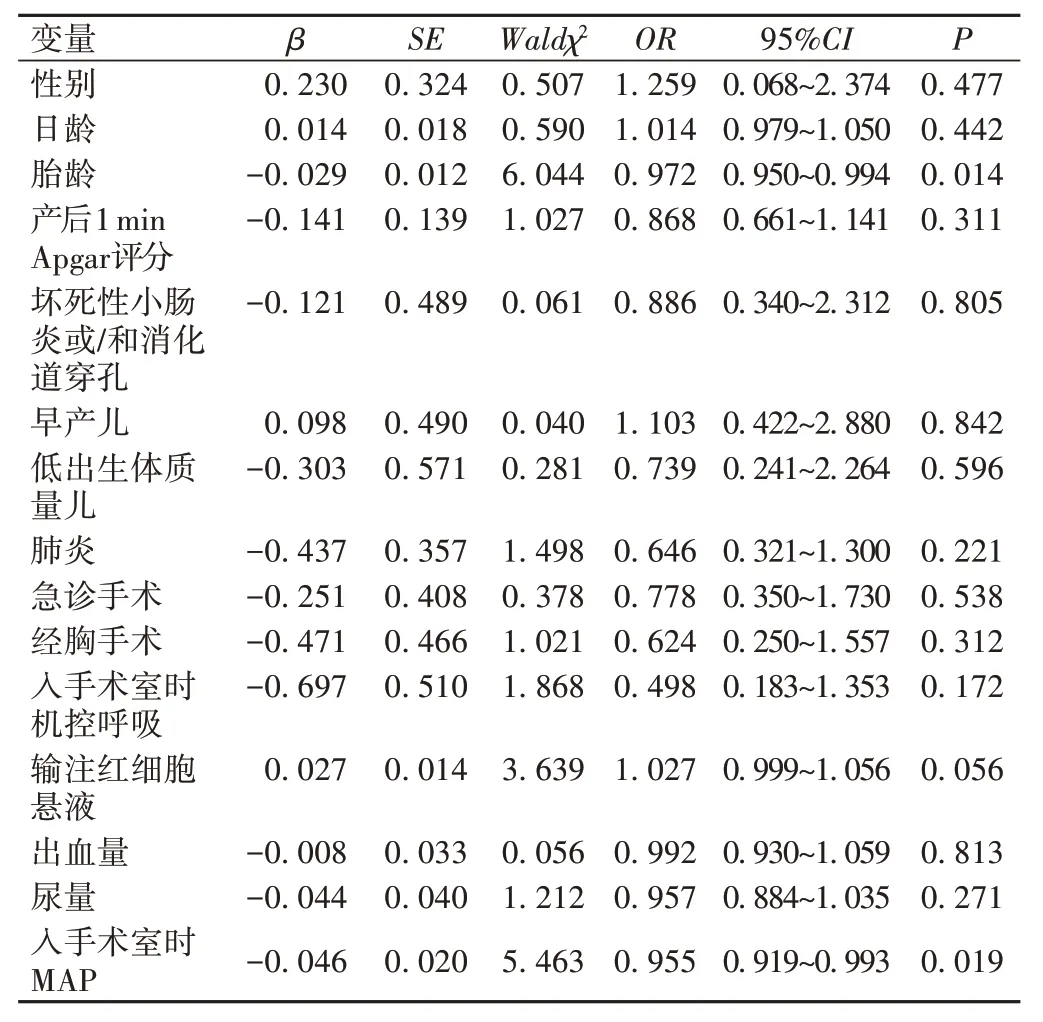
表2 术后综合不良事件的多因素分析
3 讨论
本研究发现新生儿外科手术后总体病死率为9.48%,综合不良事件发生率高达46.55%,主要为呼吸系统相关并发症,其次为感染、肝肾功能不全;胎龄过小与入手术室时的MAP 过低是新生儿发生术后不良事件的独立危险因素。
胎龄通常被定义为孕产妇末次月经第1天起至胎儿分娩时的时间,即胎儿在母体内生长发育的时间。本研究结果显示,胎龄小于267 d(38 周)时,新生儿发生综合术后不良事件的风险随胎龄的减小而增加。众所周知,胎龄28~37周出生的患儿被定义为早产儿,而此前的研究一致认为早产是影响新生儿术后发生不良事件的危险因素,且胎龄越小风险越高[3-4,6-8]。分析其原因,胎龄越小,患儿器官系统发育越不完善,往往合并多种疾病。有研究显示,早产儿非心脏手术的住院病死率是足月儿的5 倍(10.5%vs2.0%),且早产儿发生动脉导管未闭、肺动脉高压、肺部疾病、术后呼吸暂停、肠道疾病的风险均高于足月儿[9-14]。早产儿的呼吸控制系统不成熟,易出现呼吸暂停,在手术应激、低体温、麻醉药物的作用下甚至容易产生致死性呼吸暂停[9]。据报道,几乎所有胎龄小于28 周的新生儿都有呼吸暂停相关症状,胎龄为34 周时可降至20%左右,胎龄超过34 周可降至10%以下[12]。另外,早产儿患喉软化症、气管软化症、气道狭窄和声门下狭窄的风险更高,导致气道内径减小及气道阻力升高,呼吸做功增加,呼吸肌更容易疲劳。这些可能都是早产儿更易患肺部疾病的原因,也是本研究中新生儿术后呼吸系统相关并发症为术后主要不良事件的原因。坏死性小肠结肠炎主要与早产和低出生体质量有关,其特征是不同程度的肠道坏死,常并发穿孔和暴发性败血症,近10%的新生儿会出现大面积的肠道受累,需要大面积切除肠道,有可能导致短肠综合征,从而导致新生儿恢复与生长缓慢[3,13-16]。这也是本研究感染与肝肾功能不全等不良事件发生率较高的原因。本研究发现,胎龄37~38 周的患儿是术后综合不良事件发生的高危人群,分析其原因可能是本研究采用的病房全程管理的内外科嵌合模式有关。在此模式下,若患儿无明显急诊手术指征,医生常延长其术前住院时间(如针对早产儿,待其生长至足月胎龄再行手术)、予以插管纠正呼吸衰竭、积极抗感染改善肺部疾病等术前优化措施,但这些措施似乎产生了混杂作用,掩盖了早产儿产生的不良影响,这也是本研究中早产儿并非危险因素的原因;但本研究中胎龄过低是综合不良事件发生的危险因素,且胎龄小于267 d 时,发生术后不良事件的风险随胎龄的减小而增加,说明即便纠正胎龄,原始胎龄过低造成的影响仍持续到术后,难以改善。因此,对于<38 周的不同胎龄组产生的术后影响还需进行亚组分析,进一步探讨其影响。
关于新生儿麻醉的研究重点集中在预防缺氧和维持心率上,而对血压和器官流量充足性的关注较少[17]。有研究证实MAP 对早产儿脑氧合有影响[18],早期连续动态血压监测可预测极早产儿足月时的MRI脑损伤[19]。本研究发现入手术室时MAP 低是新生儿术后不良事件的独立危险因素,MAP 低于53 mmHg时,发生不良事件的风险增加,这或许能为麻醉管理提供一定理论依据。
对于新生儿的血压干预一直存在争议,有研究建议,当新生儿MAP低于胎龄时或低于30 mmHg应进行扩容或升压治疗[20]。一项大型前瞻性多中心队列研究显示,积极使用扩容或升压药治疗极低胎龄新生儿早期低血压对于出生后24月龄生长发育迟缓没有改善,这表明早期积极的血压干预似乎益处不大[21]。有研究认为,儿茶酚胺类药物的使用可改善大循环功能,提高先天性膈疝儿童的MAP 和心率,但会损伤微循环,导致预后不良[22]。这可能是因为新生儿心脏在儿茶酚胺的作用下很容易出现心肌损伤和能量底物消耗[16]。Ismail 等[23]在用亚甲蓝与加压素类似物治疗早产儿难治性脓毒性休克时发现,这些药物可显著改善MAP,显著降低去甲肾上腺素需求并减少副作用。目前四川大学华西第二医院常用的改善新生儿血压的血管活性药物为儿茶酚胺类药物,这可能在一定程度上减少了新生儿术后不良事件的发生,使用亚甲蓝与加压素类似药物来改善血压的方法也值得借鉴。有研究认为,检测血清miR-16表达水平对新生儿败血症患儿发生心功能障碍有一定诊断价值[24]。如果有类似检测手段,早期检测并干预或许能更大程度保证器官灌注。
本研究是依据新生儿入手术室时收缩压和舒张压间接计算MAP[MAP=(收缩压+2×舒张压)/3]。有研究认为,新生儿的桡动脉压力波不同于成人,上述MAP 的计算可能不准确[25];但也有研究认为在全身麻醉下的足月儿中,示波法无创和有创动脉内血压监测的MAP 几乎是一致的[26]。da Costa 等[27]则认为生命最初24 h 内脑血管反应强度确定最佳MAP 是可行的。如何更好地监测与维持血压和器官流量充足性还有待进一步探索。
在国内,传统上新生儿外科从属于小儿外科或普通外科,术前患儿一般情况的管理与优化主要由外科医师管理,根据术中情况选择术后回外科病房或是转入NICU。而我院创新使用的新生儿病房一体化管理模式则是新生儿从入院开始即收入专业的新生儿病房,由专业的新生儿内科医师进行管理。在此基础上,再由新生儿外科医师和麻醉医师从各自的专业角度出发,优化术前管理。术后患儿全部回到新生儿病房进行统一管理,实现了围术期一体化一贯制管理。本研究纳入的所有患儿,均由同一组新生儿医师进行管理,最大程度上保证了医疗实践的一致性,围术期新生儿病死率也明显低于世界平均水平[28]。且此管理模式在国内尚不多见。然而本研究为单中心研究,不能完全反映整个地区人群的水平;且本研究为回顾性病例对照研究,患儿疾病诊断来源于病案首页的主要诊断,结果存在一定偏倚。此模式的具体优势还有待进行前瞻性、多中心研究进行横向对比。
综上所述,新生儿仍是术后发生不良事件的高风险人群,提高产前诊断措施、优化胎儿子宫内及子宫外生产时间以改善胎龄带来的相关影响,提高新生儿入手术室时血压或许能降低新生儿术后不良事件的发生率,改善长期预后。
