小肝癌微血管侵犯风险术前列线图预测模型的构建与验证
2024-03-28王茜柴新群
王茜,柴新群
华中科技大学同济医学院附属协和医院 肝胆外科,湖北 武汉 430022
国家癌症中心公布的最新数据显示,我国每年肝癌新发患者38万人左右,死亡病例33.6万,发病率居恶性肿瘤第4位,死亡率居恶性肿瘤疾病第2位[1]。原发性肝癌主要包括肝细胞癌,胆管细胞癌及混合细胞癌三种组织学亚型,其中肝细胞癌最为常见,占比高达90%[2]。临床将肝内单发病灶最大径≤3 cm或2个病灶最大径之和≤3 cm的癌结节称为小肝癌(small hepatocellular carcinoma,SHCC)[3]。现阶段根治性肝切除术仍是原发性肝癌主要的治疗手段,但术后5年复发率可达70%[4]。相关临床研究已证实,微血管侵犯(microvascular invasion,MVI)是原发性肝癌复发的主要危险因素,术前发现MVI对诊疗方案的选择及手术预后具有重要意义[5]。然而当前MVI只能通过术后病理确诊,具有一定滞后性,部分研究表明AFP水平、炎症指标、肿瘤直径及放射组学等与MVI的发生关系密切[6],但是关于SHCC患者发生MVI相关危险因素的研究并不多见。本研究旨在通过回顾性分析我院288例SHCC患者的临床资料,探讨SHCC患者发生MVI的危险因素,并根据相关危险因素构建术前列线图预测模型,以期为SHCC患者的干预和治疗提供更精确的指导。
1 资料和方法
1.1 一般资料
回顾性分析2018年8 月至2023年8 月华中科技大学同济医学院附属协和医院因SHCC行根治性肝切除术的288 例患者的临床资料,根据术后病理结果是否存在MVI分为两组,MVI阳性组(n=96)和MVI阴性组(n=192)。MVI阳性组术后病理提示低分化肝细胞癌65例,中分化肝细胞癌30例,高分化肝细胞癌1例;MVI阴性组术后病理提示低分化肝细胞癌63 例,中分化肝细胞癌103 例,高分化肝细胞癌26例。本研究获得华中科技大学同济医学院附属协和医院医学伦理委员会批准(批号:[2023]伦审0586字号)。
纳入标准:(1)首次通过常规影像学检查发现肝脏小病灶(单个病灶最大直径不超过3 cm或2个病灶直径之和不超过3 cm)且术后病理学检查证实为肝细胞癌;(2)本次手术为根治性切除术;(3)术前接受普美显磁共振检查以明确影像学特征表现;(4)神志清醒,智力正常,可配合进行相关检查。
排除标准:(1)接受肝脏射频、微波消融或介入等治疗;(2)对造影剂过敏;(3)妊娠期及哺乳期妇女;(4)合并心、肺、肾等重要脏器严重疾病;(5)合并其他恶性肿瘤;
1.2 观察指标
1.2.1 一般指标 性别、年龄、身体质量指数(BMI)、有无临床表现(腹痛腹胀、发热、病灶增大等)、乙肝病史、有无合并肝硬化、肝功能Child-Pugh分级等。
1.2.2 血清学指标 甲胎蛋白(AFP)、白细胞计数(WBC)、血小板计数(PLT)、中性粒细胞计数(NE)、淋巴细胞计数(LY)、单核细胞计数(MO)、总胆红素(TBIL)、白蛋白(ALB)、丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、谷氨酰转移酶(GGT)、碱性磷酸酶(ALP)、国际标准化比值(INR)、凝血酶原时间(PT)、纤维蛋白原(FIB)等。
1.2.3 炎症指标 AST/PLT(APRI)、FIB/ALB(FAR)、NE/LY(NLR)、PLT/LY(PLR)、AST/LY(ALRI)、AST/ALT(AAR)、AST/NE(ANRI)、LY/MO(LMR)、NE×GGT/LY(NrLR)、全身炎症反应指数(SIRI)、全身免疫炎症指数(SII)、预后营养指数(PNI)等12个炎症指标,其中SIRI=MO×NE/LY,SII=PLT×NE/LY,PNI=ALB+5×LY。
1.2.4 术前影像学检查 肿瘤数目;肿瘤最大径取CT或MRI肿瘤最大径;肿瘤包膜是否强化(影像学提示包膜不规则强化);肿瘤边界是否清晰(影像学提示肿瘤边界是否光滑、有无毛刺征)等。
1.2.5 病理指标 组织学分型;肿瘤分化程度等。所有血清学检查指标结果均为术前1周以内结果。
所有影像学报告及病理报告均由2 名经验丰富且具有高级职称的专业影像科及病理科医师单独评价,如2名医师诊断不一致,则继续讨论,直至取得一致结论。
1.3 术后随访
采用门诊复查、电话随访等方式进行随访,患者于术后定期复查腹部超声或上腹部CT、血常规、肝肾功能及凝血功能等指标,评估SHCC患者术后肝功能恢复情况、复发率、生存时间、并发症等。随访时间截至2023年10月。
1.4 统计学分析
采用SPSS 26.0 和R4.3.1 统计软件进行数据处理。计量资料以()表示,组间比较采用t检验;计数资料以例(%)表示,组间比较用χ2检验或Fisher精确检验。利用受试者工作特征(receiver operating characteristic,ROC)曲线,通过计算Youden指数的最大值确定各指标对MVI预测的最佳截断值,并转换为二分类变量。以术后病理结果是否发生MVI为因变量,采用Lasso回归对变量进行降维处理,筛选系数未归零的变量,再通过多因素Logistic回归分析筛选出与SHCC发生MVI相关的主要独立危险因素。根据上述多因素回归结果应用R软件(4.3.1)建立术前列线图预测模型。绘制ROC曲线,以曲线下面积(area under the curve,AUC)、一致性指数(C-index)评估模型的区分度以及预测效能,绘制校准曲线评估模型的校准度,绘制临床决策曲线(decision curve analysis,DCA)评估模型的获益性,P<0.05为差异有统计学意义。
2 结果
2.1 两组一般资料比较
两组纳入患者均为单发SHCC,且在性别、年龄、BMI、是否合并临床表现、肝功能Child-Pugh分级、基础肝病、边缘是否清晰、LY、TBIL、ALB、PT、FAR、LMR、APRI、NrLR、PNI、ALRI、AAR、ANRI等变量比较差异均无统计学意义(P>0.05),在肿瘤最大径、包膜是否强化、术前AFP水平、病理分化程度、WBC、PLT、NE、PLR、NLR、SIRI、SII、ANRI等变量比较差异有统计学意义(P<0.05),见表1。

表1 MVI阳性组与MVI阴性组患者一般资料比较
2.2 各项指标预测MVI的最佳截断值
绘制ROC曲线,通过计算Youden指数的最大值以确定术前血清学、炎症指标等相关因素预测MVI的最佳截断值,见表2。本研究中TBIL、ALB、ALT、AST、ALP、GGT等指标截断值采用本研究中心血清学检查正常值的上限。
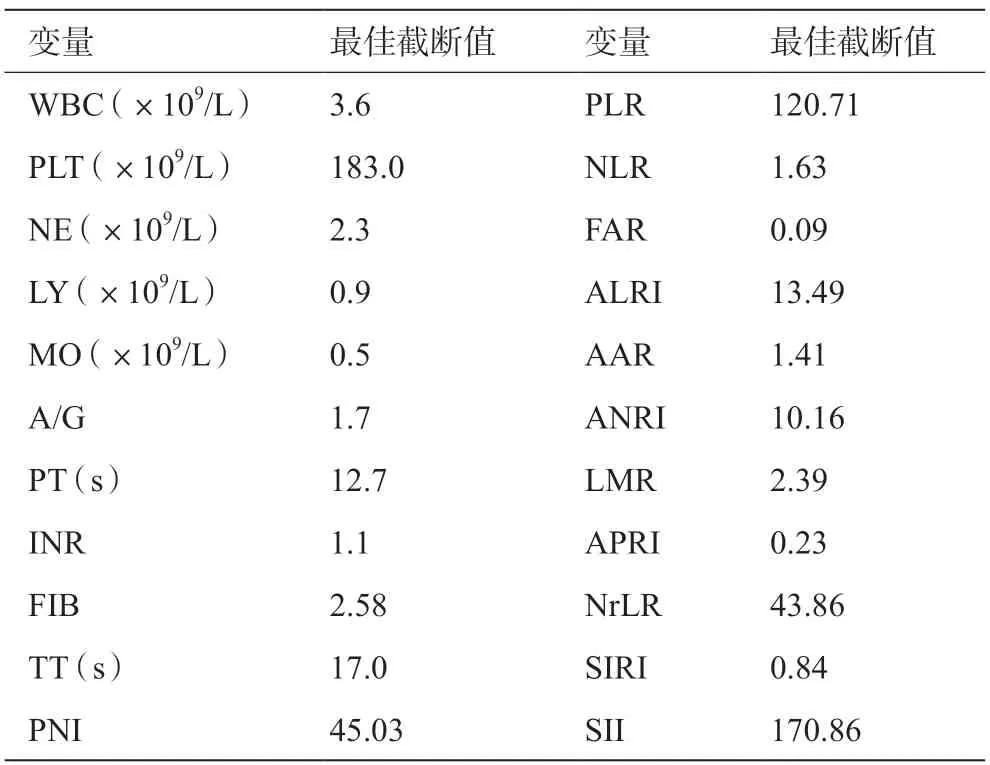
表2 各项指标最佳截断值
2.3 Lasso回归结合Logistic回归分析筛选变量
将上述38个变量纳入Lasso回归分析,当最小均方误差的λ=0.025时,左侧虚线所对应的惩罚值最低,共筛选出16个非零系数的变量,分别为AFP、包膜是否强化、PLR、NLR、FAR、LMR、SII、SIRI、ALRI、AAR、PLT、NE、LY、TBIL、PT、肿瘤最大径,此时Lasso回归模型的拟合效果最佳,见图1A、1B。
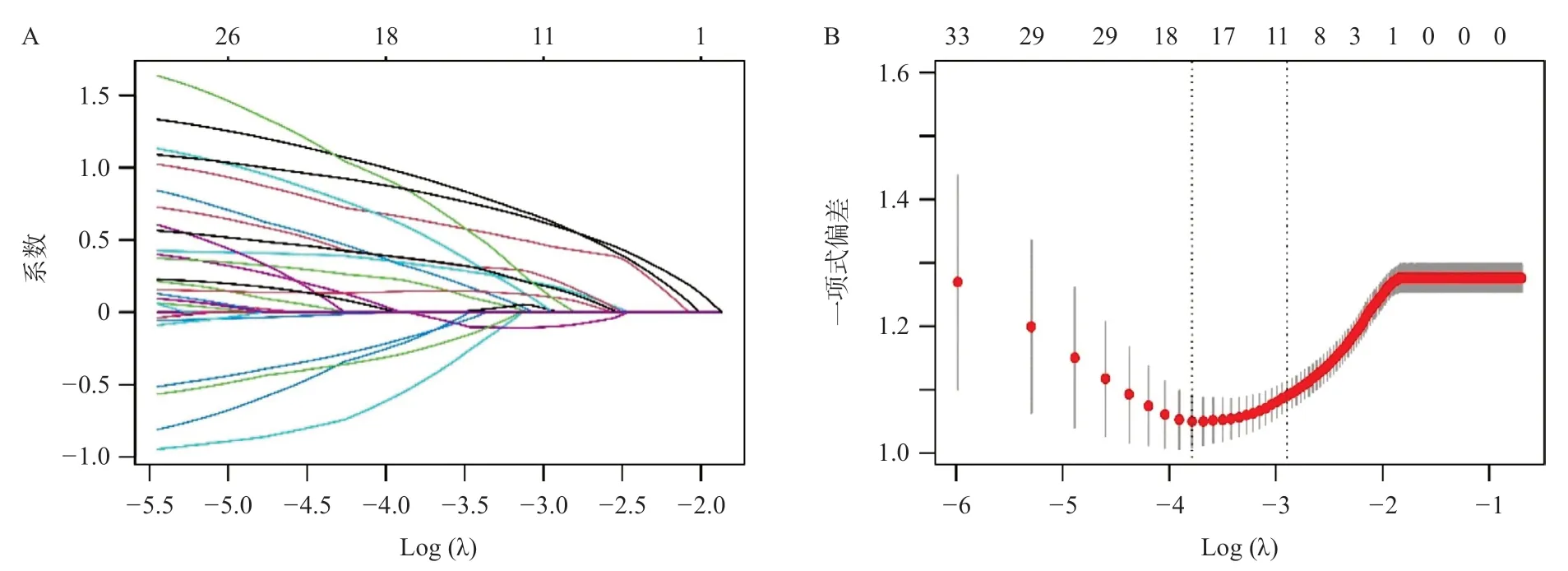
图1 Lasso回归分析
将Lasso回归分析筛选出的16 个变量进行单因素分析,共筛选出肿瘤最大径、包膜是否强化、AFP、PLR、NLR、FAR、SII、SIRI、PLT、NE、LY及PT 12个变量,见表3。将上述12个变量纳入多因素Logistics回归分析,结果显示,肿瘤最大径、包膜强化、AFP≥200 ng/mL、NLR≥1.63、SII≥170.86、PLT≥183.0×109/L为SHCC患者发生MVI的独立危险因素(P<0.05),见表4。

表3 小肝癌患者发生MVI的单因素分析
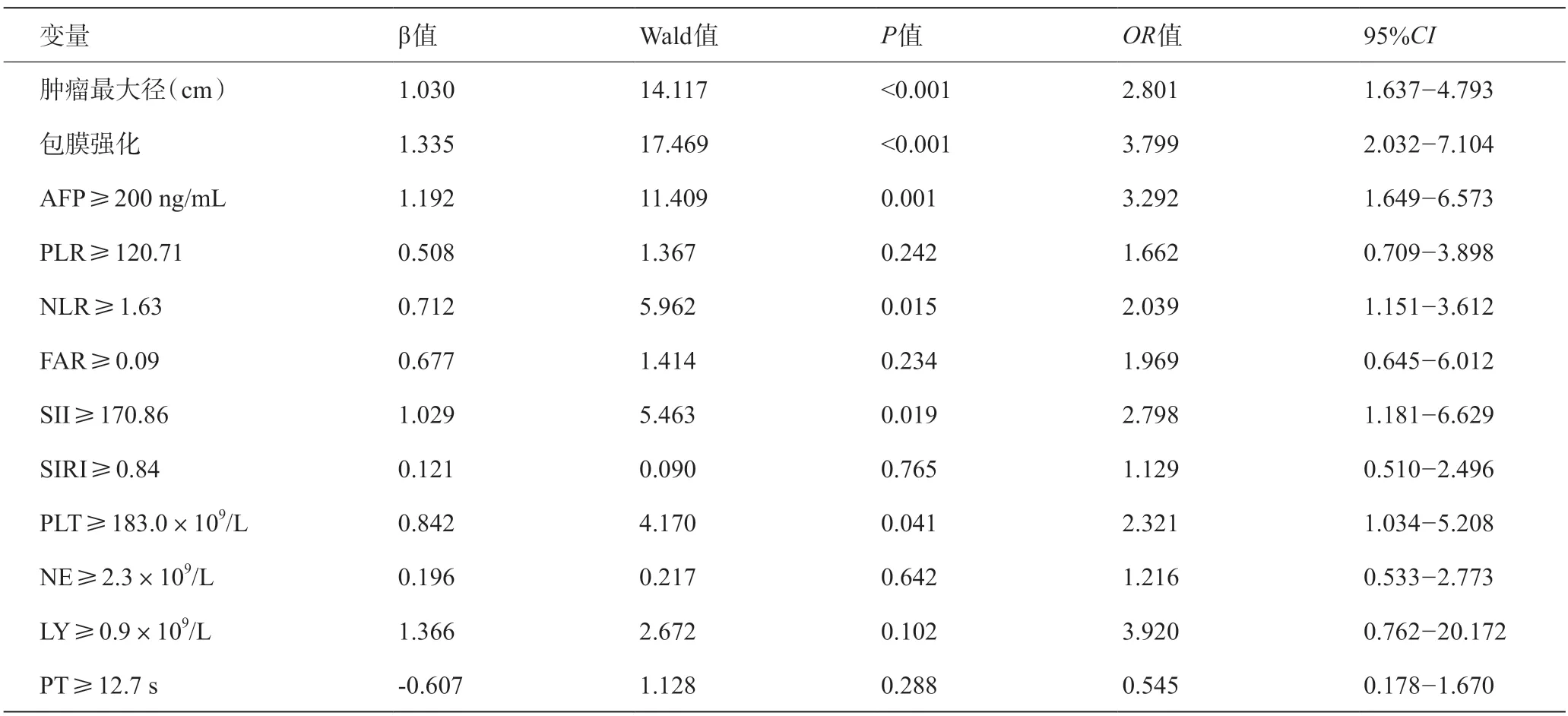
表4 小肝癌患者发生MVI的多因素Logistic回归分析
2.4 术前列线图预测模型的构建
将多因素Logistic回归分析筛选出的6个独立危险因素作为预测指标,构建SHCC患者发生MVI的风险术前列线图预测模型,见图2。根据列线图对上述筛选出的肿瘤最大径、包膜强化、AFP、NLR、SII及PLT 6个独立危险因素进行赋值,见表5。
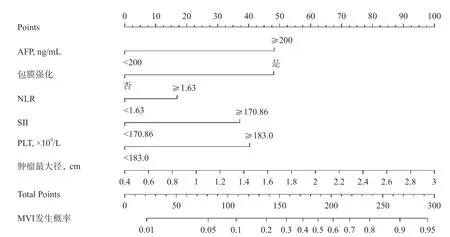
图2 小肝癌发生MVI的术前列线图预测模型
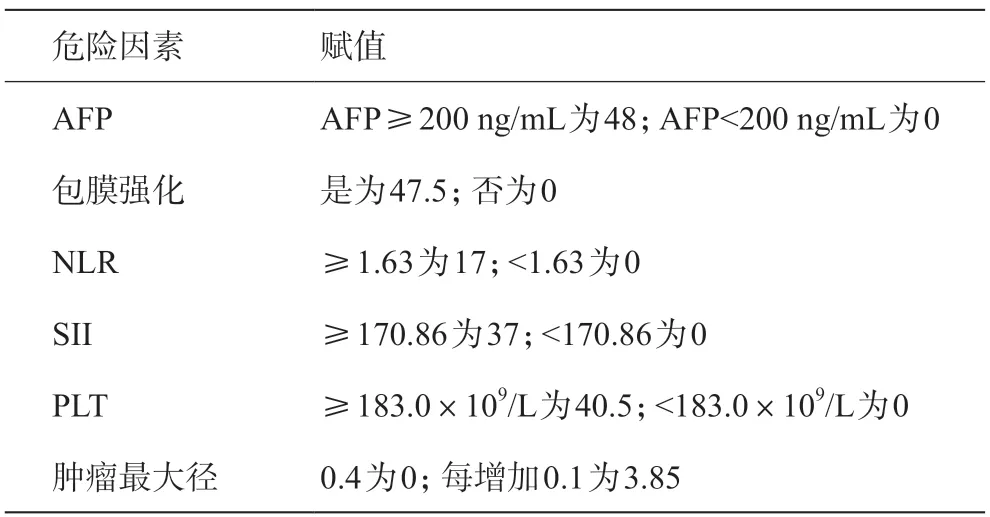
表5 危险因素评分表
2.5 术前列线图预测模型的评价
对列线图进行1000次的Bootstrap自抽样内部验证,该列线图模型的一致性指数(C-index)为0.823,模型预测效能良好。ROC曲线结果显示AUC=0.823(95%CI0.772-0.875),敏感度为0.656,特异度为0.859,提示模型具有良好区分度,见图3。通过Youden指数计算出列线图最佳的总分截断值181.3分,≥181.3分划分为MVI高风险人群,<181.3分为MVI低风险人群,与病理结果相比,该列线图模型的准确率为78.5%(226/288),敏感性为65.6%(63/96),特异性为84.9%(163/192),阳性预测值为68.5%(63/92),阴性预测值为83.2%(163/196),见表6。Calibration校准曲线显示列线图预测SHCC发生MVI的风险与实际发生风险之间具有良好的一致性,见图4。DCA曲线显示列线图模型的临床净收益高于“所有患者均有MVI”和“所有患者均无MVI”,有较强的临床适用性,见图5。
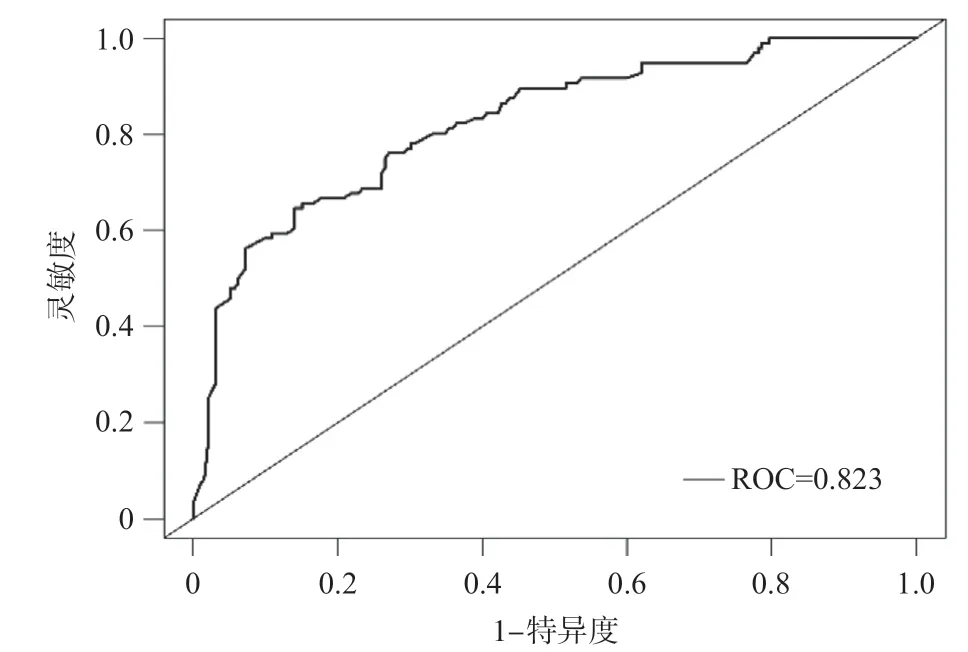
图3 预测SHCC患者发生MVI的ROC曲线

图4 预测SHCC患者发生MVI列线图术前列线图预测模型的校准曲线

图5 预测SHCC患者发生MVI列线图术前列线图预测模型的决策曲线

表6 术前列线图预测模型与病理诊断比较
3 讨论
MVI也称微血管癌栓,主要是指在显微镜下于内皮细胞衬覆的血管腔内见到癌细胞巢团,是门静脉癌栓发生的初始阶段[7-8],目前术后病理仍是确诊MVI的金标准。MVI主要反映了SHCC的侵袭性,是肝癌术后复发的重要预测指标[9]。相关研究证明,即使是SHCC,MVI仍是肝癌患者的不良预后(包括复发风险增加和远期生存率降低)的独立危险因素[7]。聂彬等[10]认为,手术切缘距离>1 cm的手术方案能明显降低肝癌复发率降低,提高总生存率,因此术前预测SHCC患者是否发生MVI不仅可以指导手术方式的选择,还可为术前新辅助方案的选择提供依据,在改善患者预后方面具有重要意义。本研究主要通过筛选血清学指标、炎症指标、肿瘤直径及放射组学中与MVI相关的独立危险因素,并建立术前列线图预测模型以指导临床应用。
AFP作为肝细胞癌的特异性肿瘤标志物,是原发性肝癌早期诊断的重要指标特,特异度可达93.3%[11-12]。相关研究证明,血清AFP水平越高,肝癌患者生存时间越短[13],说明AFP水平与预后关系密切,这可能与高水平的AFP会帮助肝癌细胞逃避免疫系统同时刺激血管内皮生长,进而加速肿瘤侵犯、MVI的进程,最后导致不良预后发生有一定关系。本研究结果显示AFP≥200 ng/mL是SHCC发生MVI的独立危险因素,这与既往研究结果基本一致[14-15]。
肝细胞癌的假包膜征象是其较为特征的影像学表现之一。假包膜征象由肿瘤生长挤压周围组织导致,一般由增生的纤维组织及被挤压的肝细胞构成。肿瘤包膜对肝细胞癌侵犯周围肝实质起到了一定的限制作用,但同时包膜中血管也更易受到肝细胞癌侵犯。因此当影像学检查提示包膜不规则强化时,往往意味着肿瘤容易出现浸润性生长,侵犯周围肝实质,同时更易发生MVI[16]。Logistic回归分析结果显示,影像学提示包膜不规则强化不仅是SHCC患者发生MVI的主要独立危险因素,并且与MVI的发生关系极为密切,有利于MVI的术前诊断。此外,Pawlik等[17]和Chen等[18]发现,肿瘤最大径与MVI的发生成正相关,瘤体越大,发生MVI的风险越高,这可能与肿瘤体积越大,血供越丰富有一定的关系[18]。在本研究中,肿瘤最大径越大,MVI的发生率越高。
炎症反应与肝细胞癌的发生和复发密切相关[19],持续的慢性炎症反应不仅可促进SHCC的发生,对于MVI也起到一定的促进作用[20]。几种重要的炎症预后指标包括NLR、SIRI、SII等可反映SHCC患者的全身炎症和免疫状态,与SHCC进展密切相关。此外,Tjon等[21]认为,血小板计数与肿瘤转移和不良预后有一定关系,血小板计数越高,发生不良预后的可能性越大。在本研究中,NLR≥1.63、SII≥170.86 及PLT≥183.0×109/L是SHCC发生MVI的独立危险因素,前期的较多研究已证实NLR及SII与肝癌患者发生MVI具有一定相关性[22-23],但是PLT与肝癌患者发生MVI的关系尚不明确。COP-NLR是一种在NLR、血小板基础上研发而来的新型炎症预后评分系统,目前已被证实是预测肝切除术后患者发生不良预后的独立危险因素[24],这与本研究结果相符合。
随着循证医学的深入研究,疾病预测模型在临床上的应用也越来越广泛。本研究通过Lasso回归分析联合单因素、多因素Logistic回归分析结果,筛选出6 个与SHCC发生MVI相关的独立危险因素,构建一个可视化SHCC患者发生MVI的术前列线图预测模型,并且对该列线图模型进行验证。该模型ROC曲线AUC为0.823,灵敏度为65.6%,特异度为85.9%,与病理结果相比,该列线图模型的准确率为78.5%,提示预测效能良好。Calibration校准曲线显示列线图预测SHCC发生MVI的风险与实际发生风险之间具有良好的一致性,DCA曲线显示列线图模型的有较强的临床适用性,临床上可根据上述因素对患者进行术前早期预测,帮助选择手术方式,以及预防不良预后,有利于个体化治疗干预,为临床决策提供依据。
本研究存在不足之处:(1)本研究为单中心回顾性研究,样本数量有限,纳入患者均为单发SHCC,可能存在一定的选择偏倚;(2)本研究中部分指标的截断值存在一定的主观性,可能对研究结果有一定的影响;(3)本研究未对患者的预后进行探索。后续拟进行大样本、多中心研究的前瞻性研究进一步完善和验证该术前预测模型。
综上所述,基于肿瘤最大径、包膜强化、AFP≥200 ng/mL、NLR≥1.63、SII≥170.86、PLT≥183.0×109/L所建立的术前预测模型能够直观、可靠地反映SHCC发生MVI的风险程度;当总分≥181.3分时提示该SHCC患者为MVI高风险人群,当总分<181.3分时提示为MVI低风险人群。该术前预测模型简单易行,具有较强的临床适应性,对指导临床决策,改善不良预后具有重要价值。
