人脐带间充质干细胞(hUC-MSC)对肝纤维化小鼠模型的治疗作用及其机制分析
2024-03-28刘平箕姚黎超胡雪王铮熊芷玉江应安
刘平箕, 姚黎超, 胡雪, 王铮, 熊芷玉, 江应安
武汉大学人民医院感染科, 武汉 430060
肝纤维化表现为细胞外基质蛋白(如Ⅰ型胶原蛋白和纤维连接蛋白)的过度沉积,是慢性病毒感染、酒精性脂肪性肝炎和非酒精性脂肪性肝炎等慢性肝损伤的常见后遗症,严重时可能导致肝硬化伴门静脉高压[1-2]。肝纤维化的特征是肝星状细胞(hepatic stellate cell,HSC)的活化和增殖,HSC是产生基质的肌成纤维细胞的主要来源。静态和储存维生素A的HSC的纤维化激活可由来自肝细胞、肝窦内皮细胞、自然杀伤细胞和巨噬细胞等细胞的细胞外信号介导[2]。活化的肝星状细胞(aHSC)在肝纤维化过程中发挥关键作用,诱导细胞凋亡以消耗aHSC的抗纤维化策略被寄予厚望,但目前仍缺乏被认可的临床证据[3]。近几十年来,间充质干细胞(mesenchymal stem cell,MSC)治疗已成为慢性肝病最有希望的治疗方法之一[4]。MSC可来源于骨髓、脐带和脂肪组织,临床和实验证据表明,MSC可通过自分泌或旁分泌多种免疫抑制因子、营养因子和外泌体,甚至分化为功能性肝细胞,发挥抗纤维化作用,并促进肝再生[5]。几丁质酶3样蛋白1(chitinase-3 like-protein-1,CHI3L1)是18-糖基水解酶家族成员,肝脏中高度富含CHI3L1,巨噬细胞、中性粒细胞和HSC等均可以表达CHI3L1[6]。研究[7]表明,血清CHI3L1可作为代偿期肝硬化患者发生首次失代偿事件风险的有效预测因子,且在联合Child-Pugh分级后具有更高的预测价值。但CHI3L1在肝纤维化中的具体作用及其是否与人脐带MSC(human umbilical cord derived mesenchymal stem cell,hUC-MSC)的治疗效应相关尚不清楚,本实验将对此研究探讨。
1 材料与方法
1.1 实验动物 选取18只SPF级6周龄C57BL/6小鼠,小鼠由武汉大学人民医院中心试验室提供(生产许可证号:SCXK2019-0004,使用许可证号:SYXK2015-0027)并饲养于该实验室,适应性饲养1周后使用随机数字表法随机分为3组,分别为对照组、CCl4模型组(CCl4组)和hUCMSC治疗组(MSC组),每组6只。以1 mg/kg CCl4腹腔注射构建小鼠肝纤维化模型,CCl4以1∶9的比例溶于玉米油溶液中。CCl4组和MSC组每周腹腔注射10% CCl4溶液2次,连续注射8周,对照组同时注射相同剂量玉米油,MSC组在注射CCl4溶液的第7、8周经尾静脉注射hUCMSC(1×106个/只),每周注射2次。于第8周末采取小鼠血清,处死小鼠,取小鼠肝脏固定,每组选择4只小鼠检测血清,MSC组1只小鼠血清样本不合格。
1.2 实验试剂 CCl4和玉米油购于上海Sigma-Aldrich公司,Anti-CHI3L1和Anti-Bax一抗购于武汉Abclonal公司,Anti-GADPH一抗和山羊抗兔IgG HRP购于上海Absin公司,重组CHI3L1和TGF-β购于武汉Abclonal公司,Antiα-SMA一抗和荧光二抗购于上海Abcam公司。
1.3 细胞来源与培养 hUC-MSC购于深圳茵冠生物科技有限公司,LX2(永生化的人源性HSC)购于中国科学院典型培养物保藏中心。hUC-MSC和LX2均用含10%胎牛血清的DMEM培养基在5% CO2、37 ℃恒温恒湿培养箱中培养,当细胞汇合度达到80%时,以胰酶消化进行传代,TGF-β干预LX2以获得aHSC,Transwell小室用于hUC-MSC和LX2共培养,1.0×105的hUC-MSC接种于上室,1.0×105个HSC接种于下室,CHI3L1加入共培养体系中以探索MSC的作用机制,500 ng/mL的重组CHI3L1被证实能够显著促进HSC的增殖和激活[8]。共培养24 h后收集HSC用于Western Blot试验。
1.4 研究方法
1.4.1 酶联免疫吸附试验(ELISA) IL-1β、IL-6、IL-10和TNF-α ELISA试剂套装购于上海碧云天生物技术公司,按照说明书操作。用标准样品制作标准曲线,将待测样品加入酶标板中,室温下孵育120 min,洗板后加入生物素化抗体室温孵育60 min,洗板后加入HRP-Streptavidin室温孵育20 min,洗板后加入TMB显色剂室温下避光孵育20 min,加入终止液后使用酶标仪检测A450值。
1.4.2 生化指标检测 获取小鼠血清后,样本送往武汉大学人民医院检验科检测ALT、AST、ALP。
1.4.3 免疫组织荧光染色 将石蜡切片放入二甲苯-梯度酒精脱蜡复水,在抗原修复缓冲液中进行抗原修复,随后在山羊血清中进行封闭,封闭结束后在一抗中孵育过夜,随后用二抗孵育,再用DAPI复染细胞核,最后以抗荧光淬灭剂封片。
1.4.4 病理染色 常规以二甲苯-梯度酒精对石蜡切片脱蜡复水,随后进行苏木素染液染细胞核和返蓝试剂返蓝,HE染色经历伊红染液对细胞质进行染色,Masson染色经历丽春红染液-磷钼酸溶液-苯胺蓝染液处理,天狼星红染色使用天狼星红苦味酸染液染色,最后梯度酒精-二甲苯脱水透明并加入中性树脂封片。
1.4.5 Western Blot试验 用裂解缓冲液(武汉塞维尔生物公司)从组织(液氮研磨后)和细胞中提取蛋白质,10% SDS-PAGE凝胶电泳用于分离蛋白,分离蛋白后将蛋白转移至PVDF膜(Millipore,美国)上,然后在4 ℃冰箱中用一抗孵育过夜,随后用二抗孵育1 h,曝光显影仪(BIO-RAD,美国)用于显示蛋白条带,ImageJ v1.8.0用于蛋白条带定量分析。
1.5 统计学方法 使用SPSS 26.0和GraphPad Prism v9.0.0进行统计分析。计量资料以表示,多组间比较采用单因素方差分析,进一步两两比较采用Dunnett-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组小鼠肝脏病理结果比较 HE染色结果显示,相较于对照组,CCl4组细胞排列混乱,细胞肿胀明显,部分细胞的细胞核消失,汇管区大量炎症细胞浸润,正常肝小叶结构被破坏。经过干预后,MSC组细胞肿胀和汇管区炎症浸润较CCl4组明显改善(图1a)。Masson染色结果显示,被蓝染的胶原纤维仅见于对照组的血管区,但可见于CCl4组的肝实质;对照组仅在血管区可见被蓝染的胶原纤维(图1b)。天狼星红染色结果显示,CCl4组可见被红染的胶原纤维较粗,且有连接汇管区的趋势(图1c)。经过hUC-MSC干预后,MSC组肝实质内胶原纤维较CCl4组分布少(P<0.05)(图1d)。

图1 各组小鼠肝脏组织病理变化Figure 1 Pathological changes in liver tissue of mice in each group
2.2 hUC-MSC治疗对肝纤维化小鼠炎症指标的影响3组小鼠IL-1β、IL-6水平差异有统计学意义(P值均<0.05)。CCl4组IL-1β、IL-6水平均较对照组升高(P值均<0.05);经过hUC-MSC治疗后,MSC组IL-6水平较CCl4组明显降低(P<0.05)(表1)。
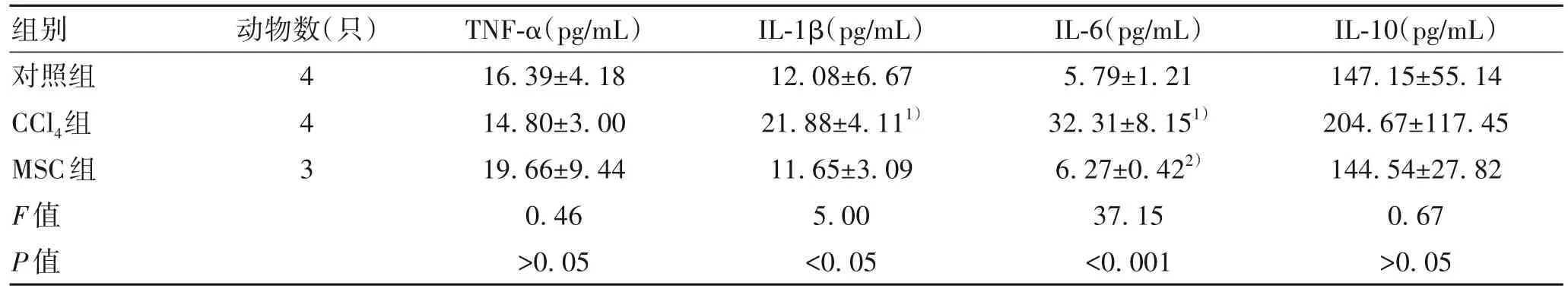
表1 各组小鼠血清炎症因子表达水平比较Table 1 Serum inflammatory factors expression levels in mice of each group
2.3 hUC-MSC治疗对肝纤维化小鼠肝功能指标的影响3组小鼠ALT、AST、ALP水平差异有统计学意义(P值均<0.01)。CCl4组ALT、AST和ALP水平均较对照组升高(P值均<0.05);经过hUC-MSC治疗后,MSC组ALT、AST和ALP水平均较CCl4组降低(P值均<0.05)(表2)。

表2 各组小鼠血清ALT、AST、ALP水平比较Table 2 Serum ALT, AST, and ALP levels in mice of each group
2.4 hUC-MSC治疗对肝纤维化小鼠aHSC表达的影响α-SMA是aHSC的标志[9],α-SMA的免疫荧光结果显示,CCl4组中α-SMA分布(红色)较对照组增多(P<0.000 1);经过hUC-MSC治疗后,MSC组α-SMA分布较CCl4组减少(P<0.000 1)(图2)。

图2 各组小鼠肝脏组织中α-SMA的表达(×200)Figure 2 Expression of α-SMA in liver tissue of mice in each group (×200)
2.5 hUC-MSC通过下调CHI3L1促进aHSC的凋亡Western Blot试验结果显示,CCl4组CHI3L1水平较对照组和MSC组均显著升高(P值均<0.05)(图3a),升高趋势与α-SMA分布一致,提示两者具有关联性。使用重组CHI3L1干预aHSC和MSC的共培养,并检测其凋亡指标Bax,结果显示,Bax在aHSC-MSC共培养组中的表达高于仅有aHSC的对照组和添加CHI3L1的aHSC-MSC共培养组(P值均<0.05)(图3b),提示CHI3L1逆转了MSC对aHSC的促凋亡作用。未发现Bax在对照组、CCl4组和MSC组中存在明显差异(P>0.05)(图3c)。
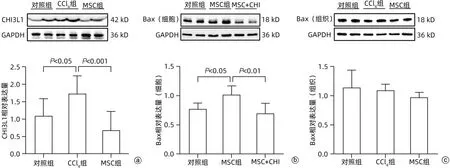
图3 CHI3L1和Bax在各组小鼠中的表达水平比较Figure 3 Protein expression of CHI3L1 and Bax in each group
3 讨论
MSC是一种经典的多能干细胞,具有广阔的临床应用前景[10]。目前,多项关于MSC治疗肝脏疾病的研究正在开展,且部分研究已证实MSC疗法的有效性和安全性[11]。MSC改善肝纤维化的作用机制复杂,其免疫调控功能主要体现在抑制自然杀伤细胞、促进巨噬细胞向M2极化、上调调节性T淋巴细胞等,此外,MSC可以通过分泌肝细胞生长因子、表皮生长因子等保护肝细胞[12]。骨髓源性MSC的外泌体还可通过促进肝细胞自噬,抑制D-半乳糖胺/脂多糖导致的肝细胞凋亡[13]。
HSC是肝纤维化过程中成纤维细胞的主要来源,在促纤维介质和细胞因子的刺激下,HSC被激活并生成α-SMA和胶原蛋白,随后导致基质沉积和纤维化。研究[9]表明,携带新型环状RNA(circDIDO1)的MSC外泌体可以通过抑制HSC激活,并促进其凋亡,缓解肝纤维化。本研究结果显示,CCl4组小鼠肝脏中的α-SMA荧光信号明显强于对照组和MSC组;将aHSC和MSC共培养,凋亡标志物Bax显著高于独立培养的aHSC组。上述结果提示MSC可促进aHSC的凋亡。对照组、CCl4组和MSC组中的Bax表达未见明显差异,可能与MSC抑制肝脏其他细胞的凋亡相关[13],MSC对不同细胞的选择性调控可能消除了Bax的差异。
本研究发现,MSC的治疗作用可能与CHI3L1下调相关。CHI3L1可由多种细胞合成,且与包括HBV在内的多种病因所致的肝硬化相关[6]。老年人群肝脏CHI3L1表达量高于年轻人群,且CHI3L1促进HSC的增殖和活化[8]。CHI3L1能够抑制死亡受体Fas介导的嗜酸性粒细胞、T淋巴细胞和巨噬细胞凋亡[14],此外,CHI3L1可通过抑制Fas介导的巨噬细胞凋亡,进而加重肝纤维化[15]。本研究发现CHI3L1和α-SMA具有相同的下调趋势,表明MSC对aHSC的促凋亡作用可能是经CHI3L1实现。进一步研究发现,重组CHI3L1逆转了MSC对HSC的促凋亡作用,证实了CHI3L1的抑制细胞凋亡的作用,MSC治疗可下调CHI3L1,从而促进aHSC凋亡,最终改善肝纤维化。
综上所述,hUC-MSC可减轻肝纤维化小鼠的炎症因子水平、纤维化程度及肝功能,作用机制可能与抑制CHI3L1进而促进HSC的凋亡相关。鉴于肝内多种细胞均可表达CHI3L1,本研究未证明被调控的CHI3L1主要来源于哪种细胞,有待进一步研究探讨。
伦理学声明:本研究方案于2022年9月1日经由武汉大学人民医院伦理委员会审批,批号:20220901A,符合实验室动物管理与使用准则。
利益冲突声明:本文不存在任何利益冲突。
作者贡献声明:刘平箕、姚黎超负责设计论文框架,起草论文;刘平箕、胡雪负责实验操作,研究过程的实施;王铮、熊芷玉负责数据收集,统计学分析,绘制图表;江应安负责论文修改,拟定写作思路,指导撰写文章并最后定稿。
