阿奇霉素急性暴露对斑马鱼幼鱼的毒性效应
2024-03-28张尚祎刘兴成王慧利钱秋慧苏州科技大学环境科学与工程学院江苏苏州215009
蒲 倩,张尚祎,陈 晨,刘兴成,王慧利,钱秋慧(苏州科技大学环境科学与工程学院,江苏 苏州 215009)
阿奇霉素(AZM)属于大环内酯类抗生素,由于AZM 的大规模生产和使用,导致其通过各种途径排放到水环境中并持续积累.全球各国的市政污水、地表水以及地下水等介质中都检测到了AZM的存在[1-3].
抗生素的过量使用和不适当的排放方式可能导致其在水环境中富集,并诱发生态健康风险[4].抗生素进入人体后也会对健康造成不良影响.流行病学研究表明,长期接触抗生素与儿童患特应性皮炎、过敏、哮喘、幼年特发性关节炎和神经发育障碍的风险增加有关[5].一些研究已证实,抗生素对鱼类产生的影响包括氧化应激、脂质和葡萄糖代谢紊乱、免疫抑制以及遗传毒性[6-9].现有研究表明,在小鼠中,通过喂食AZM 能降低短链脂肪酸和胆汁酸的含量,最终导致脂肪合成增加[10];斑马鱼幼鱼暴露于梯度浓度AZM 后,会出现肝损伤、肝脏区域大小改变、肝组织透明度下降和肝组织脂质堆积等病变[11],此外,AZM 的暴露还可以引起斑马鱼幼鱼明显的心脏毒性[12].关于AZM 毒理学效应的研究较少且不够全面.因此,本文选用斑马鱼作为模式生物,旨在全面评估AZM 急性暴露对斑马鱼幼鱼的潜在毒性影响.
1 材料与方法
1.1 动物实验
野生型斑马鱼(AB 系)购自中国武汉斑马鱼研究中心,经3 周驯化后进行育种.将所有成年斑马鱼雌雄分开置于斑马鱼养殖系统中,饲养条件为:28°C,pH(7.2±0.2).光照周期为14h/10h(光/暗),每天喂食两次丰年虾.
1.2 实验试剂及仪器
主要试剂:阿奇霉素二水合物(CAS:83905-01-5,99.9%)购于上海梯希爱化成工业发展有限公司;丙酮(CAS No.67-64-1,99.9%)和无水乙醇均购于上海联试化工试剂有限公司;PBS 粉末和乙酰胆碱酯酶(AChE)活性检测试剂盒均购于北京索莱宝科技有限公司;BCA 蛋白浓度测定试剂盒购于碧云天生物技术有限公司.
主要仪器:斑马鱼养殖系统(上海海圣生物实验设备有限公司);斑马鱼行为分析仪器(Danion Vision,荷兰 Noldus);立体荧光显微镜(Nikon, Tokyo,Japan);Thermo 全波长酶标仪(美国赛默飞公司).
1.3 实验方法
1.3.1 斑马鱼饲养及胚胎收集 斑马鱼的饲养操作,依照先前研究所述[13].斑马鱼生长3 个月龄即可性成熟,从养殖槽中选取成年斑马鱼4~6 对,提前一天晚上将雌雄斑马鱼按照1:1 的比例置于产卵器中,利用插板隔开放置一晚.第二天早上开灯将透明插板取下,刺激斑马鱼产卵.挑选优质胚胎,6h 后分别暴露于控制组、AZM 浓度梯度组(4mg/L、8mg/L 和16mg/L).每隔24h 更换1 次暴露药液,以确保维持所需的暴露浓度,并持续暴露胚胎直至实验结束.
1.3.2 阿奇霉素急性暴露下斑马鱼的表观形态学改变观察 在亚致死浓度0,4,8 和16mg/L 下对24,48,72,96hpf 的胚胎和幼鱼分别进行观察并拍照记录,同时对第72hpf 斑马鱼脊索进行观察并拍照.
1.3.3 转基因斑马鱼的发育观察 分别利用Tg(elavl3:EGFP)和Tg(kdrl:mCherry)转基因品系评价AZM 对斑马鱼神经发育和血管发育的影响;利用Tg(rag2:DsRed)转基因品系评价AZM 对胸腺T 细胞分化形成的影响,使用立体荧光显微镜(Nikon,Tokyo, Japan)对96hpf 幼鱼脑部神经元、6dpf 幼鱼血管和120hpf 幼鱼胸腺进行成像.
1.3.4 阿奇霉素急性暴露下斑马鱼幼鱼行为学分析 将暴露在AZM 梯度浓度下的斑马鱼胚胎从6hpf 培养至120hpf,转移到96 孔板并放入Noldus行为分析仪中进行观察分析,系统所有设置依照我们先前的研究所述[14],设置完成后即对斑马鱼的行为进行分析.
1.3.5 斑马鱼乙酰胆碱酯酶(AChE)的测定与分析从控制组和AZM 暴露组中分别取70 条幼鱼(5dpf)于1.5mL 的EP 管内,使用去酶PBS 清洗2 次,吸净溶液并放置电子天平秤量,根据重量(g):体积(mL)=1:9 的比例,再次加入去酶PBS 进行超声匀浆,在2500r/min 下低温离心10min.蛋白浓度和AChE 酶活性测定均根据试剂盒说明书操作进行.
1.3.6 阿奇霉素靶基因的预测及富集分析(1)使用Chemdraw20.0 软件绘制AZM 的化学结构图,转成mol2 文件格式后输入至PharmMapper 网站(http://lilab-ecust.cn/pharmmapper/index.html)进行分析预测,得到AZM 可能作用的靶基因.
(2)将从PharmMapper中获得的284个蛋白输入到String数据库(https://cn.string-db.org)中,获得对应斑马鱼目标基因.
(3)将筛选得到的目标基因导入微生信在线分析网(https://www.bioinformatics.com.cn),根据基因标识以分子生物学功能(MF)、生物学过程(BP)和细胞学组分(CC)进行 GO 功能分类和KEGG 富集分析.
1.3.7 斑马鱼巨噬细胞染色 将暴露完成后的斑马鱼幼鱼(4dpf)以30 条/孔置于6 孔板内,加入循环水配制的中性红工作液(2.5µg/mL),28℃避光孵育7h.弃去染液,使用PBS 清洗3 次,加入MS-222 麻醉后在体视显微镜下观察.
1.3.8 统计分析 本文的实验数据以平均数±标准差(SD;n=3)的形式表示,采用SPSS19.0 软件(IBM,USA)进行单因素方差分析,并在显著性水平P<0.05、P<0.01 或P<0.001 下进行了统计.
2 结果与分析
2.1 阿奇霉素急性暴露诱导斑马鱼表观形态改变
从图1 可以看出,高浓度(16mg/L)暴露组的斑马鱼在72h 出现了明显的畸形.随着暴露时间的增加,暴露于AZM 的斑马鱼出现了脊椎弯曲现象.与此同时,斑马鱼出现游囊闭合、卵黄囊肿现象.随着暴露浓度的增加,上述现象越明显.这表明,在该剂量下,AZM 的急性暴露以浓度依赖的方式对斑马鱼幼鱼早期发育产生了影响.
2.2 阿奇霉素急性暴露导致斑马鱼脊索发育异常
脊索是脊椎动物的主要结构,斑马鱼的脊索在胚胎发育阶段提供结构支撑,使得幼鱼能够进行自主运动[15].同时,还具有保护脊髓和主要血管的作用.通过显微镜观察发现,与对照相比,经过AZM 暴露后的斑马鱼脊索出现了弯曲现象,尤其是在16mg/L 浓度组中,脊索的弯曲最为显著,并且经过浓度梯度暴露的斑马鱼脊索液泡出现了紊乱和不规则的情况(图2(a)).斑马鱼依靠脊索实现自由运动,而脊索的异常发育往往与神经密切相关,基于此展开以下研究.

图2 阿奇霉素暴露导致斑马鱼幼鱼脊索/神经元损伤Fig.2 Exposure to azithromycin leads to notochord/neuronal damage in zebrafish larvae
2.3 阿奇霉素急性暴露抑制斑马鱼神经元的发育
基于斑马鱼出现脊索弯曲的现象,为了进一步探究AZM 是否对斑马鱼的神经系统产生影响,采用转基因斑马鱼Tg(elavl3:EGFP)品系观察AZM暴露对神经元发育的潜在影响. Tg(elavl3:EGFP)是将发绿色荧光蛋白EGFP 被整合到elavl3 基因的启动子序列中,elavl3 基因是一种神经元特异性RNA,在神经元发育中起重要的调节作用[15].在斑马鱼幼鱼的神经元早期发育过程中,elavl3 基因发挥着重要作用.通过显微镜观察,结果如图2(b)、2(c)所示,AZM 暴露显著降低了elavl3 的表达水平,脑部的神经元明显减少.同时,观察到高浓度组的荧光强度稍有减弱,神经元轴突变短.上述结果表明AZM 引起斑马鱼神经元发育异常,并可能影响斑马鱼对外界刺激的反应.
2.4 阿奇霉素急性暴露引发斑马鱼行为学改变
斑马鱼的早期神经中枢系统容易受到环境干扰的影响,在明暗交替环境中,幼鱼表现出特定的运动模式,运动行为的变化通常可以作为神经毒性的终点指标[16].与对照相比,AZM 暴露组(8,16mg/L)都表现出移动距离变短(图3(d))、移动速度变慢(图3(e))、光暗节律失衡(图3(a)).轨迹图和热图的分析结果也进一步证明了这一点(图3(c)),处理组的轨迹杂乱且数量较少,热图显示斑马鱼在某一区域的停留时间更长,尤其是在高浓度组(16mg/L)中.此外,在转角实验中观察到,8mg/L 和16mg/L 浓度组的斑马鱼转角增大(图3(b)),表明幼鱼可能出现了焦虑、恐惧和不安的情绪.这些观察结果表明,AZM 的急性暴露降低了斑马鱼的运动活力和反应敏感性,引发了斑马鱼的行为异常.

图3 阿奇霉素暴露导致斑马鱼幼鱼行为异常Fig.3 Exposure to azithromycin causes abnormal behaviors in larvae
2.5 阿奇霉素急性暴露导致斑马鱼AChE 活性降低
AChE 是胆碱能突触中乙酰胆碱水解的关键酶,参与细胞发育和成熟,能促进神经元的发育和再生,并被认为是发育神经毒性的生物标志物[17-18].AChE 已被证明参与许多生物体的运动行为[19],当AChE 活性受到抑制时,乙酰胆碱会积累,最终导致生物体的运动行为异常.在本研究中,当斑马鱼急性暴露于不同浓度的AZM 后,AChE 活性普遍呈现下降趋势(图4).在4mg/L 浓度组中,AChE 虽有下降趋势,但其在统计学上并未达到显著水平,在16mg/L浓度组中,对AChE活性的抑制作用更为显著,结果显示,AZM 对AChE 的抑制作用呈现出明显的浓度依赖性特征.这些结果表明,AZM 的暴露对斑马鱼幼鱼产生了明显的神经毒性效应,具体表现为影响其脊柱和神经元的正常发育,改变其运动行为,以及对AChE 活性产生抑制作用.
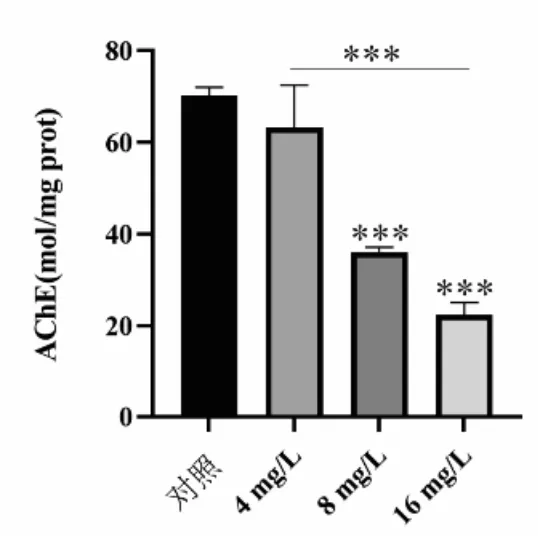
图4 阿奇霉素暴露导致AChE 活性变化Fig.4 Exposure to azithromycin leads to changes in AChE activity
2.6 AZM 暴露作用靶基因预测及功能富集分析
由图5 可知,靶基因富集在多个通路上,包括一个叶酸碳库、果糖和甘露糖代谢、核苷酸代谢、丙酮酸代谢、嘧啶代谢PPAR 信号通路、C 型凝集素信号通路、Fox O 信号通路、VEGF signaling pathway、碳代谢等代谢通路(图5(a)).GO 富集分析包含生物过程(BP)、细胞组分(CC)和分子功能(MF)3 个部分,结果显示靶基因涉及凝血、先天免疫反应和含嘌呤化合物代谢过程等生物过程;与质膜的外在成分、质膜细胞质侧的外在成分、细胞外空间、蛋白质酪氨酸激酶活性、质膜的细胞质侧和膜的外在成分细胞组分有关;在分子功能方面,主要涉及到核受体活性、配体激活的转录因子活性、类固醇激素受体活性、蛋白酪氨酸激酶活性等方面(图5(b)).根据上述富集分析结果,发现AZM 可能通过调控VEGF 信号通路和凝血生物过程对斑马鱼血管产生影响.同时,AZM 还通过C 型凝集素信号通路和先天免疫反应生物过程对斑马鱼的免疫系统产生作用.

图5 阿奇霉素作用靶基因的KEGG 富集分析和GO 功能分类Fig.5 KEGG enrichment analysis and GO functional classification of target genes affected by azithromycin
2.7 阿奇霉素急性暴露导致斑马鱼血管发育畸形
基于生物信息学结果, AZM 可能具有影响斑马鱼血管发育的潜在作用.使用Tg(kdrl:mCherry)品系斑马鱼进一步实验,Tg(kdrl:mCherry)中的kdrl 基因在血管形成初期表达活跃,对维持正常血管功能和修复受损血管起重要作用.如图6 所示.AZM 暴露组出现血管分支异常、血管排列分布杂乱并且荧光强度随暴露浓度增加而减弱.这些结果表明,AZM 的急性暴露以浓度依赖的方式加剧了斑马鱼早期血管发育的畸形,与生物信息学分析预测的结果相一致.

图6 阿奇霉素急性暴露导致斑马鱼血管发育畸形Fig.6 Acute exposure to azithromycin causes vascular developmental malformations in zebrafish
2.8 阿奇霉素急性暴露导致斑马鱼免疫系统紊乱
为验证AZM 急性暴露对免疫系统产生影响,从先天免疫系统和适应性免疫系统两方面进行验证.巨噬细胞属于先天性免疫系统,是斑马鱼幼鱼发育时期的第一个免疫细胞,最早在受精后22h 发育,而适应性免疫(T 细胞)主要在幼鱼后期发育过程建立.通过对4dpf 斑马鱼幼鱼进行中性红染色,使用显微镜观察并拍摄头部的巨噬细胞(图7(a)).

图7 阿奇霉素暴露诱导斑马鱼免疫系统紊乱Fig.7 Exposure to azithromycin induces immune system disorder in zebrafish
分析结果显示,AZM 暴露组的斑马鱼头部的巨噬细胞数量显著多于对照组.进一步定量分析显示,4,8mg/L 暴露组的斑马鱼头部巨噬细胞的数量分别为37 和45 个(图7(c)),与对照组相比具有统计学差异(P<0.05,P<0.001).而在高浓度(16mg/L)下,AZM暴露表现出促进斑马鱼巨噬细胞形成的趋势.与此同时,使用转基因Tg(rag2:DsRed)斑马鱼追踪胸腺T细胞的发育情况,发现AZM 暴露下斑马鱼胸腺面积减少(图7(b)、7(d)).随着AZM 浓度的增加,幼鱼胸腺发育的抑制效果越明显,这也暗示AZM 可能对斑马鱼的适应性免疫有抑制作用.综上,在上述浓度暴露下,AZM 会激活斑马鱼幼鱼的先天免疫反应,抑制其适应性免疫,从而导致免疫系统发生紊乱.
3 讨论
通过对斑马鱼进行AZM 的亚致死剂量急性暴露实验,发现AZM 暴露会导致斑马鱼生长畸形、游囊发育不完整和脊椎畸形,且这种异常现象随着暴露浓度的增加而加剧.游囊是斑马鱼发育过程中的重要器官,通过充气或放气的方式维持斑马鱼在水中的平衡,其发育不全有可能对斑马鱼的摄食和运动行为造成不良影响[20].因此,推测AZM 可能具有神经毒性效应. Coffin 等[21]研究发现AZM 暴露会诱导斑马鱼侧线毛细胞发育异常,同时在Mendonça-Gomes 等[22]的研究中也观察到AZM 暴露能够改变AChE 的含量.
在脊椎动物中作为生物体轴线的关键组成部分,具有支撑脊柱形成的作用.特别是在斑马鱼这一模式生物中,脊索细胞不仅为周围组织提供关键的发育信号,还引导着包括血管、神经管在内的多种组织的分化和发育[15].本研究发现,在AZM急性暴露下,斑马鱼幼鱼出现了一系列脊索相关的异常表现,包括脊索弯曲,脊索液泡紊乱以及形态不规则等现象.这些异常状况可能会对斑马鱼的神经系统和行为产生深远影响.为了探究这一假设,进一步研究了AZM 暴露下elavl3 基因的表达情况,该基因在神经元分化和维持中起到重要作用[23].通过使用转基因斑马鱼模型Tg(elavl3:EGFP),发现AZM 暴露确实导致了斑马鱼神经元数量的显著减少.在斑马鱼的生长和发育过程中,其行为模式逐渐受到中枢神经系统的调控,成为中枢神经系统发育成熟的关键指标[24].值得注意的是,斑马鱼在明暗交替的环境中会展示特定的运动模式,这一观察进一步强调了其运动行为在神经系统发育中的重要性[25].自主运动及光暗节律实验结果显示,在AZM 暴露下,斑马鱼幼鱼的移动距离和运动速度显著降低,同时还出现了光暗节律的失衡.这些异常行为表明斑马鱼在AZM 暴露后出现了类似于焦虑和抑郁的心理状态. AChE 是评估神经毒性的一个重要生物标志物,主要通过降解乙酰胆碱(ACh)来调节神经传导[26].在本研究中,暴露于AZM 的斑马鱼幼鱼表现出AChE 活性明显降低的现象.综上所述,AZM急性暴露不仅导致斑马鱼出现脊索损伤,还影响其神经元的发育和AChE 的活性,从而对斑马鱼的行为表现产生了不良影响.
为了探究AZM 潜在的神经毒性机制,采用生物信息学手段预测了AZM 作用的目标基因,并对这些基因进行了通路富集分析.然而,结果并未显示与神经系统密切相关的通路,而是更多地富集在血管形成和免疫系统相关通路上.研究表明,血管和神经系统在功能和解剖学上存在着密切的联系,例如轴突引导信号与血管模式的相互调节[27].进一步研究还发现AZM 有可能通过调控VEGF/Notch 信号通路来诱导斑马鱼的神经毒性[28].此外,在中枢神经系统中,神经元、神经胶质细胞和免疫细胞形成一个协调的网络来维持体内平衡和限制神经炎症.因此,免疫系统在保持正常脑功能方面也起着不可忽视的作用[29].基于此,推测AZM 可能通过调控血管生成和影响免疫系统从而诱发神经毒性.
为了验证这一假设,进行了实验验证.通过观察Tg(kdrl:mCherry)血管转基因斑马鱼,发现AZM 急性暴露组斑马鱼尾部血管分支异常且排布杂乱.这一现象与上述AZM 暴露下斑马鱼幼鱼行为学异常、神经元减少及AChE 活性降低的结果一致,进一步说明AZM 急性暴露导致斑马鱼幼鱼出现血管和神经毒性.
免疫系统在细胞层面主要由先天免疫(如巨噬细胞和中性粒细胞)和适应性免疫(如T 细胞和B 细胞)组成.在斑马鱼幼鱼的发育过程中,巨噬细胞是首个出现的免疫细胞类型,主要负责损伤修复和炎症反应的调控[30].在适应性免疫中,T 细胞负责识别特异性抗原,激活和调节其他免疫细胞,在维持免疫平衡和抵抗病原体方面起着关键作用[31].随着急性暴露AZM 浓度增加至8mg/L 时,我们观察到斑马鱼幼鱼先天免疫细胞(即巨噬细胞)数量明显增加,而适应性免疫细胞(即T 细胞)数量则出现下降,相应的胸腺面积也显著减少.表明AZM 暴露会造成斑马鱼先天免疫和适应性免疫的损伤.这一系列观察结果进一步印证了AZM 急性暴露不仅会对斑马鱼的血管系统和免疫系统产生毒性效应,而且还可能通过血管与神经系统,以及神经与免疫系统之间的相互作用和串扰,进一步诱发神经毒性.当然,这些推断还需要进一步的实验验证以强化其科学性和准确性.
4 结论
4.1 AZM 急性暴露造成斑马鱼幼鱼脊柱弯曲、卵黄囊水肿和游囊发育异常,并且异常程度随浓度梯度增加而增加.
4.2 AZM 急性暴露导致斑马鱼脊索损伤、脑部神经元减少、AChE 活性下降、自主运动活力减少和光暗节律失衡,上述指标均反映了AZM 对斑马鱼神经系统的毒性效应.
4.3 利用生物信息学预测出AZM 对斑马鱼作用靶基因的功能与血管和免疫相关.进一步的实验观察显示,在AZM 暴露下,斑马鱼幼鱼出现血管分支异常、巨噬细胞数量增加和胸腺T 细胞发育被抑制的现象,从而确证了AZM 具有诱导斑马鱼血管和免疫毒性的潜力.
