C/N 对HN-AD 菌藻颗粒污泥体系处理农村污水的影响
2024-03-28杨晨曦秦树敏赵婷婷重庆理工大学化学化工学院重庆400054
刘 欢,杨晨曦,秦树敏,龙 昆,赵婷婷,张 千(重庆理工大学化学化工学院,重庆 400054)
好氧颗粒污泥(AGS)是一种高效的废水处理技术.然而,长期运行中颗粒结构易失稳,导致出水水质恶化以及机械曝气能耗过高等弊端制约了该技术的大规模应用[1-3].近年来,有研究提出将AGS 技术与菌-藻共生系统耦合,构建菌-藻共生好氧颗粒污泥(ABGS)体系,以解决AGS 系统的技术难题.在ABGS 系统中,藻类通过光合作用将二氧化碳和水中的污染物同化,产生氧气供给好氧细菌氧化有机物进而降低曝气需求[4].而细菌氧化有机物产生的二氧化碳可供藻类利用.菌-藻共生关系有助于高效去除废水中的有机物和氮磷[5-7],从而实现减污降碳.此外,有研究发现菌-藻共生可以通过分泌更多的胞外聚合物(EPS)来维持颗粒污泥的性能和稳定[8].在共生系统中,由于细菌与藻之间代谢功能的变化,细菌与藻还可以通过生态位的变化来维持种间共生关系[9].尽管ABGS 系统具有较强的稳定性,然而AGS 结构内部溶解氧传导与基质扩散的主要限制因素也会对氮素去除效果产生影响[10].此外,碳氮比(C/N)是总氮(TN)去除的一个重要影响因素.ABGS系统在低C/N 条件下硝化菌增多,而高C/N 条件下光合作用受限,会破坏菌藻平衡及细菌种群生长[4].异养硝化好氧反硝化(HN-AD)菌在低碳条件下脱氮的潜能逐渐被挖掘,HN-AD 菌在C/N 为1.2~2 的条件下仍具有良好的脱氮性能[11-12].然而关于HNAD 菌与ABGS 系统结合的研究较少.有研究虽探讨了C/N(C/N=2,4,6,8,10,12)对HN-AD 菌与藻的共生体系脱氮及微生物群落的影响,发现TN 去除率与C/N 成正相关.同时微生物分析表明C/N 与体系中的微生物丰富度也成正相关,是影响微生物群落结构的主要因素[13].但是不同C/N 对HN-AD 菌-藻颗粒污泥新体系的氮去除效果、微生物特性影响以及脱氮路径鲜有研究.
综上,本文将AGS 技术同小球藻和HN-AD 菌进行有机结合,建立HN-AD 菌-藻颗粒污泥共生体系(H-ABGS),以合成农村污水为研究对象,通过污染物的测定与微生物分析手段,考察C/N 对H-ABGS 系统的污染物去除效果、微生物特性影响,以期为构建稳定、减碳降耗的新型ABGS 系统提供参考.
1 材料与方法
1.1 实验装置
实验装置如图1 所示,反应器由双层有机玻璃圆柱组成,外层是水浴层,内置加热棒,控制温度为(25±1)℃,反应器高80cm,内径10cm,工作体积为5.5L.反应器底部设有曝气盘,连接曝气机.
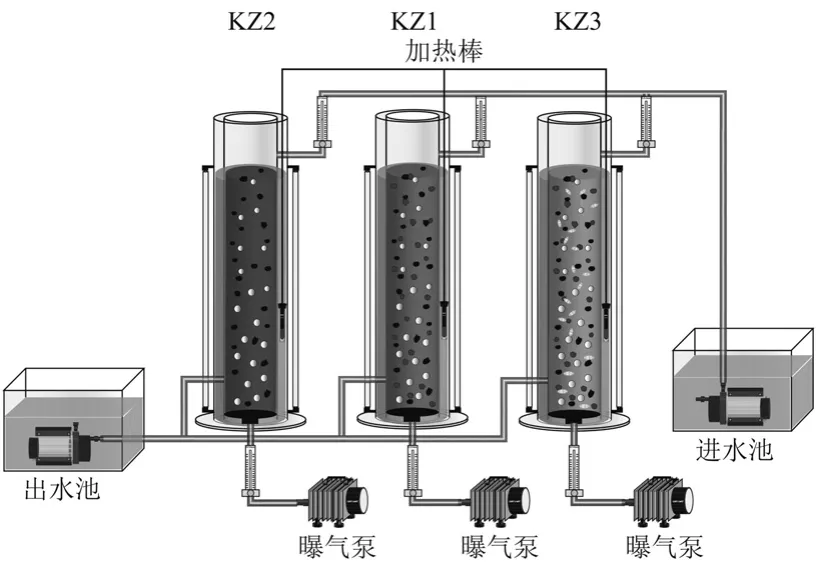
图1 实验装置Fig.1 Reactor
1.2 藻、颗粒污泥和菌剂
蛋白核小球藻(Chlorella pyrenoidosa,FACHB-9),购买自中科院水生生物所.接种蛋白核小球藻的质量浓度为14.07g/L,OD680为1.79.厌氧颗粒污泥购买自山东利博源环保材料有限公司.由厌氧颗粒污泥转为好氧颗粒污泥后,颗粒污泥K1 的污泥浓度为1.89g/L,颗粒污泥K2 的污泥浓度为1.85g/L,颗粒污泥K3 的污泥浓度为1.93g/L.HN-AD 菌剂为TA-1混合菌剂,筛选自极端环境,经过培养驯化后具有良好的脱氮特性.该混合菌剂由贪铜菌(Cupriavidus sp.SWA1) SWA1(10%~20%) 、 粪产碱杆菌(Alcaligenes faecalis)(5%~20%) 、 不动杆菌(Acinetobacter)(10%~30%)和苍白杆菌 TAC-2(Ochrobactrum sp.TAC-2)(20%~50%)复合而成.按照反应体积的5%接种,接种275mL 菌液.
1.3 实验条件及操作
颗粒污泥培养及驯化阶段系统进水为人工合成废水,进水特性如表1 所示.

表1 人工合成废水水质特性Table 1 Characteristics of artificially synthesized wastewater quality
控制DO 为(1±0.1)mg/L,进水C/N 为10,平行运行3 个装有厌氧颗粒污泥的反应器,分别编号为K1、K2、K3.将厌氧颗粒污泥在间歇式曝气条件下培养成AGS 体系[14].然后将藻加入K1 形成ABGS 体系KZ1;K2 体系中不加藻,由于驯化后微生物群落变化,编号为 KZ2;将藻和 HN-AD 菌加入 K3 形成H-ABGS 体系KZ3.根据生物和水质参数的变化趋势,当3 个反应器运行18d 后,出水指标TN、TP、COD、NH4+-N 稳定(连续5d 去除率的误差率在5%以内,此时认为反应器达到稳定).此时进行碳氮比(C/N=1,2,4,6,8,10)优化实验.
1.4 水质分析方法
本实验的水质指标均采用国家规定的标准方法,样品均采用平行测定[15].NH4+-N 用纳氏试剂分光光度法测定;TN 用碱性过硫酸钾消解分光光度法测定;TP 用钼酸铵分光光度法测定;CODcr 用重铬酸钾快速消解法测定.
1.5 微生物分析
DNA 提取前随机选取污泥在5000r/min 下离心5min,去除上清液后将生理盐水倒入样品中保存在−80℃冰箱中.采用MobioPowerSoil® DNA Isolation Kit 试剂盒提取生物膜DNA,将获得的DNA 样本送至上海美吉生物医药科技有限公司进行多样性分析,其中微生物样本分析数据已作为期刊附件数据NMDCX0000256 存储在国家微生物科学数据中心(NMDC),链接为https://nmdc.cn/resource/genomics/attachment/detail/NMDCX0000256).为了评估C/N对微生物群氮转化能力的影响,通过重建未观察状态(PICRUSt2)对群落进行系统发育调查,通过将测序reads 分配到京都基因与基因组百科(KEGG)同源物并推断功能途径来进行功能预测[16].每个酶基因的相对丰度为其预测序列数占一个样品中总序列数的百分比.为了研究细菌之间的共生模式,通过计算实体之间的成对Spearman 相关性来生成相关网络,并使用Gephi 0.9.5 对该网络进行可视化[17].
2 结果与讨论
2.1 启动阶段AGS、ABGS 与H-ABGS 体系的污染物去除性能对比
如图2(a~d)所示,AGS、ABGS 与H-ABGS 体系的COD 去除率分别为99.85%、86.01、83.62%,其中AGS 体系的COD 去除率最高.AGS、ABGS 与H-ABGS 体系的TN 去除率分别为50.57%、75.15%、89.62%.与AGS体系相比,ABGS体系的TN去除率提高了24.58%,这是由于接种微藻不但能够让污泥更快的形成成熟的颗粒结构,进而有稳定的缺氧区域,而且微藻的接种增加了藻对硝酸盐氮的同化作用[18].Su 等[19]利用ABGS 体系处理生活污水,当蛋白核小球藻与污泥质量比为5:1 时,氮和磷去除率最高分别为(91.0±7.0)%和(93.5±2.5)%.有趣的是,H- ABGS 体系的TN 去除率比ABGS 体系高出14.47%.有研究表明,接种HN-AD 菌可强化TN 去除效率[20]. AGS、ABGS 与H-ABGS 体系的NH4+-N 去除率分别为99.56%、99.28%、99.29%,3 个体系的NH4+-N 去除率差别不大.AGS、ABGS 与H-ABGS 体系的NO3--N去除率分别为77.86%、57.07%、70.46%. AGS 体系比ABGS 体系与H-ABGS 体系的NO3--N 去除率分别高出20.79%、7.4%,这是由于藻类的大规模繁殖抑制了硝化细菌的增殖,导致硝化作用差[21].
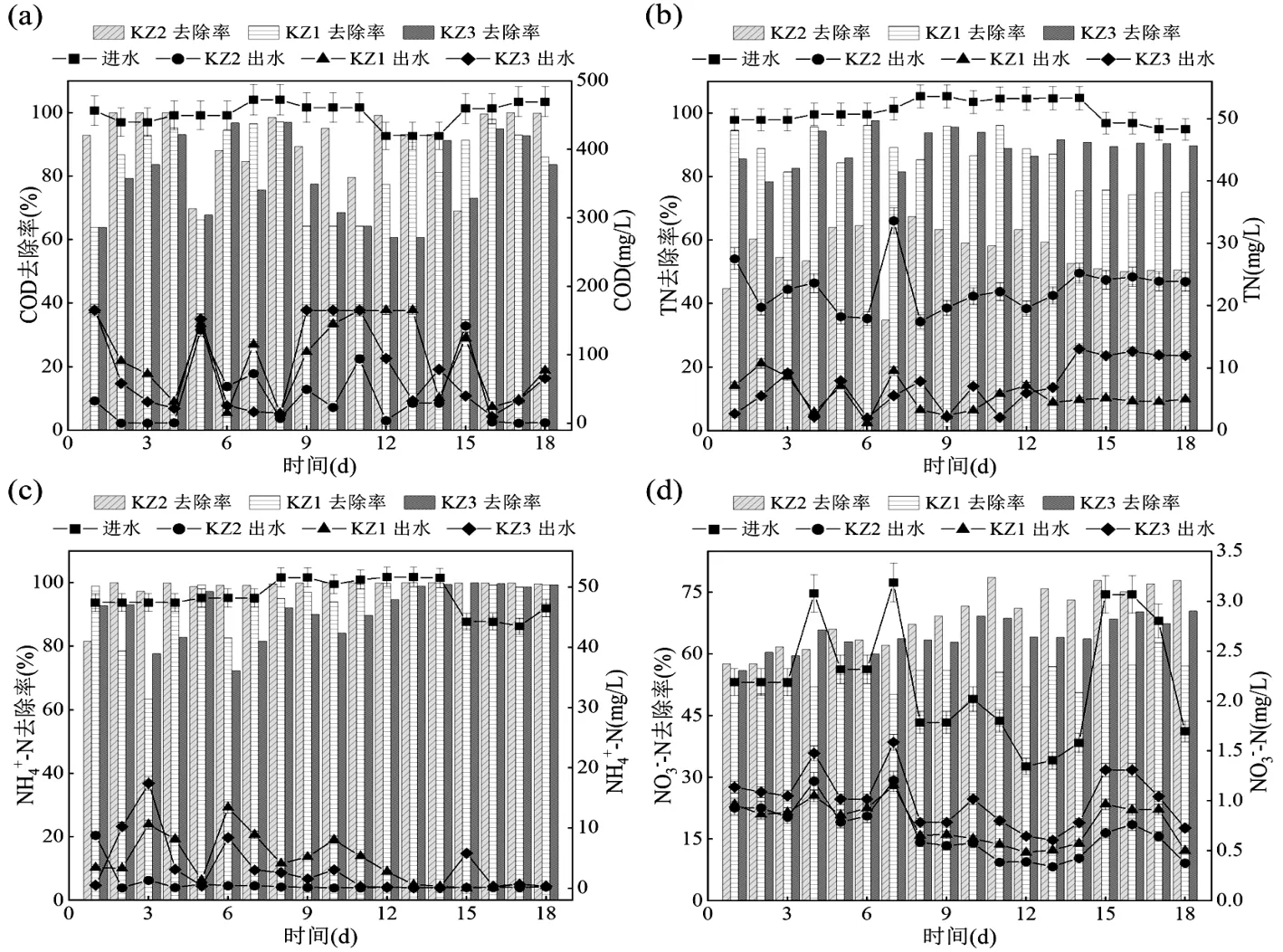
图2 AGS、ABGS、H-ABGS 体系水质指标变化情况Fig.2 Variations in water quality indicators in AGS, ABGS, and H-ABGS
2.2 不同C/N 对AGS、ABGS 与H-ABGS 体系中污染物去除效果影响
采用AGS、ABGS 与H-ABGS 体系处理人工合成废水,在HRT 为6h,DO 为(0.4±0.1) mg/L 的条件下(目前大部分关于ABGS 研究的C/N 多为6-10,同时在AGS 体系中,当C/N 低于4 时,可能会出现颗粒的解体或者不稳定.研究的主要目的是探究HN-AD 菌引入之后,该ABGS 体系能否在低碳环境下稳定,并且能否实现减碳降耗功能,因此增设了1,2,4这3个低C/N的条件;而对于C/N为1,2,4,6,8,10梯度的设计,参考了Zhang 等[13]的文献,同时这样的C/N 设定可能更接近于实际废水中的一些真实比值;此外,设定6 个C/N 对于统计学分析也更具意义),分别设置C/N为1,2,4,6,8,10连续运行.如图3所示,C/N为4~10 时ABGS、H-ABGS 体系TN、NH4+-N、COD、TP 满足《城镇污水处理厂污染物排放标准》[一级A 标](分别为15,5,50,0.5mg/L)排放.图3(a)表明,AGS体系的TN去除率与C/N为正相关,随着C/N的减小TN 去除率逐步降低,当C/N=2 时,颗粒污泥体系崩溃,对应TN去除率仅为23%.Luo等[22]的研究也有相似的结果,在研究C/N 比对AGS 结构稳定性的影响时,发现C/N 从4 降低到1 时,其胞外聚合物(EPS)中净酪氨酸产量的减少,以及主要的微生物群落转移,包括丝状细菌的减少导致了AGS 的崩溃解体.ABGS 体系随着C/N 的减小TN 去除率降低,其中当C/N=2 时,TN 去除率大幅下降,去除率仅为70%.值得注意的是,在ABGS 和H-ABGS 体系中,当C/N为1~10,TN 去除率可以达到《城镇污水处理厂污染物排放标准》一级A 标排放,这表明ABGS 和H-ABGS 体系在低C/N 条件下仍然对TN 等污染物有较好的去除效果,这可能是由于在较低的C/N 条件下,藻在生长过程中,向环境释放了许多胞外产物,如碳水化合物、氨基酸和多肽、糖、多元醇、维生素、酶等有机物[23],补充了菌必须的碳源.有趣的是,在C/N 为4 时,ABGS 和H-ABGS 体系的TN 去除率发生了明显差异,H-ABGS 体系的总氮去除率高于 ABGS 体系(12.05%)和 AGS 体系(44.86%).H-ABGS 体系在低碳条件下仍然保持高TN 去除率.这可能是适应低碳环境的HN-AD 菌发挥了主要作用[24-25].由图3(b)可知,AGS、ABGS 与H-ABGS 体系的TP 去除率随着C/N 的增大而减小,当C/N 为2时,AGS 体系的TP 去除率急剧下降,低于29%.这是因为一方面,聚磷菌在碳源充足的条件下能进行释磷和吸磷,而缺乏碳源则会抑制聚磷菌的聚磷效果[26].另一方面,聚磷菌在颗粒内部厌氧释磷,同时颗粒外部好氧吸磷,从而大幅提高TP 的去除率.然而,当氮负荷过高时,大量污泥开始解体和疏松,导致微观环境缺乏聚磷菌所需的条件[27],因此,TP 的去除率降低.其中ABGS 与H-ABGS 体系的TP 去除率远高于AGS 体系,表明加入蛋白核小球藻能提高AGS体系的TP 去除率.由图3(c)可知,ABGS 与H-ABGS体系中NH4+-N 去除率差别不大,NH4+-N 去除率随C/N 变化波动较小.然而,当C/N≤2 时,AGS 体系中NH4+-N 去除率迅速下降,无法达标排放.由图3(d)可知,ABGS 与H-ABGS 体系的COD 去除效率随着C/N 增大而增大,其中当C/N 为1 时,ABGS 与H-ABGS 体系COD 去除率显著高于AGS 体系.分析结果表明,低碳环境下(C/N≤4),AGS 体系表现出明显的不适应,TN、TP、NH4+-N 及COD 的去除率较低且波动大.而H-ABGS 体系相较ABGS 体系和AGS 体系,其更适应低碳环境,仍可保持高污染物去除性能.
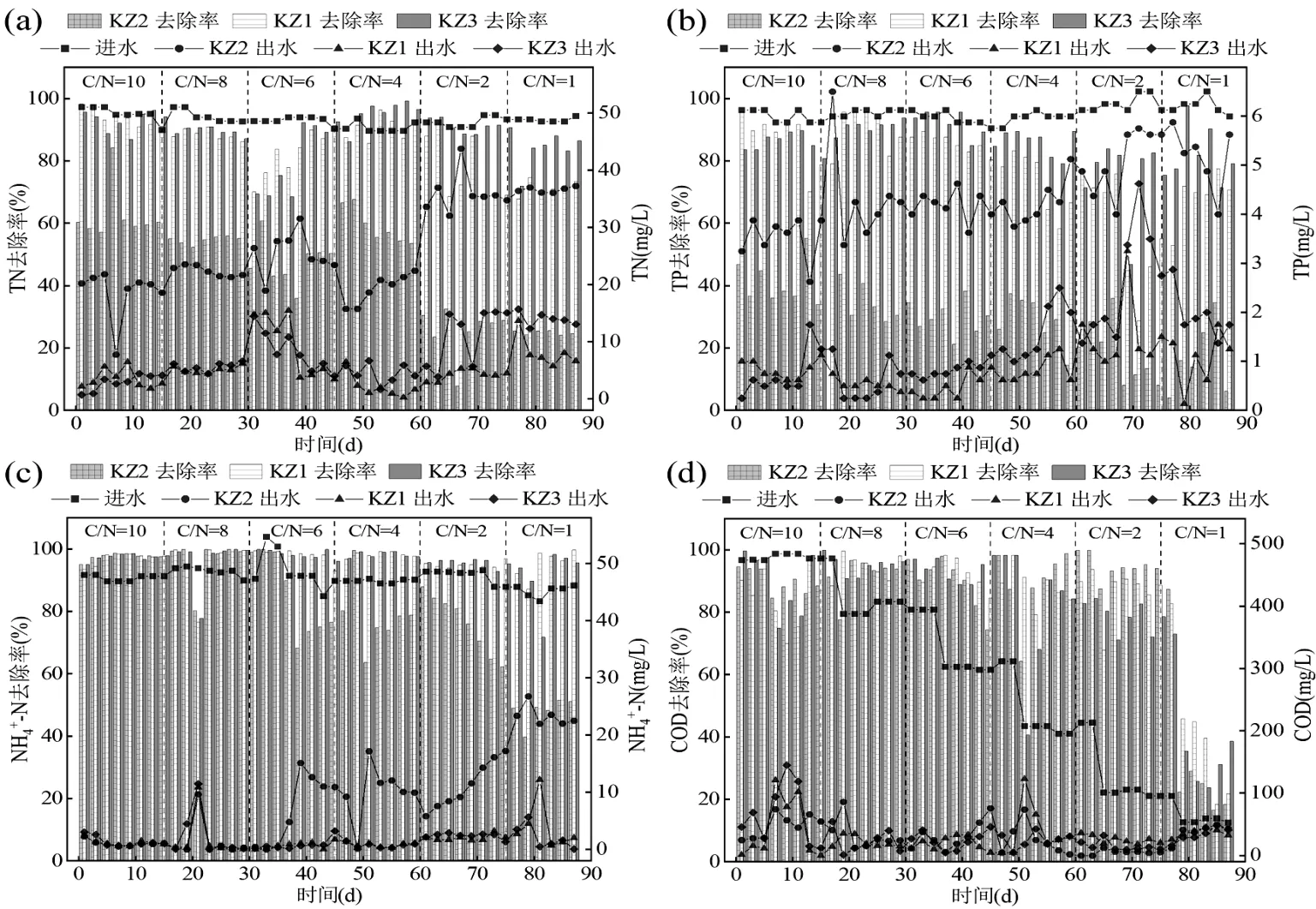
图3 不同C/N 下AGS、ABGS、H-ABGS 体系水质指标变化情况Fig.3 Variations in water quality indicators in AGS, ABGS, and H-ABGS systems under different C/N ratios
2.3 不同C/N 对AGS、ABGS 与H-ABGS 体系微生物特性影响
2.3.1 AGS、ABGS 与H-ABGS 体系在不同C/N下的Alpha 多样性分析 如表2 所示,检测样本的覆盖率指数均在99.8%以上,表明测序结果足以显示样本中的大部分微生物.随着进水C/N 的增加,Shannon 值减少,而Simpson 值增加,表明在较低C/N条件下3 个体系的群落多样性有所提高.总体而言,微生物群落的多样性和丰富度与进水C/N浓度呈负相关性.AGS 体系的生物群落多样性高于ABGS 体系和H-ABGS 体系.由于藻的加入,ABGS 和HABGS 体系在共适应过程中,微生物群落丰富度(Ace、Chao)和多样性(Shannon、Simpson)均降低,说明微生物群落受到藻积累的抑制[9].低碳环境下AGS 体系和ABGS 体系通过增加微生物多样性来适应低碳带来的影响,而H-ABGS 体系的群落的多样性和丰富度维持稳定状态,这可能是适应或对抗低碳环境的关键.此外,当C/N 为10 时,AGS 体系微生物菌群相对丰度最低,H-ABGS 体系中微生物菌群的相对丰度最高.有意思的是,这恰巧对应了图3污染物去除的性能变化.图4(b)稀疏曲线逐渐变平,说明测序深度充足合理.即使测序深度继续增加,也不会有更多的OTU[28].如图4(c)所示,利用Venn 图可视化不同碳氮比下OTU 的分布.结果表明,共有607个OTU,其中51.73%的OTU 存在于所有C/N 比值中.相较而言,低碳环境(C/N≤2)的OTU 更高.综上所述,H-ABGS体系可能通过加入藻和HN-AD菌形成了更稳定的共生体系来适应低碳环境的变化.

表2 多样性指数Table 2 Diversity index table
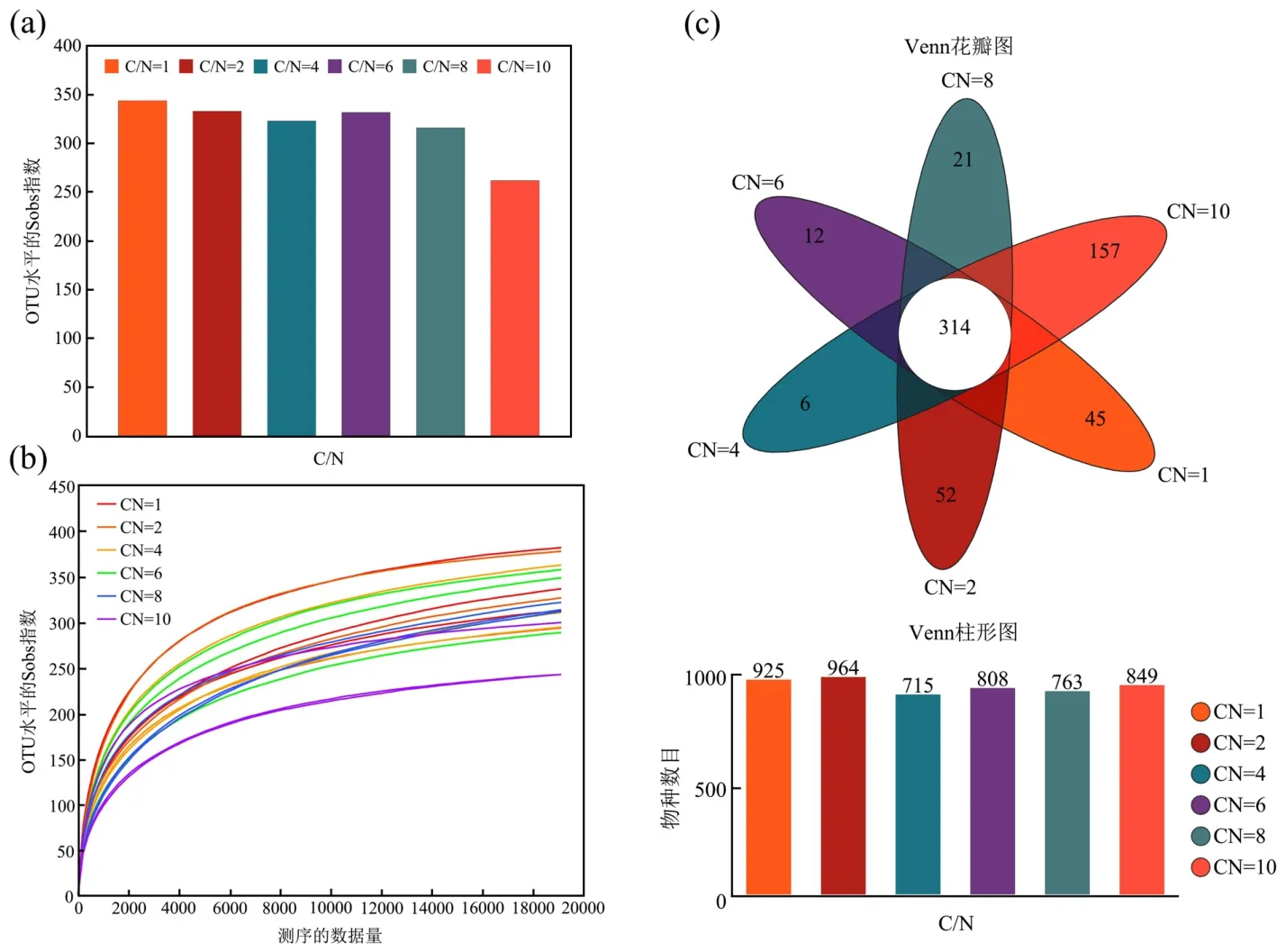
图4 微生物多样性(a) Alpha 多样性评估,(b)稀疏曲线,(c)Venn 图Fig.4 Microbial diversity(a) Alpha diversity assessment,(b) Rarefaction curve,(c) Venn diagram
2.3.2 不同C/N 对AGS、ABGS 与H-ABGS 体系微生物群落变化的影响 如图5(a~c)所示,3 个体系中变形菌门(Proteobacteria)、绿弯菌门(Chloroflexi)、拟杆菌门(Bacteroidetes)这3 个菌门的丰度总和占比超过70%左右[29].这些细菌多为异养菌,可为有机物的高效去除提供保障[30].其中AGS 体系和ABGS 体系中Proteobacteria 菌门占主导地位,而H-ABGS 体系中Chloroflexi 菌门占主导地位.在AGS 体系中,随着C/N 的增大,变形菌门(Proteobacteria)和拟杆菌门(Bacteroidota)的相对丰度逐渐增大,在C/N=10时,Proteobacteria 相对丰度最高为 55.50%,Bacteroidota 相对丰度最高是30.08%.在ABGS 体系中,随着C/N 的增大,变形菌门(Proteobacteria)相对丰度逐渐降低,在 C/N=10 时,相对丰度最低是23.36%.Chloroflexi 被认为是组成颗粒污泥的主要菌门,它可以与丝状菌相互缠绕形成颗粒核心,达到稳定颗粒结构的效果[28].因此,Chloroflexi 在厌氧氨氧化体系中发挥着重要的作用.Chloroflexi 相对丰度先升高后下降,在C/N=4 时,其最高相对丰度是33.11%,在C/N=10 时,最低相对丰度为7.42%.这可能是其在低碳环境下维持较高氨氮去除率的关键.在H-ABGS 体系中,随着C/N 的减小,绿弯菌门Chloroflexii 相对丰度逐渐增大,这保证了低碳环境下H-ABGS 体系的高氨氮去除性能.Bacteroidota 中大部分是厌氧杆菌,可以起到构建颗粒污泥骨架的作用,随着C/N 的增大,拟杆菌门(Bacteroidota)的相对丰度逐渐增大.Bacteroidota 可能通过维持HABGD 系统的稳定性,保障了生物群落的稳定以及高效的污染物去除性能.

图5 不同体系的微生物组成Fig.5 The microbial composition in different Systems
如图5(d)所示,AGS 体系中norank_f_A4b 相对丰度逐渐减小,norank_f_A4b 菌属更适合在低基质负荷条件下生存.在 AGS 体系中,在 C/N≤6 时Plasticicumulans 的相对丰度是逐渐增大,在C/N 为8时Plasticicumulans 消失.据报道,Plasticicumulans 是醋酸饲料培养中的优势种群,可以很好地适应其他脂肪酸,而蛋白核小球藻能产生脂肪酸[31],推测随着C/N 的增大, 竞争碳源更加激烈, 从而Plasticicumulans 从AGS、ABGS 与H-ABGS 体系消失.在ABGS体系中,随着C/N降低,norank_f__A4b的相对丰度先降低再增加.随着C/N 降低,属于蓝藻细菌的norank_f__norank_o__Chloroplast 相对丰度逐渐增加,藻的积累抑制了微生物群落多样性[9].在H-ABGS 体系中,随着C/N 降低,norank_f_A4b 相对丰度升高,在 C/N=1 时,其相对丰度达 36.94%.norank_f_A4b 随着C/N 增大,Thauera 的相对丰度先增大,在C/N=5 时相对丰度达到最大为13.50%,然后随着C/N 增大而减少,Thauera 是低碳氮比条件下主要的分泌EPS 功能菌属.norank_f__A4b 和芽孢杆菌属在脱氨系统中经常出现,可参与大分子有机物的降解和反硝化过程.由此表明,Thauera 与norank_f__A4b 的存在可能是H-ABGS 体系高TN 与高NH4+-N 去除率的关键.
2.3.3 微生物共生模式对AGS、ABGS 与H-ABGS体系的影响 基于微藻对微生物多样性的抑制作用,进一步分析了具有空间尺度和AGS 样品的3 组共现网络,探讨了生态位和种间相互作用的内在特征.在共同适应过程中,微藻联合体中的微生物也受到非随机微生物共生模式的影响[9].加入藻后,ABGS与H-ABGS两个系统微生物共生关联的频率逐渐减弱.边缘值逐渐减小(542~645)、平均度(AD,5.797~6.862)和聚类系数(CC,0.536~0.56)均低于AGS(表3).而共生网络的平均路径长度(APL,5.853~6.251)和模块化程度(MD,0.687~0.718)分别高于AGS(表3).AGS、ABGS 与H-ABGS 体系的微生物共生网络根据网络节点的门(a~c)和模块类(d~f)进行视觉着色(OTUs,图6),便于生态位与其分类特征之间的联系.每个节点的大小与连接数(即度)成正比;两个节点之间每个连接的边厚(权值)与相关系数成正比.在细菌门中,Proteobacteria(41.18%~43.75%)和Bacteroidota(11.46%~15.96%)居群占绝对优势,其他细菌居群均低于5.88%和8.85%(图6(a)~(c)).对于微生物模块,细菌子网被拓扑划分为8个模块(离散生态位)(图6d~f).与AGS 体系比较,ABGS、H-ABGS 体系的模组4 和模组5(增加)变化较大,而模组7 减少,说明微生物种群和功能随着培养体系的变化而变化.微生物间相互作用受到微生物多样性减少的影响,在ABGS 与H-ABGS 体系中,由于蛋白核小球藻的加入,细菌相互作用降低(图6a、图6c).细菌的子网络分别减少至645 与542 条边(表3).同时细菌的模块数减少至12 和16(表3).由于微生物代谢功能的多样性,当蛋白核小球藻的积累抑制了占据其原有生态位的优势微生物时,系统中其余微生物重新暴露,竞争并取代原有的代谢功能,在ABGS 体系中占据更多的生态位.然而,在H-ABGS 中,由于蛋白核小球藻在AGS 中的非优势地位,有更多的生态位来维持其生存;它们的生态位因加入HN-AD 菌,会随着细菌的捕获而最小化,故在H-ABGS 体系中又恢复到16 个模块,与细菌和微藻共存.分析表明通过引入HN-AD菌有助于最小化生态位,与藻形成稳定的共生体系,从而确保H-ABGS 系统的稳定性.

表3 微生物群共生网络的拓扑特性Table 3 The topological characteristics of microbial symbiotic networks
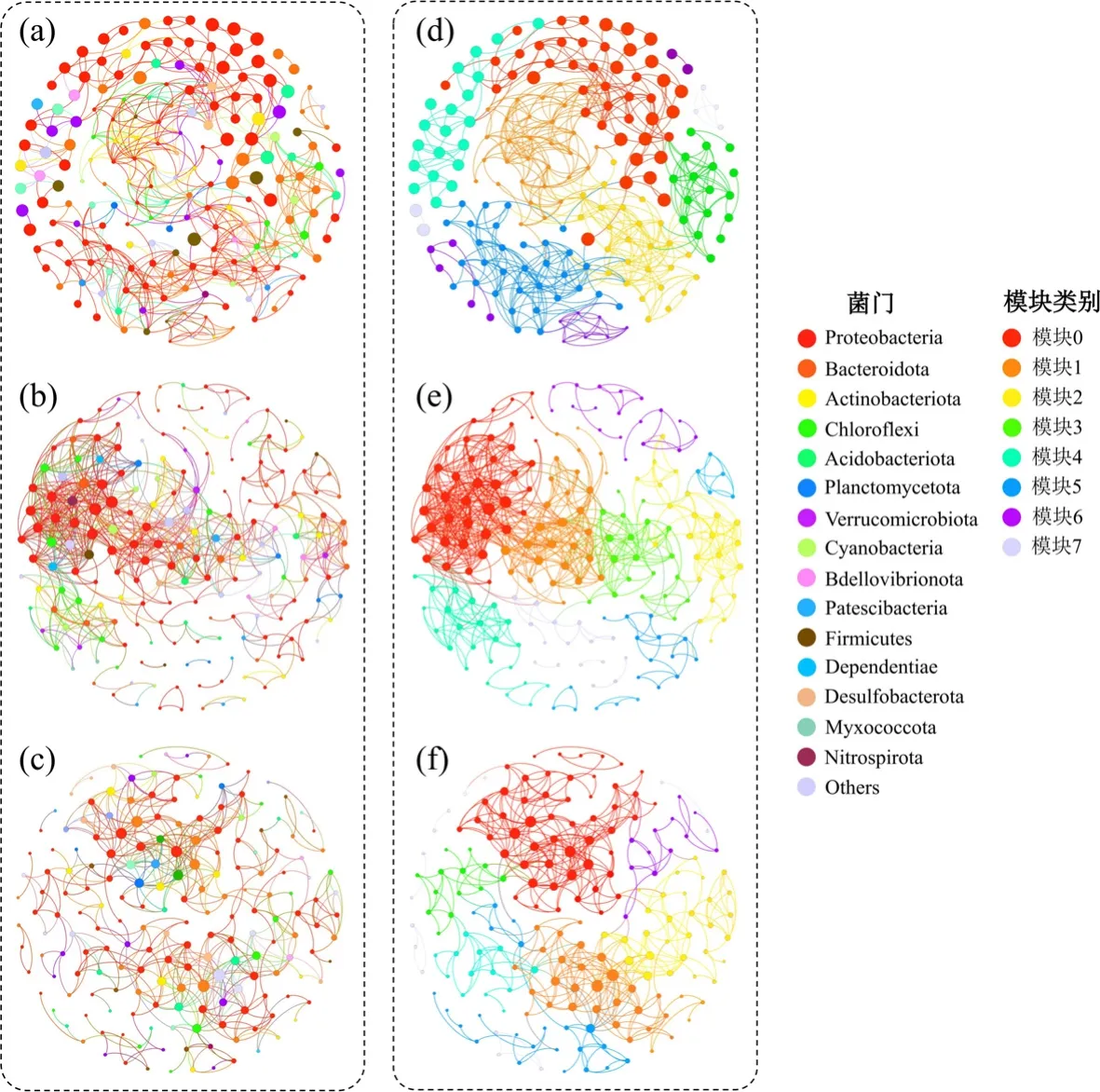
图6 基于ABGS(a、d)、AGS(b、e)、H-ABGS(c、f)系统的相关性分析的共生网络Fig.6 Symbiotic networks based on correlation analysis of ABGS(a, d), AGS(b, e), H-ABGS(c, f) system, colored by phylum(a~c) and module category(d~f)
2.3.4 微生物群落动态演替及关键影响因素 如图7所示,反硝化菌o__Burkholderiales 和丝毛单胞菌种(f__Comamonadaceae)[32]、f__Competibacteraceae、g__unclassified_o__ Micrococcales 是ABGS 体系加藻前后群落结构差异的关键细菌属; g__Runella、g__Thauera 、 g__norank_f__norank_o__norank_c__SJA-28 是导致H-ABGS 系统加藻和HN-AD 菌前后群落结构差异的关键细菌属.
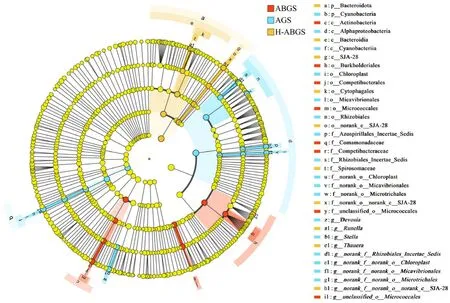
图7 微生物群落的LEfSe 分析Fig.7 LEfSe analysis of microbial communities
进一步分析NH4+-N、TN、TP 和COD 去除率以及C/N 对AGS、ABGS 和H-ABGS 体系内菌属的影响.如图8 所示,在ABGS 和H-ABGS 体系中,TP去除率与Runella 有正相关性,有研究表明Runella从增强生物除磷的活性污泥中分离出来,出现于ABGS 体系中[33],表明小球藻的加入增强了好氧颗粒污泥的除磷性能.此外,H-ABGS 体系的TN、TP去除率与Thauera、Rhodobacter 等HN-AD 菌属和Exiguobacterium 菌属呈现正相关性.上述分析表明,Thauera、Rhodobacter 等 HN-AD 菌属和Exiguobacterium 菌属的出现保证了H-ABGS 体系的高脱氮性能.

图8 相关性热图Fig.8 Correlation heatmap
2.3.5 C/N 对AGS、ABGS 和H-ABGS 系统中脱氮酶表达量的影响 AGS、ABGS 和H-ABGS 系统中,异养硝化和好氧反硝化(HN-AD)同时发生.来自有机物代谢的电子不同的电子传递链到不同的电子受体,NO3--N,NO2--N或O2(图9).有机物的代谢产生能量分子,ATP 以及NADH[34]. NADH 携带的电子通过由络合物I(Complex I)、络合物III(Complex III)、络合物IV(Complex IV)、细胞色素c(Cytc)以及硝酸还原酶(NAR)、亚硝酸还原酶(NIR)、一氧化氮还原酶(NOR)和一氧化氮合酶(NOS)组成的好氧反硝化过程的电子传递链进行传递[35].
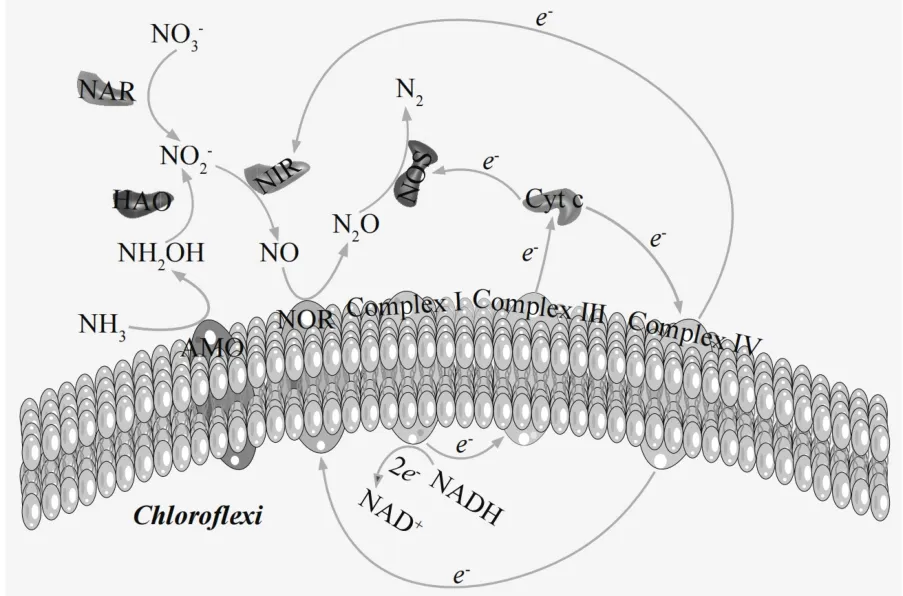
图9 AGS、ABGS 和H-ABGS 体系的异养硝化和好氧反硝化过程中的物质转化和电子传递Fig.9 Substance transformation and electron transfer during heterotrophic nitrification and aerobic denitrification processes in AGS, ABGS, and H-ABGS systems
如图10 所示,C/N 为4 时,H-ABGS 体系的硝酸还原酶(1.7.99.4)表达量最高,对应图3A 和图3C 的去除规律.高表达量的硝酸还原酶可能有助于确保H-ABGS 体系在低碳环境下具备卓越的脱氮性能.
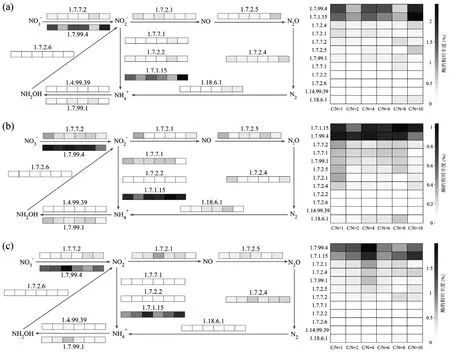
图10 三个体系在不同C/N 下的氮转化路径中各种酶的表达量Fig.10 Expression levels of various enzymes in nitrogen transformation pathways under different C/N ratios in the three systems
3 结论
3.1 C/N 为4 时,H-ABGS 体系的总氮去除率高于ABGS 体系(12.05%)和AGS 体系(44.86%).
3.2 微生物群落分析显示,适应低碳的Thauera 菌属与脱氨关键菌属 norank_f__A4b 可能是保证H-ABGS 体系低碳环境下具有高脱氮性能的关键.
3.3 微生物群落共生模式和相关性分析表明,引入HN-AD 菌有助于最小化生态位,与藻共同形成稳定的共生体系,从而确保H-ABGS 系统的稳定性.
3.4 硝酸还原酶在C/N 为4 时的高表达有助于确保H-ABGS 体系在低碳环境下具备卓越的脱氮性能.
