基于Nrf2-HO-1/GPX4信号轴探讨中药靛玉红衍生物E804抑制肺癌A549细胞增殖和迁移的作用机制
2024-03-27袁育珺曹华华罗宇慧张素梅
袁育珺,曹华华,赵 敏,罗宇慧,张素梅
肺癌主要有两种类型:非小细胞肺癌(non-smallcell lung cancer, NSCLC)和小细胞肺癌,其中NSCLC约占所有新诊断肺癌的85%[1],是肺癌主要的病理类型。越来越多的临床研究[2]证实,铁死亡在NSCLC中发挥着重要的调控作用,甚至在一线抗癌药物中能够作为一种“催化剂”增强NSCLC的治疗疗效。铁死亡是一种新型的非凋亡细胞死亡模式,其特征是铁依赖性的脂质过氧化和活性氧(reactive oxygen species,ROS)堆积[3]。研究[4-5]表明核因子E2相关因子2(nuclear factor erythroid2-related factor 2,Nrf2)-血红素氧合酶1(heme oxygenase-1,HO-1)/谷胱甘肽过氧化物酶(glutathione peroxidase 4,GPX4)轴参与铁死亡调控,与临床上多种疾病的发生和发展有关,如肿瘤、类风湿性关节炎、神经退行性疾病、缺血再灌注和心脏相关疾病等。课题组前期研究显示,中药靛玉红衍生物E804可通过抑制细胞的增殖、迁移和分化等多种机制发挥抗NSCLC系A549细胞作用,但其抑制肺癌细胞增殖和迁移是否与细胞铁死亡有关尚不清楚。所以,该研究探讨E804抑制A549细胞增殖和迁移与细胞铁死亡的关系,并从Nrf2-HO-1/GPX4信号轴探讨其可能的作用机制。
1 材料与方法
1.1 主要仪器SW-CJ-1F标准型净化工作台购自苏州安泰公司;NBS 150型CO2培养箱购自美国BioTek公司;自动化酶标仪、蛋白提取仪、垂直和水平电泳槽、电泳仪、蛋白凝胶成像系统均购自美国Bio-Rad公司;DMI3000B倒置荧光显微镜购自德国Leica公司。
1.2 试剂E804购自武汉远成生物科技有限公司;肺癌A549细胞由实验室内部提供,其基础营养液(如DMEM和小牛血清)均购自北京索莱宝科技有限公司;细胞坏死抑制剂(necrostatin-1,Nec-1)、细胞自噬抑制剂(chloroquine,CQ)、细胞凋亡抑制剂[Z-Val-Ala-Asp(OMe),Z-VAD]、细胞铁死亡抑制剂(deferoxamine,DFO)、细胞铁死亡抑制剂(ferrostatin-1,Fer-1)和细胞铁死亡抑制剂(Liproxstatin-1,Lip-1)均购自美国TargetMol公司;DCFH-DA试剂盒购自美国Sigma公司;二价铁离子(Fe2+)检测试剂盒、谷胱甘肽(glutathione,GSH)检测试剂盒和丙二醛(malondialdehyde,MDA)检测试剂盒均购自合肥碧云天生物试剂公司;铁死亡相关一抗(SLC7A11、GPX4、SLC40A1、Transferrin、Nrf2、HO-1和β-actin)购自美国Santa Cruz公司,分装后于-70 ℃ 冰箱保存;Western blot相应二抗(如:山羊抗鼠IgG和山羊抗兔IgG)均购自美国Pierce公司。
1.3 方法
1.3.1MTT法检测各组细胞增殖率 A549细胞株接种于含10%小牛血清的DMEM培养基中,置于37℃、5%CO2、饱和湿度培养箱中培养。取对数期生长的A549细胞进行下列实验。细胞随机分为对照组(0 μmol/L E804)、10 μmol/L E804组和不同抑制剂组(10 μmol/L E804分别加10 μmol/L Nec-1、15 μmol/L CQ、10 μmol/L Z-VAD、10 μmol/L DFO、10 μmol/L Fer-1和1 μmol/L Lip-1)。处理72 h。MTT实验严格参考文献操作,按如下公式计算细胞增殖率:增殖率%=[对照孔(optical density,OD)570-试验孔OD570]/对照孔OD570×100%[6],实验重复3次。
1.3.2细胞划痕实验检测各组细胞迁移能力 取对数期生长的A549细胞,按照“1.3.1”进行分组,具体方法严格按照参考文献[6]。各组细胞于0 h做好标记并拍照,处理72 h后拍照。实验重复3次。
1.3.3DCFH-DA检测各组细胞活性氧ROS水平 取对数期生长的A549细胞,随机分为对照组(0 μmol/L E804)、2.5、5和10 μmol/L E804组。处理72 h,室温下各组加10 μmol/L DCFH-DA处理10 min,PBS洗涤3次,荧光显微镜下观察并拍照,各组荧光含量用荧光酶标仪进行定量。实验重复3次。
1.3.4试剂盒检测各组细胞中Fe2+、MDA和GSH水平 取对数期生长的A549细胞,按照“1.3.3”进行分组。用Fe2+检测试剂盒(比色法)、MDA检测试剂盒(分光光度法)和GSH检测试剂盒(微量法)分别检测各组细胞中的Fe2+、MDA和GSH含量,严格按照相应说明书操作。
1.3.5Western blot检测各组细胞中蛋白表达水平 取对数生长的A549细胞,按照“1.3.3”进行批量分组。按参考文献[6]方法:提取细胞总蛋白、蛋白浓度定量和蛋白加热变性。每孔上样30 μg相应蛋白样品,采用10%的分离胶和5%的浓缩胶进行电泳,将相应蛋白转移置PVDF膜上,5%脱脂奶粉室温下结合2 h,PBS洗膜3次,分别加入目标蛋白浓度SLC7A11(1 ∶800)、GPX4(1 ∶1 100)、SLC40A1(1 ∶500)、Transferrin(1 ∶800)、β-actin(1 ∶2 000)、Nrf2(1 ∶1 000)和HO-1(1:1 500),置于4 ℃摇床过夜;次日PBS洗膜3次,加入相应目标蛋白二抗SLC7A11(1:1 000)、GPX4(1:800)、SLC40A1(1 ∶1 500)、Transferrin(1 ∶1 000)、β-actin (1 ∶2 000)、Nrf2(1 ∶1 500)和HO-1(1 ∶1 000)室温下孵育2 h,PBS洗膜3次,暗室内ECL显影并拍照,实验重复3次。本次实验采用β-actin作为参照,运用Image Pro 4.5 软件扫描目标条带灰度值,根据灰度值计算目标蛋白表达水平,目标蛋白表达水平=目标蛋白条带灰度值/β-actin条带灰度值。

2 结果
2.1 特异性抑制剂对各组细胞增殖影响本实验使用特异性抑制剂处理72 h, MTT检测结果显示:与10 μmol/L E804组比较,细胞坏死抑制剂(Nec-1)组和细胞自噬抑制剂(CQ)组对A549细胞的增殖影响较小(P>0.05);而细胞凋亡抑制剂(Z-VAD)组和细胞铁死亡抑制剂(DFO、Fer-1和Lip-1)组A549细胞的增殖有提升(P<0.01)。见图 1。

图1 MTT法检测各组细胞增殖率
2.2 各组细胞迁移情况本实验使用特异性抑制剂处理72 h, 细胞划痕结果显示,与10 μmol/L E804组比较,细胞坏死抑制剂(Nec-1)组和细胞自噬抑制剂(CQ)组对A549细胞的迁移影响较小(P>0.05);而细胞凋亡抑制剂(Z-VAD)组和细胞铁死亡抑制剂(DFO、Fer-1和Lip-1)组A549细胞的迁移距离有提升(P<0.01)。见图2、3。

图2 细胞划痕实验检测各组细胞迁移能力(×100)

图3 各组细胞迁移距离
2.3 各组细胞中ROS水平不同浓度 E804处理A549细胞72 h,荧光染色结果显示:与对照组比较,2.5、5和10 μmol/L E804组荧光强度逐渐增强,即各组ROS水平逐渐增强(F=102.3,P<0.01)。见图4、5。
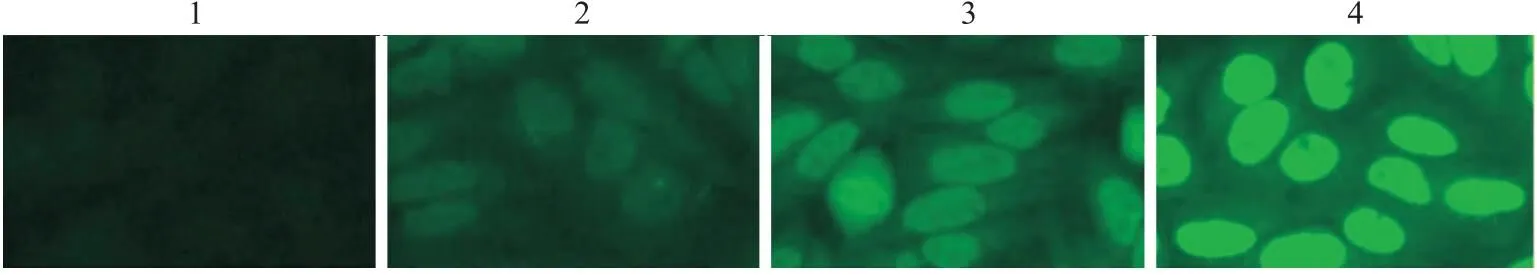
图4 E804对A549细胞内ROS的影响 ×400

图5 各组细胞荧光相对含量
2.4 各组细胞中Fe2+、MDA和GSH水平不同浓度E804处理A549细胞72 h,试剂盒检测结果显示,与对照组比较,2.5、5和10 μmol/L E804组Fe2+和MDA水平逐渐增强(F=71.21、65.02,P<0.01),而GSH水平逐渐减弱(F=76.54,P<0.01)。见图6。
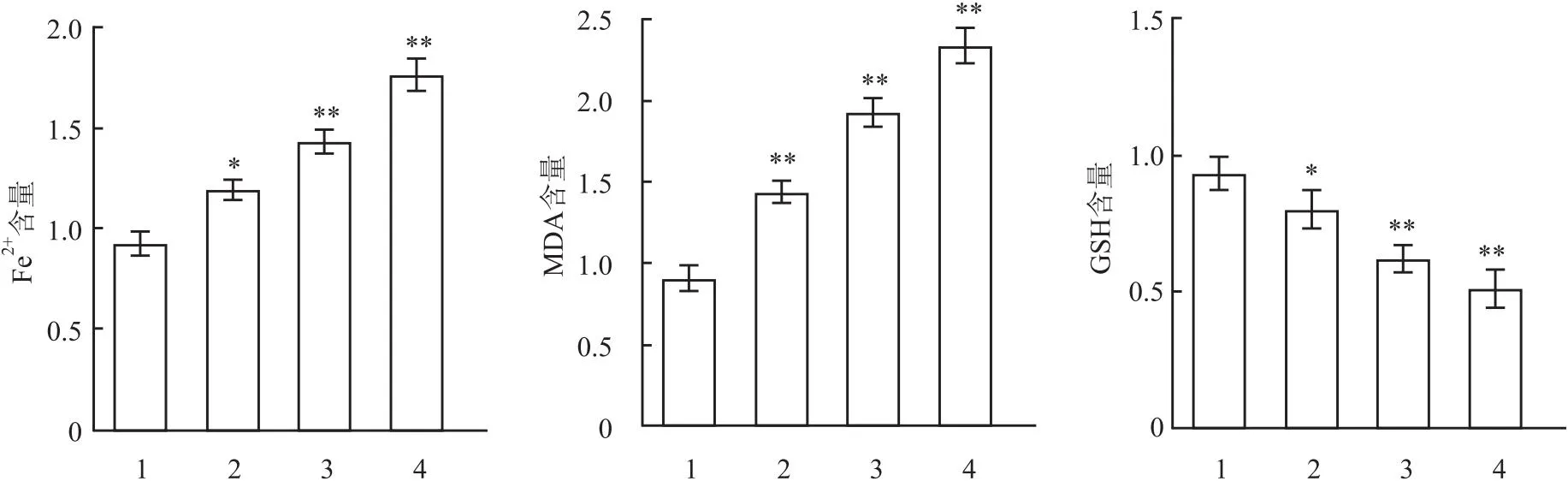
图6 E804对A549细胞铁死亡的影响
2.5 各组细胞铁死亡相关蛋白表达水平不同浓度 E804处理A549细胞72 h,Western blot检测结果显示:与对照组比较,2.5、5和10 μmol/LE804组SLC7A11、GPX4和SLC40A1表达水平逐渐降低(F=25.21、45.13、29.33,P<0.01);而Transferrin表达水平均逐渐升高(F=51.24,P<0.05)。见图7。

图7 Western blot法检测各组细胞铁死亡相关蛋白电泳图(A)和直条图(B)
2.6 各组细胞Nrf2/HO-1信号通路相关蛋白表达水平不同浓度E804处理A549细胞72 h,Western blot检测结果显示:与对照组比较,2.5、5和10 μmol/L E804组Nrf2和HO-1蛋白表达水平逐渐降低(F=34.58、44.71,P<0.01)。见图8。
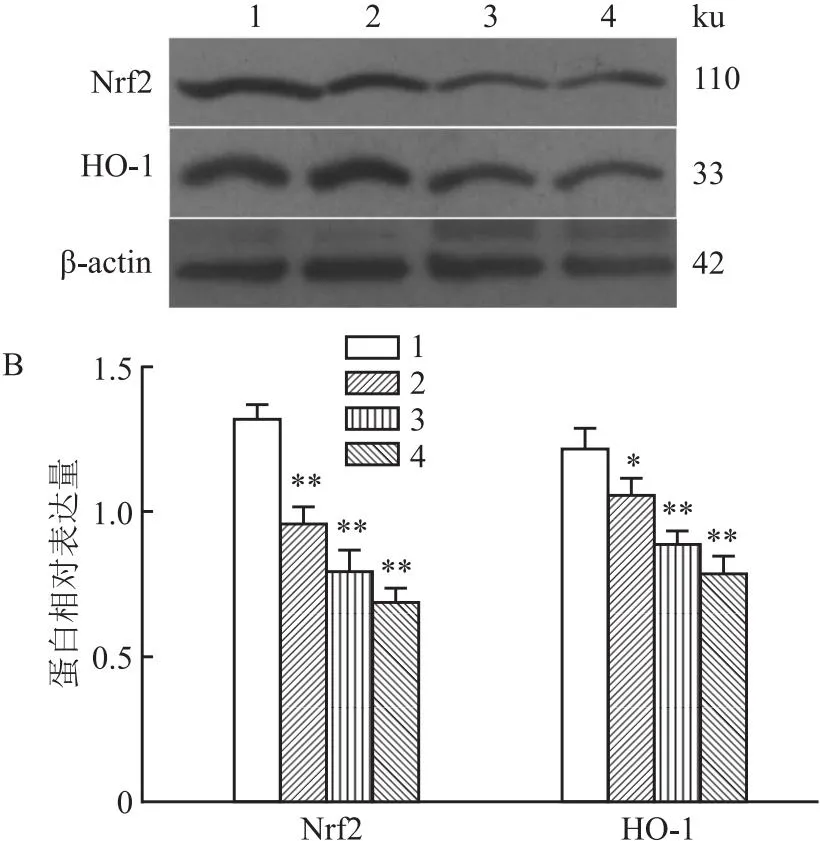
图8 Western blot法检测各组细胞Nrf2/HO-1信号通路相关蛋白表达电泳图(A)和直条图(B)
3 讨论
肿瘤细胞群体是一个高度异质性的群体,尽管医学在肿瘤治疗领域取得了突破性进展,但肿瘤依然是全球第二大致死因素[7]。对于NSCLC,尽管传统药物治疗、抗血管生成治疗、免疫治疗和靶向治疗等新兴疗法都取得了重大突破,但治疗仍然存在难点。因此,迫切需要开发用于肺癌患者的新型药物。天然产物是药用化合物的宝库,也是新型抗肿瘤活性成分的重要资源[8]。本课题组前期研究显示从传统中药靛玉红中分离的有效成分E804能有效抑制A549细胞的增殖和迁移,是具有开发前景的天然抗肿瘤药物。
耐药性仍旧是肿瘤患者治愈的主要限制因素,目前多数抗癌药物主要通过触发肿瘤细胞凋亡发挥作用,然而,肿瘤细胞对凋亡的内在性、获得性抵抗,使治疗效果受限[9]。因此,利用其他形式的非凋亡性细胞死亡为肿瘤清除提供新的治疗策略,如铁死亡。铁死亡是近年来发现的一种与凋亡和坏死及自噬不同的程序性细胞死亡方式,特点是细胞内脂质活性氧的增加速度超过细胞自身抗氧化系统的代偿,继而诱导细胞发生死亡[3]。铁死亡发生时,分子层面主要表现为:细胞内铁超载、ROS的水平增加、GSH的水平降低以及线粒体发生特征性变化[10];蛋白层面主要表现为:溶质载体家族(如SLC7A11,SLC40A1等)表达降低,GPX4表达降低,Transferrin表达升高,其中GPX4表达降低是铁死亡中最重要的分子事件[11-12]。本次研究采用不同浓度E804刺激A549细胞,结果显示细胞内铁死亡被激活,表现为ROS、Fe2+和MDA水平呈上升趋势,GSH含量呈下降趋势;同时,SLC40A1、GPX4和SLC7A11蛋白表达水平呈下降趋势,Transferrin表达水平呈上升趋势。进一步的结果显示,细胞凋亡抑制剂(Z-VAD)和细胞铁死亡抑制剂(DFO、Fer-1和Lip-1)均能够部分逆转E804对细胞的增殖和迁移抑制作用。这些结果提示,E804诱导A549细胞出现氧化损伤,推测E804对A549细胞的增殖和迁移抑制作用可能与铁死亡有关。
铁死亡是一个严谨并且复杂的过程,受多种转录因子和通路调控。Nrf2是一种重要的转录因子,通过上调SLC7A11和GPX4抑制细胞铁死亡,也参与调节细胞的GSH合成、铁代谢和中间代谢物,被认为是铁死亡的重要调节因子[13]。HO-1是最典型的诱导型酶,受Nrf2基因调控。氧化应激条件下,转录因子Nrf2启动内源性抗氧化反应元件,并激活若干下游抗氧化酶的转录,如HO-1[14]。最近研究[15]表明,在癌旁组织和肿瘤组织中Nrf2-HO-1/GPX4轴异常激活,高表达于不同类型的人类恶性肿瘤中。Western blot结果显示:E804能明显降低Nrf2、HO-1和GPX4表达水平,抑制A549细胞内Nrf2-HO-1/GPX4抗氧化轴,增加脂质过氧化和ROS积累,进一步加重细胞铁死亡。
综上所述,E804可能通过抑制A549细胞内Nrf2-HO-1/GPX4抗氧化轴,下调SLC7A11、GPX4、SLC40A1、Nrf2和HO-1蛋白表达水平,上调Transferrin蛋白表达水平,使细胞内ROS、脂质过氧化水平和二价铁离子浓度升高,脂质过氧化产物MDA积累也增多,GSH含量降低,诱导细胞铁死亡,并且抑制A549细胞增殖和迁移。本研究结果显示E804对A549细胞株具有良好的抗肿瘤活性,为临床应用提供实验依据。
