不同形态硅对砷胁迫下小麦光合生理、砷累积及相关基因表达的影响
2024-03-25甘志凯陈玮谌希
甘志凯 陈玮 谌希

摘要: 采用盆栽土培试验,以无砷(As)胁迫处理(CK)为对照,设置30 mg/kg As胁迫处理(AS)及砷胁迫下施用纳米硅(NSi)、无机硅(ISi)、有机硅(OSi)与复合处理(NSi+ISi、NSi+OSi、ISi+OSi、NSi+ISi+OSi),探索不同形态硅对As胁迫下小麦光合生理、As亚细胞分布及相关调控基因表达的影响。结果表明,As胁迫下小麦光合生理受到显著影响、As含量增加,细胞生理受到显著影响。As胁迫下不同形态硅及其组合处理均提高了光合色素(叶绿素a、叶绿素b、类胡萝卜素)含量、改善了叶绿素荧光参数(Fv/Fm、ΦPSⅡ、NPQ、qP),上调了相关重金属调控基因( TaPCS1、TaMT1、TaHMA3 )的表达,且增加了细胞壁对As的劫持能力,并促进As在液泡区室化,整体而言以纳米硅组合处理(NSi+OSi、NSi+ISi+OSi)效果较佳。此外,As胁迫下,NSi+OSi、NSi+ISi+OSi处理植株Si含量显著增加,生物富集系数(BCF)、转移系数(TF)及As含量显著降低,均以NSi+OSi优于NSi+ISi+OSi处理。综上,30 mg/kg As胁迫下不同形态硅及其组合处理可保护光合色素降解、提高光合效率、诱导重金属调控基因表达,并通过促进As的区室化从而降低As累积对小麦的负面影响,以纳米硅与正硅酸乙酯组合施用(NSi+OSi)效果最佳,其BCF、TF分别降低6.53%~76.94%、5.02%~21.45%。
关键词: 硅;砷胁迫;荧光特性;亚细胞分布;重金属调控基因
中图分类号:S512.101 文献标志码:A
文章编号:1002-1302(2024)02-0065-08
土壤重金属污染导致的作物减产和人畜基因突变风险已成为发展中国家和发达国家共同关注的环境安全问题[1]。砷(As)作为毒性最强的重(类)金属元素之一,由于工业、农业活动造成了较严重的土壤污染。在我国,约1 000万hm2的耕地处于中等砷污染,由于动物通过食物链和饮用水摄入砷的风险日益增加,当前严重的砷污染引起了人们的高度关注[2]。大量研究表明,As对绿色植物具有极強的致毒性,可显著抑制植物的光合代谢活性和矿物质养分吸收,使植物生理系统紊乱,严重时可直接导致植物死亡[3]。此外,砷胁迫往往伴随着渗透胁迫和养分稳态失衡,导致活性氧(ROS)积累,ROS过量积累可对膜脂、蛋白质、核糖核酸和光合色素造成重大损伤[4]。发育受限、砷胁迫与光合作用密切相关,砷胁迫可造成叶绿素降解、叶绿体超微结构损伤以及光合装置中的蛋白酶失活[5]。因此,As胁迫下提高抗氧化能力和光合能力对植物的正常生长发育至关重要。
硅(Si)作为地壳中第二丰富的元素,主要以硅酸盐或二氧化硅(SiO2)的形式存在,在地表土壤中,硅常以SiO2的形式存在,而以单硅酸(H4SiO4)的形式被植物吸收利用[6]。此前的研究表明,外源施用硅可以增强植物碳代谢、促进光合能力,提高水稻、大豆和番茄等作物的品质和产量[7]。硅在改善生物和非生物胁迫方面起着至关重要的作用,如施硅可通过提高光合效率、抗倒伏性以降低遮阴对大豆生长带来的不利影响[8]。此外,添加硅可以减轻镉(Cd)、铬(Cr)和砷(As)对植物的毒性,并减少它们在不同植物中的积累。Wu等的研究表明,在营养液中添加硅酸盐可以通过阻止小麦幼苗对Cd的吸收和转运以减轻Cd对植物的毒性[9]。张明辉等的研究表明,Si可通过诱导Cd转运基因( TM20、HMA3 )上调表达,促进根细胞壁和细胞器螯合Cd以及减少Cd向地上部转移,且与硒组合施用时效果最佳[10]。随着纳米技术的快速发展,许多纳米粒子(NPs)被用作肥料,以提高作物产量和减轻重金属污染,然而关于纳米硅(SiNPs)对重金属胁迫缓解效应的研究较少。
小麦(Triticum aestivum L.)是广泛种植的谷类作物之一,其含有可观的能量、矿质营养及膳食纤维,是全世界大多数人口和牲畜的主要食物[11]。然而,小麦产区由于长期非正常灌溉和不适当施肥使得小麦生产面临着土壤As污染[9]。目前,一些栽培措施已应用于提高小麦As耐受性和降低As吸收量,包括施用如生物炭、阻隔剂、功能菌、有益元素及超富集植物间作等,其中外源施入Si等有益元素被认为是最具成本效益、最简便的可持续措施之一[12]。然而目前关于外源施入Si对环境胁迫的研究主要集中于干旱、高温和Cd胁迫,关于As胁迫的研究较少[13],且已有研究主要探索硅酸盐(Na2SiO3)的应用效果,对于有机硅和纳米级硅的研究鲜有涉及。基于此,本研究通过土壤栽培试验探索As胁迫下3种不同形态硅及其组合对小麦缓解效应及相关缓解机制的影响。
1 材料与方法
1.1 供试材料
试验于2022年1—3月在南昌理工学院新能源与环境工程学院试验棚中进行。供试小麦品种为扬麦23。供试土壤取自南昌理工学院实验站,土壤类型为红壤,理化性质:pH值为7.25,表层(0~30 cm)土壤有效砷含量为0.24 mg/kg,有机质含量为19.33 g/kg,全氮、全磷、全钾含量分别为10.25%、2.19%、12.76%,速效氮、速效磷、速效钾含量分别为63.73、20.58、106.45 mg/kg。
供试硅有无机硅、有机硅、纳米硅,无机硅为四价硅酸钠(Na2SiO3),有机硅为农用正硅酸乙酯[Si(OC2H5)4],纳米硅(SiNPs)粒径为19 nm,其制备工艺参照文献[9];3个形态硅均购自上海麦克莱恩生化科技有限公司。试验所用外源As为砷酸二氢钠(NaH2AsO4·7H2O),购自默克化学试剂。供试肥料为小麦专用复合肥(N、P2O5、K2O含量分别为12%、16%、9%),其中As为痕量,购自江西天禾农资有限公司。
1.2 试验设计
试验采用随机完全区组设计,根据《土壤环境质量 农用地土壤污染风险管控标准》(GB 15618—2018)旱地土壤pH值为5.5~6.5时As污染的标准,旱地土壤As污染风险临界值为30 mg/kg;设置以下处理:CK(原土培养)、AS(原土中加入 30 mg/kg 的砷酸二氢钠)。接着基于AS处理施入不同形态硅处理:纳米硅(NSi)、硅酸钠(ISi)、正硅酸乙酯(OSi),相应的二元处理为NSi+ISi、NSi+OSi、ISi+OSi,三元处理为NSi+ISi+OSi,试验共设置9个处理,每个处理重复5次。上述硅处理采用纯水溶解,超声(35 kHz)15 min处理制备为相应硅溶液,各处理总硅浓度皆为960 μmol/L,二元、三元处理各形态硅等浓度配比[14]。
盆栽装置为圆柱形塑料桶,盆高20 cm,直径 18 cm。每盆装土10 kg,将12 g小麦专用复合肥与土壤充分混合装盆,砷胁迫施入砷酸二氢钠,非砷胁迫处理施入蒸馏水。每盆施入小麦种子6粒,出苗后减至3株。硅处理于小麦挑旗期喷施不同形态硅制剂,每次喷施10 mL,1周2次,连续4周,总量为80 mL;非硅处理则以去离子水替代。盆栽周期为90 d。
1.3 测定项目
1.3.1 植株元素含量及根系亚细胞分布测定
培养第90天,将小麦地上部、根系分开105 ℃杀青 30 min,65 ℃烘干至恒质量。将烘干的植株进行粉碎处理过0.25 mm网筛封装待测,称取500 mg样品采用HNO3-HCl进行酸解萃取,采用电感耦合等离子体光谱仪[ICAPQc,赛默飞世尔科技(中国)有限公司],采用ICP-MS法测定样品中的Si含量,采用ICP-OES法(EXPEC 6500,杭州谱育科技发展有限公司)测定植株组织中As含量。As的亚细胞分布采用差速离心法分离测定,分为细胞壁(Fc)、细胞器(Fo)、细胞膜(Fm)和细胞质(Fs),相关步骤参照Shi等所述方法[15]。
1.3.2 光合色素及叶绿素荧光参数测定
培养第90天,称取约500 mg样品采用液氮研磨、丙酮-乙醇体积比(2 ∶ 1)浸提,之后基于UV-2450型紫外分光光度计(Pharma Spec,日本岛津公司)采用紫外光度法测定叶绿素a、叶绿素b及类胡萝卜素含量,具体步骤参照李合生的方法[16]。
培养第89天,采用叶绿素荧光仪(FluorPen FP110,上海点将科技有限公司)测定叶片的荧光动力学参数,叶绿素荧光参数中,PSⅡ的最大光化学效率(Fv/Fm)、非光化学荧光淬灭系数(NPQ)、实际光化学效率(ΦPSⅡ)、光化学荧光淬灭系数(qP)的计算参照高战武等的方法[17]。
1.3.3 重金属调控基因及硅吸收基因表达测定
采用Trizol总RNA提取试剂盒对小麦根系进行总RNA提取,使用ReverTra Ace qPCR RT Kit从总RNA合成第1链cDNA,并采用无菌水将cDNA稀释100倍作为后续实时荧光定量分析(RT-qPCR)的模板。以小麦Actin(登录号:AB181991.1)为对照基因,相关基因的引物序列见表1。RT-qPCR的扩增体系、扩增程序参照Cui等所述[6],使用Light Cycle r 96 Instrument荧光定量PCR仪进行PCR分析,采用断层扫描法(2-ΔΔCT)计算目标基因的表达量。
1.4 数据处理与统计分析
砷的生物富集系数(BCF)与转移系数(TF)按照以下公式进行计算[15]:
BCF=小麦植株总As浓度/土壤中As浓度;
TF=小麦植株地上部As浓度/根系中As浓度。
采用Excel 2016进行数据整理,采用SPSS 26.0软件进行单因素及方差分析,图片皆采用Origin 2018C软件进行绘制。
2 结果与分析
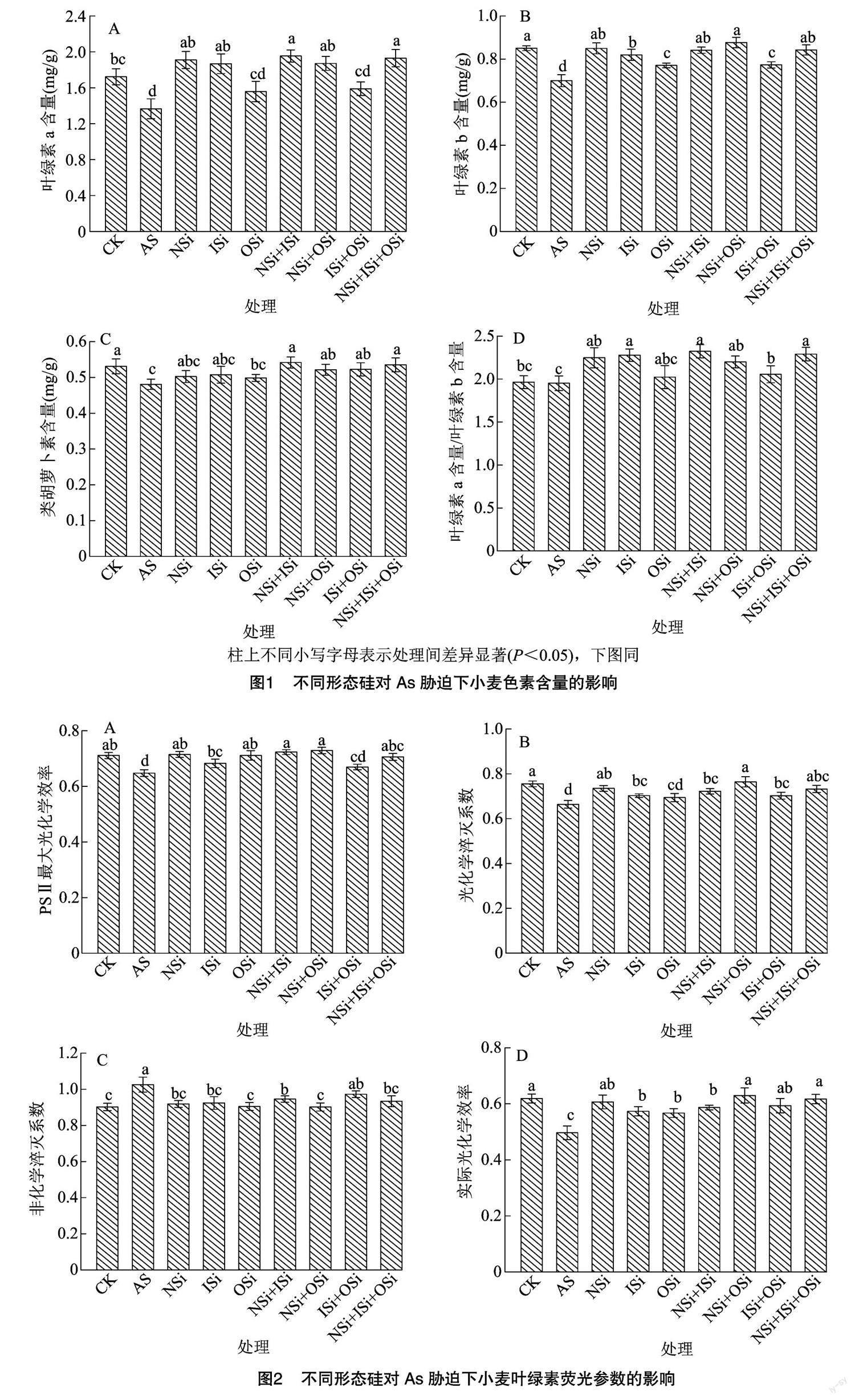
2.1 不同形态硅对砷胁迫下小麦光合色素含量的影响
由图1-A可知,叶绿素a含量中,与CK相比,As胁迫处理(AS)显著降低20.69%;与AS处理相比,As胁迫下相关硅处理(NSi、ISi、OSi、NSi+ISi、NSi+OSi、ISi+OSi、NSi+ISi+OSi)增加14.10%~43.07%,除OSi、ISi+OSi与AS处理无显著差异外,其他硅处理均显著大于AS处理。由图1-B可知,各处理叶绿素b含量表现为AS<OSi<ISi+OSi< ISi<NSi+ISi<NSi+ISi+OSi<NSi<CK<NSi+OSi處理,与AS处理相比,其他处理显著提高10.13%~25.31%;与CK相比,ISi、OSi、ISi+OSi分别显著降低3.62%、9.39%、9.10%,其他硅处理与CK均无显著差异。由图1-C可知,各处理类胡萝卜素含量差异整体较小,以AS处理最低,其显著小于CK、NSi+ISi、ISi+OSi、NSi+OSi、NSi+ISi+OSi处理;与CK相比,相关硅处理变幅为-6.12%~4.99%。而在叶绿素a含量/叶绿素b含量中,仍以AS处理最低,与CK、OSi无显著差异,其他处理均显著大于AS处理。
2.2 不同形态硅对砷胁迫下小麦叶绿素荧光参数的影响
由图2-A可知,PSⅡ最大光化学效率(Fv/Fm)中,以AS处理最低,CK较其显著提高9.78%;相关硅处理则较其增加3.43%~12.59%,但仅ISi+OSi处理与CK存在显著差异。由图2-B可知,光化学淬灭系数(qP)中,以NSi+OSi处理最高,CK次之,二者除与NSi、NSi+ISi+OSi处理无显著差异外,均显著大于其他盐胁迫处理。由图2-C可知,非化学淬灭系数(NPQ)中,以AS处理最高,其他处理较其降低5.20%~12.06%,其中ISi+OSi处理与AS处理无显著差异。由图2-D可知,实际光化学效率(ΦPSⅡ)中,以AS处理最低,其他处理较其显著提高14.15%~26.73%;就相关硅处理而言,以NSi+OSi、NSi+ISi+OSi处理较高,显著大于ISi、OSi、NSi+ISi 处理。
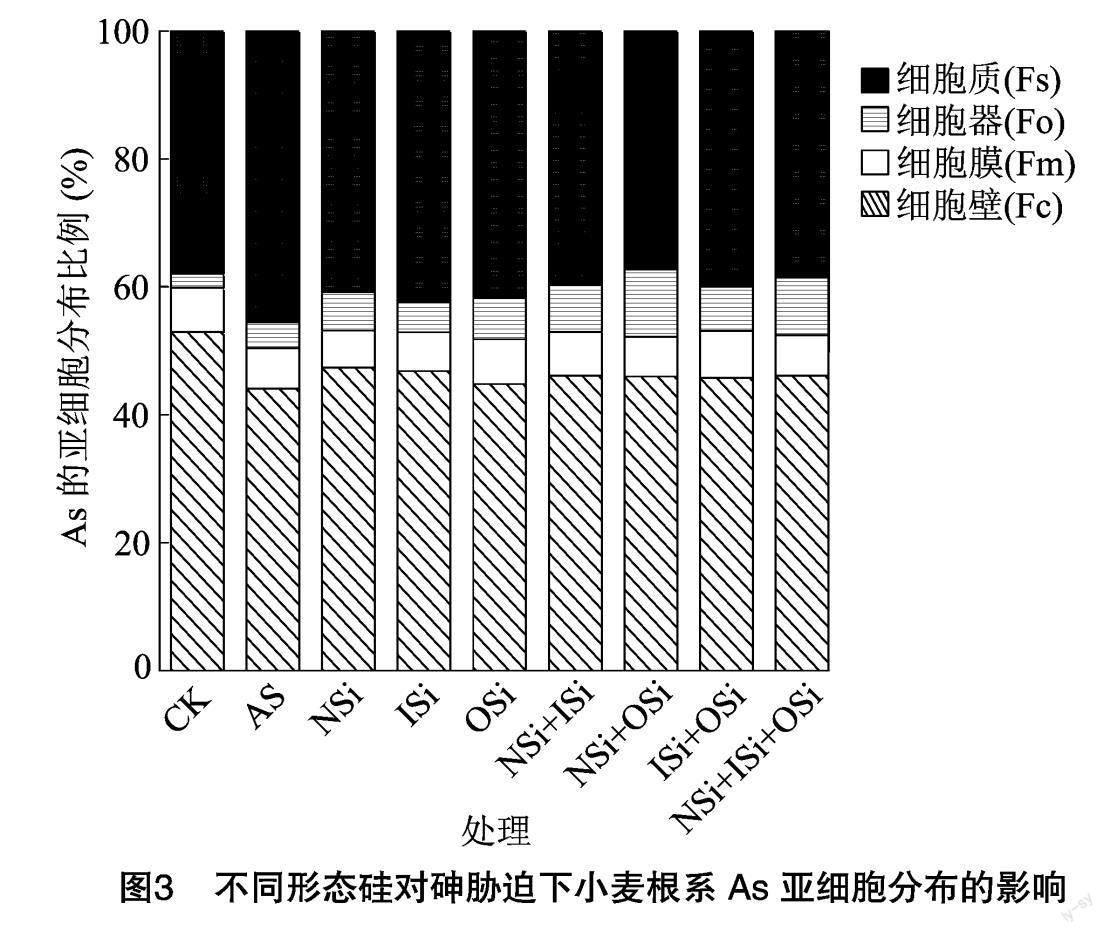
2.3 不同形态硅对砷胁迫下小麦根系As亚细胞分布的影响
由图3可知,基于差异离心法可将小麦根系亚细胞的As组分分为4个部分:细胞壁(Fc)、细胞器(Fo)、细胞膜(Fm)和细胞质(Fs)。不同硅形态及其组合处理不同组分中As分布比例差异较大,在根系中CK的As主要分布于Fc(52.93%)、Fs(37.95%)中,一小部分分布于Fo(2.18%)和Fm(6.94%)中。AS处理下,与CK相比,Fc中分布的比例较低(44.05%),Fo(4.07%)、Fs(4.07%)中分布的比例增加,而Fm中分布比例(6.37%)基本保持不变。就相關硅处理而言,其Fc中分布比例为44.79%~47.37%,Fm中分布比例为5.81%~7.38%,Fo中分布比例为4.75%~ 10.53%,Fs中分布比例为37.27%~42.34%,其中Fo中分布比例极大值及Fs中分布比例极小值均出现在NSi+OSi处理。
2.4 不同形态硅对砷胁迫下脂质过氧化物含量及重金属调控基因表达的影响
由图4-A可知,在脂质过氧化物(LPO)含量中, 以AS处理含量最高,CK、NSi、ISi、NSi+ISi、NSi+ ISi+OSi处理较其显著降低,其他处理与AS处理无显著差异。由图4-B可知, TaPCS1 的相对表达量中,各处理转录水平表现为CK<ISi<AS<OSi<NSi<NSi+ISi<ISi+OSi<NSi+ISi+OSi<NSi+OSi,与CK相比,相关砷胁迫处理提高1.88%~49.18%。由图4-C可知, TaMT1 相对表达量中,以CK 表达水平最低,相关砷胁迫处理较其显著提高14.47%~ 93.90%,其中多元组合处理整体大于一元处理,且以NSi+ISi+OSi处理表达水平最高。由图4-D可知, TaHMA3 相对表达量以CK最低,砷胁迫处理较其显著提高117.44%~212.21%;就相关砷胁迫处理而言,以NSi+OSi处理最高,其显著大于CK、AS、OSi、ISi+OSi处理。
2.5 不同形态硅对砷胁迫下小麦Si、As含量及土壤As含量的影响
由图5-A可知,在小麦植株Si含量中,未施硅处理(CK、AS)的Si含量均较低,二者无显著差异且均显著低于相关施硅处理。就施硅处理而言,各处理Si含量表现为ISi<NSi<OSi<ISi+OSi<NSi+ ISi<NSi+OSi<NSi+ISi+OSi处理,其中NSi+ISi+ OSi处理较其他硅处理提高4.59%~55.84%。各处理的硅转运通道调控基因( TaLsi1 )与植株Si含量变化趋势存在一定相似性,但NSi处理的 TaLsi1 表达水平与CK、AS处理无显著差异(图5-B)。小麦植株As含量中,无砷处理(CK)下,其根系及地上部的砷含量均明显低于砷施用处理;相关砷施用处理中均以AS处理的砷含量最高,与AS处理相比,相关硅处理的根系、地上部砷含量分别显著降低31.24%~45.14%、37.52%~55.73%(图5-C)。土壤As含量中,相关砷胁迫处理下,以AS处理最高,相关硅处理较其显著降低9.02%~13.58%,而相关硅处理间差距整体较小(图5-D)。
2.6 不同形态硅对砷胁迫下小麦As生物富集及转运的影响
由图6-A可知,砷的生物富集系数(BCF)中,以AS处理BCF最高,为0.945 9,相关硅处理较AS处理显著降低23.79%~43.48%;就砷胁迫处理而言,以NSi+OSi处理的BCF最低, 其他砷处理较其提高6.53%~76.94%,其中除NSi+ISi+OSi与 NSi+OSi 处理无显著差异外,其他砷处理均显著大于NSi+OSi处理。转移系数(TF)中,各处理TF变化规律与BCF基本一致,各处理TF表现为NSi+OSi<NSi+ISi+OSi<NSi+ISi<NSi<ISi+OSi<OSi<ISi<AS处理,即亦以AS处理最高,NSi+ISi+OSi、NSi+OSi处理较低,其中与NSi+OSi处理相比, 其他砷处理显著提高5.02%~21.45%(图6-B)。
3 结论与讨论
重金属胁迫是影响土壤可持续化及植物发育代谢的典型非生物胁迫之一,光合作用是受非生物胁迫影响的主要生理过程[18]。本研究中,与CK相比,外源施用30 mg/kg砷处理(AS)下小麦光合色素(叶绿素a、叶绿素b、类胡萝卜素)含量、PSⅡ最大光化学效率(Fv/Fm)、光化学淬灭系数(qP)、实际光化学效率(ΦPSⅡ)均显著降低,非化学淬灭系数(NPQ)显著提高。NPQ是反映光合系统Ⅱ(PSⅡ)吸收的光能无法用于光合电子传递而以热能形式散失的光能比例[17];前人研究表明,硅可通过促进呼 吸链中的呼吸与电子传递以加速叶绿素的生物合成;因此,重金属胁迫下施硅维持植物的光合能力可能与抑制光合色素降解和保护叶绿体超微结构有关[5,19]。进一步研究结果显示,叶绿素荧光参数指标极值整体出现在NSi+OSi、NSi+ISi+OSi处理,初步表明,As胁迫下不同形态硅组合纳米硅与有机硅组合施用可有效抑制光合色素的分解及维持光合作用进程。
植物螯合素基因( PCS1 )、金属硫蛋白合酶基因( MT1 )以及重金属转运蛋白( HMA3 )参与调控重金属的络合和转运[20]。 PCS1 在植物体全部器官的重金属螯合中发挥作用,其与脂质过氧化物(LPO)含量密切相关,随着 PCS1 表达下调,LPO则过量积累,从而加重重金属胁迫应激带来的负面影响。 HMA3 通过将细胞质中的重金属离子转运至液泡,同时介导重金属的长距离运输,在调控重金属螯合物的外排过程中发挥着枢纽作用[21]。 HMA3 有助于将As-螯合物通过质外体途径转运至液泡实现区室化,其转录水平深刻影响着植物的重金属抗性[10]。本研究中,外源施用30 mg/kg砷酸二氢钠处理下 TaPCS1、TaMT1以及TaHMA3 均发生上调表达;说明As积累于液泡溶胶中,且质外体途径活动频繁。而硅处理下As含量降低,施硅显著提高了小麦植株的Si含量;表明Si可以通过介导重金属调控基因的表达、硅吸收及调节抗氧化系统以缓解砷胁迫。此外,OSi相关处理的Si含量较高,这与前人的研究结论[8,22]一致:有机硅是最容易被植物吸收累积的主要硅形态。
重(类)金属在植物亚细胞中的分布模式是反映细胞健康状况的重要表征[23-24],细胞壁是阻止重金属进入细胞的首道屏障,其含有大量的果胶、纤维素和半纤维素,这些多糖物质可为细胞提供稳定而复杂的结构,且细胞壁含有大量的带负电荷的羧基等极性官能团,从而为重金属离子的进入提供多层屏障[25]。然而细胞壁的劫持能力有限,当细胞壁吸附饱和后,重金属阳离子进入细胞,从而诱导高尔基体合成硫基官能团形成络合物将重金属运至细胞器(液泡),从而降低重金属对细胞生理的负面影响[26]。本研究中,与CK相比,砷脅迫处理(AS)细胞壁中As比例降低、细胞器和细胞质中的As比例增加,且脂质过氧化物含量增加,说明30 mg/kg的As已严重干扰细胞的生理过程。本研究中,与AS处理相比,相关硅处理下的细胞壁、细胞器中As比例增加,细胞质中As比例降低。这可能是因为Si可提高细胞壁木质化以提高重金属固持能力,并有效促进As-络合物的形成并进入液泡进行区室化的缘故[27-28]。此外,本研究进一步表明,以纳米硅组合处理(NSi+OSi、NSi+ISi+OSi)的细胞器中As比例较大,细胞质中As比例较小,这可能取决于植物体内Si含量。
本研究结果表明,SiNPs处理(NSi)下小麦植株Si含量较高,但SiNPs处理的硅转运基因( TaLsi1 )表达水平与未施用硅处理(CK、AS)无明显差异。González-Garcia等的研究表明,由于纳米材料直径微小能随着水分吸收进入甜椒体内,且其更容易被细胞吸收利用[29];因此SiNPs可能随着水分、养分进入小麦体内而不经过转运蛋白介导转运。此外,生物富集系数(BCF)、转移系数(TF)中,均以NSi+OSi处理最低,其他砷处理较其分别增加6.53%~76.94%、5.02%~21.45%。综上所述,30 mg/kg As胁迫下施用不同形态硅及其组合可保护光合色素降解和提高光合效率、调节As在亚细胞的分布、调控重金属转运基因的表达使As区室化,并通过增加Si吸收和降低As累积维持生理稳态以缓解砷胁迫;整体来看以纳米硅与正硅酸乙酯组合施用(NSi+OSi)效果最佳。
参考文献:
[1] Zhuang F,Huang J Y,Li H G,et al. Biogeochemical behavior and pollution control of arsenic in mining areas:a review[J]. Frontiers in Microbiology,2023,14:1043024.
[2]曾思燕,于昊辰,马 静,等. 中国耕地表层土壤重金属污染状况评判及休耕空间权衡[J]. 土壤学报,2022,59(4):1036-1047.
[3]Tang Z,Zhao F J. The roles of membrane transporters in arsenic uptake,translocation and detoxification in plants[J]. Critical Reviews in Environmental Science and Technology,2021,51(21):2449-2484.
[4]和淑娟,王宏镔,王海娟,等. 砷胁迫下3-吲哚乙酸对不同砷富集能力植物根系形态和生理的影响[J]. 农业环境科学学报,2016,35(5):878-885.
[5]龚明贵,刘凯洋,魏亚楠,等. 砷胁迫下接种丛枝菌根真菌对棉花光合特性和叶肉细胞超微结构的影响[J]. 棉花学报,2022,34(3):256-266.
[6]Cui J H,Jin Q A,Li F B,et al. Silicon reduces the uptake of cadmium in hydroponically grown rice seedlings:why nanoscale silica is more effective than silicate[J]. Environmental Science:Nano,2022,9(6):1961-1973.
[7]Kovács S,Kutasy E,Csajbók J.The multiple role of silicon nutrition in alleviating environmental stresses in sustainable crop production[J]. Plants,2022,11(9):1223.
[8]李淑贤,刘卫国,高 阳,等. 硅对人工阴蔽胁迫下大豆幼苗生长及光合特性的影响[J]. 中国农业科学,2018,51(19):3663-3672.
[9]Wu J W,Mock H P,Giehl R F H,et al. Silicon decreases cadmium concentrations by modulating root endodermal suberin development in wheat plants[J]. Journal of Hazardous Materials,2019,364:581-590.
[10] 张明辉,时曼丽. 硒、硅对镉胁迫下小麦生长、生理特性及镉分布的影响[J]. 江苏农业科学,2022,50(17):66-73.
[11]白凤麟,樊雨荷,李 琳. 硒、硅对盐胁迫下小麦光合生理及养分累积的影响[J]. 江苏农业科学,2023,51(3):68-75.
[12]史高玲,周东美,余向阳,等. 水稻和小麦累积镉和砷的机制与阻控对策[J]. 江苏农业学报,2021,37(5):1333-1343.
[13]Zhao F J,Tang Z,Song J J,et al. Toxic metals and metalloids:uptake,transport,detoxification,phytoremediation,and crop improvement for safer food[J]. Molecular Plant,2022,15(1):27-44.
[14]Lou L Q,Shi G L,Wu J H,et al. The influence of phosphorus on arsenic uptake/efflux and As toxicity to wheat roots in comparison with sulfur and silicon[J]. Journal of Plant Growth Regulation,2015,34(2):242-250.
[15]Shi G L,Liu H A,Zhou D M,et al. Sulfur reduces the root-to-shoot translocation of arsenic and cadmium by regulating their vacuolar sequestration in wheat (Triticum aestivum L.)[J]. Frontiers in Plant Science,2022,13:1032681.
[16]李合生. 植物生理生化实验原理和技术[M]. 北京:高等教育出版社,2000.
[17]高战武,范春燕,鄢上钦,等. 盐碱胁迫下外源油菜素内酯与AM真菌对羊草光合特性及抗氧化酶系统的影响[J]. 山东农业科学,2022,54(5):44-52.
[18]吴敏兰,李荭荭,贾洋洋,等. 砷胁迫对不同烟草品种光合色素和叶绿素荧光特性的影响[J]. 生态毒理学报,2015,10(3):216-223.
[19]Li H H,Li Y T,Li X,et al. Low-arsenic accumulating cabbage possesses higher root activities against oxidative stress of arsenic[J]. Plants,2023,12(8):1699.
[20]Monayem H M,Amena K M,Najmul H M,et al. Silicon alleviates arsenic-induced toxicity in wheat through vacuolar sequestration and ROS scavenging[J]. International Journal of Phytoremediation,2018,20(8):796-804.
[21]Huang H L,Li M,Rizwan M,et al. Synergistic effect of silicon and selenium on the alleviation of cadmium toxicity in rice plants[J]. Journal of Hazardous Materials,2021,401:123393.
[22] 薛高峰,张贵龙,孙焱鑫,等. 喷施不同形态硅对温室番茄生长发育及品质的影响[J]. 中国农学通报,2012,28(16):272-276.
[23]张 立,王 杰. 不同硒形态对镉胁迫下油菜镉亚细胞分布、化学形态及硒累积的影响[J]. 江苏农业科学,2022,50(17):259-264.
[24]武 坤,孔 潇,董 郁,等. 人工湿地植物对污水中重金属铬、镉、铅富集能力的整合分析[J]. 江苏农业学报,2022,38(6):1532-1540.
[25]Riaz M,Kamran M,Rizwan M,et al. Cadmium uptake and translocation:selenium and silicon roles in Cd detoxification for the production of low Cd crops:a critical review[J]. Chemosphere,2021,273:129690.
[26]Hou L,Ji S Z,Zhang Y,et al. The mechanism of silicon on alleviating cadmium toxicity in plants:a review[J]. Frontiers in Plant Science,2023,14:1141138.
[27]Ma J F,Shen R F,Shao J F. Transport of cadmium from soil to grain in cereal crops:a review[J]. Pedosphere,2021,31(1):3-10.
[28]Sheng H C,Chen S L. Plant silicon-cell wall complexes:identification,model of covalent bond formation and biofunction[J]. Plant Physiology and Biochemistry,2020,155:13-19.
[29]González-García Y,Cárdenas-lvarez C,Cadenas-Pliego G,et al. Effect of three nanoparticles (Se,Si and Cu) on the bioactive compounds of bell pepper fruits under saline stress[J]. Plants,2021,10(2):217.
收 稿日期:2023-06-09
基金項目:江西省教育厅科学技术研究项目(编号:GJJ160387)。
作者简介:甘志凯(1984—),男,江西樟树人,讲师,从事植物生物学研究。E-mail:bjyangll@163.com。
