Treg细胞抑制慢性中耳炎模型小鼠中耳炎症的进展
2024-03-22杨启梅刘晓娜陈菁华西北妇女儿童医院耳鼻喉科西安7006陕西省人民医院耳鼻咽喉头颈外科通讯作者mail703379qqcom
王 丹,杨启梅,刘晓娜,陈菁华(西北妇女儿童医院耳鼻喉科,西安 7006;陕西省人民医院耳鼻咽喉头颈外科;通讯作者,E-mail:703379@qq.com)
慢性中耳炎(chronic otitis media,COM)是临床上多发的儿童性疾病[1],主要分为慢性分泌性中耳炎和慢性化脓性中耳炎[2,3],疾病的发展会导致听力损失、语言发育延迟以及永久性中耳损伤等[4]。研究表明,在COM的细菌感染中,大多数病例是由革兰氏阴性菌引起[5]。脂多糖是革兰氏阴性菌的一种成分,已在人类中耳积液(middle ear fluid,MEE)中检测到[6],其在慢性中耳炎患者中的水平明显高于急性中耳炎患者[7]。研究表明,COM与持续性细菌感染有关,在90%以上的COM患者的中耳黏膜(middle ear mucosa,MEM)活检标本中均发现了不同的致病菌群[8]。据报道,咽鼓管(eustachian tube,ET)功能紊乱和持续的细菌感染与COM的发病机制密切相关[9]。通过ET阻断产生的COM小鼠显示出持续的浆液性中耳积液,同时伴有中耳腔内炎性细胞浸润(尤其是淋巴细胞)和细胞因子产生的组织学变化[10]。
不可分型流感嗜血杆菌(non-typeableHaemophilusinfluenzae,NTHi)被认为是COM的主要病原体[11]。NTHi菌株可以在气道内持续很长时间,当宿主的黏膜清除机制受损时,NTHi可以引起一系列的气道感染[12]。目前,通常采用制造ET功能障碍和持续NTHi细菌感染构建COM动物模型,以用于研究COM的发病机制[12-14]。调节性T细胞(Treg),也被称为抑制性T细胞,是由一个特定的细胞亚群组成,在功能上抑制免疫系统的过度激活,保持对自我抗原的免疫耐受[15],编码Treg细胞转录因子叉头盒P3(fork headbox protein 3,Foxp3)的基因是Treg分化和功能的主基因[16]。研究表明,Treg可针对体内的细菌、病毒和寄生虫抗原被激活和扩大[17]。本研究通过ET阻断和接种NTHi,建立了持续性NTHi感染的小鼠COM模型,以探究Treg对慢性中耳炎感染进展的影响。
1 材料与方法
1.1 材料
1.1.1 试剂 磷酸盐缓冲盐水(PBS)购自上海生工有限公司;巧克力琼脂、多聚甲醛购自碧云天生物科技有限公司;27号针头购自Hamilton公司(美国);山羊血清、牛血清白蛋白购自AusgeneX公司(澳大利亚);一抗TNF-α、IL-1β、IL-10、TGF-β和CD4抗体、Foxp3抗体、CD25抗体均购自Abcam公司(美国);商用ELISA试剂盒购自R&D公司(美国);Ⅳ型胶原酶购自Sigma公司(美国);CD4+CD25+FOXP3+Treg调节性T细胞检测试剂盒购自EXBIO公司(捷克);苏木精-伊红(HE)染色试剂盒购自北京索莱宝科技有限公司。
1.1.2 实验动物与菌株 4周龄BALB/c小鼠购自陕西中医药大学【SCXK(陕)2021-001】,所有小鼠均在西北妇女儿童医院医学检验中心实验动物屏障设施中适应性饲养1周,然后进行动物实验,本研究动物实验符合动物福利规范,获得本院伦理委员会的批准(审批号:No.2021-9-06-1035)。具有活性的不可分型流感嗜血杆菌NTHi菌株由西北妇女儿童医院医学检验中心实验室提供。
1.2 方法
1.2.1 NTHi诱导实验性COM小鼠模型 根据文献所述研究方法[18],NTHi菌株采用巧克力琼脂于37 ℃和5%CO2下培养16 h,测定细菌浓度,加入磷酸盐缓冲溶液(PBS)制备浓度为2×109CFU/mL的细菌悬液。采用异氟醚吸入法麻醉小鼠后,于小鼠颌下皮肤处切口,暴露右下鼓室,切开靠近鼓室的咽鼓管(ET),并将明胶海绵插入ET(形成ET阻塞)。然后用27号针头在鼓膜上开2个微孔,将微吸管插入其中一个孔中,缓慢接种10 μL的NTHi细菌悬浮液,每3 d注射1次,共3次。通过对小鼠进行耳镜监测,出现中耳积液和中耳黏膜组织增厚表示造模成功。本实验设置模型组(n=40)和对照组(n=40),模型组为造模成功的小鼠,对照组为未进行ET阻断和NTHi接种的小鼠。
分别在末次注射后的第3天(M3 d组)、第14天(M14 d组)、第28天(M28 d组)和第56天(M56 d组),模型组和对照组均各取8只小鼠给予腹腔注射3%戊巴比妥麻醉处理并断头处死。对各只小鼠进行耳镜监测,确认MEE状态和鼓膜的变化。根据分级标准[19]进行炎症严重程度评分:0分,灰色和半透明的鼓膜,没有MEE;1分,灰色和不透明的鼓膜,有浆液性MEE或黏液性MEE;2分,黄色和不透明鼓膜,有脓性MEE;3分,不透明鼓膜,有浆液性MEE。收集各只小鼠MEE,取部分连续稀释后将样品置于巧克力琼脂上,培养并计数细菌菌落。使用200 μL生理盐水清洗小鼠中耳,分离收集小鼠中耳组织和中耳黏膜组织后续实验备用。
1.2.2 苏木精-伊红(HE)染色检测小鼠中耳黏膜组织炎性病变程度 各组小鼠中耳黏膜组织使用4%多聚甲醛固定48 h,并在0.12 mol/L的EDTA溶液(pH=7.4)中脱钙后,再进行梯度乙醇脱水和二甲苯处理,然后包埋于石蜡切成4 μm厚度切片。按照试剂盒方法进行HE染色,使用Image J软件检测和分析黏膜厚度和MEM中的炎性细胞数量,采用光学显微镜观察并拍照。
1.2.3 免疫组织化学检测CD4+和Foxp3+细胞水平 取1.2.2项下制好的石蜡切片,于室温下用3%的H2O2处理15 min。再将切片于含5%正常山羊血清的PBS缓冲液中封闭处理30 min,然后加入兔抗小鼠CD4抗体(1∶500)或兔抗小鼠Foxp3抗体(1∶500)于含1%牛血清白蛋白的PBS缓冲液于室温下孵育12 h。PBS清洗后,切片与加入生物素化的山羊抗兔抗体(1∶1 000)的1%牛血清白蛋白的PBS缓冲液于室温下孵育6 h。用PBS冲洗后,经过DAB液显色,然后苏木素染色、蓝化、脱水和透明处理,最后中性树胶封片,采用光学显微镜观察并拍照,采用Image J软件量化阳性染色强度。
1.2.4 ELISA检测小鼠MEE中炎性因子TNF-α、IL-1β、IL-10和TGF-β水平 取1.2.1项下收集的MEE,按照ELISA试剂盒方法检测肿瘤坏死因子α(TNF-α)、白细胞介素-1β(IL-1β)、IL-10和转化生长因子(TGF-β)的水平。
1.2.5 Western blot检测小鼠中耳黏膜组织中炎性因子TNF-α、IL-1β、IL-10和TGF-β蛋白表达水平 取方法1.2.1项下分离收集的各组小鼠中耳黏膜组织,加入RIPA裂解液提取组织总蛋白,采用BCA试剂盒对总蛋白定量。再经过12%的SDS-PAGE电泳分离蛋白条带,转移至PVDF膜,然后加入5%的脱脂牛奶封闭。加入一抗TNF-α(1∶500)、IL-1β(1∶1 000)、IL-10(1∶500)和TGF-β(1∶500)于4 ℃下孵育过夜。再加入稀释后的二抗于室温下孵育2 h,经过ECL显色和曝光后成像。采用Image J软件分析蛋白条带灰度值,GAPDH作为内参蛋白。
1.2.6 流式细胞术检测分析小鼠中耳黏膜组织CD4+CD25+Foxp3+Treg细胞水平 参考文献[20]方法,取1.2.1项下收集的小鼠新鲜中耳黏膜组织,采用0.5 mg/mL的Ⅳ型胶原酶解离处理组织,分离并培养制作获得单细胞悬浮液,调整细胞密度为1.0×106个/mL用于流式细胞术检测。单细胞悬浮液中加入异硫氰酸荧光素(FITC)标记的抗CD4单克隆抗体mAb、藻红素(PE)标记的抗Foxp3 mAb和别藻蓝蛋白(APC)标记的抗CD25 mAb,然后4℃下避光处理30 min,PBS洗涤后流式细胞仪上机检测分析CD4+CD25+Foxp3+Treg/CD4+比例,采用Cell Quest软件分析Treg的免疫荧光强度。
1.2.7 注射抗CD25 mAb模拟体内Treg耗竭并检测T细胞和炎性因子水平 参考文献[21]方法,在ET阻断和NTHi接种处理后第14,28,42天,每只小鼠腹腔注射125 μl抗-CD25 mAb(作为抗-CD25组,n=8),PBS组小鼠腹腔注射等体积PBS(n=8)。在治疗第56天后,小鼠腹腔注射3%戊巴比妥麻醉处理后断头处死,立即分离收集脾脏、颈部淋巴结和中耳黏膜组织,采用IV型胶原酶解离处理制作获得单细胞悬浮液。按照1.2.6所述检测脾脏、颈部淋巴结和中耳黏膜组织中CD4+CD25+Foxp3+Treg阳性细胞百分比;按照1.2.1所述收集各只小鼠MEE,培养并计数细菌菌落;按照1.2.3所述检测中耳黏膜组织单细胞悬浮液中TNF-α、IL-1β、IL-10和TGF-β的水平。
1.3 数据分析
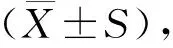
2 结果
2.1 NTHi成功诱导构建小鼠COM模型
与对照组相比,模型组小鼠均在3 d后出现中耳积液且为脓性,在第14天炎症严重程度和细菌数量均至最高值;从第28天至第56天,小鼠炎症严重程度和中耳积液细菌数量均呈一定程度下降,但相较于对照组仍处于较高水平(P<0.05,见表1)。

表1 两组小鼠中耳炎症严重程度和中耳积液细菌数量比较Table 1 Comparison of the severity of middle ear inflammation and the number of bacteria in middle ear effusion between the two groups of mice
2.2 NTHi诱导的COM小鼠中耳黏膜组织炎性细胞浸润和黏膜厚度增加
HE染色结果显示,对照组小鼠中耳黏膜组织正常;与对照组比较,模型组小鼠接种后第3天,小鼠中耳黏膜组织出现炎性细胞浸润,炎性细胞数量和黏膜厚度增加(P<0.05),到第14天至最高值;接种后第28天至第56天,小鼠中耳黏膜厚度和炎性细胞浸润程度增加趋势稍有减缓(P<0.05,见图1)。
注:与对照组相比,*P<0.05,**P<0.01。图1 NTHi诱导的COM小鼠中耳黏膜组织炎症和黏膜厚度变化Figure 1 Changes of inflammation and mucosal thickness in mucosal tissue of COM mice induced by NTHi
2.3 NTHi诱导的COM小鼠中耳黏膜组织中CD4+CD25+Foxp3+ Treg细胞水平升高
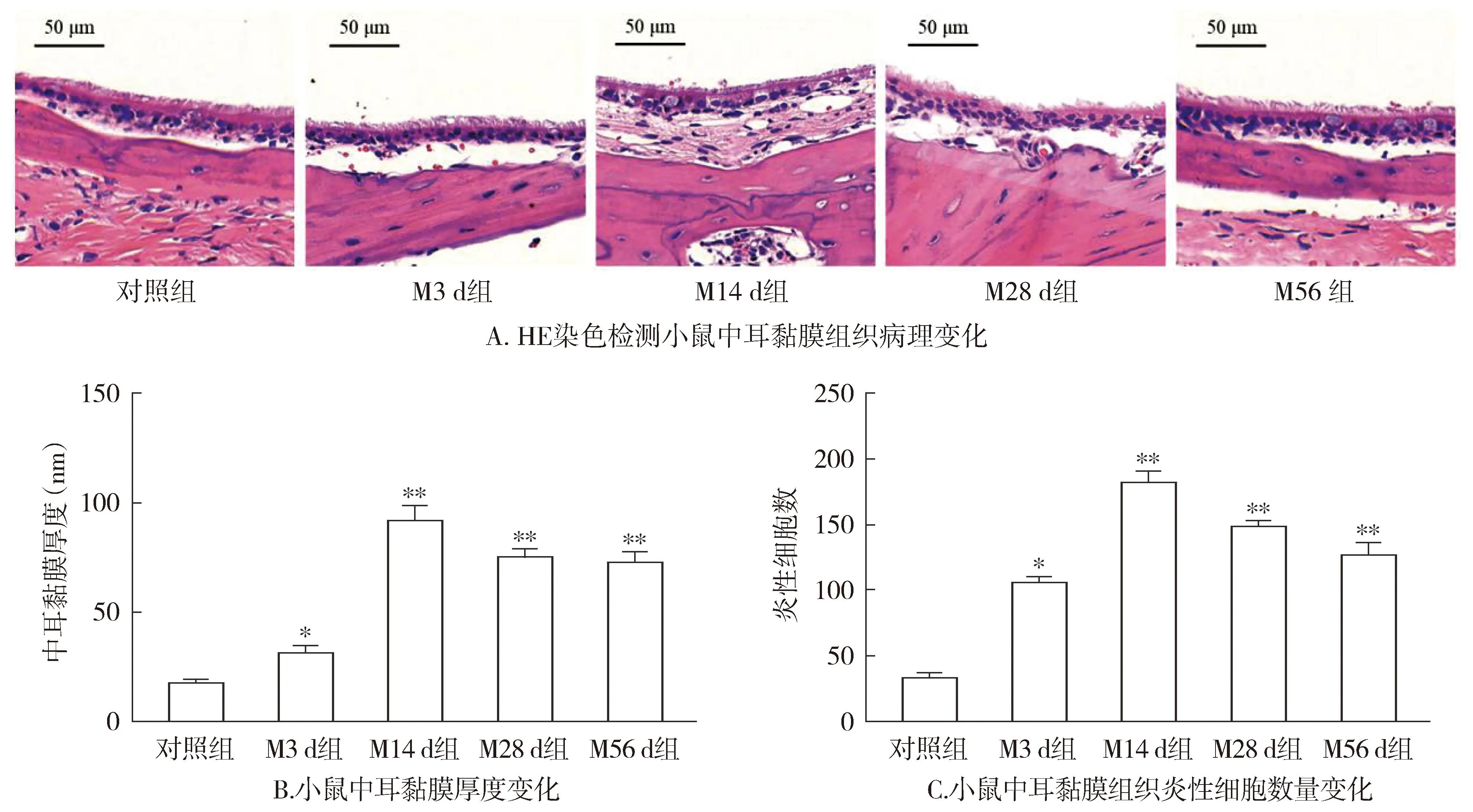
免疫组化结果显示,模型组小鼠接种后第3天,中耳黏膜组织中CD4+和Foxp3+细胞阳性染色水平升高,从接种后第28天至第56天,中耳黏膜组织中CD4+和Foxp3+细胞阳性染色水平升高趋势稍有缓解(见图2)。流式细胞术检测结果显示,与对照组相比,模型组小鼠接种后第3天,中耳黏膜组织中CD4+CD25+Foxp3+细胞水平升高(P<0.05),到第14天至最高值;接种后第28天至第56天,与对照组相比仍处于较高水平(P<0.05,见图3)。

图2 免疫组织化学检测小鼠中耳黏膜组织中CD4+和Foxp3+细胞变化Figure 2 Changes of CD4+ and Foxp3+ cells in mouse middle ear mucosa detected by immunohistochemistry
注:与对照组相比,*P<0.05,**P<0.01。图3 流式细胞术检测小鼠中耳黏膜组织中CD4+CD25+Foxp3+细胞变化Figure 3 Changes of CD4+CD25+Foxp3+ cells in mouse middle ear mucosa detected by flow cytometry
2.4 NTHi诱导的COM小鼠中耳积液和中耳黏膜组织中炎性因子水平升高
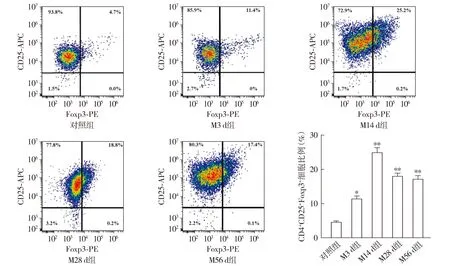
ELISA检测结果显示,与对照组相比,模型组小鼠接种后第3天,中耳积液中促炎因子IL-1β和TNF-α的水平达到最高(P<0.001),在第14天抑炎因子IL-10和TGF-β的水平达到最高(P<0.001),在第28,56天,IL-1β、TNF-α、IL-10和TGF-β的水平均呈下降趋势,但与对照组相比仍处于较高水平(P<0.01,见图4)。Western blot检测小鼠中耳黏膜组织中炎性因子水平结果变化趋势与ELISA检测结果一致(见图5)。

注:与对照组相比,**P<0.01,***P<0.001。图4 ELISA检测小鼠中耳积液中炎性因子表达水平变化Figure 4 Expressions of inflammatory factors in the middle ear effusion of mice detected by ELISA
注:与对照组相比,**P<0.01,***P<0.001。图5 Western blot检测小鼠中耳黏膜组织中炎性因子表达水平变化Figure 5 Expressions of inflammatory factors in mouse middle ear mucosa detected by Western blot
2.5 Treg细胞消耗对COM小鼠细菌清除和炎症的影响
流式细胞术结果显示,与PBS组小鼠相比,抗-CD25组小鼠中耳黏膜、脾脏和颈部淋巴结组织中CD4+CD25+Foxp3+细胞比例均显著降低(P<0.05,见图6)。细菌计数和炎性因子检测结果显示,与PBS组小鼠相比,抗-CD25组小鼠中耳积液中细菌数和中耳黏膜组织中炎性因子IL-1β、TNF-α、IL-10和TGF-β的水平均降低(P<0.01,见图7)。

图6 抗CD25 mAb对小鼠中耳黏膜组织、脾脏和颈部淋巴结中CD4+CD25+Foxp3+细胞的影响Figure 6 Effect of anti-CD25 mAb on CD4+CD25+Foxp3+ cells in middle ear mucosa tissue, spleen and cervical lymph nodes of mice
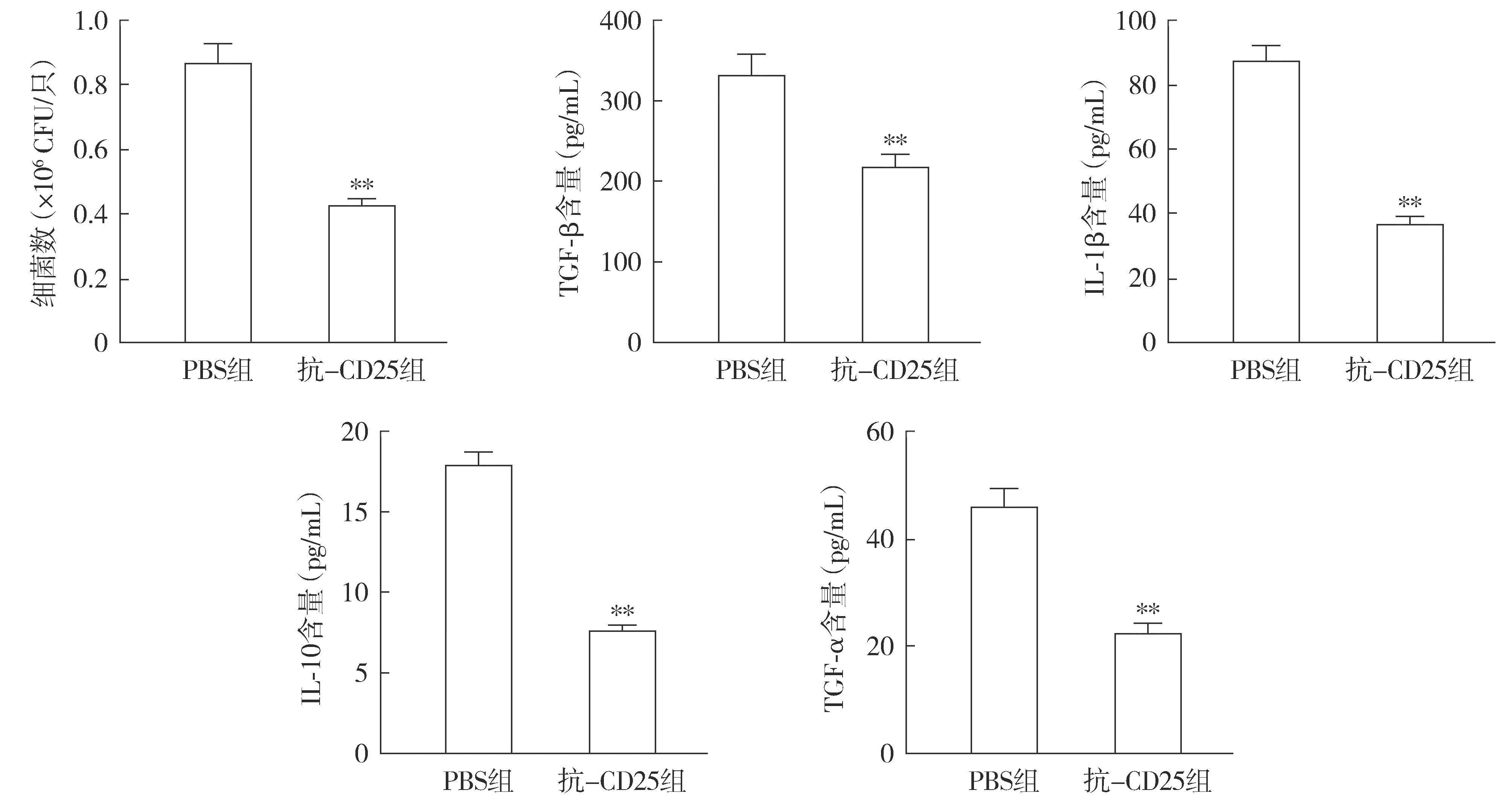
注:与PBS组相比,**P<0.01。图7 抗CD25 mAb对小鼠中耳积液细菌数和中耳黏膜组织中炎性因子水平的影响Figure 7 Effects of anti-CD25 mAb on bacterial count and inflammatory factors in middle ear effusion of mice
3 讨论
慢性中耳炎(COM)是中耳和乳突腔的一种慢性炎症,通常由复发性急性中耳炎发展而来,涉及多微生物的感染[22]。NTHi被认为是呼吸道感染疾病的重要病原菌,也是急性中耳炎的主要病原体[23]。先前有研究报道[24],接种NTHi诱发了栗鼠的急性中耳炎,但在14 d后,仅能检测到少量具有活性的NTHi,而在大鼠急性中耳炎模型中8 d后检测不到NTHi的存在。以上动物造模过程中并没有实施ET阻断处理,而中耳的感染进程也仅限于几个星期。在本研究中,通过将NTHi接种至中耳并采用ET阻断处理成功建立了COM小鼠模型。结果显示,COM小鼠的中耳黏膜增厚,且出现炎性细胞浸润;在造模后第56天,COM小鼠中耳黏膜组织仍存在炎症病理状态,且在COM小鼠的中耳积液中均检测到NTHi的存在。
CD4+CD25+Foxp3+Treg作为T淋巴细胞亚群的成员,主要对机体免疫反应起到负调控作用,通过免疫抑制作用让机体产生免疫耐受性,以防止自身免疫疾病的发生,同时还会导致炎症反应趋向慢性发展[25]。研究显示,在健康黏膜中观察到T细胞辅助亚群的平衡在炎症黏膜中发生改变,CD4+/CD8+T细胞的比例根据慢性鼻炎炎症的严重程度而增加[19]。本研究结果表明,与对照组相比,模型组COM小鼠中耳黏膜组织中CD4+和Foxp3+细胞和CD4+CD25+Foxp3+细胞比例均发生不同程度的升高,这表明Treg在COM发生过程中已发挥免疫效应。也有报道显示,Treg细胞与炎症反应的发生密切相关,且具有一定的抗炎作用,研究认为Treg细胞通过对机体免疫系统过度活化和病理性自身免疫反应的抑制,发挥免疫调节功能,维持机体免疫平衡,同时还可以发挥抗炎作用[26]。本研究中,与对照组比较,模型组COM小鼠随着造模时间的延长,小鼠中耳积液和中耳黏膜组织中促炎性因子IL-1β和TNF-α水平迅速升高,这些促炎因子激活机体先天和获得性免疫系统清除侵入的抗原;同时也检测到抑炎因子IL-10和TGF-β水平的升高,这可能提示机体内T淋巴细胞亚群CD4+CD25+Foxp3+Treg发挥免疫抑制作用,通过分泌或诱导产生抑炎因子IL-10和TGF-β,以维持机体内炎症反应的平衡,促使机体恢复正常免疫和生理水平,避免产生自身免疫性伤害。
CD4+T细胞可通过TGF-β诱导的Foxp3的表达转化为CD4+Treg[27]。1型调节性T细胞(Tr1细胞)通过产生高水平的IL-10来抑制抗原特异性免疫反应,而Tr1细胞在激活后可暂时表达Foxp3;调节T细胞3型(Th3)通过产生高水平的TGF-β以驱动外周抗原特异性Foxp3调节细胞的分化,在诱导和维持外周耐受方面发挥了关键作用[28]。在本研究中,这些Treg被认为与NTHi感染中的持续炎症有关。众所周知,Treg在控制感染性疾病(包括病毒、寄生虫和细菌)方面发挥着重要作用,Treg在宿主防御中发挥着两种不同的关键免疫作用(保护性或有害性)[29]。Treg细胞已成为机体对细菌、真菌和病毒免疫抵抗的重要组成部分,其发挥的免疫防御功能有效减轻了机体组织损伤程度,但另一方面也导致机体对入侵病原体的免疫反应降低,致使病原体在宿主体内持久存在[30]。研究表明,结核分枝杆菌对机体的持久性感染与Treg细胞在损伤组织内持续增殖和聚集密切相关,而当对Treg细胞适当消耗后,小鼠对结核分枝杆菌的负担显著下降[31]。严唯[32]研究发现,烟曲霉菌感染小鼠肺部后,CD4+CD25+Foxp3+Treg细胞参与了抑制宿主炎症反应过程,但同时也抑制了宿主对烟曲霉菌的清除作用;当模型小鼠腹腔注射CD25中和抗体后,CD4+CD25+Foxp3+Treg细胞比例下降,受感染的小鼠肺部对烟曲霉菌的负荷也下降。在本研究中,COM小鼠腹腔注射抗-CD25 mAb后,第56天CD4+CD25+Foxp3+Treg细胞比例显著下降,同时MEE中的细菌数量也显著减少,这表明机体过度免疫后,CD4+CD25+Foxp3+Treg细胞的适当降低,能够促进宿主对细菌的清除作用,该结果与严唯[32]的研究结果一致。
本研究证明了Treg细胞在慢性中耳炎中发挥免疫保护和抑制自身免疫性伤害两种不同免疫作用,同时发现在中耳局部的免疫应答中Treg细胞发挥主要免疫作用,但炎症作为一种可能涉及全身组织器官的反应,慢性中耳炎所引起的全身和局部免疫应答中Treg细胞是否仍处于主导免疫角色未可知,这也是本研究的局限性之一。同时,本研究未对慢性中耳炎小鼠Treg细胞发挥免疫效应可能涉及到的分子信号通路做深入的解析,与T细胞分化相关的PI3K/Akt/mTOR信号通路[15],以及与中耳炎相关的TGF-β信号通路[33],都有可能是慢性中耳炎中Treg细胞发挥免疫作用的分子机制,这也是未来研究需要深度解析的方向。
综上所述,本研究成功构建NTHi可持续感染的COM小鼠模型,Treg细胞在慢性中耳炎的炎症平衡维持中具有重要作用,抑制炎症的进展,但过度的Treg细胞抑制了宿主对细菌的清除作用。
