B 细胞淋巴瘤2 表达与B 细胞淋巴瘤2 抑制剂在骨髓增生异常综合征患者中疗效的相关性研究
2024-03-22吴佳霏王珺王依景郑博月王宇江川艳董丹丹李慧
吴佳霏,王珺,王依景,郑博月,王宇,江川艳,董丹丹,李慧,*
1.610054 四川省成都市,电子科技大学医学院
2.610500 四川省成都市,成都医学院临床医学院
3.610000 四川省成都市,四川省医学科学院·四川省人民医院血液内科
4.610021 四川省成都市第二人民医院血液科
5.610000 四川省成都市,四川省医学科学院·四川省人民医院病理科
骨髓增生异常综合征(myelodysplastic syndrome,MDS)最常见于老年人,是以发育异常、无效造血和进展为急性髓系白血病(acute myeloid leukemia,AML)的可变风险为特征的异质性克隆干细胞疾病[1-2]。患者的预后根据风险分层不同相差较大,从低风险患者的几年到高风险患者的几个月不等[3]。造血干细胞移植是目前唯一的根治方案,但因移植相关的不良反应常不能耐受,或者由于年龄限制、伴有合并症而不能适用[4]。目前对于高风险MDS 患者的治疗方案疗效欠佳,多数患者未接受抗白血病治疗[5]。B 细胞淋巴瘤2(Bcl-2)抗凋亡蛋白在部分恶性肿瘤中如髓系肿瘤、滤泡淋巴瘤中高表达,其与患者疾病进展、化疗耐药和总生存期缩短相关[6-8]。目前口服Bcl-2 选择性抑制剂维奈克拉(venetoclax,VEN)被WHO 批准用于≥75 岁或伴有合并症而不适合用强化化疗方案的初诊AML 患者[9]。目前VEN 在MDS 患者中的应用较少,尤其缺乏在中国患者中应用的数据。Bcl-2 在MDS 患者中的表达是否存在差异及其与VEN治疗的疗效和预后是否存在相关性,目前研究较为缺乏。据此,本研究拟通过分析Bcl-2 蛋白在MDS 患者中的表达,评估其是否与VEN 治疗的疗效和预后相关,进而确定VEN 治疗可能获益的患者亚群,为临床治疗MDS 患者提供参考。
1 对象与方法
1.1 研究对象
回顾性分析2018 年7 月—2022 年12 月就诊于四川省医学科学院·四川省人民医院71 例MDS 患者的临床资料。收集患者基线数据:性别、年龄、血常规、血生化、骨髓细胞学、流式细胞学、染色体核型[好:正常、-Y、11q-、单纯5q-、单纯12p-、单纯20q-、包括5q-在内的两个异常;中等:单纯7q-、+8、+19、i(17q)、任何单纯或独立的两个克隆异常;差:-7、inv(3)/t(3q)/3q-、包括-7/7q-在内的两个异常、复杂(≥3 种异常)]、髓系基因突变、融合基因突变、MDS-EB 分型(MDS-EB 定义为骨髓增生异常综合征伴原始细胞增多;MDS-EB-1 定义为骨髓原始细胞5%~9%或外周血原始细胞2%~4%,无Auer 小体;MDS-EB-2 定义为骨髓原始细胞10%~19%或外周血原始细胞5%~19%或有Auer小体[10])等。依据修正版国际预后积分系统(IPSS-R)将患者分为极低危(0 例)、低危(1 例)、中危(7 例)、高危(40 例)和极高危(23 例)5 个危险度。纳入标准:(1)符合WHO 修订的2016 版髓系肿瘤和AML 诊断标准[11];(2)年龄≥18 岁;(3)进行骨髓活检;(4)签署知情同意书。排除标准:(1)不能耐受化疗者;(2)伴有其他恶性肿瘤或其他严重感染者;(3)中途退出者。本研究已通过四川省人民医院伦理委员会审查[伦审(研)2022 年第433 号]。
1.2 Bcl-2 蛋白测定及分组
患者骨髓活检标本均在初诊第一次化疗前取得,病理科通过免疫组化染色技术检测Bcl-2 蛋白表达。将Bcl-2 阳性率≥10%定义为Bcl-2 阳性,<10%为Bcl-2阴性[12]。将患者分为阳性组(n=38)和阴性组(n=33)。
1.3 治疗方案
在63 例高危与极高危MDS 患者中,有38 例患者接受治疗并进行疗效评估,其中28 例患者接受VEN 联合阿扎胞苷(VA 联合方案)治疗,VEN 剂量为400 mg/d,共治疗14 d,如果同时服用唑类抗真菌药物,VEN 剂量减少至100~200 mg/d[13];10例接受低甲基化药物(HMA,包括阿扎胞苷或地西他滨)单药治疗。治疗过程中如果出现严重并发症或骨髓抑制威胁患者生命时,暂停服用VEN,在病情稳定后恢复使用。化疗期间予护胃、保肝、止吐、水化、碱化等支持治疗,加强口腔及肛周护理,给予营养支持。骨髓抑制期间,据患者临床表现及血常规检查结果,积极输注成分血及对症支持。
1.4 疗效评估
根据国际工作组提出的疗效标准[14-16]评估疗效。包括完全缓解(complete remission,CR)、部分缓解(partial response,PR)、 骨髓完全缓解(marrow complete remission,mCR)、稳定(stable disease,SD)、失败、复发、进展(progressive disease,PD)。复合完全缓解(CR/mCR)率定义为患者获得CR 或者mCR 的总概率。CR定义为骨髓原始幼稚细胞(bls)≤5%且较治疗前减少≥50%(红系<50%,bls 比例按全部有核细胞计算;红系≥50%,bls 比例按非红细胞计算),各系细胞成熟正常,可允许继续存在发育异常;外周血血红蛋白(Hb)>110 g/L,中性粒细胞计数(NEUT)≥1.0×109/L,血小板计数(PLT)≥100×109/L,无bls,无病态造血,持续时间≥4 周。PR 定义为骨髓bls 较治疗前减少≥50%,但仍>5%;外周血同CR 标准,反应时间≥4周。mCR 定义为bls ≤5%,且较治疗前减少≥50%;外周血细胞减少未恢复。SD 定义为未达到PR,但是无PD 证据,≥8 周。失败定义为治疗中死亡或疾病未控制。复发定义为满足下列条件之一:(1)骨髓中bls 回到治疗前水平;(2)NEUT 或PLT 较缓解/有效时的最高值减少≥50%;(3)Hb 减少15 g/L 或依赖输血(除外非骨髓抑制导致的输血)。PD 定义为满足下列条件之一:(1)骨髓bls<5%者,bls 较基线增加≥50%且达到>5%;骨髓bls>5%且≤10%者,bls 较基线增加≥50%且达到>10%;bls >10%且≤20%者,bls 较基线增加≥50%且达到>20%;bls>20%且≤30%者,bls 较基线增加≥50% 且达到>30%。(2)外周血NEUT 或者PLT 较缓解/有效时的最高值减少≥50%,Hb 减少>20 g/L 或依赖输血。
1.5 随访
采用门诊、住院资料及电话随访,随访1 次/月,复查患者的血常规、骨髓细胞学、流式细胞学检查结果。有以下情形之一患者剔除:患者死亡或拒绝随访、不同日期3 次随访均联系不上患者。随访截止时间为2022-12-30。总生存时间(overall survival,OS)为接受化疗第1 天至末次随访的时间。
1.6 统计学方法
采用SPSS 23.0 统计学软件进行数据分析。不符合正态分布的计量资料用M(P25,P75)表示,两组间比较采用秩和检验;计数资料以相对数表示,组间比较采用χ2检验或Fisher's 确切概率法。绘制Kaplan-Meier曲线分析不同患者的OS 并采用Log-rank 检验进行比较。采用单因素Cox 回归模型分析患者OS 的影响因素。以P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者基线资料、临床特征与分子遗传学特征比较
阳性组患者融合基因突变、髓系核磷蛋白1(NPM1)基因突变比例高于阴性组,差异有统计学意义(P<0.05)。两组患者性别、年龄、MDS-EB、bls、IPSS-R 危险度、染色体核型及髓系附加性梳样1(ASXL1)、胞嘧啶5甲基转移酶3α(DNMT3A)、甲基胞嘧啶双加氧酶2(TET2)、肿瘤蛋白P53(TP53)基因突变比例比较,差异无统计学意义(P>0.05),见表1。
2.2 不同分层患者疗效评估结果
10 例接受HMA 单药治疗的患者中有1 例Bcl-2 阴性,9 例Bcl-2 阳性。治疗14 d 后,其中4 例(40.0%)患者获得CR/mCR。28 例接受VA 联合方案的患者中有12 例Bcl-2 阴性,16 例Bcl-2 阳性。12 例<60 岁(其中4 例Bcl-2 阴性,8 例Bcl-2 阳性),16 例≥60 岁(其中8 例Bcl-2 阴性,8 例Bcl-2 阳性),7 例EB-1(其中3 例Bcl-2 阴性、4 例Bcl-2 阳性),21 例EB-2(其中9 例Bcl-2 阴性、12 例Bcl-2 阳性),21 例IPSS-R分组高危(其中8 例Bcl-2 阴性、13 例Bcl-2 阳性),7 例IPSS-R 分组极高危(其中4 例Bcl-2 阴性、3 例Bcl-2 阳性)。治疗14 d 后,20 例(71.4%)接受VA联合方案的患者获得CR/mCR。两种治疗方案患者获得CR/mCR 比例比较,差异无统计学意义(P=0.087)。
2.3 患者的生存分析
VA 联合治疗方案患者中位随访时间为7.6 个月,中位生存时间(mOS)为6.9 个月,其中Bcl-2 阴性患者mOS 为2.9 个月,Bcl-2 阳性患者mOS 为7.4 个月。Bcl-2 阳性患者与Bcl-2 阴性患者生存率比较,差异无统计学意义(χ2=2.075,P=0.150),见图1。接受HMA 单药方案Bcl-2 阳性患者的mOS 为4.3 个月,与接受VA 联合方案Bcl-2 阳性患者生存率比较,差异无统计学意义(χ2=0.824,P=0.364),见图2。
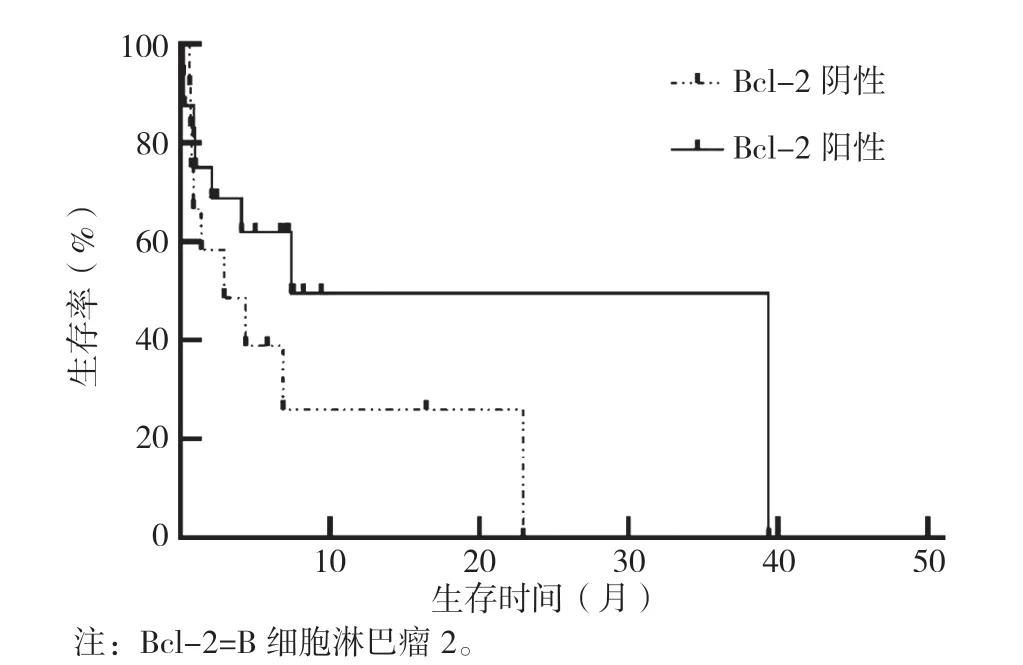
图1 采用VA 联合方案治疗Bcl-2 阳性与Bcl-2 阴性患者生存率比较Figure 1 Comparison of survival rate between Bcl-2 positive and Bcl-2 negative patients treated with VA combination regimen
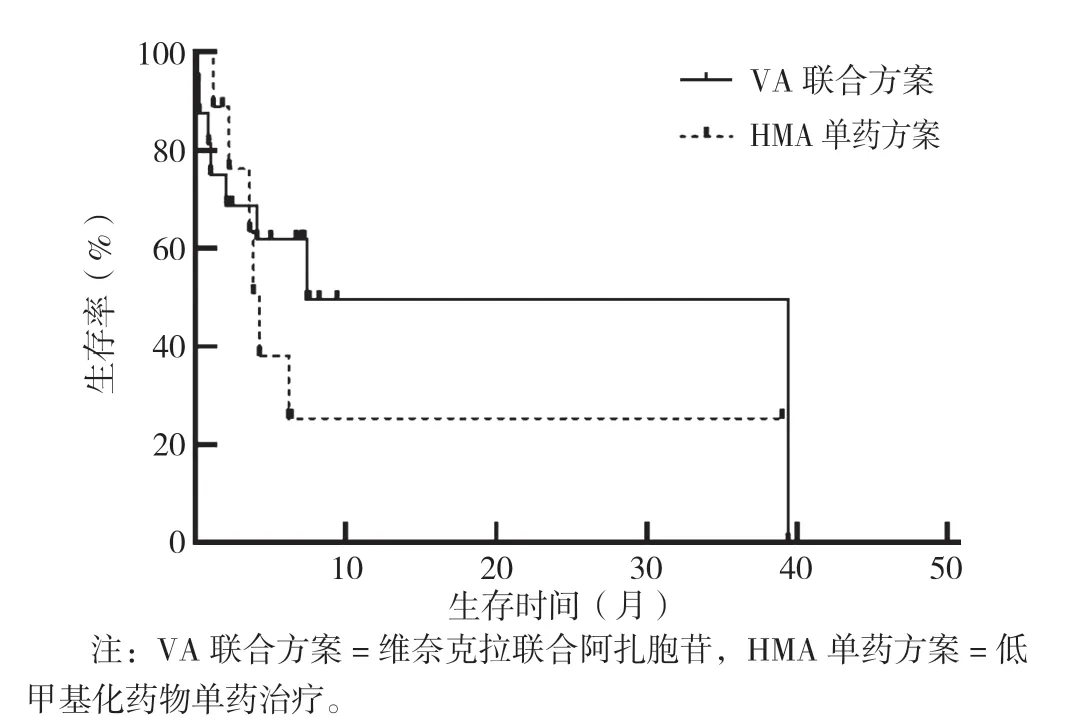
图2 采用VA 联合方案和HMA 单药方案的Bcl-2 阳性患者生存率比较Figure 2 Comparison of survival rate of Bcl-2 positive patients treated with VA and HMA regimens
2.4 接受VA 联合方案治疗患者OS 的影响因素的单因素Cox 回归分析结果
以患者OS 为时间变量,以患者生存状态为结局变量(赋值:存活=0,1=死亡),以性别(赋值:0=男,1=女)、年龄(赋值:<60 岁=0,≥60 岁=1)、Bcl-2 表达(赋值:阴性=0,阳性=1)、突变基因数量(赋值:0=<2,1=≥2)、染色体核型(赋值:好=0,中等+差=1)、MDS-EB 分型(赋值:EB1=0,EB2=2)、IPSS-R 危险度分层(赋值:高危=0,极高危=1)、疗效(赋值:未获得CR/mCR=0,获得CR/mCR=1)为自变量,采用单因素Cox 回归模型分析接受VA 联合方案治疗患者的OS 影响因素,结果显示,年龄、Bcl-2 蛋白表达、突变基因数量、染色体核型、MDSEB 分型、IPSS-R 危险度、疗效不是接受VA 联合方案治疗患者OS 的影响因素(P>0.05),见表2。
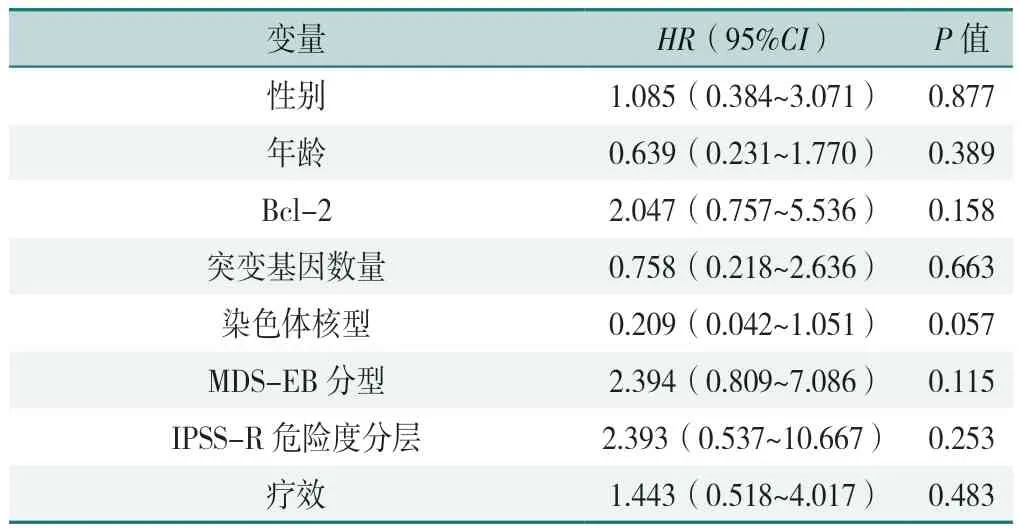
表2 接受VA 联合方案治疗患者OS 影响因素的单因素Cox 回归分析Table 2 Univariate Cox regression analysis of OS influencing factors in patients receiving VA combination therapy
3 讨论
对于中高危符合造血干细胞移植的MDS 患者,HMA 是目前的标准治疗方案;但其治疗反应有限,在大多数情况下,疾病最终会进展[17-18]。临床前研究发现,Bcl-2 蛋白在MDS 患者中高表达,在高危MDS 患者中Bcl-2 表达水平高于低危患者[6],而且疾病进展导致Bcl-2 促凋亡蛋白与Bcl-2 抗凋亡蛋白的比例显著降低[19],提示Bcl-2 蛋白表达导致疾病进展。此外,白血病细胞对多种化疗药物耐药可能与Bcl-2 蛋白表达升高有关,导致化疗的不良反应[7-8]。因此探究Bcl-2蛋白在MDS 患者中的表达与疗效及预后是否存在相关性,具有重要临床意义。本研究通过比较分析Bcl-2 蛋白在MDS 患者中的表达差异,进而评估其是否与VEN在MDS 患者中的疗效以及预后相关。
本研究中,Bcl-2 蛋白表达在性别、年龄、外周血细胞计数以及bls 等临床特征方面无统计学差异。在Bcl-2 阳性组中,IPSS-R 危险度分层高危与极高危患者比例高于阴性组,分别为94.8%和81.8%,提示Bcl-2 蛋白表达可能促使疾病进展[6]。在分子遗传学方面,伴有基因改变的Bcl-2 阳性患者比例高于阴性患者。本研究发现,MDS 患者中最常见的髓系基因突变为TP53、ASXL1、DNMT3A、TET2 和NPM1。且NPM1基因突变主要见于Bcl-2 阳性组患者。而既往研究表明,NPM1 基因突变可以导致MDS 患者快速进展为AML[20]。因此,Bcl-2 蛋白表达能导致MDS 疾病的进展[6]。
VA 联合方案对高危MDS 患者具有较好的治疗反应[21],特别是Bcl-2 阳性患者。本研究中,经VA 联合治疗1 个疗程后,71.4%的患者获得CR/mCR,与BALL 等[22]研究结果一致。而且,Bcl-2 阴性患者的CR/mCR 率低于阳性患者。通过分析Bcl-2 表达与患者的临床特征对缓解率的影响发现,在老年患者、MDSEB 亚型及IPSS-R 高危类型中,Bcl-2 阳性患者的CR/mCR 率优于阴性组。研究结果提示,VA 联合治疗对Bcl-2 阳性患者具有较好的治疗反应。
与HMA 单药方案相比,VA 联合治疗可延长Bcl-2阳性高危MDS 患者的生存期。既往研究表明,经HMA治疗失败的高风险MDS 患者的mOS 为4~6 个月[23-24]。本研究中,Bcl-2 阳性高危MDS 患者,VA 联合方案的mOS 为7.6 个月,HMA 单药方案仅为4.3 个月,但两种治疗方案间不具有统计学差异。因此表明与HMA 单药方案相比,VA 联合治疗不能使MDS 患者获得更长的OS。
综上所述,Bcl-2 蛋白表达促使MDS 的疾病进展。高危MDS 患者中,VA 联合方案具有较好的治疗反应。与HMA 单用方案相比,Bcl-2 阳性患者从VA 联合治疗中获益更多,尤其是Bcl-2 阳性的老年与IPSS-R 极高危患者,具有更高的缓解率。本研究的局限在于系单中心、回顾性研究,病例数相对较少,随访时间短。因此,所得结论尚有待多中心、前瞻性的临床试验进一步确证。
作者贡献:吴佳霏负责论文撰写、收集数据、论文撰写;王珺负责数据分析;王珺、王依景、郑博月、王宇、江川艳负责收集数据、随访患者;董丹丹负责随访患者;李慧提出研究课题,负责论文审查与修订。
本文无利益冲突。
