阈值压力负荷呼吸肌训练联合持续气道正压通气对脑卒中伴阻塞性睡眠呼吸暂停低通气综合征患者睡眠及呼吸功能的影响:一项随机对照试验
2024-03-22刘奕罕朱宁薛孟周
刘奕罕,朱宁,薛孟周
450000 河南省郑州市,郑州大学第二附属医院神经康复科
阻塞性睡眠呼吸暂停低通气综合征(OSAHS)是一种与睡眠相关的呼吸障碍性疾病,其特征为睡眠期间反复发生部分或完全上气道狭窄或阻塞,引起睡眠结构紊乱与自主神经波动,导致睡眠呼吸暂停及低氧血症,伴记忆力下降,注意力不集中和日间嗜睡等[1]。脑卒中会导致皮质脑干受损,可能引起其控制的肌肉张力发生变化,导致呼吸肌痉挛或迟缓,继而诱发OSAHS[2]。OSAHS 与脑卒中两者相互影响,形成恶性循环。OSAHS 不仅影响脑卒中患者的神经、感觉及功能康复,且增加了脑卒中的发病风险与患者死亡率[3]。流行病学资料表明,60%以上的脑卒中患者同时存在OSAHS,伴OSAHS 的脑卒中患者5 年病死率高于20%,严重威胁患者生命安全[4]。目前,持续气道正压通气(CPAP)是脑卒中伴OSAHS 的一线治疗手段,可改善患者睡眠结构参数,缓解睡眠呼吸障碍,降低脑血管事件发生率,但其疗效有赖于患者的长期应用,且依从性和耐受性较低,仍需辅以其他疗法以提高患者整体效益[5-7]。研究显示,口咽部的解剖或功能上的异常可能是脑卒中伴OSAHS 的关键发病机制,这为该疾病的治疗提供了新思路[8]。阈值压力负荷呼吸肌训练(TIMT)是一项抗阻呼吸训练,可提升肺功能,增强呼吸肌力,广泛用于神经系统、呼吸系统、循环系统等疾病的康复。本研究拟分析TIMT 联合CPAP 对脑卒中伴OSAHS 患者睡眠、肺功能及呼吸肌功能的影响。
1 资料与方法
1.1 一般资料
选取2022 年4 月—2023 年8 月郑州大学第二附属医院收治的符合入组标准的69 例脑卒中伴OSAHS 患者作为研究对象。纳入标准:(1)符合全国第四届脑血管病学术会议修订的《各类脑血管病诊断要点》中脑卒中诊断标准[9],并经核磁共振成像或CT 确诊;(2)脑卒中均为首次发病,病程为2 周~12 个月,且病情稳定,生命体征平稳;(3)美国国立卫生研究院卒中量表(NIHSS)评分<15 分;(4)符合《睡眠障碍国际分类》[10]中OSAHS 诊断标准,并经多导睡眠监测(PSG)证实;(5)年龄30~80 岁,性别不限;(6)精神正常,可配合治疗;(7)无严重器质性疾病(如心血管疾病,肝肾功能不全,精神障碍)或者有严重并发症,心脏衰竭、肾脏衰竭、呼吸衰竭、癌症等其他疾病对患者生存质量的影响。排除标准:(1)患有精神疾病、免疫系统疾病、严重肝肾疾病、心肺功能不全或障碍者;(2)有意识障碍、严重瘫痪、视力、听力障碍者;(3)患有鼻或口咽部疾病,如鼻炎、颌骨异常、严重吞咽功能障碍者;(4)青光眼;(5)脑卒中伴其他类型睡眠障碍者。本研究已经过郑州大学第二附属医院伦理委员会批准(批件号:2023060),且所有研究对象或其家属签署知情同意书。
1.2 方法
依据随机数字表法将患者分为试验组(n=35)和对照组(n=34)。入组患者均行脑卒中常规治疗与睡眠宣教。对照组行CPAP 呼吸机治疗(每晚≥6 h),起始压力为4 cmH2O(1 cmH2O=0.098 kPa),根据患者实际情况调整至适当的压力水平,达到以下标准:睡眠期无憋气、打鼾声减少、日间嗜睡有显著改善;平均血氧饱和度(SpO2)稳定,保持在90%或更高的水平,疗程6 周。试验组在对照组基础上采用赛客呼吸训练器进行TIMT。该训练包括限制气流和控制压力2 个环节,首先连接呼吸过滤器与阀头,患者取坐位,指导其进行缓慢的呼气动作,尽可能排出肺中的空气,然后快速有力地深吸气,直至肺部充满空气。测量3 次患者的最大吸气压(MIP),选择其中的最优值,将其40%设定为吸气阻力。接着用鼻夹固定受试者鼻翼,避免气流通过,嘱患者嘴含呼吸过滤器,进行腹式呼吸,用力深吸气,当咬嘴部产生的负压与阈值压力负荷(即预设负压)相同时,可产生吸气气流,嘱患者缓慢呼气、吸气,每次呼气与吸气的时间不少于3 s。随着患者逐渐对阻力的适应,根据最新的测量数据调整阻力,1 次/d,20~30 min/次,训练5 d/周,训练周期为6 周。
1.3 观察指标
1.3.1 睡眠指标检测:采用PSG 与Epworth 嗜睡量表(ESS)评估研究对象的睡眠与日间嗜睡状况。所有入组患者行PSG 检测,在检测当日需禁止饮酒和咖啡,并停止镇静催眠类药物,PSG 检测在专门的睡眠呼吸监测实验室进行,实验室的温度和湿度均保持在适宜水平,记录时间不少于7 h。建议患者在检测当日保持日常的睡眠习惯,必要时可做适当调整。睡眠监测系统会同步记录脑电、肌电、眼动、呼吸运动等指标。PSG 的结果由经验丰富的专业人员依据美国睡眠医学会指定的《睡眠及其相关事件判读手册》[11]进行判读和分析,记录相关监测数据:最低动脉血氧饱和度(LSaO2)、SpO2、氧减指数(ODI)、睡眠呼吸暂停低通气指数(AHI)、深睡眠比例(N3 期睡眠占总睡眠时间比例)、觉醒指数。采用ESS 评估研究对象的日间嗜睡状况,ESS 共8 个条目,总分0~24 分,得分越高表示嗜睡度越重。
1.3.2 肺功能指标检测:采用XEEK X1 肺功能仪检测研究对象的肺功能,检测指标为第1 秒用力呼气容积(FEV1)、用力肺活量(FVC)、一秒率(FEV1/FVC)。
1.3.3 呼吸肌功能检测:采用POWER breathe k-5 检测设备评估研究对象的呼吸肌功能,检测指标为最大呼气压(MEP)和MIP。
1.4 统计学方法
采用SPSS 26.0 软件进行统计分析。符合正态分布的计量资料用(±s)表示,采用独立样本t 检验进行组间比较,采用配对t 检验进行组内干预前后比较;不符合正态分布的计量资料使用M(P25,P75)表示,采用秩和检验进行组间比较;计数资料以相对数表示,采用χ2检验进行组间比较。以P<0.05 为差异有统计学意义。
2 结果
2.1 2 组患者一般资料比较
2 组患者年龄、性别、BMI、颈围、是否吸烟、饮酒、受教育年限、有无基础病(高血压、糖尿病、高脂血症)、AHI、脑卒中类型、病灶部位、病程、NIHSS 评分比较,差异均无统计学意义(P>0.05),见表1。
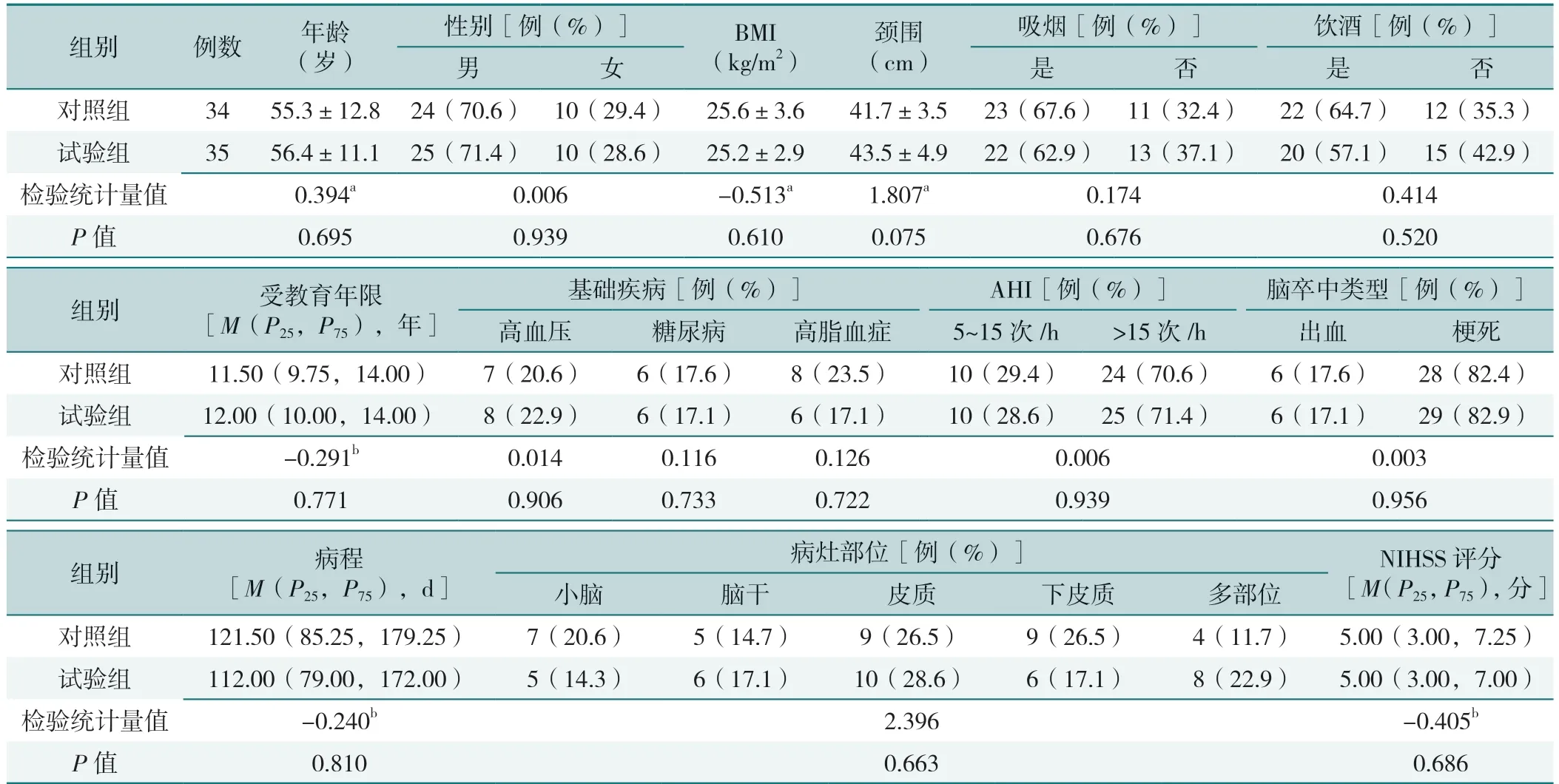
表1 2 组一般资料对比Table 1 Comparison of general data between the two groups
2.2 2 组患者干预前后睡眠状况比较
干预前,2 组患者AHI、SpO2、LSaO2、ODI、深睡眠比例(N3 期睡眠占总睡眠时间比例)、觉醒指数、ESS 评分比较,差异均无统计学意义(P>0.05)。干预6 周后,2 组患者SpO2、LSaO2、深睡眠比例(N3 期睡眠占总睡眠时间比例)高于组内干预前,AHI、ODI、觉醒指数、ESS 评分低于组内干预前,差异均有统计学意义(P<0.05)。试验组干预6 周后SpO2、LSaO2、深睡眠比例(N3 期睡眠占总睡眠时间比例)高于对照组,ODI、觉醒指数、ESS 评分低于对照组,差异均有统计学意义(P<0.05)。干预6 周后,2 组AHI 比较,差异无统计学意义(P>0.05),见表2。
表2 2 组干预前后睡眠呼吸参数比较(±s)Table 2 Comparison of sleep breathing parameters between the two groups before and after the intervention
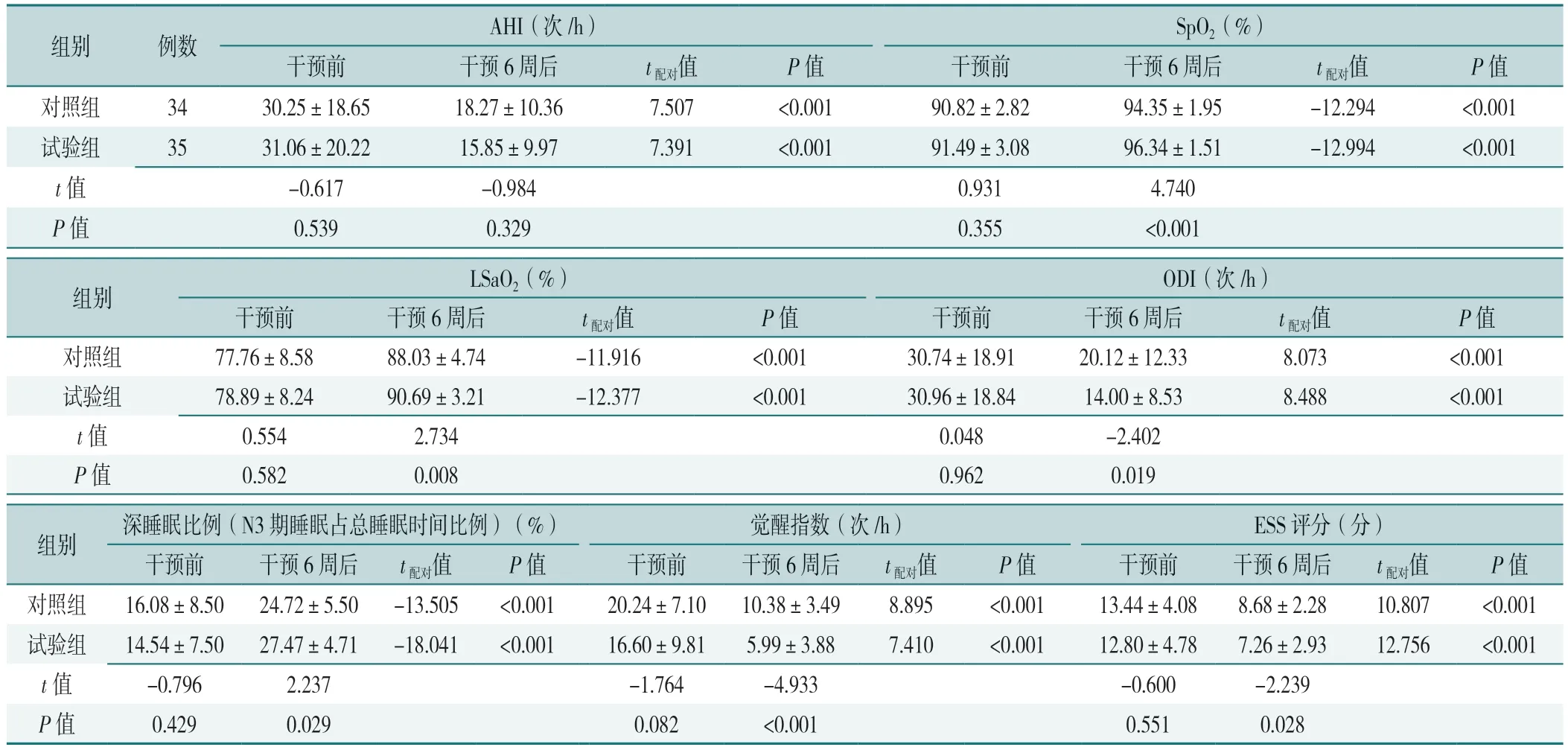
表2 2 组干预前后睡眠呼吸参数比较(±s)Table 2 Comparison of sleep breathing parameters between the two groups before and after the intervention
注:AHI=睡眠呼吸暂停低通气指数,SpO2=平均血氧饱和度,LSaO2=最低动脉血氧饱和度,ODI=氧减指数,ESS=Epworth 嗜睡量表。
组别例数AHI(次/h)SpO2(%)干预前干预6 周后t配对值P 值干预前干预6 周后t配对值P 值对照组3430.25±18.6518.27±10.367.507<0.00190.82±2.8294.35±1.95-12.294<0.001试验组3531.06±20.2215.85±9.977.391<0.00191.49±3.0896.34±1.51-12.994<0.001 t 值-0.617-0.9840.9314.740 P 值0.5390.3290.355<0.001组别LSaO2(%)ODI(次/h)干预前干预6 周后t配对值P 值干预前干预6 周后t配对值P 值对照组77.76±8.5888.03±4.74-11.916<0.00130.74±18.9120.12±12.338.073<0.001试验组78.89±8.2490.69±3.21-12.377<0.00130.96±18.8414.00±8.538.488<0.001 t 值0.5542.7340.048-2.402 P 值0.5820.0080.9620.019组别深睡眠比例(N3 期睡眠占总睡眠时间比例)(%)觉醒指数(次/h)ESS 评分(分)干预前干预6 周后t配对值P 值干预前干预6 周后t配对值P 值干预前干预6 周后t配对值P 值对照组16.08±8.5024.72±5.50-13.505<0.00120.24±7.1010.38±3.498.895<0.00113.44±4.088.68±2.2810.807<0.001试验组14.54±7.5027.47±4.71-18.041<0.00116.60±9.815.99±3.887.410<0.00112.80±4.787.26±2.9312.756<0.001 t 值-0.7962.237-1.764-4.933-0.600-2.239 P 值0.4290.0290.082<0.0010.5510.028
2.3 2 组患者干预前后肺功能比较
干预前,2 组患者FEV1、FVC、FEV1/FVC 比较,差异均无统计学意义(P>0.05)。干预6 周后,2 组患者FEV1、FVC、FEV1/FVC 均较组内干预前升高,差异均有统计学意义(P<0.05)。试验组干预6 周后FEV1、FVC、FEV1/FVC 高于对照组,差异均有统计学意义(P<0.05),见表3。
表3 2 组干预前后肺功能指标比较(±s)Table 3 Comparison of pulmonary function indexes between the two groups before and after intervention
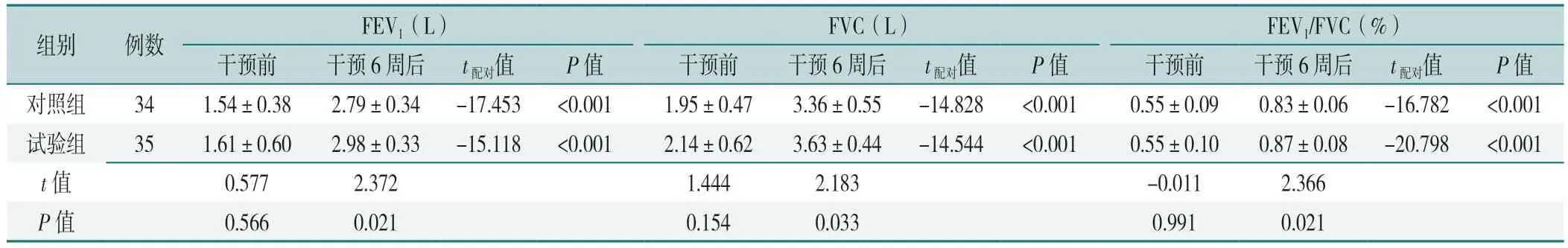
表3 2 组干预前后肺功能指标比较(±s)Table 3 Comparison of pulmonary function indexes between the two groups before and after intervention
注:FEV1=第1 秒用力呼气容积,FVC=用力肺活量,FEV1/FVC=一秒率。
组别例数FEV1(L)FVC(L)FEV1/FVC(%)干预前干预6 周后t配对值P 值干预前干预6 周后t配对值P 值干预前干预6 周后t配对值P 值对照组341.54±0.382.79±0.34-17.453<0.0011.95±0.473.36±0.55-14.828<0.0010.55±0.090.83±0.06-16.782<0.001试验组351.61±0.602.98±0.33-15.118<0.0012.14±0.623.63±0.44-14.544<0.0010.55±0.100.87±0.08-20.798<0.001 t 值0.5772.3721.4442.183-0.0112.366 P 值0.5660.0210.1540.0330.9910.021
2.4 2 组患者干预前后呼吸肌功能比较
干预前,2 组患者MEP、MIP 比较,差异均无统计学意义(P>0.05)。干预6 周后,2 组患者MEP、MIP均较组内干预前升高,差异均有统计学意义(P<0.05)。试验组干预6 周后MEP、MIP 高于对照组,差异均有统计学意义(P<0.05),见表4。
表4 2 组干预前后呼吸肌功能指标对比(±s,cmH2O)Table 4 Comparison of respiratory muscle function indexes between the two groups before and after intervention

表4 2 组干预前后呼吸肌功能指标对比(±s,cmH2O)Table 4 Comparison of respiratory muscle function indexes between the two groups before and after intervention
注:MEP=最大呼气压,MIP=最大吸气压;1 cmH2O=0.098 kPa。
组别例数MEPMIP干预前干预6 周后t配对值P 值干预前干预6 周后t配对值P 值对照组3450.29±15.52115.26±14.22-17.200<0.00141.79±9.1788.71±7.96-24.956<0.001试验组3552.86±21.54126.86±14.22-22.261<0.00140.83±9.5095.34±10.91-21.452<0.001 t 值0.5662.816-0.4292.880 P 值0.5740.0060.6690.005
3 讨论
脑卒中伴OSAHS 患者由于在睡眠期间咽部的狭窄和塌陷,进而出现睡眠呼吸暂停、SpO2下降、高碳酸血症等现象。这些变化刺激了神经中枢和外周化学感受器,从而增加交感神经系统的驱动力,使患者突然觉醒,引起睡眠碎片化及睡眠结构紊乱,极大地降低了患者的睡眠质量[12-13]。气道狭窄和塌陷可能与个体解剖结构改变、咽部扩张肌(尤其是颏舌肌)功能障碍、化学感受器的变化对呼吸阈值的影响以及呼吸中枢缺乏控制有关[14],因此减少气道阻力,增强口咽部肌张力及提升呼吸肌功能对遏制脑卒中伴OSAHS 患者的病情进展尤为重要。目前,CPAP 在脑卒中伴OSAHS 的疗效已得到广泛认可,但作为长期管理策略不仅疗效有限,且会引发多种不良反应,极大地降低患者的依从性和耐受性[15],需要结合其他疗法辅以治疗。呼吸肌训练旨在通过一系列运动训练或治疗方法对吸气肌或呼气肌进行规范、持续的训练,可增加呼吸肌群的力量与强度[16],改善呼吸功能。既往研究显示,阻力训练能促进神经递质分泌、增加肌肉组织的储能能力,可显著提升呼吸功能,改善呼吸肌肌力与耐力[17-18]。此训练是通过阈值压力负荷训练仪对吸气活动提供不依赖于流速、可以调节的定量阻力来实现抗阻的一种呼吸训练[19],持续的阻力可以增加膈肌收缩,提高吸气容量[20],从而有效地锻炼呼吸肌。
脑卒中患者呼吸肌功能下降,不仅易继发OSAHS,且增加了死亡风险。时惠等[21]研究显示,TIMT 可显著提升脑卒中患者MIP、MEP 与肺功能,降低肺部感染率。MENEZES 等[22]分析显示,5 周的TIMT 可以提升脑卒中后患者的呼吸肌力与耐力。OSAHS 患者气道阻塞和呼吸暂停将导致吸气努力增加和吸气肌慢性过载,反复努力对抗气道阻塞和间歇性低氧会使患者吸气肌长时间承受着巨大负荷,几乎没有休息的机会,因此,吸气肌是最易疲劳的肌肉[23]。董校玉等[24]研究提示,TIMT 可缩短肌节长度,增加Ⅰ型和Ⅱ型肌纤维数量,重塑呼吸肌群,并减轻呼吸疲劳感。对于大多数OSAHS 患者在呼吸暂停时,横膈肌是主要的吸气肌,膈肌无力与功能障碍会降低吸气压,引起低氧血症及肺部感染等。LIN 等[25]研究提示,在进行TIMT 期间,阈值压力负荷是横膈膜的关键激活剂,抗阻呼吸训练可增加隔膜活动使更多的空气进入肺,改善患者的肺通气功能。
NÓBREGA-JÚNIOR 等[26]与 RAMIREZSARMIENTO 等[27]通过试验证实阻力训练能有效增加膈肌厚度,改善OSAHS 患者的MEP、MIP 及肺功能。本研究结果发现,2 组患者干预6 周后的MEP、MIP、FEV1、FVC、FEV1/FVC 均较干预前升高,且试验组较对照组提升显著,说明CPAP 治疗及联合疗法均能提高脑卒中伴OSAHS 患者肺功能与呼吸肌功能,但联合疗法对提高患者呼吸肌肌力及运动耐力、增加上气道肌肉活动、改变呼吸模式、提高呼吸效率、改善肺功能更有效。此外,本研究对患者干预前后的睡眠呼吸参数进行了分析,发现干预后两组患者AHI 较干预前均降低,试验组较对照组AHI 在临床观察上略有下降,但无统计学差异(P>0.05)。提示CPAP 治疗和联合治疗均能降低脑卒中伴OSAHS 患者的睡眠呼吸暂停及低通气事件,但两种治疗方式对AHI 的改善效果无显著差异。近年来对TIMT 是否能改善AHI 存在争议,一项系统性回顾研究发现,阻力训练改善了OSAHS 患者的MIP 和睡眠质量,并减少了日间嗜睡,但AHI 的变化并不显著[13]。LIN 等[25]对中、重度的OSAHS 患者行为期12周的TIMT 后,发现患者的AHI 和日间嗜睡显著降低。DE OLIVEIRA VAZ 等[28]对患有脑卒中伴OSAHS 患者进行5 周高强度(训练负荷>60% MIP)的抗阻呼吸训练,发现AHI 较前降低显著。本研究对试验组仅进行了6周非高强度的TIMT 训练,可能是干预周期较短、训练负荷较低、研究样本不够多等是造成两组患者干预后AHI 差异不明显的原因。本研究结果还发现,两组患者经干预后SpO2、LSaO2、深睡眠比例(N3 期睡眠占总睡眠时间比例)较干预前均升高,ODI、觉醒指数、ESS评分较干预前均降低,且试验组较对照组改善均较显著,提示CPAP 和联合疗法均能改善患者睡眠呼吸参数日间嗜睡,联合疗法能显著促进脑卒中伴OSAHS 患者血液中氧分子的溶解,提高SpO2,降低患者慢性间歇性低氧与高碳酸血症。同时,此结果也说明了联合治疗能更加有效地纠正患者缺氧及呼吸努力相关的微觉醒,减少睡眠碎片化,增加深睡眠比例,减少日间嗜睡,改善患者睡眠状况。
4 小结
本研究通过对脑卒中伴OSAHS 患者进行CPAP 联合TIMT 治疗,结果显示,这种联合疗法能有效优化患者睡眠呼吸参数,提高肺功能并增强呼吸肌力与耐力。TIMT 是一种简单、高效的呼吸肌训练方法,其不仅可根据患者的具体状况进行精确的阈值压力调整,提高肺功能与改善睡眠,且为脑卒中伴OSAHS 患者的康复提供更有益的康复方案,值得在临床上进一步推广。但本研究仍存在一些不足,由于时间限制,本研究样本量较少,且干预时间较短,对于长期疗效,还需要进行大样本量和长期的前瞻性临床试验进一步验证。
作者贡献:刘奕罕提出研究思路,设计研究方案,撰写论文;朱宁负责研究过程的实施、调查对象的选取、样本的采集、最终版本修订,对论文负责;薛孟周负责数据收集、采集、统计学分析、绘制图表。
本文无利益冲突。
