LncRNA HOTAIR调节细胞自噬对脊髓损伤模型神经元凋亡的保护作用
2024-03-22赵俊陈勇吴春芳
赵俊 陈勇 吴春芳
摘要 目的:探讨长链非编码核糖核酸(LncRNA)HOX转录反义RNA(HOTAIR)在脊髓损伤凋亡和自噬中的作用及相关机制。方法:将雄性SD大鼠随机分為假手术组(Sham组)和模型组(SCI组)。构建缺氧缺糖诱导的SY-SH5Y细胞模型(OGD模型),将SY-SH5Y细胞分为Control组、OGD组、OGD+Vector组、OGD+pcDNA-HOTAIR组、OGD+pcDNA-HOTAIR+NC mimic组、OGD+pcDNA-HOTAIR+miR-17 mimic组。通过脊髓损伤运动功能(BBB)评分评估大鼠运动功能的恢复能力;通过双荧光素酶报告基因实验分别检测HOTAIR和miR-17、miR-17和Beclin-1之间的靶向关系;实时定量聚合酶链反应(RT-qPCR)检测大鼠脊髓组织和细胞中HOTAIR、miR-17、Beclin-1 mRNA的表达;蛋白免疫印迹法(Western Blot)检测大鼠脊髓组织和细胞中Beclin-1、微管相关蛋白轻链3Ⅱ(LC3Ⅱ)、P62蛋白的表达;流式细胞术检测各组细胞凋亡情况。结果:与Sham组比较,SCI组大鼠BBB评分下降,脊髓组织中HOTAIR水平降低,miR-17水平升高,差异均有统计学意义(P<0.05)。与Control组比较,OGD组处理的SY-SH5Y细胞中HOTAIR水平降低,miR-17水平升高,神经元凋亡率升高,LC3Ⅱ蛋白表达降低,P62蛋白表达升高,差异均有统计学意义(P<0.05);与OGD+Vector组比较,OGD+pcDNA-HOTAIR组细胞中HOTAIR水平升高(P<0.05),神经元凋亡率降低(P<0.05),LC3Ⅱ蛋白表达升高(P<0.05),P62蛋白表达降低(P<0.05),而自噬抑制剂3-甲基腺嘌呤(3-MA)逆转了这一结果(P<0.05)。双荧光素酶报告基因实验结果显示,Beclin-1是miR-17的靶基因,miR-17是HOTAIR的靶基因。与OGD+pcDNA-HOTAIR+NC mimic组比较,OGD+pcDNA-HOTAIR+miR-17 mimic组细胞中miR-17表达明显升高,神经元凋亡率明显升高,Beclin-1和LC3Ⅱ蛋白表达降低,P62蛋白表达升高,差异均有统计学意义(P<0.05)。结论:LncRNA HOTAIR通过靶向miR-17/Beclin-1通路增强自噬,从而减轻神经元凋亡和改善脊髓损伤。
关键词 脊髓损伤;长链非编码核糖核酸;HOX转录反义RNA;细胞自噬;神经元凋亡
doi:10.12102/j.issn.1672-1349.2024.01.014
脊髓损伤(SCI)是血管外科、胸外科、脊柱外科手术中常见的并发症,可引起损伤脊髓节段肢体运动和感觉功能障碍,严重威胁人类健康和生命[1]。神经元凋亡是脊髓损伤中的主要病理特征之一,导致一定程度的神经损伤、坏死或自主神经功能障碍[2-3]。然而,细胞凋亡并不是决定细胞命运的唯一途径,自噬与凋亡相互作用[4]。自噬又称Ⅱ型程序性细胞死亡,可清除细胞生长和衰老过程中多余或损伤的细胞器,在维持细胞稳态中发挥重要作用[5]。研究表明,在脊髓损伤模型大鼠中,自噬已被证实通过抑制脊髓损伤后的神经元凋亡来减少神经元损伤和促进运动恢复[6]。长链非编码核糖核酸(LncRNA)是一类核苷酸长度超过200的非编码RNA,它们在多种生物和病理过程中广泛调节基因表达。HOX转录反义RNA(HOTAIR)位于12号染色体,与多种人类疾病有关,包括癌症和心肌损伤[7-8]。HOTAIR影响神经元凋亡,HOTAIR通过调节miR-874-5p促进帕金森病介导的神经元损伤[9]。然而,关于HOTAIR在脊髓损伤中对神经元凋亡的作用机制尚未明确。因此,本研究探讨LncRNA HOTAIR在脊髓损伤神经细胞凋亡和自噬中的作用,旨在为脊髓损伤治疗提供新的见解。
1 材料与方法
1.1 主要试剂与仪器
miRcute miRNA荧光定量检测试剂盒、miRcute miRNA cDNA第一链合成试剂盒购自天根生化科技(北京)有限公司;pcDNA-HOTAIR、Vector、miR-17 mimic及NC mimic质粒购自汉恒生物科技(上海)有限公司;二喹啉甲酸(BCA)蛋白质测定试剂盒购自上海碧云天生物技术有限公司;双荧光素酶报告基因检测试剂盒购自普洛麦格(北京)生物技术有限公司;Lipofectamine 2000转染试剂购自Invitrogen公司;V-异硫氰酸荧光素(Annexin V-FITC)/碘化丙啶(propidium iodide,PI)双染细胞凋亡检测试剂盒购自Sigma-Aldrich中国公司。流式细胞仪购自BD公司;低氧培养箱购自Thermo Scientific公司;ABI 7500 实时PCR系统购自Thermo Fisher Scientific公司。
1.2 实验动物
雄性SD大鼠,体质量200~230 g,由河南省实验动物中心提供,饲养在标准温度(23~25 ℃)、湿度(50%~60%)的环境条件下,12 h光/暗循环,所有动物均可自由获得食物和水。本研究的动物实验均按照中国卫生研究院《实验动物护理使用指南》进行,并经我院伦理委员会批准。
1.3 实验方法
1.3.1 构建脊髓损伤模型
将大鼠随机分为假手术组(Sham组)、模型组(SCI组)。模型组构建脊髓损伤模型:将大鼠麻醉后俯卧位于手术台上,消毒备皮。逐层解剖暴露大鼠脊柱,在T9和T10棘突处行椎板切除术以彻底暴露脊髓。然后用10 g的重物从5 cm高的地方落下击打脊髓表面,造成脊髓损伤。当观察到双下肢瘫痪、尾巴摆动和脊髓血肿形成,表明脊髓损伤模型的成功建立。随后,用生理盐水清洗伤口,将肌肉和皮肤分层缝合。Sham组大鼠仅进行椎板切除术。脊髓损伤术后,每天按摩大鼠膀胱2次,直至自主排尿功能恢复。为了验证HOTAIR在脊髓损伤体内进展中的作用,通过建立脊髓损伤大鼠模型,将5 μL pcDNA-HOTAIR及其阴性对照Vector腺病毒载体用玻璃微移液管注射到大鼠脊髓(每组6只)。48 h后处死大鼠,取脊髓组织进行后续实验。
1.3.2 脊髓损伤运动功能(BBB)评分
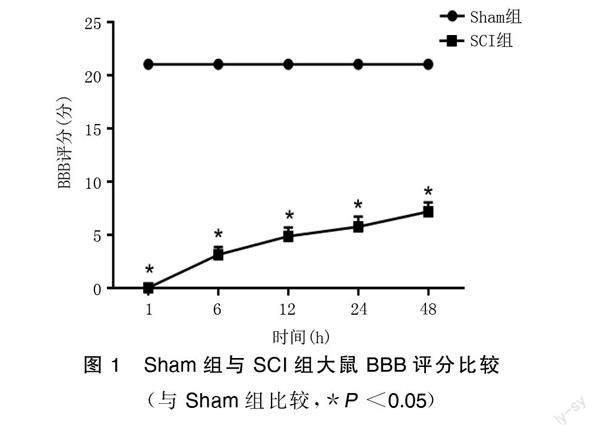
采用BBB评分评估大鼠运动功能的恢复能力[10]。分别在大鼠脊髓损伤后1、6、12、24、48 h对大鼠的运动进行双盲观察。BBB评分是由2名独立的调查人员进行盲测。将大鼠置于实验平台上,对大鼠的后肢运动进行评分和观察,每次测试持续4 min。每只大鼠的最終评分取2名研究者的平均分。
1.3.3 实时定量聚合酶链式反应(RT-qPCR)
在脊髓损伤后48 h处死大鼠,取损伤部位上下1 cm的脊髓组织,用Trizol试剂提取总RNA。为了量化HOTAIR和miR-17的表达,使用miRcute miRNA cDNA第一链合成试剂盒根据其说明书将1 μg RNA逆转录为cDNA。LncRNA和miRNA表达水平的相对定量在ABI 7500 实时聚合酶链式反应系统上进行,并使用miRcute miRNA荧光定量检测试剂盒通过2-ΔΔCt方法计算。LncRNA和miRNA的相对表达分别归一化为甘油醛-3-磷酸脱氢酶(GAPDH)和U6表达。
1.3.4 蛋白免疫印迹法(Western Blot)
使用RIPA裂解缓冲液从脊髓组织中获取总蛋白,并使用BCA蛋白质测定试剂盒测定其蛋白质浓度。将样品用12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,并转移至聚偏二氟乙烯(PVDF)膜上。随后,PVDF膜用含5%脱脂牛奶的TBST在室温下封闭1 h,然后用抗Beclin-1、微管相关蛋白轻链3Ⅱ(LC3Ⅱ)、P62的一抗在4 ℃孵育过夜。用磷酸缓冲盐溶液(PBS)洗3次后与辣根过氧化物酶(HRP)偶联的二抗在室温下孵育1 h。条带通过增强化学发光(ECL)曝光并使用Image J 软件进行分析。
1.3.5 细胞培养
将人海马神经元来源的细胞系SY-SH5Y在添加有Eagle′s最低必需培养基(EMEM)、1%非必需氨基酸、2 mmol/L谷氨酰胺、15%胎牛血清的Ham′s F12培养基于37 ℃、5% CO2的培养箱中培养。进行缺氧葡萄糖剥夺(OGD)试验以通过减少O2和葡萄糖的补充来模拟神经元损伤诱导的缺血病理条件。神经元在OGD溶液中于94%N2、5%CO2、1%O2的受控低氧培养箱中于37 ℃孵育1 h。然后神经元在含有5.5 mmol/L葡萄糖的OGD溶液中于37 ℃和5% CO2下培养24 h进行复氧。
1.3.6 细胞转染
为了研究HOTAIR和miR-17在神经元凋亡中的作用及其相互作用,将SY-SH5Y细胞分为6组:Control组、OGD组、OGD+Vector组、OGD+pcDNA-HOTAIR组、OGD+pcDNA-HOTAIR+NC mimic组、OGD+pcDNA-HOTAIR+miR-17 mimic组。根据说明书使用Lipofectamine 2000将pcDNA-HOTAIR、Vector、miR-17 mimic及NC mimic质粒转染到SY-SH5Y细胞中。用OGD处理细胞6 h,然后置于含有1 mmol/L自噬抑制剂3-甲基腺嘌呤(3-MA)的正常培养基中并再给氧24 h,收集细胞并进行后续实验。
1.3.7 流式细胞术
用膜联蛋白V-FITC/Annexin V-FITC/PI细胞凋亡检测试剂盒测定SY-SH5Y细胞凋亡,然后进行流式细胞分析。将SY-SH5Y细胞(2×105/孔)接种至6孔板中,待其生长融合至70%~80%。收集细胞并用200 μL的Annexin V-FITC和10 μL的PI染色,最后用流式细胞仪检测细胞凋亡。
1.3.8 双荧光素酶报告基因实验
将HOTAIR-WT、HOTAIR-MUT序列或Beclin-1-野生型(WT)、Beclin-1-突变型(MUT)序列插入荧光素酶报告载体pmirGLO。随后,使用Lipofectamine 2000将pmirGLO-HOTAIR-WT、pmirGLO-HOTAIR-MUT以及pmirGLO-Beclin-1-WT、pmirGLO-Beclin-1-MUT分别与NC mimic、miR-17 mimic共转染到SY-SH5Y细胞中。最后,通过双荧光素酶报告基因检测系统分析细胞的荧光素酶活性。
1.4 统计学处理
采用SPSS 21.0软件进行统计分析。符合正态分布的定量资料以均数±标准差(x±s) 表示,组间比较用t检验,多组间比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结 果
2.1 脊髓损伤大鼠脊髓组织和OGD诱导的细胞中HOTAIR、miR-17表达比较
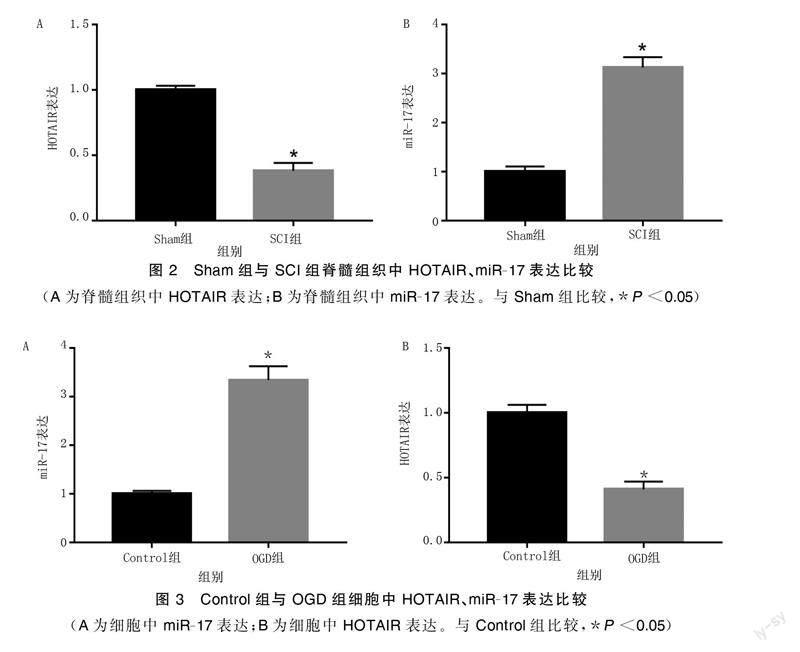
与Sham组比较,SCI组术后1、6、12、24、48 h的BBB评分均明显下降(P<0.05)。术后48 h取脊髓组织进行RT-qPCR实验,结果显示,与Sham组比较,SCI组大鼠脊髓组织中HOTAIR水平明显降低(P<0.05),miR-17水平明显升高(P<0.05);与Control组比较,OGD组处理的SY-SH5Y细胞中HOTAIR水平明显降低,miR-17水平明显升高(P<0.05)。详见图1~图3。
2.2 HOTAIR对自噬和神经元凋亡的影响
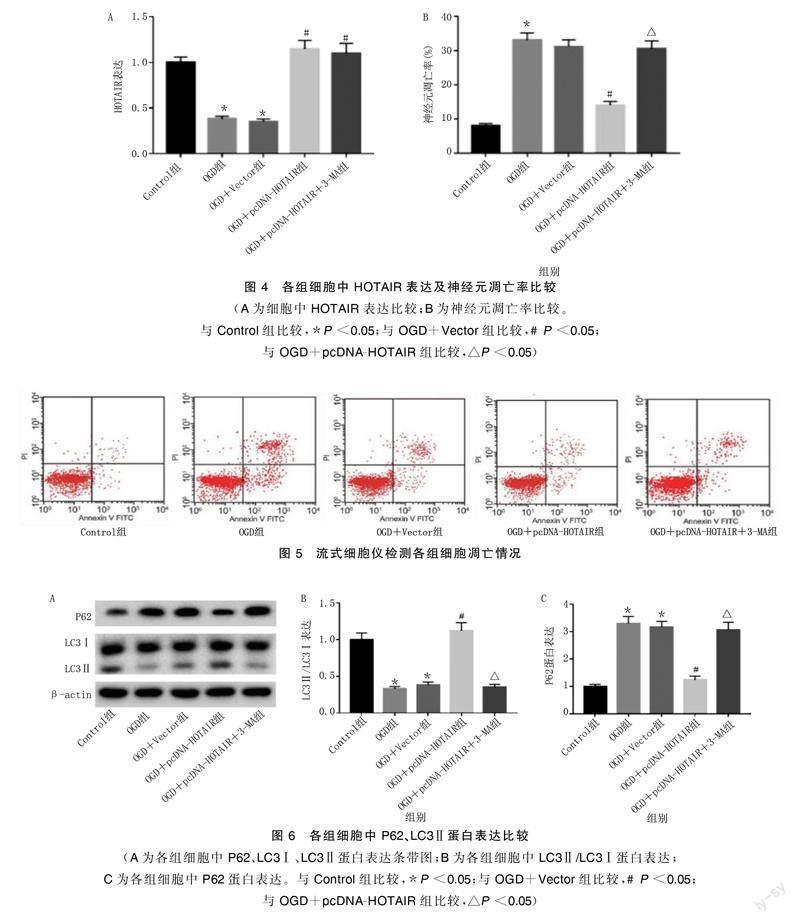
与Control组比较,OGD组细胞中HOTAIR水平明显降低,神经元凋亡率明显升高,LC3Ⅱ蛋白表达降低,P62蛋白表达升高,差异均有统计学意义(P<0.05);与OGD+Vector组比较,OGD+pcDNA-HOTAIR组细胞中HOTAIR水平明显升高,神经元凋亡率明显降低,LC3Ⅱ蛋白表达升高,P62蛋白表达降低,差异均有统计学意义(P<0.05);与OGD+pcDNA-HOTAIR组比较,OGD+pcDNA-HOTAIR+3-MA组细胞中HOTAIR表达无明显变化(P>0.05),神经元凋亡率明显升高(P<0.05),LC3Ⅱ蛋白表达降低,P62蛋白表达升高(P<0.05)。详见图4~图6。
2.3 HOTAIR靶向miR-17
双荧光素酶报告基因实验结果显示,与NC mimic组比较,miR-17 mimic与HOTAIR-3′-UTR-WT共转染时的荧光素酶活性明显降低(P<0.05),而miR-17 mimic与HOTAIR-3′-UTR-MUT共转染时的荧光素酶活性无明显性变化(P>0.05);RT-qPCR實验结果显示,与Vector组比较,pcDNA-HOTAIR组细胞中miR-17表达明显降低(P<0.05)。详见图7。
2.4 miR-17靶向Beclin-1
双荧光素酶报告基因实验结果显示,与NC mimic组比较,miR-17 mimic与Beclin-1-3′-UTR-WT共转染时的荧光素酶活性明显降低(P<0.05),而miR-17 mimic与Beclin-1-3′-UTR-MUT共转染时的荧光素酶活性无明显性变化(P>0.05);RT-qPCR和Western Blotting实验结果显示,与NC mimic组比较,miR-17 mimic组细胞中Beclin-1的mRNA和蛋白表达明显降低(P<0.05)。详见图8~图10。
2.5 HOTAIR通过miR-17/Beclin-1通路对自噬和凋亡的影响
与OGD+Vector组比较,OGD+pcDNA-HOTAIR组细胞中miR-17蛋白表达明显降低,神经元凋亡率明显降低,Beclin-1和LC3Ⅱ蛋白表达升高,P62蛋白表达降低,差异均有统计学意义(P<0.05);与OGD+pcDNA-HOTAIR+NC mimic组比较,OGD+pcDNA-HOTAIR+miR-17 mimic组细胞中miR-17蛋白表达明显升高,神经元凋亡率明显升高,Beclin-1和LC3Ⅱ蛋白表达降低,P62蛋白表达升高,差异均有统计学意义(P<0.05)。详见图11~图13。
2.6 HOTAIR过表达对脊髓损伤大鼠神经功能的影响
与Vector组比较,pcDNA-HOTAIR组大鼠在脊髓损伤后12~48 h的BBB评分明显升高,HOTAIR表达升高,miR-17表达降低,LC3Ⅱ蛋白表达明显升高,而P62蛋白表达明显降低,差异均有统计学意义(P<0.05)。详见图14~图15。
3 讨 论
脊髓损伤是一种严重的神经创伤,但其发病机制和关键影响因素尚未明确阐明。神经元凋亡是神经元丢失的主要因素,与脊髓损伤的发展有关[11]。研究表明,自噬与脊髓损伤诱导的神经细胞凋亡密切相关[12]。然而,其机制仍有待阐明。本研究通过构建脊髓损伤体内体外模型来阐明LncRNA HOTAIR在脊髓损伤中的作用及其与自噬和凋亡的关系,这一研究可能为脊髓损伤的治疗和预后评估提供新的有效靶点。
LncRNAs对细胞自噬或凋亡的调节作用已在人类疾病中得到证实。如LncRNA MALAT1通过诱导自噬抑制多发性骨髓瘤细胞凋亡[13]。LncRNAs还可以调节脊髓损伤的启动和进展,主要是通过影响细胞自噬或凋亡,如LncRNA SNHG5通过上调Krueppel样因子4(KLF4)来增强星形胶质细胞和小胶质细胞的活力促进创伤性脊髓损伤[14]。在急性脊髓损伤中,敲除LncRNA BDNF-AS抑制神经元细胞凋亡[15]。抑制LncRNA Sox2ot可减少细胞凋亡和自噬从而抑制脊髓损伤[16]。因此,调节LncRNA的表达有可能通过抑制自噬来减轻脊髓损伤。本研究发现,LncRNA HOTAIR在OGD处理的SY-SH5Y细胞中降低,且LncRNA HOTAIR抑制细胞凋亡,而当用自噬抑制剂3-MA刺激时,细胞凋亡率升高,表明LncRNA HOTAIR通过诱导自噬抑制神经元凋亡,揭示了LncRNA HOTAIR在脊髓损伤中的神经保护作用,有利于脊髓损伤大鼠的神经功能恢复。因此,选择LncRNA HOTAIR进行下一步的研究。
证据表明,大多数LncRNAs通过作为miRNAs的竞争性内源性RNA(ceRNA)调节疾病的起始和进展[17]。LncRNA XIST通过竞争性结合miR-494促进脊髓损伤大鼠神经元凋亡,参与脊髓损伤的发病机制[18]。MALAT1通过调节miR-204在脊髓缺血再灌注损伤中发挥神经保护作用[19]。此外,研究发现LncRNAs作为ceRNAs在各种疾病的发展中调节自噬。本研究发现,LncRNA HOTAIR在脊髓损伤大鼠模型和细胞模型中低表达,而miR-17高表达,并且LncRNA HOTAIR靶向miR-17并负调节miR-17的表达。此外,本研究进一步发现,LncRNA HOTAIR通过靶向miR-17增强自噬从而改善神经元细胞凋亡和缓解脊髓损伤。miR-17是一种新型miRNA,与多种癌症密切相关。研究发现miR-17-5p通过靶向Runt相关转录因子3(RUNX3)促进胃癌细胞增殖和侵袭性[20]。miR-17通过靶向轴突生长诱向因子4(NTN4)诱导乳腺癌生长和转移[21]。研究表明在脊髓损伤后的神经元损伤中,敲除miR-17可能有助于脊髓损伤治疗[22]。然而,miR-17与脊髓损伤之间的关系尚未阐明。Beclin-1是一种关键的自噬相关蛋白和凋亡调节因子[23],据报道,在脊髓神经元中,Beclin-1过表达明显增强自噬并逆转机械损伤诱导的细胞凋亡,提示Beclin-1在脊髓损伤中促进自噬和保护神经元免于凋亡的作用[24]。此外,白藜芦醇通过激活自噬和抑制沉默信息调节因子1(SIRT1)/腺苷酸活化蛋白激酶(AMPK)信号通路介导的细胞凋亡来保护脊髓损伤[3]。以上研究表明,Beclin1在调节自噬、神经元凋亡和脊髓损伤发展中具有重要作用。本研究证实了miR-17通过调控Beclin-1在自噬、凋亡和脊髓损伤进展中的作用。
综上所述,本研究发现LncRNA HOTAIR在脊髓损伤大鼠模型和OGD细胞模型中低表达,而miR-17高表达,过表达LncRNA HOTAIR通过miR-17/Beclin-1途径增强自噬减少神经元细胞凋亡和改善脊髓损伤。因此,本研究可能为脊髓损伤的治疗提供新的策略。然而,本研究仍存在一定的局限性。首先,需要探索更多LncRNA HOTAIR的潜在靶点,寻找对神经元自噬、凋亡、脊髓损伤影响最大的最佳miRNA。此外,许多miR-17的其他靶向基因和miR-17的其他内源性竞争RNA也值得在未来进一步研究。
参考文献:
[1]吴军,关涛,田峰,等.瑞香素对脊髓损伤大鼠运动功能改善作用的TRL4/NF-κB信号通路机制研究[J].中国比较医学杂志,2021,31(4):84-90.
[2]李昊天,陈凌强,王兵,等.miR-124-3p靶向作用于calpain 1抑制氧化应激对脊髓损伤后神经元凋亡的影响[J].中国脊柱脊髓杂志,2019,29(12):1109-1118.
[3]ZHAO H S,CHEN S R,GAO K,et al.Resveratrol protects against spinal cord injury by activating autophagy and inhibiting apoptosis mediated by the SIRT1/AMPK signaling pathway[J].Neuroscience,2017,348:241-251.
[4]CUI C,LIN T,GONG Z L,et al.Relationship between autophagy,apoptosis and endoplasmic reticulum stress induced by melatonin in osteoblasts by septin7 expression[J].Molecular Medicine Reports,2020,21(6):2427-2434.
[5]LUO C L,TAO L Y.The function and mechanisms of autophagy in spinal cord injury[M]//Autophagy:Biology and Diseases.Singapore:Springer Singapore,2020:649-654.
[6]ABBASZADEH F,FAKHRI S,KHAN H.Targeting apoptosis and autophagy following spinal cord injury:therapeutic approaches to polyphenols and candidate phytochemicals[J].Pharmacological Research,2020,160:105069.
[7]RAJAGOPAL T,TALLURI S,AKSHAYA R L,et al.HOTAIR LncRNA:a novel oncogenic propellant in human cancer[J].Clinica Chimica Acta,2020,503:1-18.
[8]SUN Y,HU Z Q.LncRNA HOTAIR aggravates myocardial ischemia-reperfusion injury by sponging microRNA-126 to upregulate SRSF1[J].Eur Rev Med Pharmacol Sci,2020,24(17):9046-9054.
[9]ZHAO J Y,LI H L,CHANG N.LncRNA HOTAIR promotes MPP+-induced neuronal injury in Parkinson′s disease by regulating the miR-874-5p/ATG10 axis[J].EXCLI Journal,2020,19:1141-1153.
[10]YU X,ZHANG S,ZHAO D,et al.SIRT1 inhibits apoptosis in invivo and invitro models of spinal cord injury via microRNA-494[J].Int J Mol Med,2019,43(4):1758-1768.
[11]余波,張红梅,洪军,等.Akt/XIAP信号通路在脊髓损伤后抑制神经细胞凋亡[J].基因组学与应用生物学,2020,39(7):3264-3269.
[12]周快,蔡卫华.脊髓继发性损伤中自噬和凋亡相互调节的研究现状[J].中国矫形外科杂志,2018,26(4):336-339.
[13]GAO D,LV A E,LI H P,et al.LncRNA MALAT-1 elevates HMGB1 to promote autophagy resulting in inhibition of tumor cell apoptosis in multiple myeloma[J].Journal of Cellular Biochemistry,2017,118(10):3341-3348.
[14]JIANG Z S,ZHANG J R.LncRNA SNHG5 enhances astrocytes and microglia viability via upregulating KLF4 in spinal cord injury[J].International Journal of Biological Macromolecules,2018,120:66-72.
[15]ZHANG H,LI D,ZHANG Y,et al.Knockdown of lncRNA BDNF-AS suppresses neuronal cell apoptosis via down regulating miR-130b-5p target gene PRDM5 in acute spinal cord injury[J].RNA Biol,2018,15(8):1071-1080.
[16]YIN D,ZHENG X Q,ZHUANG J X,et al.Downregulation of long noncoding RNA Sox2ot protects PC-12 cells from hydrogen peroxide-induced injury in spinal cord injury via regulating the miR-211-myeloid cell leukemia-1 isoform2 axis[J].Journal of Cellular Biochemistry,2018,119(12):9675-9684.
[17]YANG X Z,CHENG T T,HE Q J,et al.LINC01133 as ceRNA inhibits gastric cancer progression by sponging miR-106a-3p to regulate APC expression and the Wnt/β-catenin pathway[J].Molecular Cancer,2018,17(1):1-15.
[18]GU S X,XIE R,LIU X D,et al.Long coding RNA XIST contributes to neuronal apoptosis through the downregulation of AKT phosphorylation and is negatively regulated by miR-494 in rat spinal cord injury[J].International Journal of Molecular Sciences,2017,18(4):732.
[19]QIAO Y,PENG C L,LI J,et al.LncRNA MALAT1 is neuroprotective in a rat model of spinal cord ischemia-reperfusion injury through miR-204 regulation[J].Current Neurovascular Research,2018,15(3):211-219.
[20]SONG J,LIU Y J,WANG T Y,et al.miR-17-5p promotes cellular proliferation and invasiveness by targeting RUNX3 in gastric cancer[J].Biomedecine & Pharmacotherapie,2020,128:110246.
[21]WANG Y Z,XU W J,WANG Y N,et al.miR-17-5p promotes migration and invasion in breast cancer cells by repressing netrin 4[J].International Journal of Clinical and Experimental Pathology,2019,12(5):1649-1657.
[22]LUAN Y X,CHEN M,ZHOU L X.miR-17 targets PTEN and facilitates glial scar formation after spinal cord injuries via the PI3K/Akt/mTOR pathway[J].Brain Research Bulletin,2017,128:68-75.
[23]谢昆,李密杰,蒋成砚,等.自噬相关蛋白ATG5/BECLIN-1調控细胞自噬和凋亡的分子机理研究进展[J].中国人兽共患病学报,2018,34(3):272-275;285..
[24]HAO J E,LI S Y,SHI X X,et al.Bone marrow mesenchymal stem cells protect against n-hexane-induced neuropathy through beclin 1-independent inhibition of autophagy[J].Scientific Reports,2018,8:4516.
(收稿日期:2022-02-12)
(本文编辑郭怀印)
基金项目 河南省医学科学研究重点课题计划基金项目(No.202102310398)
引用信息 赵俊,陈勇,吴春芳.LncRNA HOTAIR调节细胞自噬对脊髓损伤模型神经元凋亡的保护作用[J].中西医结合心脑血管病杂志,2024,22(1):79-87.