苦豆碱通过调控miR-210对脂多糖致心肌细胞凋亡及炎性因子表达的影响
2024-03-22初毅代宁曹艳杰
初毅 代宁 曹艳杰

摘要 目的:探讨苦豆碱对脂多糖(LPS)致心肌细胞凋亡和炎症反应的影响。方法:将大鼠心肌H9c2细胞分为NC组(不作任何处理)、LPS组、LPS+苦豆碱低剂量组、LPS+苦豆碱中剂量组、LPS+苦豆碱高剂量组、LPS+miR-NC组、LPS+miR-210组、LPS+苦豆碱中剂量组+anti-miR-NC组、LPS+苦豆堿中剂量组+anti-miR-210组。通过细胞计数试剂盒-8(CCK-8)、流式细胞术、蛋白免疫印迹法检测细胞增殖、凋亡及其相关蛋白表达情况;酶联免疫吸附试验(ELISA)检测白细胞介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)水平;实时荧光定量聚合酶链式反应(RT-PCR)检测miR-210表达水平。结果:不同浓度苦豆碱处理后,LPS处理的心肌细胞活性及Ki-67、Bcl-2、miR-210蛋白表达水平增加,细胞凋亡率及p21、Bax蛋白表达水平降低,IL-1β、TNF-α水平降低,差异均有统计学意义(P<0.05)。过表达miR-210后LPS处理的心肌细胞活性、Ki-67、Bcl-2表达水平增加,细胞凋亡率及p21、Bax表达水平降低,IL-1β、TNF-α水平降低,差异均有统计学意义(P<0.05)。干扰miR-210表达能逆转苦豆碱对LPS诱导的H9c2细胞增殖、凋亡及炎性因子的影响。结论:苦豆碱可通过上调miR-210抑制LPS致心肌细胞凋亡和炎症反应。
关键词 苦豆碱;miR-210;脂多糖;心肌细胞凋亡;炎性因子;白细胞介素-1β;肿瘤坏死因子-α;实验研究
doi:10.12102/j.issn.1672-1349.2024.01.009
心血管疾病为临床高发病,严重威胁着人民的身体健康,常见的心血管疾病有心律失常、心肌缺血、心肌梗死等,近年来中医药在治疗心血管疾病方面表现出独特优势,疗效确切,安全性较好[1]。心肌损伤与心血管疾病的发生发展密切相关,而细胞凋亡与炎症反应在心肌损伤的发生中起重要作用[2-3]。苦豆碱是从豆科植物苦豆草的种子及地上部分提取的一种生物碱,具有抗菌、抗炎、抗心律失常和心肌保护等作用[4]。苦豆碱可通过抑制炎症反应改善异丙肾上腺素诱导的大鼠心肌肥厚[5]。苦豆碱可通过激活磷脂酰肌醇3-激酶(PI3K)/蛋白激酶B(AKT)信号通路抗心肌细胞缺血再灌注引起的损伤及炎症应答[6];对野百合碱诱导的大鼠肺动脉高压具有保护作用[7];可抑制氧化型低密度脂蛋白(ox-LDL)诱导的人脐静脉血管内皮细胞的内皮功能障碍和炎症反应[8]。以上研究均表明苦豆碱具有抗损伤及抗炎作用。但苦豆碱对脂多糖(LPS)诱导的心肌细胞凋亡和炎症反应的影响及机制尚不清楚。miR-210是相关miRNA的一种,对心肌细胞凋亡和改善心脏功能具有重要作用;miR-210有望成为预测或诊断心血管疾病的标志物[9]。miR-210抑制过氧化氢诱导的心肌细胞凋亡和自噬[10],miR-210过表达可通过促进心肌细胞增殖和血管生成,促进心肌梗死后的心脏修复[11]。因此,本研究旨在探讨苦豆碱是否通过调控miR-210影响LPS诱导的心肌细胞损伤。
1 材料与方法
1.1 实验材料
大鼠心肌H9c2细胞购于美国ATCC;LPS购于北京百奥莱博科技有限公司;DMEM购于美国Gibco公司;苦豆碱购于上海源叶生物科技有限公司;细胞计数试剂盒-8(CCK-8)试剂盒、凋亡试剂盒购于日本同仁化学研究所;二喹啉甲酸(BCA)试剂盒购于美国Pierce公司;荧光定量试剂盒购于上海经科化学公司;白细胞介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)的酶联免疫吸附试验(ELISA)试剂盒购于南京森贝伽生物公司。
1.2 细胞处理与分组
H9c2细胞在含10%胎牛血清的DMEM培养基中培养,取生长状态良好的H9c2细胞,将其随机分为NC组(不做任何处理)、LPS组(加入0.5 μg/mL的LPS)、LPS+苦豆碱低剂量组(加入0.5 μg/mL的LPS和20 mg/L苦豆碱)、LPS+苦豆碱中剂量组(加入0.5 μg/mL的LPS和50 mg/L苦豆碱)、LPS+苦豆碱高剂量组(加入0.5 μg/mL的LPS和100 mg/L苦豆碱)、LPS+miR-NC组(转染miR-NC+0.5 μg/mL的LPS)、LPS+miR-210组(转染miR-210+0.5 μg/mL的LPS)、LPS+苦豆碱中剂量组+anti-miR-NC组(转染anti-miR-NC+0.5 μg/mL的LPS+和50 mg/L苦豆碱)、LPS+苦豆碱中剂量组+anti-miR-210组(转染anti-miR-210+0.5 μg/mL的LPS+和50 mg/L苦豆碱)。miR-NC、miR-210、anti-miR-NC、anti-miR-210转染的具体步骤:取50 μL无血清培养基稀释miR-NC、miR-210、anti-miR-NC、anti-miR-210的质粒,混匀;同时取50 μL无血清培养基稀释转染试剂,混匀后室温静置5 min,将上述两种溶液混合,室温静置20 min,然后将其与培养至80%融合度的细胞混合,转染6 h后进行药物处理。
1.3 CCK-8检测细胞增殖
取培养48 h的细胞,加10 μL的CCK-8试剂,孵育2 h后,酶标仪检测450 nm波长处OD值。
1.4 流式细胞术检测细胞凋亡
取各组培养48 h的细胞,预冷后用磷酸缓冲盐溶液(PBS)漂洗,加入V-异硫氰酸荧光素(Annexin V-FITC)10 μL,再加入碘化丙啶(propidium iodide,PI)5 μL,避光孵育10 min,流式细胞仪检测细胞凋亡率。
1.5 蛋白免疫印迹法(Western Blot)检测相关蛋白表达
提取总蛋白,BCA试剂盒定量;行电泳后聚偏二氟乙烯(PVDF)转膜,接着封闭在5%脱脂奶粉中,加一抗4 ℃孵育过夜;加二抗室温孵育90 min,增强化学发光试剂(enhanced chemiluminescence,ECL)发光液显影,成像后检测蛋白条带灰度值,蛋白相对表达水平等于目的条带和β-actin条带灰度值的比值。
1.6 ELISA检测IL-1β、TNF-α水平
各组细胞培养48 h,按照IL-1β、TNF-α试剂盒说明操作,酶标仪检测450 nm波长处OD值,根据标准曲线计算上清液中IL-1β、TNF-α水平。
1.7 实时荧光定量聚合酶链式反应(RT-qPCR)检测miR-210表达水平
提取各组H9c2细胞总RNA,反转录成cDNA,进行RT-qPCR,以U6为内参,相对表达量用2-△△Ct法计算。miR-210正向引物:5′-ATGCCTGTGCGTGTGA-3′,反向引物:5′-GTGCGTGTCGTGGAGTC-3′。
1.8 统计学处理
采用SPSS 20.0软件进行统计学分析。符合正态分布的定量资料以均数±标准差(x±s)表示,两组比较采用t检验,多组间比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结 果
2.1 不同浓度苦豆碱对LPS诱导H9c2细胞增殖、凋亡的影响
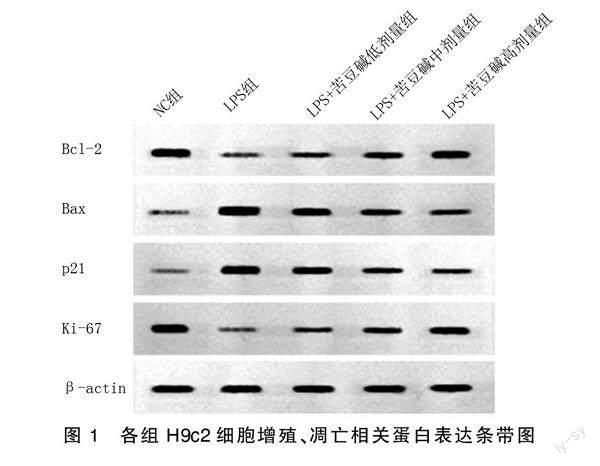
与NC组比较,LPS组细胞活性及Ki-67、Bcl-2蛋白表达水平降低,细胞凋亡率及p21、Bax蛋白表达水平升高,差异均有统计学意义(P<0.05);与LPS组比较,不同浓度苦豆碱组细胞活性及Ki-67、Bcl-2蛋白表达水平升高,细胞凋亡率及p21、Bax蛋白表达水平降低,差异均有统计学意义(P<0.05)。详见图1、表1、图2。
2.2 不同浓度苦豆碱对LPS诱导H9c2细胞炎性因子的影响
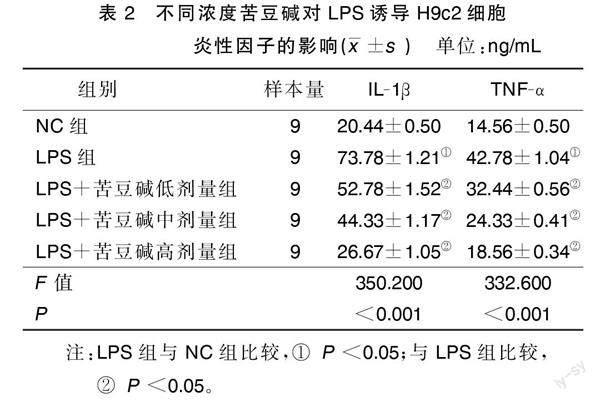
与NC组比较,LPS组IL-1β、TNF-α水平升高(P<0.05);与LPS组比较,不同浓度苦豆碱组IL-1β、TNF-α水平降低(P<0.05)。详见表2。
2.3 不同浓度苦豆碱对LPS诱导H9c2细胞miR-210表达的影响
与NC组比较,LPS组H9c2细胞中miR-210表达水平降低(P<0.05);与LPS组比较,不同浓度苦豆碱组H9c2细胞中miR-210表达水平升高(P<0.05)。詳见表3。
2.4 过表达miR-210对LPS诱导H9c2细胞增殖和凋亡的影响
与LPS+miR-NC组比较,LPS+miR-210组miR-210表达水平、细胞活性及Ki-67、Bcl-2蛋白表达水平升高,细胞凋亡率及p21、Bax蛋白表达水平降低,差异均有统计学意义(P<0.001)。详见表4、图3、图4。
2.5 过表达miR-210对LPS诱导H9c2细胞炎性因子的影响
与LPS+miR-NC组比较,LPS+miR-210组IL-1β、TNF-α水平降低(P<0.001)。详见表5。
2.6 干扰miR-210表达能逆转苦豆碱对LPS诱导H9c2细胞增殖、凋亡及炎性因子的影响
与LPS+苦豆碱中剂量+anti-miR-NC组比较,LPS+苦豆碱中剂量+anti-miR-210组miR-210表达水平、细胞活性及Ki-67、Bcl-2蛋白表达水平降低,细胞凋亡率及p21、Bax蛋白表达水平升高,IL-1β、TNF-α水平升高(P<0.05)。详见图5、图6、表6。
3 讨 论心肌细胞凋亡与多种心血管疾病有关,而许多心血管疾病都伴随着炎症反应的发生,抑制心肌细胞凋亡和炎症反应对防治心血管疾病具有重要意义。最近的研究显示,中医药治疗可抑制心肌细胞凋亡和炎症反应[12-13]。有研究报道,苦豆碱对海马神经元氧糖剥夺再灌注损伤具有明显的保护作用[14]。苦豆碱可抑制心肌细胞凋亡,从而减轻冠状动脉微栓塞引起的心肌损伤[15];可通过调控核转录因子-κB(NF-κB)信号通路,降低炎性因子TNF-α及IL-1β水平,从而改善哮喘小鼠肺功能,减轻哮喘症状及炎症反应[16];可通过抑制炎症反应来抑制人肺血管平滑肌细胞增殖[17]。本研究发现,不同浓度苦豆碱处理LPS诱导的心肌细胞后,心肌细胞活性及Ki-67、Bcl-2蛋白表达升高,细胞凋亡率及p21、Bax蛋白表达水平降低,IL-1β、TNF-α水平降低,提示苦豆碱可减轻LPS诱导的心肌细胞损伤。
研究报道,miR-210可以抑制氧葡萄糖剥夺/再灌注诱导的心肌细胞凋亡[18]。miR-210可减轻心肌梗死后心脏细胞凋亡[19]。本研究结果显示,不同浓度苦豆碱处理LPS诱导的心肌细胞中,增加miR-210表达水平;过表达miR-210增加LPS处理的心肌细胞活性及Ki-67、Bcl-2蛋白表达水平,降低细胞凋亡率及p21、Bax蛋白表达水平,降低IL-1β、TNF-α水平。表明过表达miR-210抑制了LPS诱导的心肌细胞凋亡和炎症反应,与以往研究结果相符,miR-210具有抑制心肌细胞凋亡的作用。还有研究报道miR-210具有抗炎作用,如miR-210-3p可通过抑制胰岛素样生长因子2(IGF2)减轻动脉粥样硬化中的炎症反应[20]。紫草素可能通过上调miR-210减轻LPS诱导的人肾小管上皮细胞(HK-2)炎性损伤[21]。此外,本研究结果显示,干扰miR-210表达逆转苦豆碱对LPS诱导的H9c2细胞增殖、凋亡及炎性因子的影响。综上所述,苦豆碱可通过增加miR-210抑制LPS致心肌细胞凋亡和炎症反应。
参考文献:
[1]马育轩,王艳丽,潘军英,等.中药治疗心血管疾病现代研究进展[J].中医药信息,2018,35(5):109-116.
[2]李靖南,张俊霞,张岩.心肌细胞程序性坏死——心脏疾病防治的新靶点[J].中国心血管杂志,2019,24(5):404-407.
[3]徐标,孙璇.炎症在心肌损伤和修复中的作用[J].临床心血管病杂志,2018,34(7):633-635.
[4]孙朋,鄢庆祥,杜同同,等.苦豆碱的研究概况[J].中国民族民间医药,2017,26(24):49-53.
[5]郑婕,戴贵东,闫琳,等.苦豆碱通过抑制炎症反应保护异丙肾上腺素诱导心脏肥厚作用的研究[J].宁夏医学杂志,2018,40(1):10-12.
[6]张会超,徐里,芮浩淼,等.苦豆碱对缺血再灌注引起的H9c2心肌细胞损伤和炎症应答的作用[J].中国病理生理杂志,2018,34(2):281-286.
[7]杨佳美.苦豆碱对肺动脉高压的保护作用研究[D].银川:宁夏医科大学,2018.
[8]LI W W,LI Y S,ZHAO Y,et al.The protective effects of aloperine against ox-LDL-induced endothelial dysfunction and inflammation in HUVECs[J].Artificial Cells,Nanomedicine,and Biotechnology,2020,48(1):107-115.
[9]WANG L R,JIA Q J,CHEN X N,et al.Role of cardiac progenitor cell-derived exosome-mediated microRNA-210 in cardiovascular disease[J].Journal of Cellular and Molecular Medicine,2019,23(11):7124-7131.
[10]李揚雪.MiR-210在过氧化氢诱导大鼠心肌细胞氧化应激损伤中的作用及其机制研究[D].长春:吉林大学,2016.
[11]ARIF M,PANDEY R,ALAM P,et al.microRNA-210-mediated proliferation,survival,and angiogenesis promote cardiac repair post myocardial infarction in rodents[J].Journal of Molecular Medicine,2017,95(12):1369-1385.
[12]陈飞,陈珺滢.中医药防治心肌细胞凋亡的研究进展[J].中国中医药科技,2019,26(6):979-981.
[13]王梦妮,刘宏岩.中医方药治疗心肌缺血再灌注损伤的研究进展[J].吉林中医药,2020,40(1):137-139.
[14]郝银菊,周茹,姚婉霞,等.苦豆碱对氧糖剥夺再灌注损伤后海马神经元的保护作用[J].中药药理与临床,2016,32(1):44-46.
[15]MAO Q,GUO F F,LIANG X L,et al.Aloperine activates the PI3K/Akt pathway and protects against coronary microembolisation-induced myocardial injury in rats[J].Pharmacology,2019,104(1/2):90-97.
[16]李海龙,罗庆波,何静江,等.苦豆碱对哮喘小鼠肺功能及NF-κB、TNF-α、IL-1β的影响[J].中药药理与临床,2016,32(3):69-72.
[17]CHANG Z,ZHANG P,ZHANG M,et al.Aloperine suppresses human pulmonary vascular smooth muscle cell proliferation via inhibiting inflammatory response[J].The Chinese Journal of Physiology,2019,62(4):157-165.
[18]BIAN W S,SHI P X,MI X F,et al.miR-210 protects cardiomyocytes from OGD/R injury by inhibiting E2F3[J].European Review for Medical and Pharmacological Sciences,2018,22(3):743-749.
[19]CHENG H,CHANG S,XU R,et al.Hypoxia-challenged MSC-derived exosomes deliver miR-210 to attenuate post-infarction cardiac apoptosis[J].Stem Cell Res Ther,2020,11(1):224.
[20]QIAO X R,WANG L,LIU M P,et al.miR-210-3p attenuates lipid accumulation and inflammation in atherosclerosis by repressing IGF2[J].Bioscience,Biotechnology,and Biochemistry,2020,84(2):321-329.
[21]CHEN Y H,LI H M.RETRACTED:alkannin protects human renal proximal tubular epithelial cells from LPS-induced inflammatory injury by regulation of microRNA-210[J].Biomedecine & Pharmacotherapie,2018,108:1679-1685.
(收稿日期:2022-09-23)
(本文编辑郭怀印)
引用信息 初毅,代宁,曹艳杰.苦豆碱通过调控miR-210对脂多糖致心肌细胞凋亡及炎性因子表达的影响[J].中西医结合心脑血管病杂志,2024,22(1):51-55.