利用南瓜蒸煮液绿色制备纳米银及其抑菌性能的研究
2024-03-19高大响杨鹤同
高大响,杨鹤同
利用南瓜蒸煮液绿色制备纳米银及其抑菌性能的研究
高大响*,杨鹤同
(江苏农林职业技术学院,江苏 句容 212400)
以南瓜蒸煮液和AgNO3为原料,烷基糖苷(APG)为表面活性剂,以微波加热绿色制备纳米银溶胶,研究其制备工艺、性能和抑菌效果。以单因子对纳米银的制备进行优化。通过紫外-可见吸收光谱(UV-vis)、透射电镜(TEM)、能量色谱(EDS)和X射线衍射(XRD)等方法对合成纳米银的特征吸收峰、形貌以及稳定性等进行分析,并考察纳米银对大肠杆菌()和金黄色葡萄球菌()的抑菌性能。纳米银制备适宜的优化工艺条件:在南瓜蒸煮液体积为40 mL情况下,AgNO3的初始质量浓度为1.2 g/L、pH值为13、微波加热时间为60 s。经优化后,所制备的纳米银的UV-vis光谱在406 nm处出现强的特征吸收峰,EDS色谱进一步证实了纳米银的存在。纳米银为球形,平均粒径为13.4 nm,粒径小,分散性和稳定性好。抗菌试验表明,不同质量浓度的纳米银对和均有较强的抑制和杀灭效果,对的MIC值和MBC值分别为5 mg/L和10 mg/L,对的MIC值和MBC值分别为40 mg/L和320 mg/L。该AgNPs对革兰氏阴性和革兰氏阳性细菌具有抗菌能力,在食品包装中具有较好的应用前景。
南瓜蒸煮液;纳米银;抑菌性能
纳米银(Silver Nanoparticles,AgNPs)通常指粒径在1~100 nm的金属银单质,由于具有大比表面积、小尺寸和量子效应等优势,同等浓度下其抑菌能力明显强于银单质,且不会产生耐药性,具有低毒性和强抗菌活性等优点,被应用于食品包装、水污染治理和医疗抗菌等领域[1-3]。纳米银可对食源性微生物有明显抑制和杀灭作用,在食品包装中加入AgNPs可有效保证食品质量,在食品保鲜方面有巨大的应用潜力[4]。目前,纳米银的制备工艺主要有物理法、化学法、生物法等,化学法制备的纳米银粒子易团聚,有些会产生有毒副产物,不环保[5],不适合于食品包装。如何制备出稳定性好且满足实际应用需求、低成本、环保型的纳米银材料成为研究的一大热点。近年来,以植物提取物为主要生物材料来合成AgNPs的生物合成法,是绿色生产纳米银最常用的方法。可直接、快速地合成粒径小、稳定性好的AgNPs,且在合成过程中不产生有毒副产物,这种绿色合成法已成为当前研究的热点。
然而,植物材料提取物大都含有醛、糖等弱还原剂,AgNO3被醛、糖等弱还原剂还原时,反应活化能高,反应速率慢,导致生成的AgNPs容易发生互相碰撞而团聚[6]。为防止生成的AgNPs团聚,相关研究中,利用山楂[7]、姜[8]、金银花[9]、莲藕[10]、茜草根[11]等的提取物还原AgNO3往往采用高温加热回流或恒温振荡等方法,或以银氨溶液代替AgNO3为银源进行反应[12]。现有的这些植物法制备纳米银采用的生物材料成本往往较高,加热时间长、工艺条件苛刻且方法单一。因此,选用新颖、廉价的生物材料及其方法将成为绿色合成高效AgNPs抗菌剂和节能降耗的关键,对纳米银在果蔬贮藏保鲜方面的大面积推广应用于具有重要意义。
南瓜()又名倭瓜,是葫芦科南瓜属一年生草本植物,种植历史悠久,世界各地均广泛栽培。南瓜具有较高的营养价值,中医认为,南瓜具有补中益气,益心敛肺,解毒杀虫,降糖止渴的功效。南瓜果实可溶性固形物含量较高,其中可溶性还原糖含量可达3.87 g/100 g,此外,还含有多种氨基酸、β-胡萝卜素、果胶、矿物质和丰富的膳食纤维,通过加工可以制备各种食品[13]。在家庭中,南瓜一般通过蒸煮后食用,简单方便,易消化,营养价值高。南瓜单独蒸煮后,剩余的蒸煮液往往被丢弃。南瓜通过蒸煮,里面部分可溶性还原糖和酚类化合物溶于热水中,其中的羟基和醛基起还原作用,是天然的还原剂,用于制备纳米银,简便易得。目前,作者未见有利用南瓜蒸煮液绿色制备纳米银的相关研究和报道。
本研究直接以AgNO3为银源代替银氨溶液,以南瓜蒸煮液为还原剂,环保型烷基糖苷(APG)作为保护剂,采用微波辅助南瓜蒸煮液快速制备纳米银材料。利用廉价的南瓜材料结合微波加热合成纳米银的制备工艺,成本低,清洁、无毒、环境友好,并且反应条件温和。本研究对纳米银的制备工艺进行了单因子优化,采用紫外-可见吸收光谱(UV-Vis)、扫描电镜(TEM)等对制备的纳米银材料性能加以表征,并对纳米银溶胶的稳定性和抑菌杀菌性能进行分析,为进一步开发银系抗菌剂及在食品包装中的应用提供理论依据。
1 实验
1.1 材料与仪器
细菌材料:供试菌种大肠杆菌(ATCC25922,)、金黄色葡萄球菌(ATCC25923,)均由本实验室保藏。
其他材料:南瓜为市售成熟“锦栗”(Jin Li)南瓜鲜品、NB培养基(青岛海博生物技术有限公司)、琼脂(Sigma)、烷基糖苷0810(APG,江苏万琪生物科技股份有限公司,中性,固含量≧50%)溶液(1 mL烷基糖苷/10 mL去离子水)、NaOH(AR)、AgNO3(AR),实验用水均为去离子水。
主要仪器:G90F23CN3PV-BM1型微波炉,广东格兰仕微波生活电器制造有限公司;MJPS-150培养箱,上海精宏实验设备有限公司;THZ-98c摇床,上海一恒科学仪器有限公司;MK3型酶标仪,赛默飞世尔科技有限公司;紫外-可见光分光光度计,日本岛津;500型全自动菌落计数仪,Interscience;Leica DMI4000荧光显微镜B,德国徕卡,激发光为536 nm,发射波长为617 nm。
1.2 方法
1.2.1 南瓜蒸煮液纳米银的制备及优化
取南瓜400 g,清洗干净,去皮瓤,切分成小块状,置于500 mL烧杯中,于高压蒸汽灭菌锅中,在温度121 ℃下,蒸煮1 h。冷却后取出,纱布过滤得到蒸煮液。取20 mL稀释至40 mL,加1 mL APG,调节pH值为11;然后加固体硝酸银至最终质量浓度为0.8 g/L,迅速置于微波炉中,在800 W下,微波加热40 s,取出,自然静置1~2 h,期间用玻璃棒间歇搅拌;最后得到纳米银水溶胶。将制备的AgNPs溶胶取1 mL稀释50倍,然后用UV-vis分光光度计进行250~500 nm波长范围的吸收光谱扫描,确定纳米银的生成。
取5份40 mL稀释的南瓜蒸煮液,用NaOH(质量分数为10%)水溶液将pH值调节为11,分别加入AgNO3,使其最终质量浓度为0.4、0.8、1.2、1.6、2.0 g/L。微波加热混合液,以考察在一定体积的南瓜蒸煮液情况下,AgNO3浓度对纳米银的生成影响。在上述确定的最佳AgNO3浓度下,调节南瓜蒸煮液pH值分别为9、10、11、12、13,考察南瓜蒸煮液pH值对纳米银的生成影响。在最佳AgNO3浓度和pH值条件下,分别设置微波加热时间为30、40、50、60、70 s,考察不同微波加热时间对纳米银生成的影响。
取上述最佳微波加热时间条件下的反应悬浮液,以9 000 r/min转速离心30 min,弃去上层清液得到沉淀。用去离子水洗涤3次,收集沉淀,冷冻干燥,得到南瓜蒸煮液纳米银颗粒,备用。
1.2.2 材料的表征
采用JEOL JEM2100型透射电子显微镜(TEM)(日本电子株式会社)观察纳米银颗粒形貌、粒径情况,加速电压为200 kV。使用IR Tracer-100傅里叶红外光谱仪(日本岛津)测定样品的FTIR,分辨率为4 cm−1,扫描范围为400~4 000 cm−1。采用UV2600型分光光度计(日本岛津)测定纳米银溶胶的吸光度值。采用XRD-7000型XRD衍射仪(日本岛津公司)分析样品结晶度,扫描电流为30 mA,扫描电压为40 kV,辐射源为Cu靶、Кα射线(=0.154 18 nm),2的扫描范围为5°~80°,扫描速度为0.02(°)/s。采用光电子能谱仪分析纳米银的元素组成。在25 ℃下用电位分析仪(ZS90型Zeta电位分析仪,英国马尔文公司)测定所制备的纳米银溶液的Zeta电位。
1.2.3 抗菌性能分析
1.2.3.1 最低抑菌浓度和最小杀菌浓度
纳米银的抗菌能力通常用最低抑菌浓度(MIC)和最小杀菌浓度(MBC)来衡量。采用2倍稀释法测定纳米银的MIC和MBC值[14]。将测试菌种于NB平板上划线,37 ℃培养过夜至可见明显菌斑。挑取适量成熟菌落,至3 mL NB液体培养基中,在37 ℃下培养10~15 h,至OD600值约为0.6。生理盐水OD600值调整至0.5,按照体积分数0.1%的比例加入到NB液体培养基中。在96孔板中布板,在行和行加入400 μL NB液体培养基,在、、行加入400 μL的菌液,在、、行加入400 μL的菌液。在1~11列,分别加入400 μL不同浓度的纳米银溶胶,使得每个孔中的抑菌剂浓度为前一个孔中抑菌剂浓度的1/2,在第12列中分别加入400 μL去离子水,作为对照组,其他操作与实验组相同。将96孔板置于37 ℃,振荡培养24 h后,吸取200 μL至96孔酶标板检测OD600值,之后在超净台静置30 min,肉眼观察菌体浑浊情况,以不长菌的最低浓度为MIC。实验中每个样品做3个平行样。
根据MIC实验的结果,在MIC前4个梯度(5、10、20、40 mg/L),在MIC前4个梯度(80、160、320、640 mg/L)中,分别取100 μL培养液涂到NB板,在37 ℃培养18 h,拍照计数。以杀死99.9%(降低3个数量级)的供试菌株所需的最低纳米银浓度确定为MBC,实验中每个样品做3个平行样。
1.2.3.2 抑菌动力学
纳米银材料的抑菌动力学关系参考相关文献[15],并作一定的修改。分别将、测试菌种于NB液体培养基中在37 ℃下培养10~15 h,至OD600值约为0.6,用NB液体培养基将OD600值调至0.5。配置含有最终质量浓度分别为0、5、10、20、40 mg/L纳米银材料的NB培养液各8 mL,之后分别接入OD600值为0.5的80 μL菌液,在37 ℃下恒温震荡培养。配置分别含有0、20、40、80、160、320 mg/L抑菌材料的NB培养液各8 mL,之后分别接入OD600值为0.5的80 μL菌液,在37 ℃下恒温振荡培养。同时分别做空白和对照组,空白组为NB液体培养基,对照组为NB液体培养基和菌液。每隔0、30、60、90、120、150、180、210、240、270、300、330、360 min分别取200 μL的菌液到酶标板中,用酶标仪分别检测OD600值,记录数据并绘制抑菌动力学曲线。上述实验设置3次重复。
1.2.3.3 荧光试验
分别取1.2.3.2节中OD600值调至0.5的、2种NB液体培养液。利用NB液体培养基、纳米银溶液,分别配制含有纳米银最终质量浓度为20 mg/L的菌液、含有纳米银最终质量浓度为320 mg/L的菌液。放入37 ℃培养箱中,培养0、5、60、120 min。之后取95 μL菌液,加入5 μL碘化丙啶(Propidium Iodide,PI)试剂,混合均匀后,避光染色5 min,在荧光显微镜下观察细菌染色和死亡状况。
1.2.4 数据处理
采用Origin2017软件对南瓜蒸煮液纳米银制备工艺及结构表征数据进行制图和分析。纳米银抑菌和杀菌效果运用SPSS19.0软件进行单因素方差分析。采用Ducan检验分析在0.05水平上的显著性。
2 结果与分析
2.1 南瓜蒸煮液纳米银的制备工艺优化
UV-Vis吸收光谱在400~450 nm处出现的吸收峰是纳米银形成的依据,单一的表面等离子共振带证明合成的纳米银材料主要为球形[16]。有文献表明,球形纳米银的共振峰位置蓝移程度越强,粒径越小,相反的,红移则表明粒径增加[17]。因此,采用UV-Vis吸收光谱的特征峰及对应的吸收波长大小是考察纳米银生成和优化工艺的简便手段。所制备的纳米银溶胶的吸收光谱见图1。
由图1a初步实验可知,南瓜蒸煮液和硝酸银溶液的UV-Vis吸收光谱在400 nm附近并无吸收峰,而南瓜蒸煮液与AgNO3作用后,在400 nm附近有明显的吸收峰。其最大吸收峰位于410.2 nm处,可初步判断纳米银粒子形成,且为球形。吸收峰的出现是因为纳米银的表面存在自由电子运动,当这种运动与外加电磁波振荡频率相同时就会产生表面等离子共振吸收峰(SPR峰)。
由图1b单因子优化试验表明,在保持南瓜蒸煮液40 mL不变的情况下,改变硝酸银的量,当AgNO3初始质量浓度为0.4 g/L时,在404.3 nm处出现最大峰,但纳米银质量浓度并不高;而当AgNO3的初始质量浓度为1.2 g/L时,纳米银质量浓度最大,特征峰位置红移至406 nm处。随着质量浓度的增加,纳米银的生成量逐渐减小,且特征峰进一步红移,在初始质量浓度为2.0 g/L时,纳米银的特征峰位置在412.1 nm处。AgNO3质量浓度的升高使得纳米银最大吸收峰逐渐红移,粒径增大。这是因为AgNO3质量浓度过高导致过量未反应的Ag+聚集在AgNPs表面,并在AgNPs表面发生还原反应,新合成的纳米银富集在晶核表面,使AgNPs粒子团聚,粒径变大。综合考虑,AgNO3初始质量浓度选择1.2 g/L为宜。
由图1c可看出,在碱性条件下,随着pH值的增大,纳米银的生成量逐渐增多,南瓜蒸煮液的pH值由11升高至12,生成纳米银的效率明显提高,但峰形较宽;当pH值提高到13时,生成纳米银的量不再提高,但吸收峰变得尖而窄。pH值的变化对特征峰对应的波长影响不大。对南瓜蒸煮液来说,碱性环境是其还原Ag+的重要条件。随着反应液pH值升高,参与反应的糖类及酚类化合物中的羟基官能团去质子化的能力增强,易失去H+而带负电荷,更容易与Ag+作用生成单质Ag。因此,pH值选择13为宜。
图1d表明,在30 s内,由于热效应不明显,反应物分子有效碰撞的次数有限,因此,不能生成纳米银或很少。随着加热时间的延长,纳米银粒子的质量浓度逐渐增大,在60 s时,纳米银生成量最高,对应的波长最低,位于406 nm处。纳米银粒子生成量在60 s后下降,其特征峰位置红移,粒径变大,是因为纳米银粒子在高温下团聚,稳定性降低,粒径变大。因此,微波加热时间60 s为宜。
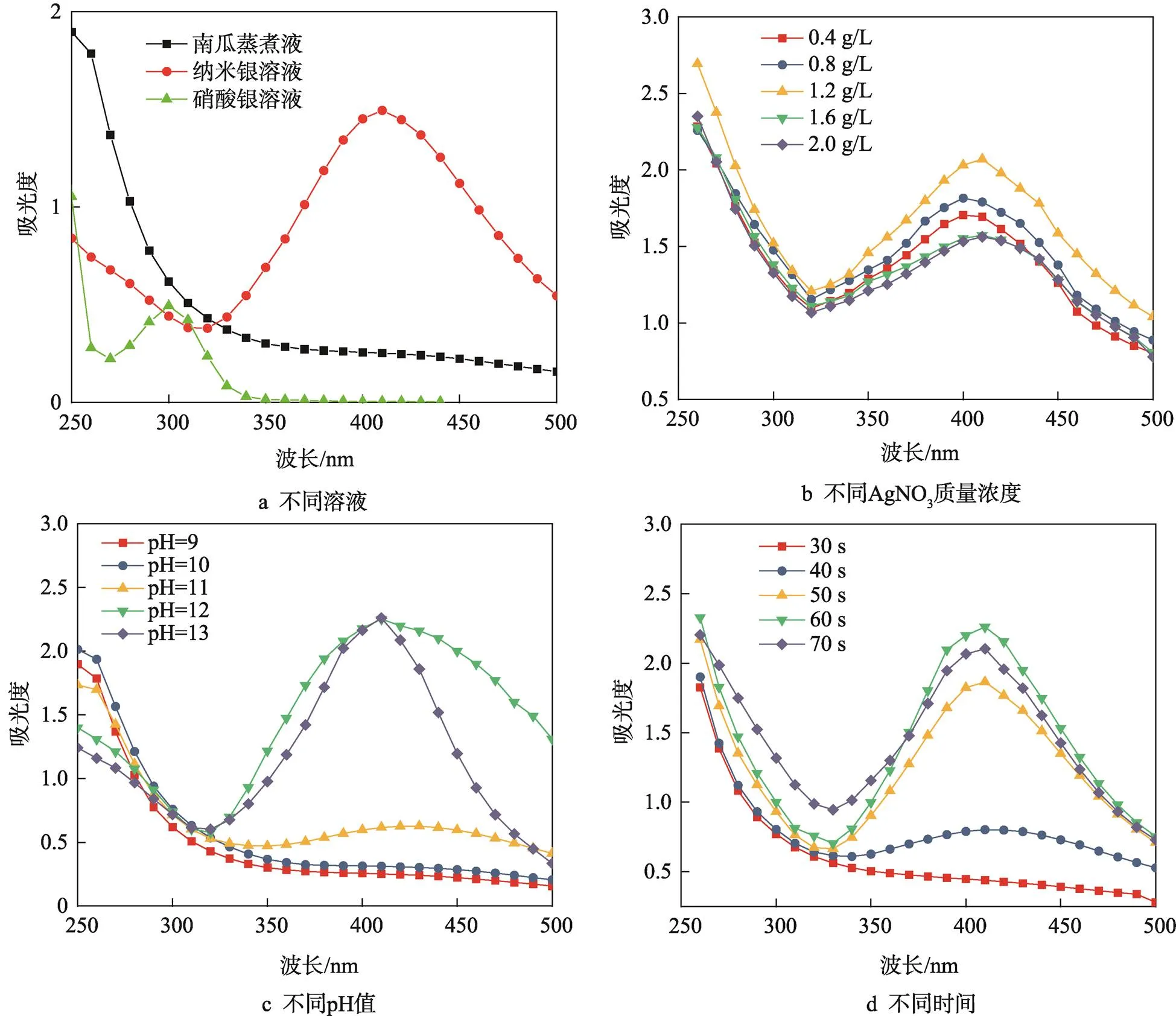
图1 纳米银溶胶紫外-可见吸收光谱及优化工艺
微波加热明显加快了纳米银粒子的形成,这是因为微波将电磁能转化为热能,反应体系的温度快速升高,使AgNO3被还原的速率加快。更为重要的是,水分子的快速旋转能破坏水分子之间的氢键,产生氢自由基(·H)、羟基自由基(·OH)和溶剂化电子。大量自由基和自由电子的存在使得Ag+离子的还原速率加快[18]。
2.2 南瓜蒸煮液纳米银材料的表征
2.2.1 TEM分析
通过TEM表征合成的AgNPs的形态和粒径大小,结果如图2所示。图2a、b和c表明,合成的AgNPs为类球形,形态均匀。使用Image J软件分析确定粒径大小,结果如图2d所示,AgNPs的粒径范围为3~24 nm,且具有较窄的粒径分布,平均粒径为13.4 nm,表明合成的AgNPs粒径小,分散性好。该AgNPs的平均粒径比Balciunaitiene等[19]通过苦艾提取物合成的球形AgNPs(平均粒径50 nm)更小。烷基糖苷类表面活性剂与南瓜蒸煮液中的糖类的羟基等协同吸附和分散Ag+,保证了合成的AgNPs高分散性和小粒径。
2.2.2 FTIR光谱分析
天然糖类含有−OH、−COOH及−C=O等官能团,这些官能团能与金属纳米粒子结合,从而增强金属纳米粒子的稳定性,阻止纳米粒子聚集。FTIR光谱见图3所示,FTIR光谱中在3 406 cm−1处为纳米银材料的O−H伸缩振动峰,表明还原剂中存在羟基,在波数为2 856、2 927 cm−1处的吸收峰为亚甲基(−CH2)、甲基(−CH3)伸缩振动产生的特征吸收峰,1 742cm−1、1 610cm−1处分别为羰基C=O和C=C振动形成的特征峰,1 381 cm−1处是C−H弯曲振动造成的,1 096cm−1处吸收峰是由C−O−C醚键的不对称伸缩振动产生,该峰是糖类的特征峰[20]。由此说明,南瓜纳米银提取液中的一些可溶性糖类成分主要参与了AgNPs的形成,并作为保护基团吸附在AgNPs表面,增加了其表面极性,提高了AgNPs的稳定性和分散性,避免了AgNPs的聚集。
2.2.3 EDS分析
采用能量色谱仪对纳米银粉末中的元素进行分析,图4为制备的纳米银材料的能谱图(EDS)。结果表明,在3 keV时表现出纳米银材料典型的光学吸收峰[21]。这是由于AgNPs表面等离子体共振效应引起的特征吸收峰,该结果证实了制备的材料为纳米银粒子。此外,纳米银溶胶中还含有C、O等元素的存在,结合红外结果分析,其来源主要是南瓜蒸煮液中的糖类成分,也验证了南瓜蒸煮液成分包覆在纳米银表面。
2.2.4 XRD分析
图5为南瓜蒸煮液纳米银的XRD图谱。图5中所示2角在38.48°、43.42°、64.68°和77.44°处4个特征衍射峰可分别归属于纳米银的(111)、(200)、(220)和(311)晶面(JCPDS No.04-0783),表明合成的纳米银晶相为面心立方结构(Face-Centered Cubic,FCC)[22]。由此,可以证明南瓜蒸煮液可以有效地合成纳米银。2角在25.18°处的宽吸收峰可能是南瓜蒸煮液中的活性物质吸附于AgNPs表面引起的。

图2 纳米银的TEM图(a~c)和粒径分布图(d)

图3 纳米银的红外光谱图

图4 纳米银的EDS图谱

图5 纳米银的XRD图谱
2.2.5 稳定性
在25 ℃下,测南瓜蒸煮液纳米银的Zeta电位,结果如图6a所示。纳米银的Zeta电位为−21.2 mV,说明纳米银材料表面吸附的糖类物质带有负电荷。正是由于纳米银表面所带负电荷之间的静电排斥作用使制备的纳米银材料具有良好的稳定性,不易发生团聚。

图6 纳米银溶胶Zeta电位(a)及静置的稳定性(b)
将制备的纳米银溶胶,置于30 ℃下静置30 d,然后测其吸光度的变化,考察其稳定性,结果见图6b。在30 d内,纳米银溶胶的UV-Vis光谱的吸收峰没有明显变化,表明该纳米银材料在水中极稳定。可能是因为南瓜蒸煮液中的小分子物质吸附在AgNPs的表面,降低了AgNPs的表面能,因此在水中不易团聚也不易沉降。
2.3 抑菌实验
2.3.1 最低抑菌浓度和最小杀菌浓度
纳米银对和的抑制效果见表1和表2。结果表明,不同质量浓度的纳米银对和均具有明显的抑制作用,抑制率随着质量浓度的增加而增大。单因子方差分析和Duncan检验结果表明,不同质量浓度的AgNPs对和抑制性均达到显著水平(<0.05),且随着质量浓度的不断增大,抑制效果越好。根据吸光度情况并结合培养液的澄清度结果显示,该纳米银溶胶对和的MIC值分别为5 mg/L和40 mg/L,相比之下,南瓜蒸煮液制备的AgNPs比文献[23]报道的AgNPs具有更好的抗菌活性。AgNPs的抗菌能力与其大小、形状及表面电荷等多种因素有关[24]。AgNPs的粒径越小,比表面积越大,更有利于与细菌的结合而改变膜的通透性,发挥抑菌作用[19]。本研究所制备的纳米银颗粒较小,可能是抑菌性好的原因之一。不过,除了粒径本身的大小和形状外,还由于制备的材料不同,某些材料的提取物成分具有一定的抑菌性能,在合成过程中被吸附在纳米银材料的表面,使合成的AgNPs材料的抑菌性能产生叠加效应。
表1 不同质量浓度纳米银对的抑菌情况

Tab.1 Inhibition of E.coli by AgNPs of different concentrations
注:表中数据为平均值±标准差(=3),同一列中不同小写字母表示有显著性差异(<0.05);96孔板中培养液出现浑浊的用“ +”表示,澄清的则用“−”表示。
表2 不同质量浓度纳米银对的抑菌情况

Tab.2 Inhibition of S.aureus by AgNPs of different concentrations
注:表中数据为平均值±标准差(=3),同一列中不同小写字母表示有显著性差异(<0.05);96孔板中培养液出现浑浊的用“ + ”表示,澄清的则用“−”表示。
表3、表4分别显示的是银纳米粒子对和的杀菌效果。可以看出,银纳米粒子对这2株菌具有明显的杀菌作用,且随着银纳米粒子质量浓度的增加,杀菌效果也越来越好。根据单因素方差分析可知,2组数据差异性显著(0.05),合成的银纳米粒子对和的杀菌效果不同,银纳米粒子对的毒害作用更强一些。和的MBC值分别为10 mg/L和320 mg/L。
2.3.2 纳米银材料的抑菌曲线
细菌培养液的吸光度可以反映培养液中细菌的增殖速度,故通过测量细菌培养液在600 nm处的吸光度值也能确定制备的纳米银对和生长的抑制作用。由图7可见,随着培养时间的增加,加入生理盐水的对照组菌液的OD600值不断增大,而加入不同质量浓度纳米银后其OD600值则发生了一定的变化。对于,当在培养液中加入不同质量浓度的纳米银后,的生长有不同程度的抑制,当纳米银的最终质量浓度为5 mg/L时,的生长被完全抑制;对于,加入最终质量浓度为20 mg/L的纳米银材料,其OD600值与对照组相比明显变小,表明纳米银抑制了生长;将纳米银质量浓度继续增大至40 mg/L后,其OD600值基本不发生变化,表明此质量浓度下的生长被完全抑制。由此可见,制备的纳米银对和均有较好的抑制效果。
表3 不同质量浓度纳米银对的杀菌情况

Tab.3 Sterilization of E.coli by AgNPs of different concentrations
注:表中数据为平均值±标准差(=3),同一列中不同小写字母表示有显著性差异(<0.05)
表4 不同质量浓度纳米银对的杀菌情况
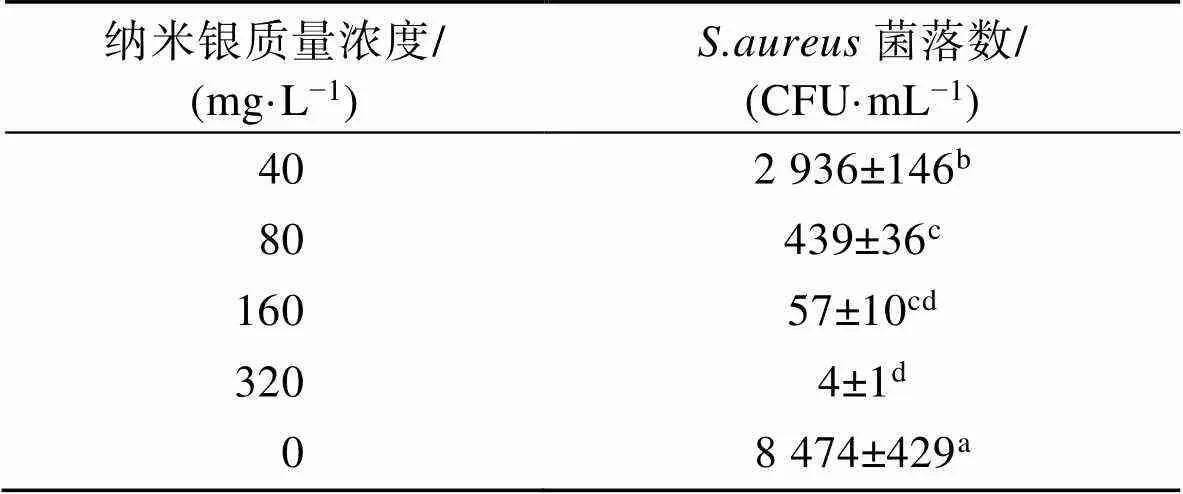
Tab.4 Sterilization of S.aureus by AgNPs of different concentrations
注:表中数据为平均值±标准差(=3),同一列中不同小写字母表示有显著性差异(<0.05)。
2.3.3 荧光染色实验
PI是一种DNA结合性染料,其激发和发射波长分别为536 nm和617 nm,产生红色荧光,但无膜通透性,不能透过活细胞膜,只能染死细胞。因此,在荧光显微镜下观察正常细胞不能着色,凋亡细胞(细胞膜破裂)呈红色荧光。的荧光染色结果见图8,的荧光染色结果见图9。纳米银材料处理后的,随着时间的增加。红色荧光数量与对照组相比明显增加。5 min后,死菌比例明显增多,表明越来越多的细胞膜遭到破坏。细胞死亡率逐渐增加,且出现部分溶解的现象。而在未经处理的对照组中,随着时间的增加,红色并未出现明显变化。也有类似的现象,经过120 min后死亡细胞明显增多。上述实验结果说明,制备的南瓜蒸煮液纳米银对和具备良好的杀菌效果。

图7 抑菌动力学曲线
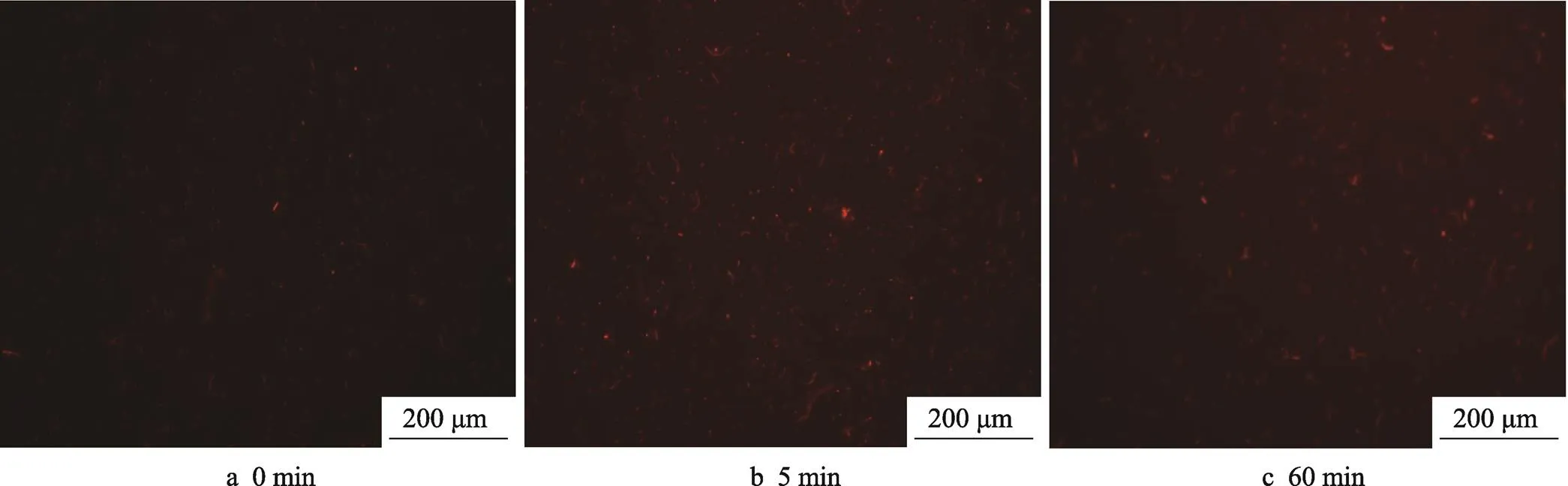
图8 E.coli荧光染色

图9 S.aureus荧光染色
制备的南瓜蒸煮液纳米银可能通过改变细菌细胞的形态和结构,使细胞失活,从而达到抗菌的作用。其可能的抗菌机制是AgNPs能够穿通细菌细胞壁,附着在细胞膜的表面,与细胞膜表面含硫蛋白质或含磷物质产生较强的相互作用,从而改变了细胞膜的通透性,并进一步影响细胞的呼吸功能。因此,相对于,革兰氏阴性菌由于细胞壁较薄而更易受纳米银影响,表现为抗菌性更好[25]。此外,AgNPs也可能穿过细胞膜进入细胞内,攻击呼吸链,阻碍细胞代谢和细胞分裂,促进细胞凋亡。
3 结语
以南瓜蒸煮液和AgNO3为原料,APG为表面活性剂,通过微波加热成功合成了纳米银水溶胶,进一步干燥得到了纳米银粒子。该纳米银粒子为球形,分散性和稳定性好,粒径小。该纳米银粒子对和均有较强的抑制和杀灭效果,对的MIC值和MBC值分别为5 mg/L和10 mg/L,对的MIC值和MBC值分别为40 mg/L和320 mg/L。
目前关于纳米银制备的方法层出不穷,从环保和可持续发展的角度考虑,应大力推广以植物提取物为代表的生物还原法制备纳米银。为了提高纳米银胶的稳定性,可以将生物还原法和微波辅助法结合使用。本研究一方面使南瓜得到了高值化利用,另一方面为AgNPs的绿色高效合成提供了新思路,所合成的AgNPs对革兰氏阴性和阳性细菌均有良好的抗菌效果,可用于抗菌食品包装。后续仍需对南瓜蒸煮液合成AgNPs的具体机理以及在食品包装中的应用效果进行深度研究。
[1] 罗晨, 董铮, 庄松娟, 等. 纳米银抗菌包装对虾仁冷藏过程中品质的影响[J]. 包装工程, 2018, 39(7): 60-64.
LUO C, DONG Z, ZHUANG S J, et al. The Effect of Nano-Silver Antibacterial Package on the Quality of Shrimp Meat during Cold Storage[J]. Packaging Engineering, 2018, 39(7): 60-64.
[2] ISMAIL A O, AJAYI S O, ALAUSA A O, et al. Antimicrobial and Antibiofilm Activities of Green Synthesized Silver Nanoparticles for Water Treatment[J]. Journal of Physics: Conference Series, 2021, 1734(1): 012043.
[3] ALKHULAIFI M M, ALSHEHRI J H, ALWEHAIBI M A, et al. Green Synthesis of Silver Nanoparticles Using Citrus Limon Peels and Evaluation of Their Antibacterial and Cytotoxic Properties[J]. Saudi Journal of Biological Sciences, 2020, 27(12): 3434-3441.
[4] ZHAO X X, WANG K, AI C, et al. Improvement of Antifungal and Antibacterial Activities of Food Packages Using Silver Nanoparticles Synthesized by Iturin A[J]. Food Packaging and Shelf Life, 2021, 28: 100669.
[5] ALI YAQOOB A, UMAR K, IBRAHIM M N M. Silver Nanoparticles: Various Methods of Synthesis, Size Affecting Factors and Their Potential Applications-A Review[J]. Applied Nanoscience, 2020, 10(5): 1369-1378.
[6] RAGHAVENDRA G M, JAYARAMUDU T, VARAPRASAD K, et al. Cellulose-Polymer-Ag Nanocomposite Fibers for Antibacterial Fabrics/Skin Scaffolds[J]. Carbohydrate Polymers, 2013, 93(2): 553-560.
[7] 姜宇, 李福艳, 刘冲冲, 等. 山楂提取物生物合成纳米银对四种常见水产病原菌的抑制作用[J]. 海洋与湖沼, 2016, 47(1): 253-260.
JIANG Y, LI F Y, LIU C C, et al. Biosynthezied Silver Nanopaticles Using Hawthorn Fruit Extract and Their Antibacterial Activity Against Four Common Aquatic Pathogens[J]. Oceanologia et Limnologia Sinica, 2016, 47(1): 253-260.
[8] 刘冲冲, 王磊, 徐慧, 等. 姜提取物生物合成纳米银抑菌活性的研究[J]. 食品与生物技术学报, 2017, 36(6): 590-597.
LIU C C, WANG L, XU H, et al. Antibacterial Study of Silver Nanoparticles Biosynthesized with Ginger Extract[J]. Journal of Food Science and Biotechnology, 2017, 36(6): 590-597.
[9] 朱炯霖, 李红, 秦圆, 等. 金银花提取物制备纳米银及其对织物的抗菌性能[J]. 大连工业大学学报, 2021, 40(5): 339-344.
ZHU J L, LI H, QIN Y, et al. Preparation of Nano Silver from Honeysuckle Extracts and Its Antibacterial Properties for Fabric[J]. Journal of Dalian Polytechnic University, 2021, 40(5): 339-344.
[10] 吴承宗, 魏亚楠, 戴昕彤, 等. 基于莲藕提取物生物合成纳米银及其抑菌活性研究[J]. 食品与发酵工业, 2023, 49(16): 253-260.
WU C Z, WEI Y N, DAI X T, et al. Biosynthesis of Silver Nanoparticles from Lotus Root Extract and Its Antibacterial Activity[J]. Food and Fermentation Industries, 2023, 49(16): 253-260.
[11] 郭锐, 张智刚, 刘慧宏, 等. 茜草根提取物纳米银的合成及其在羊毛织物上的应用[J]. 毛纺科技, 2021, 49(11): 28-32.
GUO R, ZHANG Z G, LIU H H, et al. Synthesis of Silver Nanoparticles Extracted from Madder Root and Its Application in Wool Fabric[J]. Wool Textile Journal, 2021, 49(11): 28-32.
[12] 何悦, 杜津, 任丹, 等. 利用柚子皮提取液制备具有抗氧化和抗菌性能的纳米银[J]. 食品与发酵工业, 2022, 48(23): 165-172.
HE Y, DU J, REN D, et al. Preparation of Silver Nanoparticles with Antioxidation and Antibacterial Properties Using Pomelo Peel Extract[J]. Food and Fermentation Industries, 2022, 48(23): 165-172.
[13] 王士苗, 智利红, 刘骏, 等. 12个南瓜品种果实营养成分含量的测定与分析[J]. 中国瓜菜, 2018, 31(7): 13-17.
WANG S M, ZHI L H, LIU J, et al. Determination and Analysis of Nutrient Content of 12 Varieties of Cucurbita Moschata Varieties[J]. China Cucurbits and Vegetables, 2018, 31(7): 13-17.
[14] 王海青, 阚红卫, 靳康, 等. 浙贝止咳颗粒镇咳祛痰及抗菌作用研究[J]. 中国实验方剂学杂志, 2011, 17(16): 207-210.
WANG H Q, KAN H W, JIN K, et al. Antitussive, Expectorant and Antibacterial Actions of Zhebei Zhike Granules[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2011, 17(16): 207-210.
[15] 秦静, 姜力文, 杨春苗, 等. 氧化石墨烯纳米银复合材料的制备及其抗菌性[J]. 环境化学, 2016, 35(3): 445-450.
QIN J, JIANG L W, YANG C M, et al. Preparation of Graphene Oxide? silver Nanoparticles and Its Antibacterial Activity[J]. Environmental Chemistry, 2016, 35(3): 445-450.
[16] ZHOU L, GU H, WANG C, et al. Study on the Synthesis and Surface Enhanced Raman Spectroscopy of Graphene-Based Nanocomposites Decorated with Noble Metal Nanoparticles[J]. Colloids Surf A, 2013, 430: 103-109.
[17] RYCENGA M, COBLEY C M, ZENG J, et al. Controlling the Synthesis and Assembly of Silver Nanostructures for Plasmonic Applications[J]. Chemical Reviews, 2011, 111(6): 3669-3712.
[18] 徐光年, 乔学亮, 邱小林, 等. 微波法快速制备单分散纳米银溶胶[J]. 稀有金属材料与工程, 2012, 41(3): 531-534.
XU G N, QIAO X L, QIU X L, et al. Rapid Preparation of Monodisperse Nano-Silver Colloids Using Microwave Irradiation[J]. Rare Metal Materials and Engineering, 2012, 41(3): 531-534.
[19] BALCIUNAITIENE A, VISKELIS P, VISKELIS J, et al. Green Synthesis of Silver Nanoparticles Using Extract ofL,L andvulgaris L, Physico-Chemical Characterization, Antimicrobial and Antioxidant Activity[J]. Processes, 2021, 9(8): 1304.
[20] 王若男. 黄精多糖的制备及在抗菌材料中的应用研究[D].芜湖: 安徽工程大学, 2023.
WANG R N. Preparation of Polygonati Rhizoma Polysaccharide and Its Application in Antibacterial Materials[D]. Wuhu: Anhui University of Engineering, 2023.
[21] HAGLAN A M, ABBAS H S, AKKÖZ C, et al. Characterization and Antibacterial Efficiency of Silver Nanoparticles Biosynthesized by Using Green Algae Enteromorpha Intestinalis[J]. International Nano Letters, 2020, 10(3): 197-205.
[22] SHAH Z, HASSAN S, SHAHEEN K, et al. Synthesis of AgNPs Coated with Secondary Metabolites of Acacia Nilotica: An Efficient Antimicrobial and Detoxification Agent for Environmental Toxic Organic Pollutants[J]. Materials Science & Engineering C, Materials for Biological Applications, 2020, 111: 110829.
[23] 魏思敏, 王英辉, 唐志书, 等. 大枣水提液还原制备纳米银材料及抗氧化和抗菌活性研究[J]. 天然产物研究与开发, 2020, 32(2): 182-189.
WEI S M, WANG Y H, TANG Z S, et al. Green Synthesis of Silver Nanoparticles Using Jujube Aqueous Extract and Evaluation of Their Antioxidant and Antibacterial Effects[J]. Natural Product Research and Development, 2020, 32(2): 182-189.
[24] BUSZEWSKI B, RAILEAN-PLUGARU V, POMASTOWSKI P, et al. Antimicrobial Activity of Biosilver Nanoparticles Produced by a Novel Streptacidiphilus Durhamensis Strain[J]. Journal of Microbiology, Immunology, and Infection, 2018, 51(1): 45-54.
[25] KIM J S, KUK E, YU K N, et al. Antimicrobial Effects of Silver Nanoparticles[J]. Nanomedicine, 2007, 3(1): 95-101.
Green Preparation of AgNPs by Pumpkin Cooking Liquid and its Antibacterial Properties
GAO Daxiang*, YANG Hetong
(Jiangsu Vocational College of Agriculture and Forestry, Jiangsu Jurong 212400, China)
The work aims to prepare nano-silver sol by microwave heating with pumpkin cooking liquid and AgNO3as raw materials and APG as surfactant to study its preparation process, performance and antibacterial effect. The preparation of AgNPs was optimized by single factor. UV-vis, TEM, EDS, and XRD were used to analyze the characteristic absorption peaks, morphology, structure and stability of the synthesized silver nanoparticles. The antibacterial properties of AgNPs againstandwere determined. The optimum technological conditions for preparation of AgNPs were as follows: in 40 mL of pumpkin cooking liquid, AgNO3initial concentration 1.2 g/L, pH value 13, microwave heating time 60 s. After optimization, the UV-vis spectra of the prepared AgNPs showed strong characteristic absorption peaks at 406 nm, and the EDS spectrum further confirmed the existence of AgNPs. AgNPs were spherical with an average particle size of 13.4 nm, small particle size and good dispersion and stability. The antibacterial test showed that AgNPs of different concentrations had strong inhibition and killing effect onand. The MIC and MBC ofwere 5 mg/L and 10 mg/L, respectively, and the MIC and MBC ofwere 40 mg/L and 320 mg/L, respectively. The AgNPs has antibacterial ability against G-and G+bacteria and has good application prospects in food packaging.
pumpkin cooking liquid; silver nanoparticles; antibacterial property
TB484
A
1001-3563(2024)05-0081-10
10.19554/j.cnki.1001-3563.2024.05.010
2023-12-04
句容市科技项目(ZA42201);江苏农林职业技术学院科技项目(2021kj57)
