羟基磷灰石/氧化石墨烯复合支架在骨缺损修复治疗中的研究进展
2024-03-19杨宁文何星
杨宁文, 何星
( 上海理工大学 材料与化学学院,上海 200093 )
骨骼是人体重要的机械支撑器官和造血免疫器官,骨组织这种特殊的结构具有很高的力学强度,但是随着年龄的增长和疾病的损伤影响,正常的骨组织可能会发生变化,形成难愈合的骨缺损。据世界卫生组织报告,全球每年大概新增200 万骨缺损患者,骨缺损治疗周期长,治疗费用昂贵,长期的药物和手术治疗给患者带来生理和心理上的巨大折磨,同样也给各国健康系统带来了沉重的负担。由各种骨疾病导致的骨缺损在临床治疗上一直是个难题,骨缺损部位的微环境比较复杂,治疗条件也更苛刻。骨组织工程技术的发展和应用为解决上述难题提供了有利的技术支持,为了更有效地治疗骨缺损,需要根据骨缺损的病理特征构建多功能化的复合材料支架,所构建的支架不仅要能够促进骨细胞的黏附生长,还要能调节骨缺损部位的病理环境,从而达到治疗和修复骨缺损的目的。骨基质实际是无机盐和胶原通过自组装形成的一种有序复合材料,钙盐不仅提高了基质的力学性能,同时还有助于骨细胞生长矿化相关信号的传导。目前,制备的氧化石墨烯/无机钙复合材料多是粉末状和膜状结构,无法有效地承载细胞的渗透和组织的生长。立体的连通结构有利于各种营养分子的相互转换,同时也可以促进细胞在支架上的生长和渗透;因此,构建三维的多孔结构对骨组织支架至关重要。
1 羟基磷灰石/氧化石墨烯(HA/GO)复合支架
HA/GO 复合支架是一种具有生物活性的生物材料,用于骨组织工程领域。它由HA 和GO 组成,结合了两者的优点。HA 是一种天然存在于骨骼和牙齿中的矿物质,具有良好的生物相容性和生物活性。它能够与人体的骨组织结合,促进骨细胞的生长和分化。然而,HA 本身的力学性能较差,不足以满足一些骨缺损修复的要求。GO 是一种具有高导电性、高强度和良好生物相容性的纳米材料。它可以增强复合材料的力学性能,有助于细胞的增殖和分化[1]。HA/GO 复合支架克服了单一材料的局限性,提供了一种具有优良力学性能和生物活性的生物材料。其粗糙的表面有利于骨细胞的附着和增殖,同时不具有明显的毒性。
1.1 HA/GO 复合材料制备方法
与其他复合体系一样,第二相增强体的均质化对HA/GO 的性能至关重要。当HA 和GO 结合时,复合制备过程中有两个主要目标。首先是将HA 均匀分散在GO 上,确保整个复合材料性能均匀;第二,加强HA 与GO 之间的连接。良好的混合和共混使复合材料易于分散,并能改善界面结合。目前为止,有多种HA/GO 复合材料的制备方法被报道。主要可以分为化学法和机械混合法,化学法又包括湿化学沉淀法、溶胶-凝胶法、水热法和电化学沉积法;机械混合则包括超声辅助法、探针超声波处理和机械搅拌等。
(1) 湿化学沉淀法[2-3]制备HA/GO,HA 为棒状且在GO 中具有良好的分散性,HA/GO 复合材料的TEM 图像如图1(a)所示。HA/GO 复合材料具有良好的成骨能力,可作为一种骨传导复合材料支持成骨细胞的黏附。与未包覆的GO 纳米颗粒相比,成骨细胞的穿透性较高。HA 表面功能化促进细胞附着和增殖以促进骨形成。此外,纳米HA 可防止GO 团聚,提高GO 的电学性能。
(2) 溶胶-凝胶(Sol-Gel)技术是一种简单、经济、有效的制备纳米HA 包埋GO 片杂化材料的方法,主要依赖GO 的亲水性和静电斥力。用这种方法合成的HA/GO 复合材料中的HA 为针状且分散性好,如图1(b)所示。Raucci 等[4]通过Sol-Gel 法合成了HA/GO 复合膜,这是一种很有前途的生物医学涂层,可用于骨移植和其他外科应用。
(3) Neelgund 等[5]和Ramadas 等[6]成功地采用水热法制备了HA/GO 复合材料。Yao 等[7]也做了类似的工作。经水热处理后的HA 具有圆柱状的形态,如图1(c)所示[5],合成的HA/GO 可以作为药物载体。水热处理的HA/GO 纳米复合材料不仅具有高度的生物相容性,而且具有力学性能改善的特点,可以作为植入生物材料在临床中应用。
(4) 电化学沉积或电泳沉积(EPD)主要用来生产生物陶瓷,适用于在复杂几何形状的衬底上制备经济实惠的涂层,是一种广泛用于陶瓷和生物材料的涂层技术[8]。Zeng 等[9]和Li 等[10]参与了采用电化学沉积方法合成HA/GO 复合涂层,TEM图像可以看出,合成的HA/GO 为片层状并且尺寸分布均匀。GO 的XPS 图谱3 种类型的碳峰分别位于284.8 eV、 286.8 eV 和288.1 eV, 分别属于C—C、C—O 和C=O 基团[11]。HA/GO 复合涂层的C1s 图谱中也检测到C—C 和C—O 基团。源于GO 和Ti 衬底在沉积过程中发生了化学反应[12]。在拉曼光谱中G 带对应于碳原子切向振动的石墨碳层的特征,D 带是描述石墨碳缺陷的典型标志[13]。两条带的比值强度(ID/IG)与GO 中的缺陷程度相关,比值越大,相对应的晶体缺陷越大[14]。GO 片的添加可能减少了涂层和Ti 基底之间热膨胀系数的失配最终导致HA/GO 涂层与基底结合紧密,HA/GO 复合材料的这种性质使其有望成为种植体涂层的候选材料[15]。
(5) 通过超声辅助合成的纳米棒HA/GO 复合材料是一种以GO 为模板、无毒且具有生物活性复合材料,其形态如图1(d)所示,研究表明,这种形态的HA/GO 复合材料促进了细胞增殖,可以用作骨缺损替代材料[16]。2017 年,Radha 等[17]合成了具有稳定界面的HA/GO 纳米复合材料,通过将HA 功能化到GO 表面,利用探针超声工艺制备HA/GO 纳米复合材料,该HA/GO 复合材料呈现出良好的力学性能、生物稳定性和相容性。通过超声辅助制备的HA/GO 复合材料中GO 表面的褶皱增加,不规则褶皱表面有助于机械锁定并增加HA/GO 的应力传递。这种无毒且生物相容的复合材料显示了骨整合能力和骨替代或修复材料的良好增殖[18]。
1.2 HA/GO 复合支架构建方式
目前制备的HA/GO 复合材料多是粉末状和膜状结构,无法有效地承载细胞的渗透和组织的生长。立体的连通结构有利于各种营养分子的相互转换,同时也可以促进细胞在支架上的生长和渗透;因此,构建三维的多孔结构对骨组织支架至关重要[19]。骨缺损支架的构建需要同时满足以下条件:(1) 良好的力学性能可以支持组织的形成,骨组织特殊的结构还要求支架有一定的塑形;(2) 可控的生物降解率;(3) 空间和表面适合细胞的迁移和生长;(4) 有连通的孔洞结构提供营养物质的输送和代谢物排泄。基于以上4 个条件,常见的构建HA/GO 复合支架的方法有冷冻干燥法、静电纺丝、3D 打印和自组装等。
1.2.1 冷冻干燥
冷冻干燥也称为溶剂亚冰点干燥或冻结干燥,通过冷冻溶液,降低环境压力使冷冻水升华来制备支架,这种方法制备的支架通常有均匀的多孔结构。均匀的孔结构不仅提高了支架的力学性能,同时更有利于细胞吸附贴壁生长。通过冷冻干燥GO、HA 和海藻酸钠(SA)混合物,获得了具有所需力学和生物特性的支架[20]。这种新型纳米复合支架的孔隙率超过85%,平均孔径大于150 mm;表现出明显的线弹性、塌陷平台和致密化状态,如图2(a)所示,这在多孔支架中很常见[21]。Nair等[22]通过使用冷冻干燥方法将GO 纳米薄片结合到明胶-HA 基质中,得到了均匀孔洞结构的明胶基GO/HA 支架,其形态如图2(b)所示,与冷冻干燥制备的SA 基GO/HA 的结构非常相似。

图2 不同构建方式HA/GO 复合支架形貌:(a) 壳聚糖基复合支架[21];(b) 明胶基复合支架[22];(c) 纳米纤维基复合支架[29];(d) 自组装法制备的HA/GO 复合支架[35]Fig.2 HA/GO composite scaffold morphology with different construction methods: (a) Chitosan based composite scaffold[21]; (b) Gelatin based composite scaffold[22]; (c) Nanofiber based composite scaffold[29]; (d) HA/GO composite scaffold prepared by self-assembly method[35]
1.2.2 静电纺丝
静电纺丝利用高压下产生的电场将聚合物液体从喷丝头中挤出,在收集器上形成聚合物纤维和多孔支架[23],这是一种成本低、效益高、用途广泛的方法来生成不同形状和大小的三维支架。图3 为一种典型的静电纺丝装置[24],电纺设备的典型设置由3 个基本元件组成:高压电源、与喷丝板连接的液池和金属收集器。静电纺丝的基本原理是高压电源与喷丝头相连,聚合物溶液通过喷丝头喷向研磨金属收集器,当连接到聚合物储存器的泵开始将液体挤出时,在喷丝头的尖端形成聚合物液体的液滴。当电场接通时,电荷将聚合物溶液拖向收集器。电场强度开始升高,聚合物溶液中的相互排斥作用及相反电荷的收集器和聚合物液体之间产生吸引力,这些现象导致最初形成的垂坠伸长[25]。如果电场强度继续增加,它将最终达到一个临界点,在该临界点,液体的表面张力将被静电力平衡,最终形成泰勒锥[26]。然后聚合物流体从锥体边缘喷出,喷丝头产生了直径很小的薄纤维[25]。当聚合物射流在电场内行进时,其弯曲不稳定性会增加到达收集器所需的时间和路径,从而导致射流变薄和溶剂蒸发。随后是一个高度不稳定的纤维射流区域,不稳定抖动导致射流弯曲和转向,最终产生射流破裂和分裂的现象,固体纤维沉积在收集器的表面形成支架[24,27]。

图3 一种典型的静电纺丝装置[24]Fig.3 A typical electrospinning device[24]
Liang 等[28]通过静电纺丝制备了由明胶/壳聚糖/HA/GO 组成的复合纳米纤维,并研究了溶液组成对纤维形态的影响;GO 的加入可以获得微观结构均匀光滑的纳米纤维,该纳米纤维支架具有良好的抗金黄色葡萄球菌和大肠杆菌的抗菌效果。Ma 等[29]使用静电纺丝法制备了纳米纤维聚乳酸(PLA)/HA/GO 支架,复合材料的SEM 图像如图2(c)所示,纤维呈现出松散的三维(3D)框架。两种纳米纤维之间的区别在于以下几个方面:整洁的PLA 纳米纤维直径均匀,表面相对光滑;在PLA中添加HA/GO 导致获得复合纤维的表面粗糙度增加。纤维中存在一些关节和突起,这与GO 和HA纳米颗粒的引入有关。
1.2.3 3D 打印
三维打印是一种优越的添加制造技术,用于打印具有定制形状、可控化学和孔隙率的支架[30]。虽然骨具有自愈合能力,但大面积的骨缺损或损伤不能完全自然愈合。应该加入支架或基质材料来帮助愈合过程。对于骨组织工程,3D 打印可用于从CAD 文件直接制造具有定制孔隙率的支架。该方法的优点是可以通过控制获得精细结构件、互连的孔隙率、没有与支撑结构的任何第二材料相关的污染问题及对金属和陶瓷生物材料的直接打印能力[31]。
钙磷陶瓷尤其是HA 由于其优异的生物活性、骨传导性和与骨的相似性而广泛应用于骨组织工程[32]。图4(a)显示了具有不同孔径的3D 打印支架的一些例子,图4(b)中的磷酸三钙(TCP)支架分别使用3D 打印和微波烧结制成,图4(c)显示了培养3 天后支架表面和孔壁上人胎儿成骨细胞(hFOB)细胞的形态,在孔洞中显示出良好的细胞黏附和细胞向内生长,表明支架是无毒的。图4(d)为纯TCP 支架表面形态和设计的大孔分布的二次电子显微镜(SEM)图像。如图4(e)纯TCP 和掺杂TCP 的样品中,4 周和8 周后,在植入物/宿主骨界面及互连的大孔和固有微孔内部观察到新的骨形成。图4(f)的组织学评估和组织形态学分析表明,治疗组(掺杂TCP 的复合支架)在早期促进了类骨样骨,随后促进了骨的完全矿化,这对于体内骨的快速愈合和矿化至关重要。
1.2.4 自组装
自组装是制备3D 支架最简单有效的方式,在冰浴中超声混合GO 和HA 纳米颗粒(nHA),形成均匀的悬浮液,然后将混合物在200℃下加热3 h以诱导其自组装[33]。该技术在不使用还原剂和有机溶剂的情况下将GO 还原为rGO,这可以最大限度地减少复合材料的细胞毒性,nHA/rGO 多孔支架的制备过程如图5(a)所示。首先将GO 悬浮液与nHA 混合,形成不同质量比的nHA 与GO 的均一水胶体。将混合物在200℃下加热3 h,以减少GO 片层并触发自组装过程,然后将反应混合物转化为稳定的水凝胶[34]。在反应过程中,GO转化为rGO,HA 被束缚在支架中。通过监测反应混合物中的Tyndall 效应,直观地证实了rGO 和nHA 的混合过程。在图5(b)中,由于Tyndall 效应,在反应前观察到一条鲜红光线,但当自组装发生后,在溶液中没有发现光散射。这一现象表明,rGO 和nHA 完全参与了水凝胶的形成。

图5 自组装制备HA/GO 复合支架[33]:(a) HA/GO 制备原理;(b) HA/GO 制备过程中的Tyndall 效应Fig.5 Self-assembly to prepare HA/GO composite scaffolds[33]:(a) HA/GO preparation principle; (b) Tyndall effect in HA/GO preparation process
水热法自组装所制备的支架是直径在20~100 µm范围内的多孔结构,能明显观察到nHA 质量比的增加会改变支架的形态。因此,nHA 与GO 的质量比是影响支架结构的一个重要参数,应进行准确控制,以确保骨修复的最佳生物相容性。nHA在rGO 的3D 结构内是稳定的,不会从复合支架中释放[35]。图2(d)的SEM 图像上的EDS 分析显示,支架表面上的碳元素的量随着nHA 比率的增加而减少,表明nHA 稳定的结合在石墨烯片的表面上,支架的结构稳定,适用于作为骨缺损的复合支架。
2 HA/GO 复合支架的力学性能
骨缺损用复合支架需要有较好的力学性能,支架的力学性能应与植入部位的力学性质相匹配,以小梁骨为参照,其抗压强度应大于5 MPa,抗压模量在45~100 MPa 之间[36]。支架的力学强度应足以抵抗生理应力,不能在组织细胞生长期间发生塌陷。支架的力学强度还会影响细胞内骨架产生的张力,这种张力对控制细胞的形状和功能起着重要的作用[37]。为了使支架符合骨组织工程的要求,必须对支架力学性能进行调节和控制[38]。
将HA/GO 与聚己内酯(PCL)混合,制备出HA/GO/PCL 复合支架[5]。PCL 及其纳米复合材料在不同HA/GO 混合载荷下的典型应力-应变曲线如图6(a)所示。从这些曲线中可以明显看出,PCL 纳米复合物的整体变形行为与纯PCL 相似,并且所有样品的产率都不一致,这归因于HA/GO混合物在PCL 聚合物基质中的完全分散,界面应力可以很好地从PCL 基质转移到中缝纳米片。当HA/GO 的浓度进一步增加时,PCL 纳米复合材料的拉伸强度逐渐降低,但仍然高于纯PCL。同时,可以观察到纳米复合材料的断裂伸长率随着HA/GO 含量的增加而增加。

图6 HA/GO 复合支架的力学性能:(a) 不同聚己内酯(PCL)含量的HA/GO 应力-应变行为[5];(b) 不同含量HA/GO 纳米压痕测试[18];(c) 不同海藻酸钠(SA)含量的应力-应变曲线[39]Fig.6 Mechanical properties of HA/GO composite scaffolds: (a) Stress-strain behavior of HA/GO with different poly(ε-caprolactone) (PCL) contents[5];(b) HA/GO nanoindentation testing with different contents[18]; (c) Stress-strain curves of different sodium alginate (SA) contents[39]
通过简单的溶液混合和冷冻干燥制备了的GO、HA 和SA 组成的新型多孔杂化纳米复合支架[39]。如图6(c)所示,从应力-应变曲线可以得到抗压强度(σe1*)和抗压模量(E*),前者由应力-应变曲线初始线性区域的线性回归确定,后者由E*与Δσ/Δε 回归曲线的交点确定。正如预期的那样,由于GO 和HA 具有更强的力学性能,HA/GO/SA纳米复合材料表现出比纯SA 高得多的压缩强度和压缩模量。
通过纳米压痕加载-卸载测试水热法自组装制备的具有不同含量的球形多孔羟基磷灰石(SHA)/GO 复合支架的力学性能。如图6(b)所示[18],随着 GO 含量的增加,SHA/GO 复合支架承受的载荷量增加,弹性模量和硬度也呈现出相同的趋势。SHA/GO-3 的弹性模量和硬度分别为(12.45±0.33) GPa 和 (686.67±26.95) MPa,高于其他样品。结果表明 GO 对 SHA/GO 复合支架的力学性能有影响。所制备的复合材料的力学性能得到一定增强,在生物医学如合成骨移植材料或植入物涂层中具有很大潜力。
3 HA/GO 复合支架的生物相容性
3.1 细胞毒性实验
小鼠胚胎成骨细胞前体细胞(MC3T3-E1)在纯GO 和棒状羟基磷灰石(RHA)-1.5/GO 上培养1、3和5 天后,通过透射光学显微镜评估细胞毒性。用噻唑蓝检测(MTT)法检测不同材料表面生长的MC3T3-E1 细胞的黏附和增殖活性[40],图7(a)为MTT 分析结果,MC3T3-E1 细胞在纯GO 和RHA/GO 复合材料上具有良好的生长状态,这为细胞黏附提供了更合适的表面,对细胞扩散具有有益的影响。图7(h)显示了MC3T3-E1 细胞在共培养1、3 和5 天后在纯GO、SHA-1.5/GO 和对照样品上的增殖情况,随着培养时间的延长,每个样品的细胞增殖都明显高于培养初期(p<0.05,p为显著性水平);3 天和5 天后,SHA-1.5/GO 底物上的细胞明显高于其他两种底物[18]。

图7 HA/GO 复合支架的细胞毒性[2,4,18,33,40]:(a) 小鼠胚胎成骨细胞前体细胞 (MC3T3-E1)在不同材料上的噻唑蓝检测 (MTT)检测结果;(b) Saos-2 成骨样细胞在不同材料上的细胞增殖率;(c) 人骨髓间充斥干细胞 (hMSCs)在不同材料上的细胞活性;(d) 人骨肉瘤细胞(MG-63)在不同材料上的增殖情况;(e) hMSCs 细胞代谢情况;(f) 不同HA 含量的复合材料形貌;(g) MC3T3-E1 细胞形态;(h) MC3T3-E1 细胞的增殖情况;(i) 培养不同天数MC3T3-E1 细胞细胞增值状况Fig.7 Cytotoxicity of HA/GO composite scaffolds[2,4,18,33,40]: (a) 3-[4, 5-dimethylthiazol-2-yl]-2, 5-diphenyltetrazolium bromide (MTT) monitoring results of mouse osteoblast (MC3T3-E1) cells on different materials; (b) Cell proliferation rate of Saos-2 osteoblast like cells on different materials; (c) Cellular activity of human mesenchymal stem cells (hMSCs) cells on different materials; (d) The proliferation of Human osteosarcoma cells (MG-63) cells on different materials; (e) Metabolism of hMSCs cells; (f) Morphology of composite materials with different HA contents; (g) MC3T3-E1 cell morphology;(h) The proliferation of MC3T3-E1 cells; (i) Cell proliferation status of MC3T3-E1 cells cultured for different days
人成骨肉瘤细胞(Saos-2)是众多人类肿瘤细胞系中的一种,该细胞在免疫抑制小鼠中不致瘤,细胞表达表皮生长因子EGF 受体、转化生长因子β 受体(1 型和2 型)[41]。培养24 h Saos-2 成骨样细胞的细胞增殖率如图7(b)所示,细胞增殖率随样品浓度的增加而增加。GO 的官能团促进了细胞在其表面的黏附,从而提高了细胞的增殖率。HA/GO 表现出比GO 更好的增殖能力,与GO 结合的HA 可能在成骨过程中赋予额外的特征和功能。
人骨髓间充斥干细胞(hMSCs)是一种能分化成骨细胞、脂肪细胞和软骨细胞的多能干细胞,具有强大的增殖潜力和免疫调节能力,被广泛应用于骨组织工程、细胞治疗和基因治疗[42]。用Alamar Blue Test 检测细胞在不同材料(HA、GO、HA/GO)上的增殖情况[4]。图7(e)显示了培养7、14 和21 天后材料对hMSCs 代谢活性的影响[2]。图7(c)结果表明,在体外培养过程中,hMSCs 的数量随着培养时间的延长而显著增加,尤其是在HA/GO 上的细胞增殖能力优于GO 材料。在HA/GO 复合支架中,细胞增殖速率略有下降,但降幅低于空白对照组。表明该材料无毒,不影响细胞增殖,具有良好的生物相容性。
人骨肉瘤细胞(MG-63)通过CCK-8 分析在纯Ti、纯HA 和GO/HA 涂覆的Ti 样品上培养的活力和增殖。如图7(d)所示,细胞数量随培养时间的延长而增加。培养1 天和3 天后,纯Ti 和纯HA之间的细胞活力没有显著差异,而复合涂层组中MG63 细胞的细胞活性(OD)值在统计学上更高。此外,随着这些复合涂层中GO 浓度的增加,细胞活力也相应增加。第1 天和第5 天的数据表明,100 µg/mL GO/HA 复合涂层上的活细胞总数高于其他实验组,随着细胞培养时间的增长,HA/GO复合涂层上细胞增殖速率远高于其他组,证明HA/GO 细胞毒性较低,有利于细胞生长。
3.2 细胞增殖与附着
图8 为HA/GO 复合支架的细胞增殖附着实验。从图8(a)中可以清楚地看到,20%nHA 浓度下nHA/rGO 支架的大鼠骨髓间充质干细胞(rBMSCs)的活细胞密度在第4 天和第8 天显著高于其他支架。从支架的定量细胞分析中也获得了类似的结果。20%nHA/rGO 支架细胞状态与其他支架相比,生长最好,细胞密度最高。20%nHA/RGO 上的细胞培养8 天后,支架完全被细胞覆盖,而其他支架仅达到20%~70% 的覆盖率。通常,支架上的细胞增殖率主要取决于其组成和结构。rGO 基支架的形态随着HA 质量比的增加而变化,rGO 与HA的质量比影响细胞的增殖率[33]。
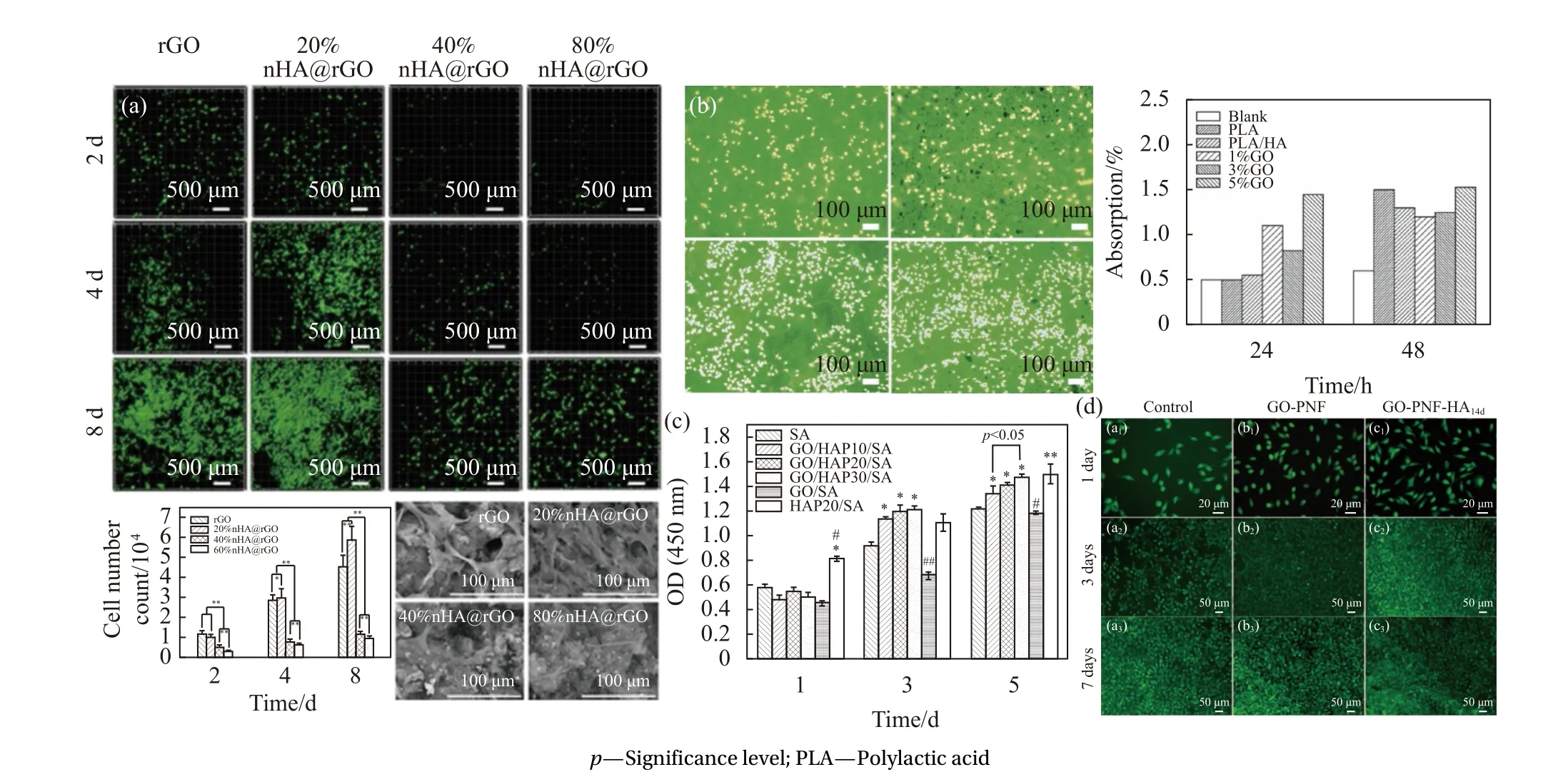
图8 HA/GO 复合支架的细胞增殖附着实验:(a)大鼠骨髓间充质干细胞(rBMSCs)活细胞密度[33];(b) MC3T3-E1 细胞增值情况[29];(c) 人骨肉瘤细胞(MG-63)细胞增值情况[39];(d) MC3T3-E1 细胞增值情况[50]Fig.8 Cell proliferation and attachment assay for HA/GO composite scaffolds: (a) Rat bone mesenchymal stem cells (rBMSCs) live cell density[33];(b) MC3T3-E1 cell proliferation status[29]; (c) Human osteosarcoma cells (MG-63) proliferation status[39]; (d) MC3T3-E1 cell proliferation status[50]
由于PLA/HA/GO 纳米纤维组成的3D 支架特有的粗糙表面,有利于促进细胞黏附和生长[43]。使用荧光显微镜测定了MC3T3-E1 细胞在整洁的PLA 支架和PLA/HA/GO 支架上的生长,如图8(b)所示。随着培养时间的增加,MC3T3-E1 细胞在两个支架上很好地黏附和增殖。此外,与整洁的PLA 支架相比,在48 h 后,PLA/HA/GO 支架上生长的细胞数量更大,这个结果表明了在PLA 中加入HA/GO 更有利于细胞生长[29]。
如图8(c)所示[39],CCK-8 结果表明,与纯SA和GO/SA 纳米复合材料相比,GO/HAP/SA 纳米复合材料具有促进细胞增殖的作用;将MG-63 细胞接种于不同支架上培养1、3、5 天后,用CCK-8 比色法检测细胞活力和增殖能力。支架的光密度(活细胞总数)随着培养时间的延长而增加,HA 的掺入可显著促进细胞的增殖,且这种促进作用与HA 的含量有关。这是由于HA 具有显著的生物相容性、骨传导性和无毒性,可以促进成骨细胞在HA 生物聚合物支架上的附着、增殖和分化[44-46]。SEM 显示孔壁表面粗糙度增加,由于粗糙度为细胞提供了更大的附着表面积,从而促进了细胞的黏附、扩散和增殖[47-48]。此外,在HA/SA复合材料中加入GO 并没有引起细胞活力的显著变化。这是由于GO 和HA 都具有良好的生物相容性,而且杂化纳米复合材料中GO 的含量较低。GO/HA/SA 复合支架比纯SA 和GO/SA 具有更好的细胞行为[49]。Wang 等[50]制备了一种基于自组装肽纳米纤维(PNFs)合成的GO-PNF-HA 复合支架,图8(d)细胞测试实验表明,所制备的GO-PNF-HA 复合支架促进了MC3T3-E1 细胞的黏附与增值。
3.3 组织相容性
细胞实验不足以评估所得到的支架在活体内应用后对生理功能的影响,研究支架在生物体内的组织相容性是有必要的。为了直观地显示支架的活体组织相容性,2021 年,陈何维等[51]构建了一种GO/HA/Mg(OH)2复合涂层,兔股骨髁骨折模型的X 射线扫描显示,GO/HA/Mg(OH)2复合涂层的螺钉周围术后3 周时,多类骨密度影像生成,说明植入体周边的新生骨组织逐渐增多,出现了较显著的骨生长现象,组织学切片染色观察发现,空白组螺钉在体内降解迅速,术后4 周仅残余少量材料,且随着螺钉降解,植体周边并未有明显骨组织长入。而GO/HA/Mg(OH)2复合涂层改性后的螺钉组,术后4 周仍保持了较好的材料完整性,且随着螺钉降解,植入体周边出现了大量的新生骨组织,有明显的骨生长迹象,表明复合涂层的构建能够显著提升螺钉的体内成骨活性。在大鼠糖尿病模型中,骨缺损部位植入HA/rGO 复合支架,在HA/rGO 移植5 周后提取支架。切片支架染色以检测肥大和纤维化。图9(d)中,空白组和20%HA/rGO 组的患者均未检测到明显的增生和水肿。还发现支架被疏松的结缔组织包围并分隔成大小不等的隔间,显示出与宿主组织的良好结合。从结缔组织截面可以看出,支架和表皮之间的界面处存在胶原纤维囊,表明对植入的生物材料有良好的身体反应[52]。组织学结果显示,HA/rGO 皮下植入后,支架不会引起任何严重的不良反应,因此证实了其在活体骨缺损修复中的生物安全性。
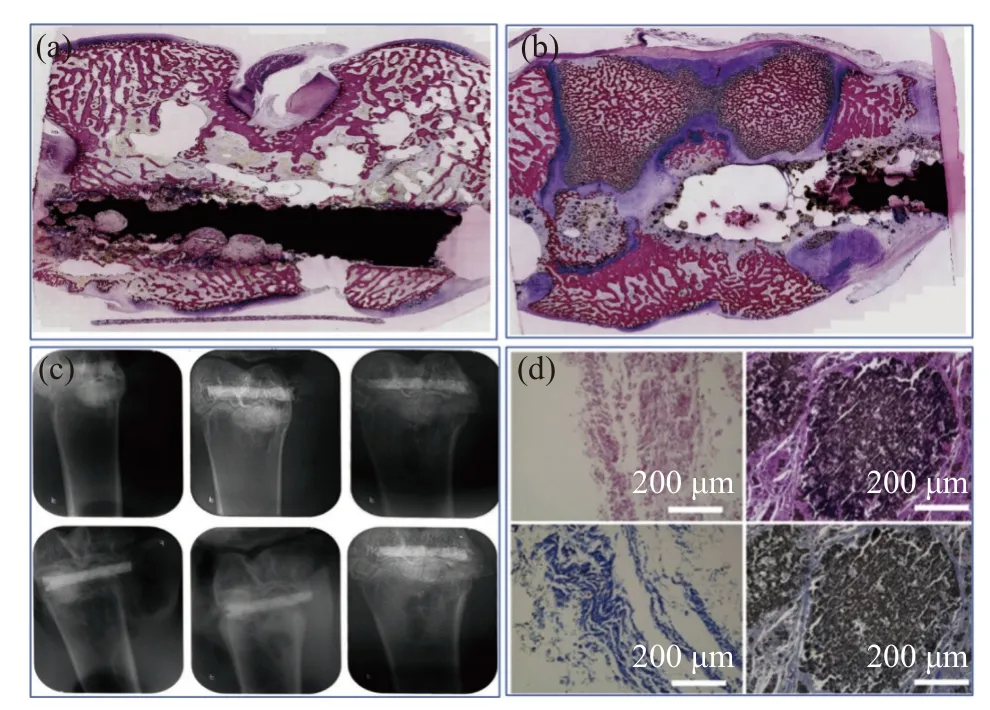
图9 HA/GO 复合支架的组织相容性[51]:(a) 螺钉植入3 周后;(b) 螺钉植入4 周后;(c) 植入螺钉后影像图;(d) 结缔组织截面图Fig.9 Histocompatibility of HA/GO composite scaffolds[51]: (a) After 3 weeks of screw implantation; (b) After 4 weeks of screw implantation; (c)Image after screw implantation; (d) Cross section of connective tissue
4 HA/GO 复合支架存在的问题和挑战
理想的骨缺损用复合支架材料是要能被宿主骨组织逐步吸收替代,最终与自体骨牢固愈合。材料学、生物医学、分析学的发展给骨组织工程带来了深远的影响,仍有许多问题需要研究:
(1) 单纯的GO 材料可能具有力学性能不匹配、体内降解速度缓慢和愈合延迟等缺点。单纯的HA 支架材料,其结构和功能与人体骨组织差距很大,存在力学强度差、降解产物堆积引起骨组织微环境变化不利于组织愈合等缺点;
(2) HA 与GO 的复合支架,虽然结构和组成接近骨组织,但要真正在体外预构天然骨组织的纳米结构,受到目前材料制作工艺水平的限制,难以达到临床需要的水平;
(3) 应力对细胞作用的传递机制仍然不清楚。不能回答什么细胞在什么力学条件下能形成自体组织的问题。
5 结 论
本文介绍了羟基磷灰石/氧化石墨烯(HA/GO)复合材料的合成机制和制备方法,详述了HA/GO复合支架在骨缺损疾病中的研究进展:
(1) 使用不同的合成方法可以在GO 上制备出针状、棒状、片层状等不同形态的HA;不同形态的HA/GO 在治疗骨缺损领域有不同的应用;
(2) 国内外众多的HA/GO 的体内体外生物实验表明,HA/GO 对骨细胞没有明显的毒性,以HA/GO 为基底构建的支架通常具用均匀的多孔结构,有利于骨细胞增殖;
(3) 复杂的骨组织结构要求治疗骨缺损的支架必须有优良的力学性能和生物性能,因而需要通过对HA/GO 复合支架深入的研究和对其结构和组分精微的控制来探寻作用机制,以便设计制造出更多降解率可控、力学性能好、适合骨细胞生长的HA/GO 复合支架,为骨缺损疾病提供一个可能更加有效的治疗方法。
