细胞外ATP激活受体P2X7在骨质疏松症中的作用机制
2024-03-19张浩龙赵瑞潘静齐雅茜雷新宇白金霞张忠文王薇张浩令宋志靖
张浩龙 赵瑞 潘静 齐雅茜 雷新宇 白金霞 张忠文 王薇 张浩令* 宋志靖,5*
1.马来西亚理科大学高级医学和牙科研究所,马来西亚 槟城 13200
2.甘肃中医药大学中医临床学院,甘肃 兰州 730000
3.甘肃中医药大学针灸推拿学院,甘肃 兰州 730000
4.甘肃中医药大学公共卫生学院,甘肃 兰州 730000
5.敦煌医学与转化教育部重点实验室,甘肃 兰州 730000
随着全球人口逐渐步入老龄化,骨质疏松症已成为全球范围内的一大公共卫生挑战[1]。这种疾病表现为骨密度减低、骨微结构破坏,骨折风险增加[2]。当前,针对骨质疏松症的治疗策略主要包括药物治疗,如抗骨吸收剂(双膦酸盐、利塞膦酸钠、伊班膦酸盐和唑来膦酸等)、生活方式的调整(增加钙和维生素D的摄入、保持适当的运动)以及定期进行骨密度检查等[3-4]。然而,这些治疗手段大多仅能缓解症状,并未能在根本上改变疾病的进程。因此,探索新的治疗靶点以开发更为有效的治疗策略,已然成为当前研究的关键方向。
近年来,作为由细胞外腺嘌呤核苷三磷酸(adenosine-triphosphate,ATP)激活的离子通道,P2X7受体在骨质疏松症的发展过程中,特别是在骨吸收和破骨细胞功能方面,已被广大科研工作者高度认可[5]。Kvist等[6]在2017年证实,在骨质疏松小鼠模型中,消除P2X7受体可以预防炎症性骨质流失,同时维持其骨强度。Lu等[7]发现敲除P2X7受体可以通过调节自噬和Ca2+/钙黄素/NFATc1信号通路来抑制破骨细胞的分化,进而抑制骨质疏松症的发生。因此,P2X7受体有可能成为骨质疏松症治疗的新靶点。本文致力于深入探讨P2X7受体在骨质疏松症中的作用,以及其作为免疫系统与骨质疏松症之间联系的角色,为骨质疏松症的新型治疗策略提供新的视角和启示。
1 P2X7对破骨细胞和成骨细胞的影响
P2X7受体在骨骼相关疾病中扮演着至关重要的角色,特别在破骨细胞与成骨细胞的功能调节上显得尤为突出。在破骨细胞中,P2X7受体的活化能够诱导氧化应激反应,启动NF-κB(核因子激活的B细胞的κ-轻链增强)信号通路,并推动破骨细胞前体细胞的分化,从而强化骨质吸收活动。在成骨细胞中,P2X7受体能够激发其增殖和分化,进一步促进骨质的矿化过程。然而,持久或过度的活化可能诱发细胞凋亡,对成骨细胞产生负面影响。因此,作为骨骼代谢的核心分子,P2X7受体在维持骨骼健康方面具有至关重要的价值。
1.1 P2X7对破骨细胞的影响
P2X7受体在破骨细胞的活动中发挥着核心作用,其活化能够刺激破骨细胞加强对骨质的吸收。在响应炎症部位释放的刺激或对机械刺激的反应时,P2X7核苷酸受体能够通过NF-κB来调控破骨细胞的生成和活性[8-9]。然而,P2X7受体的过度活化会导致骨质吸收或骨质丧失从而诱发骨质疏松症和其他骨骼相关疾病[10]。例如,Zha等[11]的研究揭示了肿瘤坏死因子-α(TNF-α)可以通过磷脂酰肌醇3-激酶/丝氨酸/苏氨酸激酶(PI3k/Akt)信号通路增强P2X7受体以及NF-κB配体受体激活剂(receptor activator ofnuclear factor kappa-B ligand,RANKL)的表达,促使骨髓间充质干细胞(BMSCs)向破骨细胞的分化,加速骨质的损失并诱发绝经后妇女的骨质疏松症。此外,在长期或高剂量的铬金属暴露下,P2X7的活化通过上调PI3K/AKT通路抑制成骨细胞活性并刺激破骨细胞生成诱发骨质疏松症[12]。阻断P2X7受体可以抑制TNF-α促进的破骨细胞分化,明显延缓骨质疏松症的进展[7]。研究表明,敲除P2X7受体可调控自噬、Ca2+/钙黄素/NFATc1信号通路、MAPK信号通路来抑制破骨细胞的分化[13-14]。Hwang等[15]敲除P2X7受体可抑制溶血磷脂酸(LPA)刺激的破骨细胞直径和骨吸收能力。因此,以P2X7受体作为药物靶点,通过抑制P2X7可以降低破骨细胞的活性,为骨质疏松症等骨骼疾病的治疗开辟新的路径。
总的来说,P2X7受体的激活可以促进破骨细胞的生成。然而,关于细胞外ATP在调控骨吸收中的重要作用存在着矛盾的证据。细胞外高浓度ATP既有可能诱发骨吸收,也可能通过启动细胞凋亡来降低骨吸收。此外,细胞内ATP水平对破骨细胞的生存和再吸收具有积极的调节作用(图1)[16-18]。

图1 P2X7激活调节破骨前体细胞和破骨细胞的作用机制Fig.1 Mechanism of P2X7 activation regulating the function of osteoclast precursors and osteoclasts
1.2 P2X7对成骨细胞的影响
成骨细胞是骨骼形成和矿化的关键细胞[19]。在成骨细胞的生物学功能中,P2X7受体发挥着重大的影响。P2X7受体的激活能够刺激成骨细胞的增殖和分化,进一步推动新骨的生成和骨矩阵的矿化,但过度激活可能对成骨细胞产生负面影响。一些研究指出,长期或过度激活P2X7受体可能导致成骨细胞的过度增殖以及细胞凋亡。如长期镉暴露激活P2X7,通过下调PI3K/AKT信号通路抑制BMSCs和骨髓单核细胞(BMMs)向成骨细胞的分化,并促进成骨细胞凋亡,从而诱发骨质疏松症的发生[12]。因此,P2X7受体活动的平衡在维护骨骼健康中起着至关重要的作用。失衡的P2X7受体活动对于成骨细胞的抑制作用,使其成为了在治疗骨骼疾病和骨质疏松症等疾病中的潜力靶点。例如,抗菌肽LL37 (Human cathelicidin,Ropocamptide)通过P2X7受体和MAPK信号通路抑制炎症细胞因子白细胞介素-1β(IL-1β)、TNF-α和RANKL的表达,降低脂多糖(LPS)诱导的成骨抑制作用[20]。低强度脉冲超声(LIPUS)可以诱导细胞外ATP通过P2X7受体及其下游的信号通路,促进人类间充质干细胞(hMSCs)的成骨分化[21]。然而,关于如何精确调控P2X7受体以优化骨骼健康,科研人员仍需要进行更深入的研究。
成骨细胞的发育源自间充质干细胞(MSCs),在此过程中,内源性ATP的释放能够激活P2X7受体,从而推动MSCs向成骨细胞的分化。细胞外的ATP通过水解生成ADP/AMP和焦磷酸(PPi),这两者对成骨细胞的功能产生抑制作用,而内源性ATP(无论是基础状态还是机械刺激诱导的)则具有促成骨效果。P2X7受体信号能够触发一系列下游事件[前列腺素E2(PGE2)的合成/释放、磷脂酸(LPA)的合成/释放,以及丝氨酸/苏氨酸激酶(ERK1/2)的激活],增强成骨细胞的分化并促进骨组织形成。机械刺激导致ATP的释放,通过激活P2X7受体,以此来增强受体介导的成骨功能。对于P2X7受体的瞬时激活,其可通过激动剂介导,促进成骨细胞的分化和基质矿化;然而,持续的刺激会导致细胞外ATP积累,进而诱发细胞凋亡,呈现出抗成骨性(图2)[8,13,22-23]。
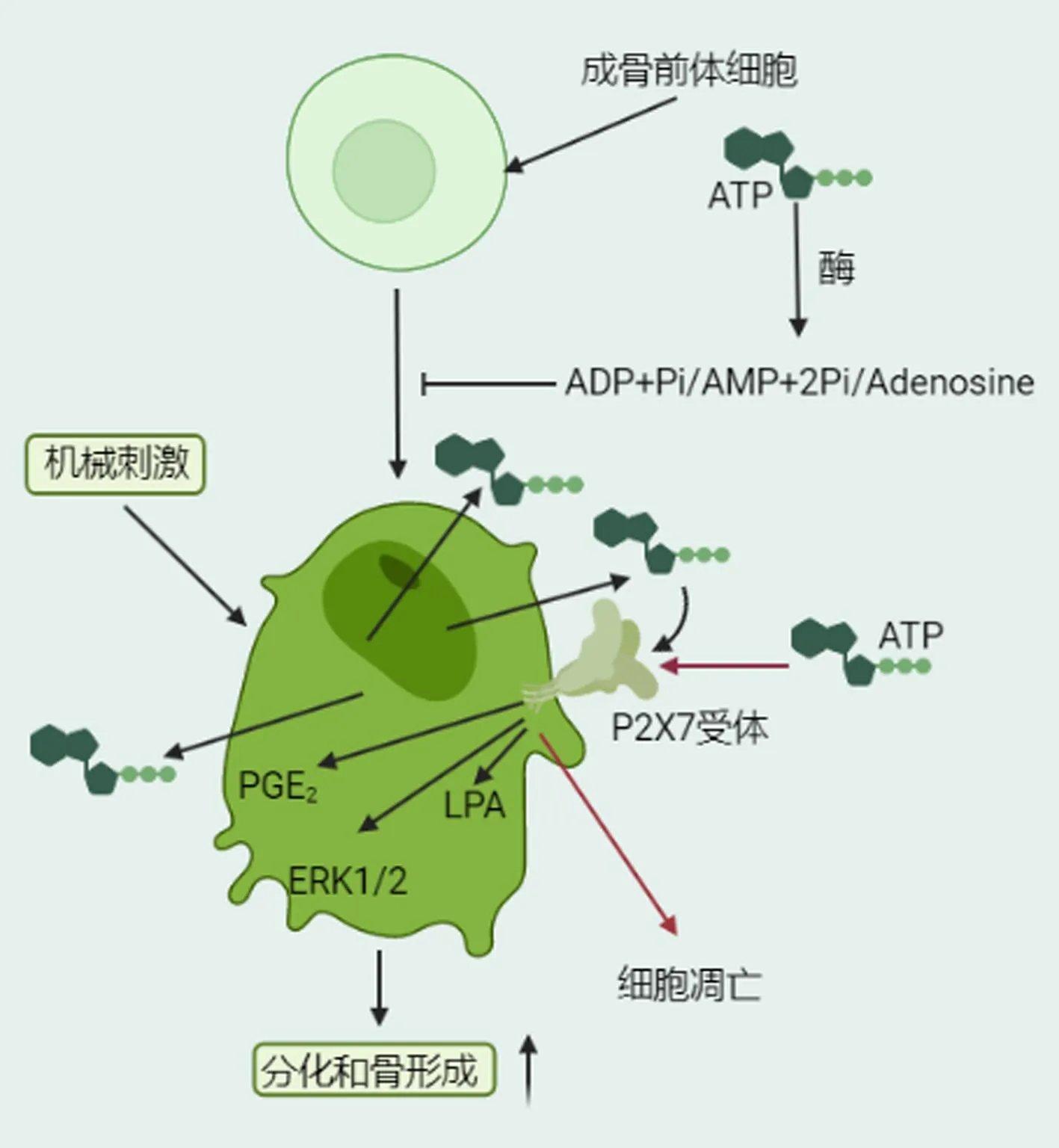
图2 P2X7激活调节成骨前体细胞和成骨细胞的作用机制Fig.2 Mechanism of P2X7 activation regulating the function of osteoblast precursors and osteoblasts
2 P2X7作为免疫炎性系统和骨质疏松症之间的纽带
2.1 P2X7与慢性炎症性骨质疏松症
P2X7受体是一种由ATP激活的离子通道,存在于各类细胞类型中,尤其在免疫细胞(如巨噬细胞和淋巴细胞等)中表达量较高[24]。此类受体在多种细胞生理活动中,如信号传导、炎症反应、细胞增殖与凋亡,均发挥着决定性的作用。近期的研究揭示了P2X7受体在慢性炎症性骨质疏松症发展过程中扮演着关键角色[25]。慢性炎症性骨质疏松症是一种由持久的炎症状态引发的骨质流失疾病,常伴随发生于类风湿性关节炎和炎症性肠病等慢性炎症疾病中。在这类疾病的发展过程中,炎症细胞和细胞因子的过度活动导致骨骼重塑过程的失衡,即破骨细胞的骨吸收活动超过了成骨细胞的骨生成活动,从而引发了骨质疏松症[6]。
P2X7受体对慢性炎症性骨质疏松症的影响主要表现在两个方面:一是调节炎症反应,二是直接影响骨骼细胞。首先,P2X7受体可以调控炎症细胞的活性和细胞因子的生成,如TNF-α、白介素-1(IL-1)和白介素-6(IL-6),参与炎症反应。这些细胞因子可以直接刺激破骨细胞的形成和活化,加快骨吸收[26]。例如,高浓度的TNF-α可以通过PI3K/Akt信号通路,上调BMSCs中的P2X7受体表达,促进BMSCs向破骨细胞的分化,进一步加强骨吸收,加剧骨质疏松症的发展[7]。另一方面,低浓度的TNF-α(1~5 ng/mL)可以通过NF-κB信号通路促进成骨细胞的分化,同时抑制破骨细胞的分化[27]。同时,炎症反应会引发RANKL分泌增加,进一步促进破骨细胞的分化和功能。除上述细胞因子外,其他细胞因子如白介素-12(IL-12)、白介素-18(IL-18)、白介素-33(IL-33)和干扰素α2(IFN-α2)可以抑制破骨细胞的分化,抑制骨质流失[23]。然而,对于P2X7受体如何在微观层面上影响这些过程,以及如何有效利用这些机制来开发新的治疗策略,仍需要进一步的研究。
炎症过程中,大量ATP的释放激活免疫细胞以及破骨细胞和成骨细胞上的P2X7受体。当炎症部位的组织或细胞受到损伤时,释放出的ATP可激活骨细胞上的P2X7受体。同样,炎症部位的单核细胞等免疫细胞的P2X7受体会被细胞或组织损伤释放的ATP激活。这些细胞上的P2X7受体激活会诱导K+流出和NALP3炎性体激活,导致促炎细胞因子IL-1、IL-6、IL-1β和TNF-α的加工和释放。这些因子通过PI3k/AKT途径促进单核细胞与破骨细胞的融合,进而推动骨的吸收。同时,增强成骨细胞中的RANKL表达可促进破骨细胞形成并加速骨吸收。此外,一些炎症细胞因子(如IL-12、IL-18、IL-33)可抑制破骨细胞,促进成骨细胞分化,抑制骨质流失(图3)[8,13,28]。
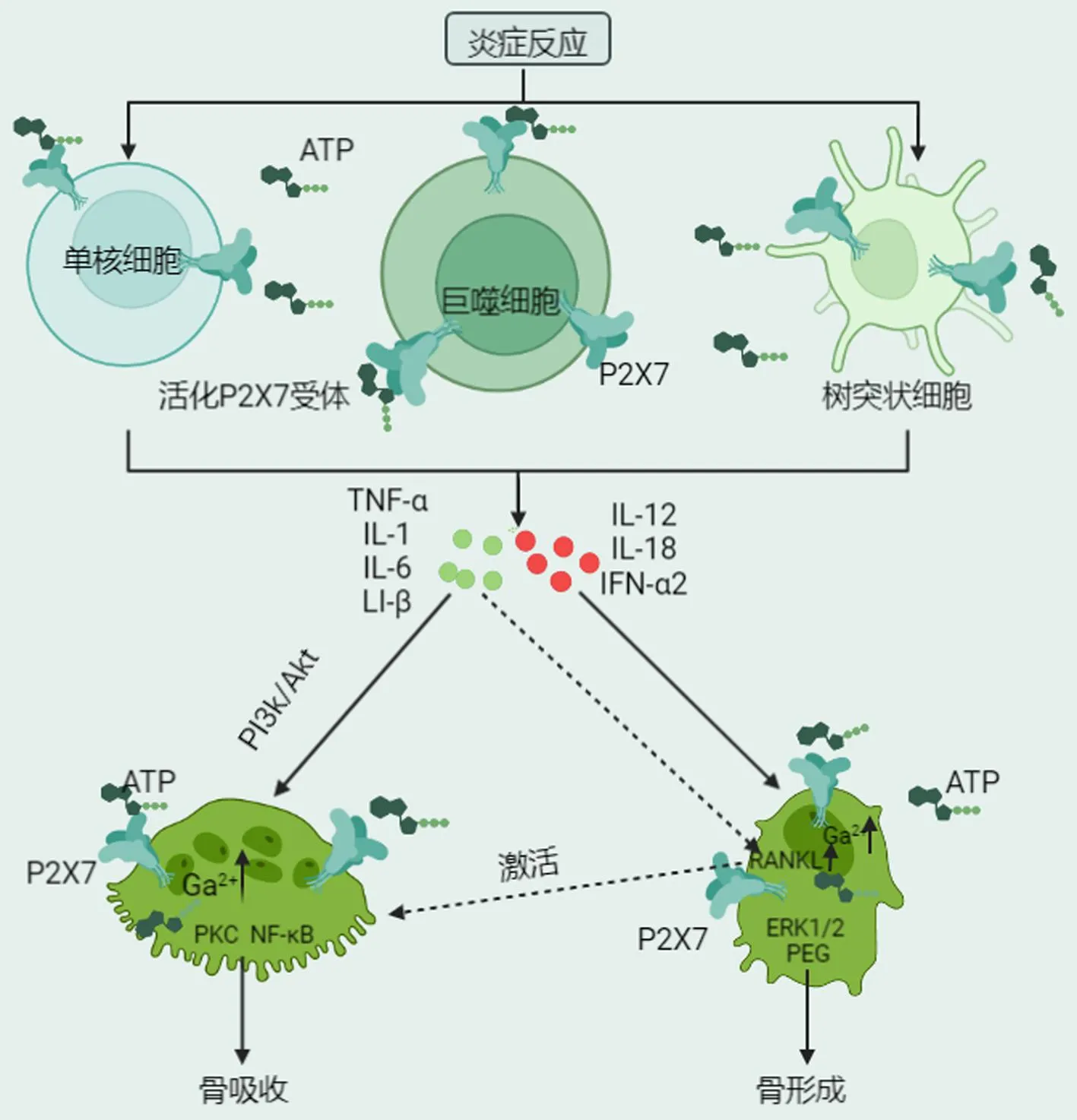
图3 P2X7与慢性炎症性骨质疏松症作用机制Fig.3 Mechanism of P2X7 in chronic inflammatory osteoporosis
2.2 P2X7与免疫系统介导的骨质疏松症
免疫系统在骨质疏松症的发展过程中扮演着重要的角色,尤其是免疫细胞和炎症因子对骨质调控的作用不容忽视。感染或疾病所引发的炎症,或者免疫功能失调导致的病理性问题,都可能对骨质产生破坏性的影响,从而增加患者骨质疏松和骨折的风险。例如,在自身免疫力下降的情况下,由于CD4+细胞的功能出现问题且数量有所减少,其对骨保护素(OPG)的共刺激作用相应减弱,从而导致OPG的生成量下降。这会使RANKL与OPG的比值增加,提升破骨细胞的活性,加速骨质吸收,进而提高骨质疏松症的风险[29]。细胞外的ATP通过激活P2X7受体-NF-κB(p65)信号通路,促进树突状细胞的成熟,并同时释放炎症因子如γ-干扰素 (IFN-γ)和IL-12[30]。此外,树突状细胞的P2X7受体的激活也会产生IL-1β和IL-18等细胞因子,进一步增强炎症反应[31]。IL-18和IL-12的释放抑制破骨细胞活动,同时促进成骨细胞的分化,从而有助于预防骨质流失[13-15,28]。
2.3 P2X7基因多态性与骨质疏松症
编码P2X7受体的基因P2RX7已被证实存在众多形态变异,这些变异可能对P2X7受体的功能产生重大影响,并可能与多种疾病的发病风险紧密相关。关于P2X7基因多态性与骨质疏松症关系的研究尚属初级阶段,但P2X7基因多态性影响骨骼细胞,包括成骨细胞和破骨细胞的活动已被证实。Wang等[32]研究结果表明,P2X7R rs3751143CC基因型以及rs1718119 G-rs2230911 G-rs3751143C单倍型与骨质疏松症风险增加存在显著关联。同时,P2X7R rs3751143与ER-α PvuⅡ两个位点的相互作用使中国绝经后妇女对骨质疏松症的易感性显著增加。Xu等[33]的研究也揭示了P2X7R rs3751143功能多态性可能对中国绝经后妇女的骨质疏松症易感性产生影响。Jrgensen等[34]发现骨质流失率与Arg307Gln氨基酸替代显著相关,携带这种多态性杂合子的个体骨质流失率增加40%。此外,携带Ile568Asn变异等位基因也能增加个体骨质流失,加速骨质疏松症的发生。相比之下,Gln460Arg和Ala348Thr多态性与防止骨质流失有关。Ala348Thr 多态性与绝经后10年椎体骨折发生率较低相关。这项研究进一步验证了P2X7受体基因多态性在骨密度调控方面的重要性。Stéfani等[35]通过对121名巴西人进行 P2X7基因中7个非同义单核苷酸多态性(SNPs)的基因分型,发现TL 18147-P2X7受体基因中的单核苷酸多态性与骨密度和踝关节骨折有关。
P2X7受体以及其编码基因P2RX7的多态性构成了一个新兴而充满潜力的研究领域,这可能为深化对骨质疏松症的认识,以及提供预防和治疗骨质疏松症的新颖思路。然而,仍需更多研究以揭示P2X7受体在骨质疏松症中的确切作用,以及P2RX7基因多态性如何影响这一过程。此外,还需在更广大的样本群体及不同种族中进行更深入的研究,以验证现有的发现,并确定这些发现是否具有广泛的适用性。只有通过这种方式的研究,才能充分发掘P2X7受体和P2RX7基因多态性这一具有巨大潜力的研究领域,为骨质疏松症的预防和治疗开拓新的策略。
3 P2X7治疗骨质疏松症的潜在治疗靶点
通过激活P2X7受体可以实现破骨细胞骨吸收与成骨细胞骨形成之间的理想平衡,从而有效地改善骨质疏松症,使其成为治疗骨质疏松症的关键调节剂及潜在治疗靶点[8]。现阶段,已有多种P2X7受体调控剂被应用于骨质疏松症的治疗,如P2X7受体拮抗剂A438079和A740003[36]。除了P2X7受体调控剂,一些天然药物成分如芹菜素、丹参酮ⅡA磺酸钠(STS)等,被证实或推测对骨质疏松症的治疗具有积极效果。这些药物主要通过靶向调控破骨细胞的活动、抑制炎症反应以及诱导干细胞向成骨细胞的分化等方式防止骨质流失,治疗骨质疏松症[37-38]。此外,P2X7受体还能影响BMSCs的分化。研究指出,P2X7受体的活性可以推动这些干细胞向破骨细胞方向分化,而非成骨细胞。因此,通过调控P2X7受体的活性,可能引导干细胞向成骨细胞的方向分化,进而增加骨质。
P2X7受体具有成为骨质疏松症治疗的潜在靶点的可能性。然而,为了将这些理论应用于实际的治疗策略,还需要进行更多的研究,包括开发和测试靶向P2X7受体的药物,确定其剂量和毒副作用,以及在临床试验中验证其疗效和安全性。
4 结语与展望
P2X7受体因其在调控炎症过程、影响骨质重塑,以及引导骨髓间充质干细胞分化等关键环节中的作用,被认为是治疗骨质疏松症的重要新靶点。关于P2X7受体在骨质疏松症治疗中的研究已有一些初步的成果,但仍需针对以下问题进行深入探讨。首先,对于P2X7受体在骨质重塑和炎症反应中的具体分子和细胞层面运作机制仍需进一步明确,以便更有效地将P2X7受体作为治疗骨质疏松症的新靶点。其次,虽然部分P2X7受体调节剂在骨质疏松症治疗中得到初步应用,但其治疗效果和安全性仍需要通过更多的临床试验进行验证。同时,科研人员也需要研发更为有效且安全的P2X7受体调节剂。再者,需要深入探讨P2X7受体与其他骨质疏松症治疗目标的相互作用,这些交互可能影响治疗效果,因此,揭示这些交互作用对于优化治疗策略具有重要价值。而P2X7基因的多态性决定了不同的人群(如不同种族、年龄、性别等)对P2X7受体调节剂的反应存在差异,研究人员需要对此进行深入研究,以找出更有效、更安全以及更加个性化的治疗策略。最后,针对P2X7受体的研究并不仅限于骨质疏松症治疗,其在骨质疏松症预防以及其他骨相关疾病(如骨质增生、骨肿瘤等)治疗中的作用也值得进一步探索。
总体来说,P2X7受体作为治疗骨质疏松症的新靶点,其理论意义重大且应用前景广阔。本文期待在深入研究的推动下,发现更多的P2X7受体调控策略,并将这些策略应用于临床,以此为骨质疏松症患者带来实质性的益处。
