健康中老年人群血清骨转换标志物与FRAX骨折风险相关性分析
2024-03-19陈虹谷赵国阳马安培王奕哲
陈虹谷 赵国阳* 马安培 王奕哲
1. 江苏大学附属医院,江苏 镇江 212000
2. 江苏大学医学院,江苏 镇江 212000
骨质疏松性骨折(osteoporotic fracture,OF)又称脆性骨折,是指在日常活动中受到轻微创伤后随即发生或在日常的活动中所发生的骨折。鉴于中国庞大的人口规模和日益严重的老龄化趋势,中国人的髋部骨折发生率在今后数十年内还将继续保持增长态势。中老年人群一旦发生了骨折尤其是髋部骨折,会引起一系列并发症,不仅会给患者带来身体及精神上的双重打击,也会给其家庭和社会带来巨大的压力[1]。
FRAX(fracture risk assessment tool)是由WHO推荐使用、用于评估未来10年主要部位骨质疏松性骨折和髋部骨折的发生概率并将其用于判断是否进行治疗的一种工具。目前,FRAX工具广泛应用于国内外骨折风险评估,但随着研究的不断深入,人们逐渐发现了FRAX的种种局限[2]。尽管FRAX模型在骨折风险评估中综合考虑了多个因素,但对于脆性骨折史、使用糖皮质激素、吸烟以及饮酒等特定因素,可能存在剂量-效应关系,这些关系在FRAX模型中尚未得到充分纳入。另外有研究显示,在骨质疏松性骨折的患者中只有不到一半存在骨密度降低,甚至一部分骨折患者不仅骨密度在正常范围内并且不存在FRAX模型中考虑到的危险因素[3]。骨转换标志物(bone turnover markers,BTMs)是一种来自于骨组织自身的代谢产物,它不仅可用于监测骨质疏松患者治疗中的时效性和有效性,而且在一些研究中独立于骨密度与骨折风险的增加相关[4-5]。但由于缺乏数据,目前骨折风险计算算法中没有包括骨转化标志物的测量[6]。对BTMs在骨折风险预测中的应用进行深入的研究,或许将会促进其被纳入常规临床实践[7]。
本研究拟通过分析健康中老年人群体内血清骨转换标志物水平与FRAX骨折概率的关系,探讨血清骨转化标志物在骨折风险预测中的价值,以期为临床骨折风险的预测提供研究资料。
1 材料与方法
1.1 对象
2016年1月至2022年6月在镇江地区招募50岁及以上骨密度、骨转换标志物完善,既往史明确的人群。排除患有严重肝肾疾病、甲状腺功能减低、甲状旁腺功能亢进症、性腺功能减低、库欣综合征、结缔组织病、多发性骨髓瘤和恶性肿瘤等明显影响骨代谢疾病的人群以及长期使用降钙素、类固醇激素、双膦酸盐、钙剂、维生素D等影响骨代谢药物的人群,最后入选121人。研究方案经江苏大学附属医院伦理委员会批准(伦理审批号:KY2022K0902)。
1.2 方法
1.2.1一般资料:统一收集研究对象的年龄、性别、既往用药、疾病史,是否服用抗骨质疏松药物,是否存在既往脆性骨折史,现在是否吸烟,目前每日饮酒量,是否患类风湿关节炎,既往是否使用糖皮质激素,父母是否有髋部骨折史等。人体测量:由同一人员测量所有研究对象的体重和身高,并计算出体质量指数(body mass index, BMI)。
1.2.2血清骨转换标志物测定:1型胶原C末端肽 (C-telopeptide of type 1 collagen, CTX)、总1型原胶原N端前肽 (total type 1 procollagen N peptide, tP1NP) 以及骨钙素(osteocalcin, OC),使用ROCHE Cobas 600型号仪器,检测时使用电化学发光法。所有研究对象均在清晨空腹状态下由统一培训人员采集血液样本。
1.2.3骨密度检测:使用双能X线骨密度仪(GE Lunar Madison WI)测定研究对象骨密度(bone mineral density,BMD),检测并记录研究对象的股骨颈(F-BMD)、髋部(H-BMD)以及腰椎骨密度(L-BMD)。
1.2.4FRAX骨折风险计算:登录https://www.sheffield.ac.uk/FRAX网站,使用中国模式,输入相关信息(包括股骨颈骨密度),计算出未来10年主要部位骨质疏松性骨折和髋部骨折概率。
1.3 统计学方法

2 结果
2.1 受试者基本信息
本研究入选对象121人中,男性20人,女性101人,其中绝经女性99名。女性组的股骨颈、髋部以及腰椎骨密度均比男性低,并且OC、tPINP显著高于男性组。同时FRAX未来10年主要骨质疏松骨折概率(FRAX-M)和髋部骨折概率(FRAX-H)也显著高于男性组,但年龄、BMI和CTX在两组间没有显著差异。详见表1。

表1 受试者基本信息
2.2 不同FRAX概率组的各组受试者临床指标比较
FRAX主要骨质疏松性骨折概率≥20 %或FRAX髋部骨折概率≥3 %人群为FRAX高骨折风险组,其他为FRAX低中骨折风险组,比较两组人群各临床指标差异。结果显示,年龄、性别、身高、体重、各部位骨密度、OC以及tP1NP在两组中具有显著差异。详见表2。

表2 不同的骨折风险组之间各变量比较
2.3 FRAX骨折概率与血清骨转换标志物相关性分析
分别以FRAX-M和FRAX-H与血清骨转换标志物进行Spearman相关分析。结果显示,OC、tP1NP、CTX与FRAX-M呈正相关,相关系数r分别是0.385 (P<0.001)、0.378 (P<0.001)和0.208 (P=0.022);OC、tP1NP与FRAX-H呈正相关,相关系数r分别是0.308 (P=0.001)和0.287 (P=0.001)。详见表3。

表3 FRAX骨折概率与血清骨转换标志物相关性分析
2.4 FRAX骨折概率多元线性回归分析及分层分析
对FRAX-M和FRAX-H、tP1NP、OC、CTX的值分别取对数得到LN FRAX-M、LN FRAX-H、 LN tP1NP、LN OC、LN CTX。以年龄、性别、BMI、股骨颈BMD、LN tP1NP、LN OC、LN CTX为自变量,分别以LN FRAX-M、LN FRAX-H为因变量选择步进法进行多元线性回归分析,结果显示:股骨颈 BMD、LN tP1NP留在回归方程,说明LN tP1NP是 FRAX主要部位骨质疏松性和髋部骨折风险的重要相关因素并且不受骨密度影响(详见表4)。分层分析探究逐步增加t1PNP、CTX和OC变量是否可以提高BMD、性别、年龄、BMI对FRAX骨折概率的预测水平,结果显示:当因变量为LN FRAX-M时,在原有模型基础之上加入LN tP1NP后,模型预测能力增强,具有统计学意义。调整后R2=0.641,R2变化量=0.044,F变化量=14.798(P<0.001);当因变量为LN FRAX-H时,在原有模型基础之上加入LN tP1NP后,模型预测能力增强,具有统计学意义。调整后R2=0.749,R2变化量=0.026,F变化量=12.642(P=0.001)(详见表5、表6)。

表4 FRAX骨折概率多元线性回归Table 4 Multiple linear regression of FRAX fracture probability
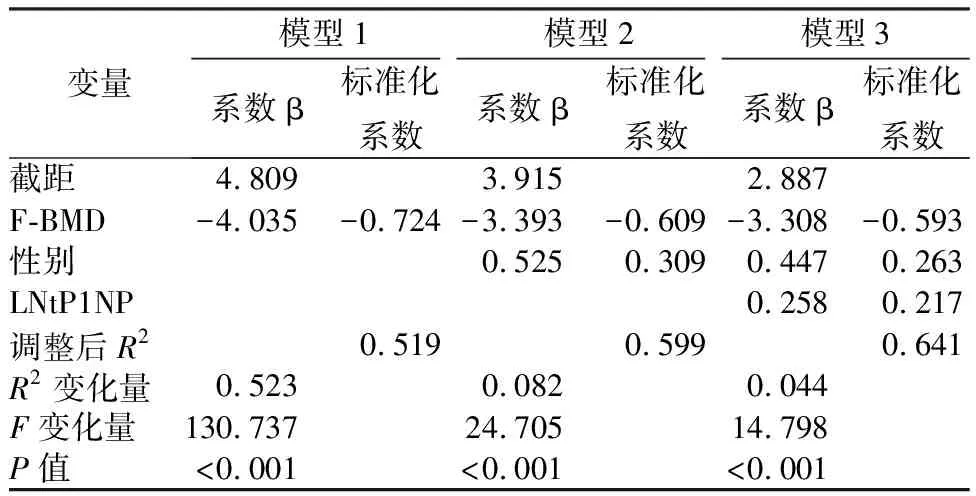
表5 FRAX主要部位骨折概率分层回归

表6 FRAX髋部骨折概率分层回归
3 讨论
随着人口老龄化程度的加剧,增龄相关疾病的发病率也逐渐提高。骨质疏松症作为最常见的全身性慢性疾病之一,对中国中老年人的健康构成严重威胁。一项荟萃分析显示,中国中老年人骨质疏松症的患病率平均为23%,其中27%的女性和16%的男性分别受到影响[8]。然而,由于公众对骨质疏松症的认识普遍不足,骨密度检测率较低,大部分骨质疏松症患者在低骨量的早期阶段没有及时采取预防措施,直到发生骨折后才会被确诊,错过了早期预防和治疗的有利时机。因此,早期筛查、诊断骨质疏松并识别骨折风险十分重要。目前国际上关于骨转换标志物与骨质疏松性骨折风险相关性的横断面研究、队列研究、病例对照研究的研究结果并不一致[9],也缺乏关于BTMS的研究来检验BTMS与骨折风险算法中包含的其他风险因素的相互作用,以确定BTMS对这些算法的贡献[6],因此目前没有将BTM包括在诸如骨折风险评估工具(FRAX)等常用的骨折风险计算器中。
BTMs分为骨吸收和骨形成两大类标志物,可分别直接反映破骨细胞和成骨细胞的活动,也能一定程度上反映出骨代谢的转换速率。在检测到BMD变化之前,骨转换标志物就可以在相对较短的时间间隔内识别骨重塑的变化,有多个研究指出骨转换标志物升高与骨折风险的增加可能存在一定的相关性。这可能是因为其一,当人体内骨转换标志物升高时,骨密度减少的倾向性更大[10];其二,体内持续超过正常值上限的骨转换标志物水平可能会直接影响骨强度,并且该机制可能独立于骨密度[11-13]。国际骨质疏松基金会(IOF)和国际临床化学和实验室医学联合会(IFCC)早在2011年就建议将P1NP和β-CTX作为骨折风险的预测和OP治疗的监测指标,且将其纳入权威指南[14-15]。目前IFCC和IOF正在努力扩大BTMs对OF影响的研究,这可能会促进临床将骨转换标志物用于骨折风险的预测[16]。
本研究中女性血清OC、tP1NP水平都显著高于男性,这可能是因为本研究纳入的中老年女性绝大部分为已绝经女性。根据雌激素缺乏学说[17-18],BTM值在女性围绝经期就开始增加,并在女性绝经后迅速上升[19]。这也与既往一项长达10年的队列研究结论符合[20]。骨折高风险组的受试者相较骨折低中风险组有着更高的血清OC和tP1NP水平,提示骨折高风险的中老年人有着更高的骨转化速率,而中老年人群中较高的骨转化速率通常伴随着骨吸收和形成之间的不平衡[6],进一步导致了骨量改变以及骨折风险增加。
P1NP是由骨胶原细胞在代谢途径中生成的多肽分解而来,反映了1型骨胶原的合成速度,更直接地反映了成骨细胞的活性,代表了新骨形成的状态,P1NP升高表明骨转换速率加快[21]。Aixian Tian等[22]研究显示P1NP与骨折呈显著正相关,在调整协变量后的研究的亚组分析中,在女性群体中存在显著的相关性。随着年龄的增加和绝经的发生,人体内P1NP的小幅度变化发生在骨密度改变之前,甚至可以用其来预测骨密度变化的趋势。本研究显示,在多元线性回归模型中,在矫正BMD和性别等因素后tP1NP不论是和FRAX全身主要骨折概率还是和FRAX髋部骨折概率都有着显著的相关性,这也与之前的一些研究[23]在一定程度上符合。并且分层回归显示,加入tP1NP后,回归模型的预测骨折风险的能力较前显著增加。因此,在骨质疏松性骨折风险评估时结合P1NP可能会获得更为准确的骨折概率。
CTX是1型胶原蛋白的羧基端降解产物,是反映骨吸收活性的敏感指标,对监测治疗和防止骨折发生有重要作用[16]。本研究中CTX与FRAX未来10年骨折概率并无明显的相关性,这与之前的一项包含了1 044名75~90岁女性的大型队列研究[24]的结论不同,该研究表明在75、80、85岁三个年龄段的女性中,高水平的CTX一直与骨折风险相关,尽管随着年龄增加HR会有一些衰减,但CTX似乎是一个可靠的骨折预测指标,并且相比于骨形成标志物,CTX在高龄患者中与骨折风险的相关性更一致。这种差异可能是因为本研究以50岁以上的健康中老年人群为对象,而且与P1NP相比,CTX在不同年龄、性别、生理成熟度的健康人群中个体差异较大[25],因此没有出现阳性结果。这也提示CTX在不同年龄段和生理状态下,其作为骨折预测标志物的效力可能会有所不同。在评估其在骨折风险预测中的应用时,需要更多的深入研究,以充分理解其影响因素及其与不同人群中骨折风险之间的关系。
当然,本研究也存在一些局限性。首先本研究为回顾性研究,无法得到血清骨转换标志物水平与脆性骨折发生的存在因果关系的结论;其次本研究为单中心研究,样本量相对不足,未来仍需进一步扩大样本来研究骨转换标志物在骨折预测中的价值。
总之,本研究结果表明,在健康中老年人群中血清骨转化标志物tP1NP和FRAX未来10年骨折概率相关,tP1NP可能是健康中老年人群脆性骨折发生的重要因素。今后在使用FRAX等骨折风险评估工具时可能需要考虑结合tP1NP等骨转换标志物来提高骨折预测的准确性。
