基于YWHAZ/p38MAPK/CASP3信号通路探讨软脉煎治疗动脉粥样硬化的机制
2024-03-18杜文婷
赵 雪,顾 耘,张 璐,杜文婷
(上海中医药大学附属龙华医院,上海 200032)
动脉粥样硬化(atherosclerosis,AS)被认为是一种进行性血管慢性炎症性疾病,也是世界上心血管疾病致死的主要原因之一[1]。前瞻性研究表明低密度脂蛋白与缺血性心脏病死亡率之间存在着强烈的正相关关系,国际公认的针对性治疗药物——他汀类已经被广泛应用于临床[2]。但是AS是一个复杂的生理、病理过程,单一作用靶点并不能完全满足临床预防和治疗的需要,目前中医药多靶点干预在AS治疗方面展现出优势。
中药复方软脉煎(RMJ)是上海名中医顾耘教授的经验方,由熟地黄、黄芪、陈皮、肉苁蓉、荷叶、绞股蓝6味中药组成,方中熟地黄、黄芪补益精气,陈皮理气健脾、燥湿化痰,荷叶升阳利湿、散瘀止血,绞股蓝健脾益气、清热解毒,肉苁蓉补肾阳、益精血。前期课题组已证实RMJ可以保护血管内皮、抑制血管平滑肌生长、调节血脂、减小颈动脉斑块面积及改善临床症状[3]。通过网络药理学,我们可以从大数据中识别药物与疾病的靶点,进一步探究其作用机制和相关通路[4]。
1 材料与方法
1.1 网络药理学分析
1.1.1RMJ药物活性成分及靶点收集 采用中医药整合药理学网络计算研究平台TCMSP(Traditional Chinese Medicine Systems Pharmacology),搜索RMJ中熟地黄、黄芪、陈皮、肉苁蓉、荷叶、绞股蓝6味中药的活性成分及其对应的靶点,随后根据药动学性质参数(ADME)进行筛选,设置生物利用度OB≥30%,类药性DL≥0.18。
1.1.2“药物-活性成分-靶点”网络构建 采用Uniport(https://www.uniprot.org/)数据库对药物靶点名称进行标准化处理,利用软件Cytoscape3.8.2绘制“药物-活性成分-靶点”网络图。
1.1.3疾病靶点收集 以“Atherosclerosis”为关键词在DrugBank(https://go.drugbank.com/)、TTD(http://db.idrblab.net/ttd/)、GeneCards(https://www.genecards.org/)、在线人类孟德尔遗传数据库OMIM (online mendelian inheritance in man)网站进行检索,获得AS的相关靶点。
1.1.4PPI网络构建 借助Cytoscape3.8.2软件中的插件Bisogenet将药物活性成分靶点和AS疾病靶点导入并“merge”两个网络获得交集网络,对交集网络进行拓扑分析(连接度、紧密度等),获得核心靶点相互作用网络。
1.1.5GO功能富集分析和KEGG通路富集分析 将RMJ治疗AS的潜在靶点导入David(https://david.ncifcrf.gov/)数据库进行GO及KEGG富集分析。
1.2 分子对接采用Seesar软件将排名关键成分分别与核心靶点进行分子对接,计算其结合能力,根据亲和度排序,筛选出亲和度值小于1 000 000 nm的成分。使用基于结构的建模支持服务器(https://proteins.plus/)展示对接结果的3D、2D结构。
1.3 实验验证
1.3.1实验材料 ①动物:SPF级ApoE-/-C57BL/6J小鼠30只,C57BL/6J小鼠10只,8周龄,雄性,体质量(20±2)g,购置于北京维通利华实验动物技术有限公司,合格证号20210006。动物饲养于上海中医药大学实验动物中心,温度(24±2) ℃,湿度65%~75%,设置12 h光暗循环,自由饮水。C57BL/6J小鼠普饲,ApoE-/-C57BL/6J小鼠高脂饲养,高脂饲料由78.85%基础饲料、21%脂肪、0.15%胆固醇组成,购置于上海帆泊生物,合格证号:(2022)05005。动物实验符合动物福利与伦理相关规范,伦理编号:PZSHUTCM220926004。②药物:RMJ颗粒剂(包括黄芪15 g、陈皮6 g、肉苁蓉12 g、熟地15 g、荷叶15 g、绞股蓝30 g)购置于上海中医药大学附属龙华医院,生产批号:21090158,蒸馏水溶解。③试剂:GAPDH抗体(CST,5174),Cleaved caspase3 抗体(CST,9664S),p-p38 MAPK 抗体(CST,4511S) ,YWHAZ 抗体(Santa Cruz,sc-518031) ,预染蛋白Marker(莫纳,PE30301),RIPA裂解液(雅酶,PC101),BCA蛋白定量试剂盒(雅酶,ZJ101),TBSTw(碧云天,ST673)。④仪器:全自动生化分析仪(深圳雷杜生命),电泳仪(上海天能科技),蛋白印迹智能成像系统(ThermoFisher Scientific),病理切片机(上海徕卡),光学显微镜(日本Olympus),台式高速冷冻离心机(德国Eppendoref),超纯水机(美国艾肯)。
1.3.2实验方法 ①造模、分组和给药:小鼠适应性饲养1周,C57BL/6J小鼠(10只)设为对照组予普饲,30只ApoE-/-C57BL/6J小鼠高脂饲养12周建立AS模型,随机挑选3只取主动脉进行油红染色鉴定造模结果,将AS模型小鼠随机分为模型组(9只),RMJ高剂量组(9只),RMJ低剂量组(9只)。将RMJ颗粒剂用蒸馏水配置成混悬液,以70 kg成人等效剂量换算,RMJ高剂量组小鼠每日给药16.38 g·kg-1,低剂量组每日给药8.19 g·kg-1模型组和对照组予等剂量蒸馏水灌胃,灌胃时间为12周。②观察指标:血脂测定:末次给药后禁食12 h摘眼球取血,室温静置2 h,4 ℃、3000 r·min-1离心15 min,取上清,全自动生化仪自动测定各组血清中TC、TG、LDL-C、HDL-C含量。主动脉病理切片染色:将采血后的小鼠开胸暴露心脏,心脏灌注生理盐水后采用4%多聚甲醛固定,OCT包埋切片后进行常规HE、Masson和天狼猩红染色。免疫荧光检测:主动脉病理切片用3%BSA室温封闭1 h,1 ∶100稀释Mac2抗体4 ℃孵育过夜,1 ∶1 000稀释二抗室温孵育1 h,1 ∶7 000稀释DAPI染色15 min,封片,荧光显微镜下拍照,ImageJ软件分析图像。Western blot检测主动脉蛋白的表达水平:将主动脉进行研磨、超声,RIPA裂解液冰上裂解30 min,离心取上清,BCA试剂盒检测蛋白浓度,各组浓度配制相同。制胶,上样(10~30 μg)。电泳,转膜,5%脱脂牛奶封闭2 h,1 ∶1 000稀释一抗4 ℃孵育过夜,1 ∶1 000稀释二抗孵育2 h,1 ∶1配制显影液显影,ImageJ软件分析图像。
1.3.3实验结果统计 采用SPSS 22.0软件进行数据统计分析,计量资料符合正态分布且方差齐,多组比较用One-way ANOVA单因素方差分析,组间两两比较采用Turkey检验;显著性水平α=0.05。
2 结果
2.1 网络药理学分析结果
2.1.1RMJ药物活性成分及其作用靶点筛选 RMJ通过TCMSP平台共筛选了72个药物活性成分,其中熟地黄2个,黄芪20个,陈皮5个,肉苁蓉6个,荷叶15个,绞股蓝24个,将上述药物活性成分作用靶点去除重复项后共得到199个。
2.1.2AS靶点收集 于DrugBank、GeneCards、OMIM、TTD数据库以“Atherosclerosis”为关键词进行检索,去重后共得到疾病靶点4129个,将RMJ药物靶点与AS疾病靶点取交集得到168个交集靶点,用Venny2.1制作韦恩图(Fig 1)。
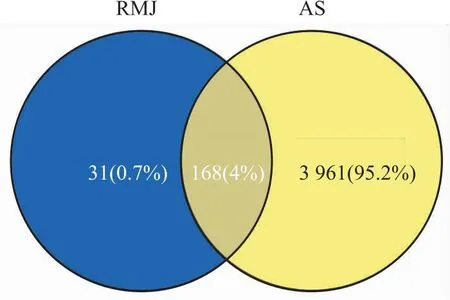
Fig 1 Drug-disease targets
2.1.3PPI网络构建 借助Cytoscape3.8.2软件中的插件Bisogenet将药物作用靶点和AS疾病靶点导入并“merge”两个网络获得交集网络,最终得到107个核心靶点的PPI网络(Fig 2)。其中Degree值> 55的靶点有7个:NPM1、HSPA5、YWHAZ、HSPA8、TP53、MCM2、UBC,定义这7个靶点是治疗AS的核心靶点(Tab 1)。

Fig 2 Protein-protein interaction (PPI) network
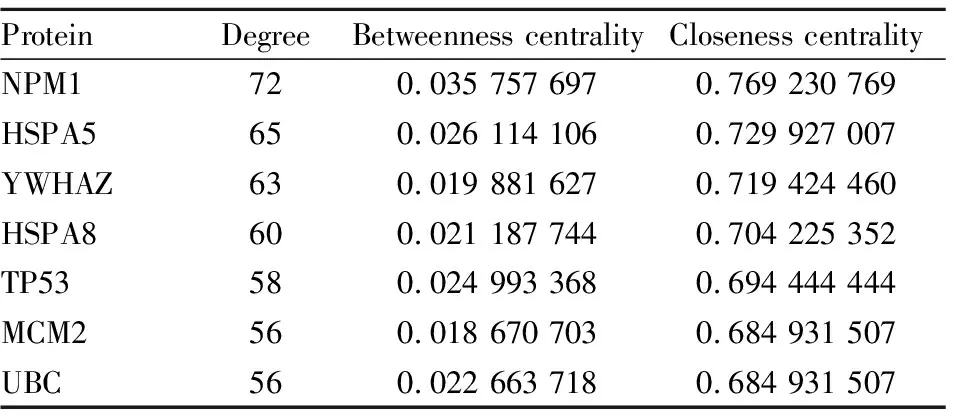
Tab 1 Key targets
2.1.4GO和KEGG富集分析 将RMJ药物与AS疾病的交集靶点导入DAVID数据库进行GO和KEGG富集信号通路分析,生物过程(BP)753个,主要有RNA聚合酶II启动子转录的正规调节、细胞质结合、酶结合等,细胞成分(CC)84个,主要有胞液、细胞核、核膜、细胞质等。以P≤0.05为标准,并以P值升序排列,筛选出 BP、MF、CC前10个采用生信网进行绘图分析(Fig 3)。KEGG富集分析得到170条信号通路,以P<0.05为筛选条件,筛选出前20条通路(Fig 4),主要包括癌症的途径、脂质和AS、血流剪切应力和AS、活性氧(ROS)、炎症信号通路等。
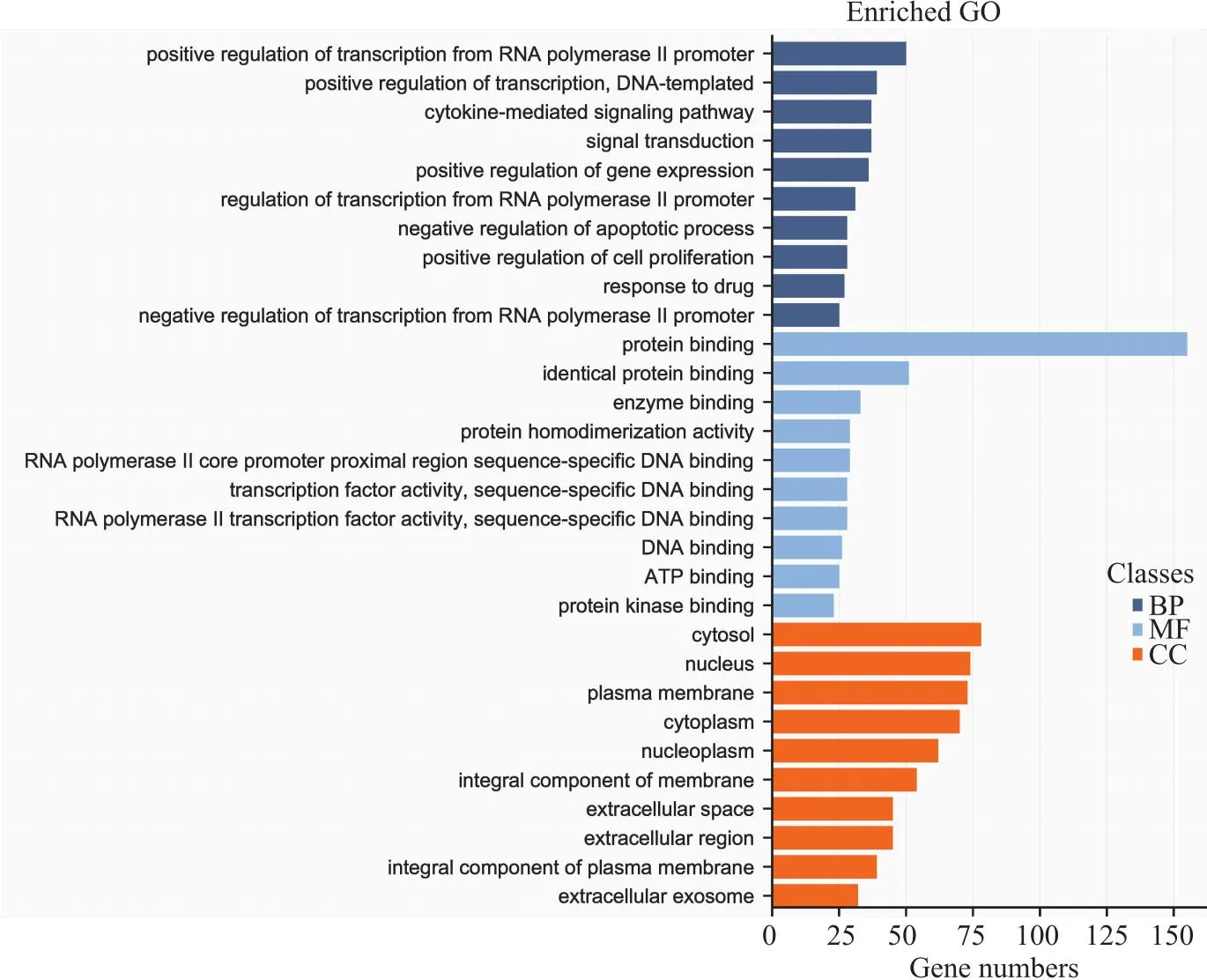
Fig 3 Gene ontology (GO) analysis
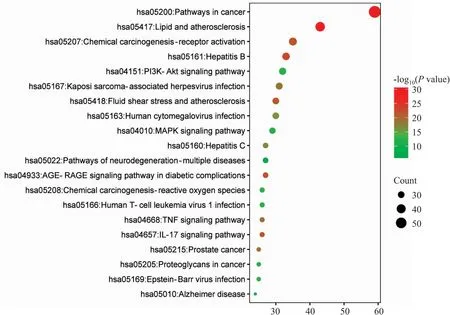
Fig 4 Kyoto encyclopedia of genes and genomes (KEGG) analysis
2.2 分子对接结果选择10个关键成分槲皮素(quercetin)、山柰酚(kaempferol)、异鼠李素(isorhamnetin)、7-O-甲基异木糖醇(7-O-methylisomucronulatol)、诺比列汀(nobiletin)、芒柄花素(formononetin0、柚皮素(naringenin)、阿美巴芬(armepavine)、豆甾醇(stigmasterol)、邻去甲花碱(o-Nornuciferine)与核心靶点NPM1、HSPA5、YWHAZ、HSPA8、TP53、MCM2、UBC进行分子对接。采用Seesar软件将关键成分分别与核心靶点的最佳结合口袋进行分子对接,计算其结合能力,根据亲和度排序,筛选出亲和度值小于1 000 000 nm的成分如下,docking结果表明槲皮素、山柰酚、诺比列汀、柚皮素、阿美巴芬、豆甾醇、邻去甲花碱与核心靶点蛋白有很强的结合能力,见Tab 2。Fig 5展示了核心靶点蛋白与关键化合物的分子对接3D结构。

Tab 2 Protein-molecule binding affinity

Fig 5 Protein-molecule docking 3D structures
2.3 实验验证结果
2.3.1主动脉HE、Masson、天狼猩红染色 HE染色结果示(Fig 6):与对照组相比,模型组主动脉相对斑块面积明显增大(P<0.01),并且含有更多的泡沫细胞和胆固醇结晶;与模型组相比,RMJ高剂量组和低剂量组主动脉斑块面积明显减小(P<0.01),并且泡沫细胞和胆固醇结晶含量减少。Masson、天狼猩红染色结果示:与对照组相比,模型组胶原相对含量明显下降(P<0.01);与模型组相比,RMJ高剂量组胶原相对含量明显增高(P<0.01或P<0.05),RMJ低剂量组胶原相对含量增高不明显(P>0.05)。病理结果显示RMJ高剂量组治疗效果较最佳,后续将重点比较RMJ高剂量组(RMJ组)与模型组差异。

Fig 6 Aorta HE, Masson, and picrosirius red staining
2.3.2RMJ对AS模型小鼠血脂的影响 与对照组相比,模型组小鼠的TG、TC、LDL-C水平明显升高(P<0.01或P<0.05),HDL-C水平明显降低(P<0.05);与模型组相比,RMJ组TG、LDL-C水平明显降低(P<0.05),见Fig 7。
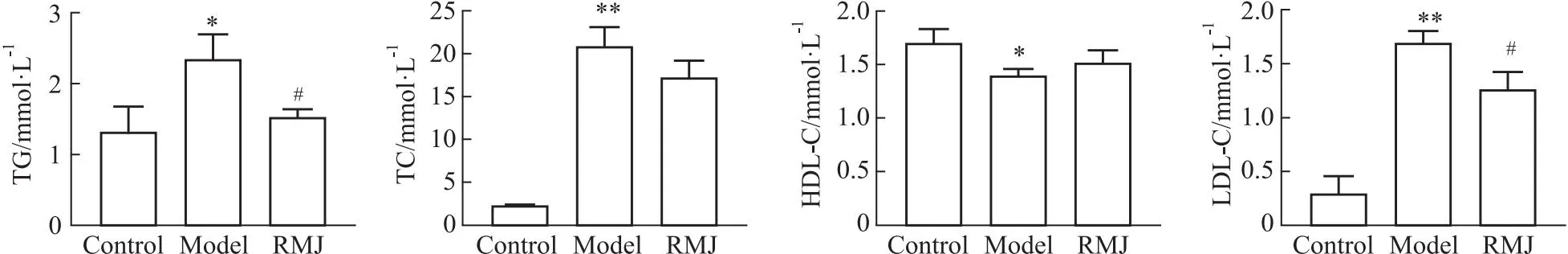
Fig 7 TG, TC, LDL-C, HDL-C detection results
2.3.3RMJ对AS小鼠主动脉Mac2、YWHAZ蛋白表达的影响 与对照组相比,模型组Mac2(巨噬细胞标志物)、YWHAZ蛋白相对表达量明显增高(P<0.01);与模型组相比,RMJ组Mac2、YWHAZ蛋白相对表达量明显降低(P<0.01或P<0.05),见Fig 8。
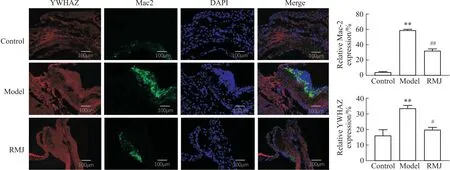
Fig 8 Immunofluorescence detection of Mac2 and YWHAZ protein expression
2.3.4RMJ对AS小鼠主动脉p-p38MAPK、c-CASP3蛋白表达的影响 与对照组相比,模型组p38MAPK磷酸化水平和c-CASP3蛋白表达水平明显升高(P<0.01或P<0.05),与模型组相比,RMJ组p38MAPK磷酸化水平和c-CASP3蛋白表达水平明显下降(P<0.01或P<0.05)见Fig 9。
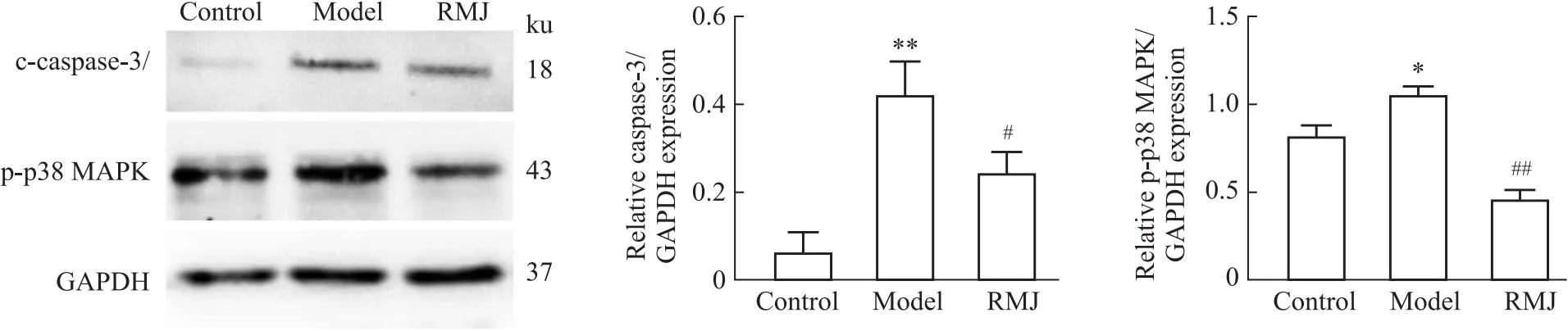
Fig 9 Western blot detection of p-p38MAPK and c-CASP3 protein expression
3 讨论
通过网络数据库筛选和分子对接验证,我们最终获得了槲皮素、山柰酚、诺比列汀、柚皮素、阿美巴芬、豆甾醇、邻去甲花碱7个关键活性成分,其中荷叶含有槲皮素、山柰酚、阿美巴芬、邻去甲花碱,黄芪含有槲皮素、山柰酚,陈皮含有诺比列汀、柚皮素,肉苁蓉含有槲皮素,绞股蓝含有槲皮素,熟地黄含有豆甾醇。槲皮素被证实不仅可以降低血浆和主动脉中总胆固醇、总脂肪酸和TG的含量,还可以有效抑制乳糜连接素15脂氧合酶进而抑制低密度脂蛋白的合成[5- 6];山柰酚被证实可以防止异位脂质积累[7],槲皮素、山柰酚属于黄酮类化合物,已有研究证实黄酮类化合物具有抗炎特性[8];诺比列汀可以通过增强miR-590对脂蛋白脂酶表达的抑制作用来减轻促炎细胞因子的分泌和脂质积累,进而改善血管内皮功能[9- 10];柚皮素可以减少斑块巨噬细胞并增加平滑肌细胞[11];阿美巴芬通过抑制T细胞/巨噬细胞的浸润、降低炎症细胞因子水平起到抗炎、调节免疫的作用[12];豆甾醇可以通过调节肝X受体基因表达降低血清胆固醇水平[13];邻去甲花碱可能通过调节胆汁分泌、甘油脂、鞘脂代谢和过氧化物酶体增殖物激活受体信号通路等来调节脂质代谢[14]。通过筛选的关键化合物,我们总结RMJ可以通过调节脂质代谢、改善血管内皮功能、抗炎和调节免疫治疗AS。
通过RMJ治疗AS的靶点进行GO和KEGG富集信号通路分析,可以获得RMJ治疗AS疾病密切相关的生物过程和信号通路。在GOBP分析中,显示RMJ可以干预AS细胞增殖、细胞凋亡和细胞因子介导的信号通路。血管平滑肌细胞的增殖和新内膜的形成加重了AS病变的发展[15],另有研究显示造血干细胞增殖可以加速克隆性造血导致AS疾病加重[16];晚期AS斑块中血管平滑肌细胞功能受损的原因可能是细胞死亡或衰老[17];在一项用人类内皮细胞模拟屏障功能受损的研究中,发现细胞因子刺激后的内皮屏障功能减弱[18]。另外,KEGG分析显示:RMJ治疗AS与脂质代谢通路、流体剪切应力调节、ROS以及TNF、MAPK、PI3K-Akt 、IL-17信号通路相关。脂质积累是AS的主要病因之一,AS通常与脂质代谢异常和高脂血症相关[19];已有研究表明,在细胞成熟期间施加流体剪切应力可以有效减少脂质积累[20];由过量ROS引起的氧化应激已经被证实为AS的关键发病机制[21],ROS直接增加炎症和黏附因子的表达、氧化低密度脂蛋白的形成等,它们激活泛素通路,降低内皮一氧化氮合酶活性,抑制腺苷一磷酸(AMP)蛋白激酶和脂联素的激活,所有这些都会加速AS进展[22];已经有明确的临床和实验证据证明AS是一种慢性炎症性疾病[23],机制研究表明,促AS因子(TNF-α)是程序性细胞清除受损的一种基本驱动因素,由此造成病变血管细胞和凋亡细胞碎片病理积累形成慢性炎症[24];IL-17对AS具有一个双向的影响作用,一方面可以诱导炎症和细胞凋亡,另一方面它又可以通过促进纤维帽形成来稳定斑块[25];PI3K/Akt通路通过调控巨噬细胞的存活、增殖和迁移影响AS的发展[26];MAPK参与炎症信号传导,并响应各种细胞内、外刺激而促进氧化应激[27]。通过GO 和 KEGG 富集信号通路分析我们总结RMJ可以通过抗炎、影响细胞增殖与凋亡、调节脂质代谢、减少氧化应激、改善内皮功能来治疗AS。
本次实验验证了与AS发生发展关系密切的MAPK信号通路,其中p38MAPK途径主要作用于炎症和免疫。前期筛选出的YWHAZ是p38MAPK信号通路的正调节剂,YWHAZ低表达可以通过抑制MAPK信号通路减少血管平滑肌细胞增殖和内膜增生[28],并且YWHAZ涉及多种信号转导途径,其中包括表皮生长因子受体(EGFR)信号[29],EGFR缺失可以限制IL-6和TNF-α的产生、脂质摄取进而抑制动脉粥样硬化进展[30]。CASP3(caspase-3)是细胞中的一种蛋白酶,通常以未激活状态存在。当CASP3被激活并自我切割时,会产生c-CASP3(cleaved caspase-3)。因此,在细胞凋亡过程中,c-CASP3的表达量通常会增加,因为CASP3的活性增加[31]。炎症触发p38MAPK途径激活和黏附分子表达[32],进而诱发凋亡,c-CASP3表达增高[33]。
我们首次运用网络药理学探究补肾类中药复方RMJ治疗AS的作用机制。核心靶点的探究验证了课题组以往的部分研究成果:RMJ可以抑制对平滑肌有增生作用的IL-6表达进而改善内皮功能[34];在AS晚期通过Bax/Bcl-2异源二聚体与Bax-Bax同源二聚体竞争Bax减少同源二聚体的形成,从而抑制血管平滑肌细胞的凋亡来提高斑块的稳定性[35];RMJ早期可以抑制PI3K/Akt/mTOR信号通路,促进自噬防治AS,晚期可以促进PI3K/Akt/mTOR信号通路,抑制过度自噬稳定AS斑块[36]。本研究通过动物实验验证了RMJ可以通过下调关键靶点YWHAZ及p-p38MAPK、c-CASP3调控p38MAPK信号通路,减轻AS炎症反应及炎症诱发的凋亡。课题组未来将继续关注并验证RMJ通过诱导糖酵解和TIGAR影响细胞自噬,影响泛素化和细胞衰老等治疗AS的作用机制。
