魔芋甘露低聚糖增强肠道屏障功能改善酒精性中枢神经损伤的实验研究
2024-03-18陈晶晶钟文艳沈文卓袁成福
陈晶晶,钟文艳,2,沈文卓,肖 莉,2,袁成福,2
(三峡大学1.基础医学院、2.肿瘤微环境与免疫治疗湖北省重点实验室,湖北 宜昌 443002)
酒精滥用是一个影响全球健康的重大公共卫生问题[1],给社会的医疗体系和经济造成重大的负担。在长期大量的饮酒中,酒精和其代谢物会导致多器官损伤,包括神经系统。无论是一次大量饮酒或长期滥用都可以导致精神障碍,严重者可以出现不可逆的神经系统损害,导致认知功能障碍,抑郁样行为和诱发成瘾性[2]。对酒精导致的相关疾病最基本的治疗措施是戒酒和营养支持,但由于成瘾、社会环境和生活习惯等多因素影响,大部分患者无法完全做到。因此,深入阐明其发病机制和继续开发有效的预防和治疗性药物,具有重要的科学研究意义和应用前景。
魔芋甘露低聚糖(Konjac mannan oligosaccharides,KMOS)[3],由β-D-甘露糖和β-D-葡萄糖残基通过β-(1→4)糖苷键连接而成,是一种重要的功能性低聚糖。甘露低聚糖具有抗炎、抗氧化、调节免疫、减轻糖脂代谢障碍等多种生理功能[4]。由于甘露低聚糖不能直接被机体胃肠道消化吸收,只能被结肠微生物发酵利用,也被认为是益生元的一种。和其他药物,尤其是抗生素相比,其安全性高,不产生耐药性,具有良好的开发潜能。KMOS及其衍生物已被作为食品添加剂或者作为保健食品成分,用于预防多种疾病[5]。已有多种益生元被用于预防和治疗与肠道衍生细菌产物相关的疾病以及与肠道渗漏相关的疾病[6]。然而,关于低聚甘露糖对酒精摄入造成的神经损伤的作用及其机制还不明确。在本实验中,我们基于“肠-脑轴”探讨KMOS增强肠道屏蔽功能,改善慢性酒精导致的神经损伤的作用及其机制。
1 材料与方法
1.1 材料
1.1.1实验动物 雄性C57BL/6J小鼠(8周龄,体质量20~22 g) 48只由中国三峡大学动物中心提供和喂养[质量证书编号SCXK(JI)2019-0008;中国宜昌],动物自由获取食物和水,(23±3)℃,12 h光照/黑暗循环(实验动物伦理号:2019010S)。
1.1.2药品和试剂 本实验中所用的魔芋低聚甘露糖购于湖北恩施天天佳生物科技有限公司,经HPLC鉴定纯度≥98.0%。Lieber-DeCarlic液体饲料购于南通特洛菲饲料科技有限公司(酒精饲料货号TP4030D,对照饲料货号TP4030C)。尼氏染色液和ECL化学发光检测试剂盒购自中国武汉赛维尔生物科技有限公司,抗荧光衰减封片剂(DAPI)购于广州索莱宝公司,RIPA缓冲液和BCA蛋白检测试剂盒购自中国北京普利莱基因技术有限公司。检测脂多糖(lipopolysaccharide,LPS)浓度试剂盒购自北京百奥莱博科技有限公司。实验中所用的抗体Anti-NLRP3(1 ∶2 000, WL02635)、Anti-pro-IL-1β(1 ∶1 500, WL02257)、Anti-matuee-IL-1β(1 ∶500, WL00891)、Anti-caspase-1/cleaved caspase-1(1 ∶1 000, WL03450)、Anti-parkin(1 ∶500, WL02512)和Anti-PINK1(1 ∶1 000,WL04963)购自沈阳万类公司, β-Actin(bs-0061R, 1 ∶4 000)购自北京博奥森公司,Anti-occludin(1 ∶1 000, A12621)购自武汉爱博泰克公司。基因引物序列由上海生工生物工程股份有限公司合成;TRIzol购于日本TaKaRa Bio Inc公司,实时定量PCR所需的试剂Taq Pro Universal SYBR qPCR Master Mix购自于南京诺唯赞公司。
1.1.3主要仪器设备 实时定量PCR仪器购于美国Bio-Rad公司,酶标仪购于瑞士Tecan公司,Nanodrop分光光度仪器购自美国Thermo公司,凝胶成像系统购于美国Kodak公司,Western blot电泳和转膜设备购自美国Bio-Rad公司,超薄切片机购于德国Leica公司,冷冻切片机购于中国达科为公司。
1.2 方法
1.2.1动物模型制备 C57BL/6J雄性小鼠被随机分成饮食对照组、酒精饮食模型组、KMOS低剂量组(100 mg·kg-1)组、KMOS高剂量组(200 mg·kg-1)组,每组12只。采用Gao-binge法建立小鼠慢性ASH模型[7]。药物作用组每日KMOS灌胃一次,对照组和酒精饮食模型组灌以相应体积的质量浓度为5 g·L-1羧甲基纤维素钠溶剂,喂养6周。
1.2.2组织染色 脑组织浸泡在4%多聚甲醛中24 h,乙醇脱水,石蜡包埋并制作成5 μm的切片。常规苏木精-伊红或尼式液染色,于显微镜下观察组织病理变化。免疫荧光检测时,脑组织切片,脱蜡水化,浸于沸腾的修复液(0.01 mol·L-1枸橼酸缓冲液,pH 6.0)中进行抗原修复10 min,自然冷却至室温后取出玻片,用PBS(pH 7.4)冲洗3遍,每次3 min,室温封闭30 min。抗IBA1(1 ∶300)一抗,于4 ℃湿盒中孵育过夜。PBST冲洗切片3次,每次3 min,与荧光二抗湿盒中室温避光孵育1 h,PBST冲洗切片4次,每次3 min。含DAPI抗荧光淬灭剂封片,荧光显微镜下采集图像,IPP 6.0软件分析荧光强度。
1.2.3ELISA检测 血浆LPS测定根据试剂盒说明书操作,检测血浆中LPS的浓度。TNF-α、IL-6、IL-1β所有低于检测范围最小值的数据均被认为是0。
1.2.4Western blotting 皮层、海马组织和回肠组织加入RIPA裂解缓冲液充分研磨,4 ℃下12 000 r·min-1离心30 min,吸取上清液获得总蛋白。BCA 蛋白定量法测定含量。蛋白样品加入5×SDS蛋白上样缓冲液100 ℃变性5 min。30 μg样品经SDS-聚丙烯酰胺凝胶电泳,转至PVDF膜,5%脱脂牛奶,室温封闭1 h。加入特异性一抗4 ℃孵育过夜,TBST洗膜,二抗室温孵育1 h,TBST洗膜,ECL化学发光并显影。以β-actin为内参,用ImageJ软件分析蛋白质条带密度值。
1.2.5RT-PCR分析 使用TRIzol从小鼠结肠组织样品中裂解提取总RNA,以1 μg的总RNA为模板,采用随机引物利用逆转录酶反转成cDNA。以cDNA为模板,其相应的特异性引物扩增目的基因。以GAPDH基因表达为内参,相对基因表达用2-ΔΔCT法计算。使用的引物如下:TNF-α, 正向: CCTGTAGCCCACGTCGTAG; 反向: GGGAGTAGACAAGGTACAACCC; IL-1β, 正向: GAAATGCCACCTTTTGACAGTG; 反向: CTGGATGCTCTCATCAGGACA; GAPDH, 正向: TCAAGAAGGGTGGTGAAGG; 反向: TCAAAGGGTGGAGGGGGGGGGTGGTT。
1.2.6Caco-2细胞培养 Caco-2细胞培养于DMEM培养基(含10% FBS),37 ℃、5% CO2的环境中培养。Caco-2细胞以2×105个/孔接种于6孔板,待细胞融合度约70%后,100 mmol·L-1的酒精诱导细胞损伤,同时加或不加高、低浓度KMOS(100、200 μmol·L-1),培养24 h,收集细胞进行蛋白分析或制成细胞爬片进行免疫荧光分析。
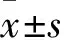
2 结果
2.1 KMOS有效改善慢性酒精摄入导致的小鼠神经元损伤临床研究表明,酗酒者的神经元与非饮酒者相比数量明显减少,脑重量也降低[8]。本研究也观察到慢性酒精饮食小鼠有较低的体质量和脑体质量比,KMOS的干预明显逆转酒精对小鼠体质量和脑质量的降低(Fig 1A, 1B)。尼氏体是神经元蛋白质合成的重要部位,其减少是评估神经元数量和功能的重要指标。慢性酒精的摄入导致小鼠皮层和海马神经元的尼氏体染色明显减轻,KMOS的干预有效地逆转了小鼠神经元的这种变化(Fig 1C) 。这说明KMOS的使用能有效改善慢性酒精摄入小鼠神经元的损伤。

Fig 1 KMOS treatment effectively inhibited neuronal cell damage caused by chronic alcohol
2.2 KMOS抑制慢性酒精喂养小鼠脑组织小胶质细胞活化和炎性反应小胶质细胞激活导致的炎症反应是神经元损伤的重要因素[9]。我们使用免疫荧光观察小胶质细胞标志物IBA1的表达。结果显示,对照组小鼠大脑皮层和海马区域偶见IBA1+细胞,同时阳性细胞内免疫荧光着色点小,荧光强度低,基本未见明显的活化状态。酒精喂养小鼠脑内IBA1阳性细胞数多,免疫荧光着色点较大(胞体增大),荧光强度高且呈阿米巴样,活化明显。而KMOS的干预明显抑制了小鼠小胶质细胞的活化(Fig 2A, 2B)。同时,KMOS的使用也明显抑制了小鼠脑组织炎性因子TNF-α、IL-6和IL-1β的表达(Fig 2C)。

Fig 2 KMOS treatment inhibited the activation of microglia caused by chronic alcohol
2.3 KMOS抑制慢性酒精喂养小鼠脑组织NLRP3活化水平小胶质细胞NLRP3炎症小体的激活常常被认为是脑组织炎症反应的重要信号因子[10]。对小鼠大脑皮层和海马的检测显示,经酒精喂养后小鼠大脑皮层和海马组织NLRP3、pro-caspase-1、caspase-1、pro-IL-1β和IL-1β的表达量均明显上升,而KMOS的干预明显降低了小鼠皮层和海马组织NLRP3的活化水平(Fig 3)。

Fig 3 KMOS treatment inhibited NLRP3 activation in the brain tissue of chronic alcohol-fed
2.4 KMOS逆转了慢性酒精喂养导致的小鼠大脑线粒体自噬损伤已有报道,小胶质细胞NLRP3炎性小体活化生成的炎性因子可造成细胞线粒体自噬的损伤[11],导致受损细胞线粒体积累的增加和活性氧的释放,进一步加剧细胞损伤。对小鼠脑组织线粒体自噬相关蛋白的检测表明,KMOS的用药逆转了酒精饮食喂养小鼠皮层和海马组织Parkin、PINK1蛋白表达水平的降低(Fig 4)。这一结果说明KMOS抑制NLRP3炎性小体活化,改善慢性酒精喂养导致小鼠脑组织线粒体自噬损伤。

Fig 4 KMOS reversed the damage of brain mitophagy caused by chronic alcohol feeding in
2.5 KMOS明显改善酒精导致的小鼠肠道屏蔽功能损伤,降低血清LPS水平酒精的摄入会导致肠道黏膜损伤和屏蔽功能降低。实验结果显示,酒精饮食组小鼠结肠出现肠黏膜绒毛缩短和断裂,上皮细胞紊乱,大量炎症细胞浸润的情况。KMOS治疗后,这些病理变化得到了改善(Fig 5A)。同时,酒精饮食小鼠结肠组织紧密连接蛋白Occludin的表达出现明显降低,而KMOS的处理明显逆转了这一现象(Fig 5B),降低结肠组织炎性因子TNF-α和IL-1β的mRNA表达水平(Fig 5C,5D)。更重要的是,慢性酒精酒喂养可导致小鼠血清中LPS水平的明显增加,而KMOS的干预明显降低了血清LPS的水平(Fig 5E)。
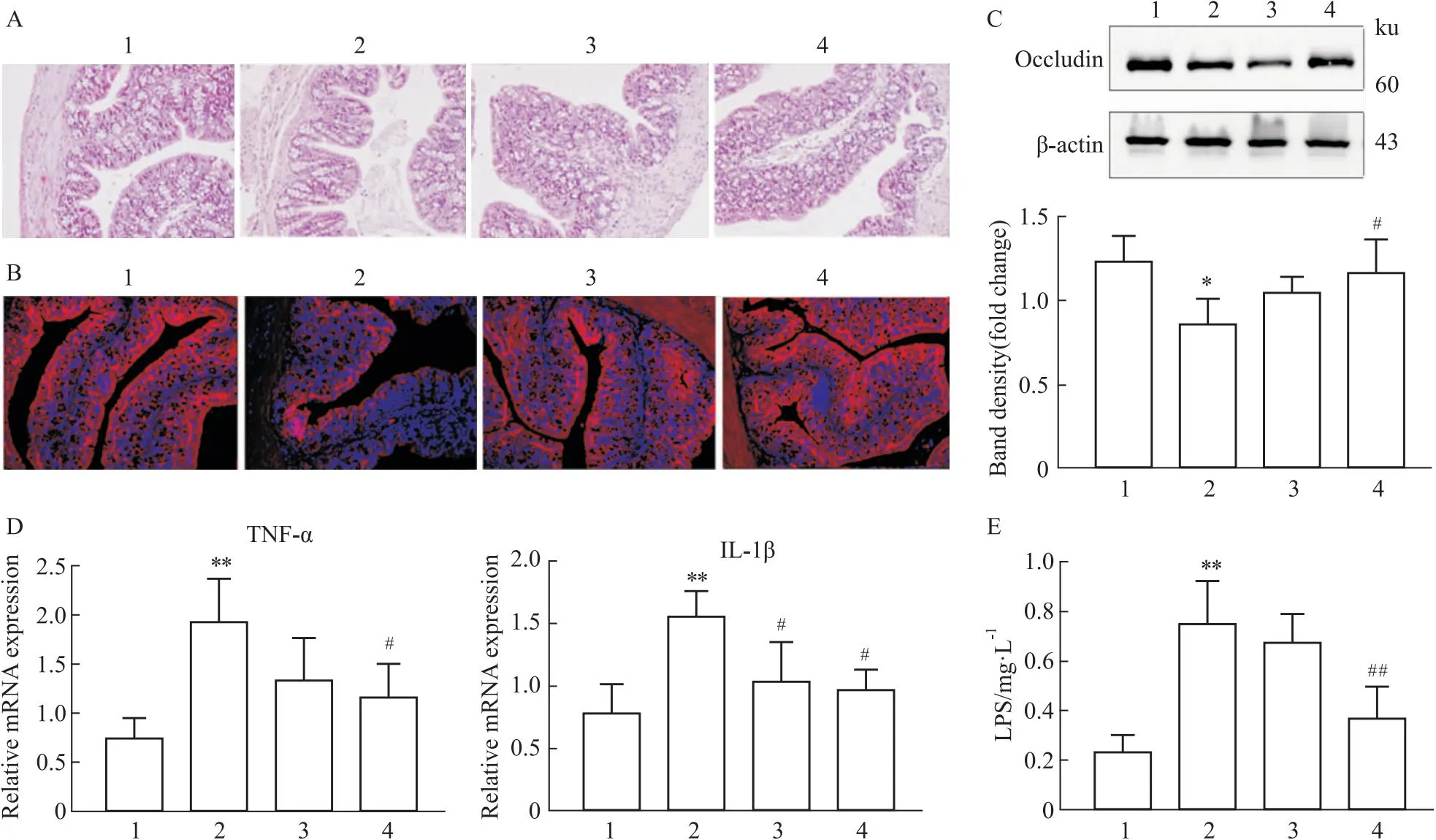
Fig 5 KMOS significantly improved alcohol-induced intestinal shielding function damage in
2.6 KMOS增强酒精暴露下Caco-2细胞的Occludin表达为了进一步明确KMOS对肠道组织损伤的保护作用,我们使用酒精刺激Caco-2细胞建立细胞损伤模型。结果显示,KMOS的干预明显提高了酒精诱导下Caco-2细胞Occludin蛋白的表达水平(Fig 6A, 6B);抑制炎性因子TNF-α和IL-1β的mRNA表达水平(Fig 6C)。
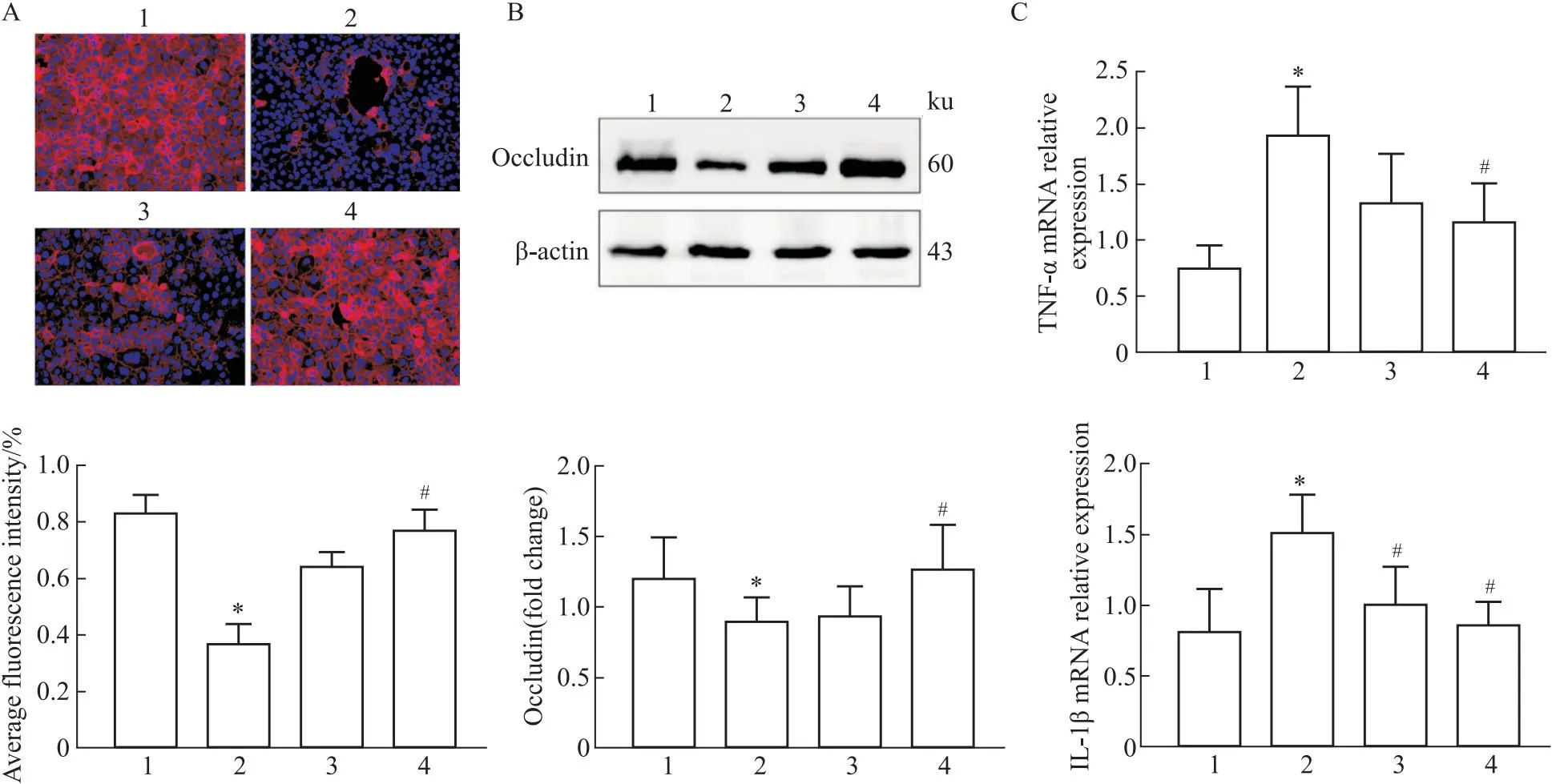
Fig 6 KMOS significantly improved alcohol-induced Occludin expression in Caco-2 n=5)
3 讨论
大量研究表明,慢性饮酒会导致中枢神经系统损伤。近年来,功能低聚糖由于其功能的广泛和安全性受到研究者的广泛关注。本实验使用KMOS干预慢性酒精摄入小鼠,结果表明,KMOS可有效地减轻海马和皮质的神经元病理损伤。KMOS的这种有效性被揭示归因于抑制小胶质细胞介导的神经炎症,表现出对酒精性神经损伤的预防潜力。
抑制小胶质细胞过度活化是治疗和预防神经系统炎症和神经退行性疾病研究的重要靶点[12]。近年来的研究表明,小胶质细胞激活在持续性神经退行性疾病的进展中起主导作用。小胶质细胞作为中枢神经系统的常驻免疫监视细胞,其被不恰当或持续激活时,会分泌各种炎症细胞因子,最终破坏周围的神经元细胞。其中小胶质细胞中NLRP3炎性小体,被视为脑神经炎症反应中的重要信号因子[11]。NLRP3炎性小体可被病毒、LPS、氧化应激等因素激活,促使IL-1β、IL-18等炎性因子的成熟和分泌,对神经元细胞产生毒性作用[13];同时也可进一步造成细胞线粒体自噬的损伤,导致受损线粒体的积累和活性氧的释放[11]。Gao等[14]发现,何首乌提取的有效成分之一四羟基芪糖苷能明显抑制小胶质细胞和神经元中的NLRP3信号通路,有效缓解LPS诱导的炎症反应,进而调节PINK1/Parkin信号通路的自噬。用槲皮素治疗抑郁症发现,槲皮素可以通过促进线粒体自噬抑制小胶质细胞NLRP3活化,进而改善神经元的损伤[15]。我们的实验结果表明,KMOS的干预明显抑制了慢性酒精暴露小鼠海马和皮质组织的小胶质细胞激活,降低NLRP3炎症小体的活化和炎性因子TNF-α、IL-6、IL-1β表达水平,改善线粒体自噬蛋白PINK1、Parkin的损伤,这说明KMOS通过对小胶质细胞NLRP3炎性小体过度活化的干预,抑制慢性酒精摄入导致的神经炎症,来减轻酒精性中枢神经系统损伤。但是KMOS无法直接被肠黏膜细胞所吸收入血,因此这种对小胶质细胞活化的抑制作用可能是间接实现的,其具体机制还需进一步研究。
酒精的摄入可导致肠道菌群的紊乱和肠屏障完整性的破坏,使肠道细菌及细菌产物,如内毒素LPS进入体循环,从而导致系统性炎症反应和多个器官的损伤[16]。防御素、紧密连接蛋白和肠道免疫细胞是构成肠道屏障的主要组件。肠道上皮细胞之间的紧密连接对于维持肠道屏障完整性和影响肠道上皮对微生物及其产物的渗漏至关重要。Bala等[16]研究结果发现长期滥用酒精会破坏小肠紧密连接的完整性,提高肠道通透性增高,血浆内毒素水平较健康对照组明显升高。Li等[17]的研究也同样发现,长期饮酒者,肠道菌群释放更多的内毒素,破坏肠道屏障,引起炎症反应,介导多脏器的组织损伤。已有实验报道,在鸡的饲料中添加甘露低聚糖和活性酵母可减轻大肠杆菌导致的鸡肠道炎症反应,增强肠道紧密连接蛋白的表达,改善肠道屏障功能的损伤[5]。单独使用甘露低聚糖就可以重塑肠道微生物群,增强肠道屏蔽功能,阻止LPS的肠漏和提高肠道内短链脂肪酸含量,从而改善阿尔兹海默症小鼠的认知障碍[18]。我们的实验结果显示,酒精暴露小鼠肠道紧密连接蛋白Occludin严重下调,结合血清中LPS明显增加的实验结果,说明慢性酒精刺激会导致肠道屏障功能损害,使得肠道LPS逸出。不同剂量的KMOS干预都能有效上调酒精摄入小鼠肠道Occludin蛋白含量,增强肠道屏障功能,从而降低了血清中LPS水平。体外实验也进一步证明,KMOS可以明显抑制酒精暴露下Caco-2细胞炎性因子表达的增加,提高Occludin表达的水平。这些结果提示,KMOS能够提高肠道紧密连接蛋白的表达,改善酒精诱导的肠道损伤,抑制LPS进入循环系统。
综上所述,KMOS的使用可以抑制慢性酒精摄入小鼠小胶质细胞的过度活化,改善其对神经元的神经毒性作用,其可能的机制是通过抑制肠道细胞炎性反应,增强肠道屏障功能,来减少肠道源性LPS进入大脑。由于其使用的安全性,KMOS具有成为预防酒精性神经损伤药物的潜力。
