益骨汤对去势大鼠骨密度及经典BMP2信号通路的影响
2024-03-16林晓芳方芳李桂锦姚新苗
林晓芳 方芳 李桂锦 姚新苗


[摘要] 目的 觀察益骨汤对去势大鼠骨组织中经典骨形态发生蛋白(bone morphogenetic protein,BMP)2信号通路的影响,旨在探讨益骨汤防治骨质疏松症(osteoporosis,OP)的作用机制。方法 将44只12周龄雌性Wistar大鼠随机分为四组,每组11只。正常组不进行任何处理,模型组、戊酸雌二醇组和益骨汤组大鼠进行去势手术以模拟骨质疏松。造模成功后,分别以10ml/kg双蒸水灌胃(正常组、模型组)、0.36mg/kg戊酸雌二醇水溶液灌胃及10ml/kg益骨汤灌胃, 1次/d。12周后,双能X射线骨密度仪测定股骨骨密度(bone mineral density,BMD),实时聚合酶链反应(polymerase chain reaction,PCR)检测BMP2经典信号通路BMP2、Smad1、Runx2、OSX基因的表达,免疫组织化学法、Western blot法检测BMP2经典信号通路BMP2、Smad1、Runx2、OSX蛋白的表达量。结果 ①双能X射线骨密度仪测定股骨骨密度,结果显示,与模型组比较,益骨汤组大鼠的BMD升高(P<0.01)。②实时荧光定量PCR检测,与模型组比较,益骨汤组大鼠的BMP2、Smad1、Runx2、Noggin基因表达量升高(P<0.05)。③免疫组织化学法检测:与模型组比较,益骨汤组大鼠的BMP2、Smad1、Runx2、OSX蛋白表达量升高(P<0.05)。④Western blot法检测:与模型组比较,益骨汤组大鼠的Smad1、Runx2、OSX蛋白含量升高(P<0.05)。结论 益骨汤可能通过激活BMP2经典信号通路及抑制Noggin的高表达,促进骨形成和防治骨质疏松。
[关键词] 益骨汤;去势大鼠;骨质疏松;BMP2经典信号通路;Noggin
[中图分类号] R33 [文献标识码] A [DOI] 10.3969/j.issn.1673-9701.2024.06.017
Effect of Yigu decoction on classical BMP2 signaling pathway in bone tissue of ovariectomized rats
LIN Xiaofang1, FANG Fang2, LI Guijin3, YAO Xinmiao3
1.Department of Orthopedics, Taizhou Hospital of Zhejiang Province, Linhai 317000, Zhejiang, China; 2.Laboratory of Acupuncture Neurobiology, the Third Clinical School of Medicine, Zhejiang Chinese Medicine University, Hangzhou 310053, Zhejiang, China; 3.Department of Orthopaedics, the Third Affiliated Hospital of Zhejiang Chinese Medicine University, Hangzhou 310053, Zhejiang, China
[Abstract] Objective To observe the impact of Yigu decoction on the classic bone morphogenetic protein (BMP)2 signaling pathway in rat bone organization, aim to explore the mechanism of Yigu decoction in preventing and treating osteoporosis (OP). Methods A total of 44 12-week-old female Wistar rats were randomly divided into four groups, with 11 rats in each group. The normal group did not receive any treatment, while the model group, estradiol valerate group and Yigu decoction group were castrated to simulate osteoporosis. After successful modeling, the rats were gavaged with 10ml/kg double steamed water (normal group, model group), 0.36mg/kg estradiol valerate aqueous solution, and 10ml/kg Yigu decoction, once a day. After 12 weeks, bone mineral density (BMD) of the femur was measured by dual-energy X-ray absorptiometry, real-time quantitative PCR was used to detect the expression levels of BMP2, Smad1, Runx2, and OSX genes in the BMP2 classical signaling pathway. Immunohistochemistry and Western blot were used to detect the expression levels of BMP2, Smad1, Runx2, and OSX proteins in the BMP2 classical signaling pathway. Results ①The bone mineral density (BMD) of the femur measured by dual-energy X-ray absorptiometry showed that compared with the model group, the BMD of the Yigu decoction group was significantly increased (P<0.01). ②Using real-time quantitative PCR, it was found that compared with the model group, the expression levels of BMP2, Smad1, Runx2, and Noggin genes in the Yigu decoction group were significantly increased (P<0.05). ③Immunohistochemistry showed that the protein expression levels of BMP2, Smad1, Runx2 and OSX in Yigu decoction group were increased than those in model group (P<0.05). ④Western blot showed that the protein expression of Smad1, Runx2 and OSX in Yigu decoction group were higher than those in model group (P<0.05). Conclusion Yigu decoction may promote bone formation and prevent and treat osteoporosis by activating the classical BMP2 signaling pathway and inhibiting the high expression of Noggin.
[Key words] Yigu decoction; Ovariectomized rats; osteoporosis; BMP2 classic signaling pathway; Noggin
骨质疏松症(osteoporosis,OP)是一种常见的全身性骨骼疾病,其特点是骨量低、骨组织微结构损坏,导致骨脆性增加,影响骨骼的强度和健康[1]。据估计,全世界约18%的女性和6%的男性因OP引起髋部脆性骨折[2]。笔者团队研究发现益骨汤含药血清促成骨细胞增殖、分化及矿化,具有抑制骨吸收、加快骨形成、上调BMP2和Noggin基因表达的作用,但具体机制尚不明确[3-5]。
研究显示骨形态发生蛋白(bone morphogenetic protein,BMP)2信号传导涉及包括骨形成在内的许多生理过程。在BMP家族中,BMP2被认为是骨发育调控中最重要的一员,BMP2的缺失将导致骨形成的严重受损[6-7]。转化生长因子-β(transforming Growth Factor Beta,TGF-β)和BMP是调节细胞生长、发育和分化过程的重要信号分子。Smads蛋白家族在TGF-β和BMP信号转导中发挥关键作用,它们将这些信号从细胞膜传递到细胞核,从而调控基因的表达[8]。Runt转相关转录因子2(Runt-related transcription factor2,Runx2)、OSX是BMP2途径中的下游基因,控制成骨细胞分化和骨形成发育,而Noggin是由间质表达的BMP信号通路的一种蛋白抑制剂[9-10]。在前期研究的基础上,本研究选取去势大鼠作为研究对象,测定其股骨骨密度(bone mineral density,BMD)及BMP2、Smad1、Runx2、OSX等基因及蛋白含量,同时观察Noggin基因的表达量,旨在探究益骨汤防治骨质疏松的作用机制。
1 材料与方法
1.1 药物、仪器与试剂
药物:戊酸雌二醇(批准文号:国药准字J20170009,生产单位:拜耳医药保健有限公司,规格:1mg)。益骨汤是姚新苗医师多年临床经验总结的中药方剂,药物组成为淫羊藿15g、生地15g、骨碎补15g、补骨脂10g、丹参30g和山药15g,以上药物均购自浙江中医药大学中山医院,为方便使用将方剂熬制成按原生药计2g/ml的口服液[11-12]。本研究中使用的X射线BMD仪由美国LUNAR公司生产,实时聚合酶链反应(polymerase chain reaction,PCR)仪由安捷伦公司生产。总RNA提取试剂盒购自杭州宝赛生物科技有限公司(批号:RE02050);反转录试剂盒购自杭州宝赛生物科技有限公司(批号:RT02020);3,3-二氨基联苯胺(3,3-diaminobenzidine,DAB)显色试剂盒购自武汉博士德生物工程有限公司(批号:SA2023);BCA蛋白定量试剂盒购自天根生物科技有限公司(批号:PA115-1);荧光定量试剂盒购自杭州宝赛生物科技有限公司(批号:PM10003);抗BMP2抗体购自Proteintech Group,INC(批号:18933-1- AP);抗Smad1抗体购自Abcam(批号:ab40854);抗Runx2抗体购自Abcam(批号:ab133261);抗OSX抗体购自Abcam(批号:ab94744);抗Actin抗体购自Abcam(批号:ab8227)。山羊抗兔抗体购自Abcam(批号ab97200)。本研究经浙江中医药大学实验动物管理与伦理委员会审批通过(伦理审批号:ZSLL-2017-002)。
1.2 动物模型制备及分组
选取12周龄清洁级健康雌性Wistar大鼠44只,随机分为四组,每组11只[许可证号:SCXK(沪)2017-0016,合格证编码:2017001806499]。大鼠饲养于浙江中医药大学动物实验中心,动物中心设施许可证号:SYXK(浙)2017-0184。
大鼠以氯氨酮腹腔注射麻醉,剂量为5μg/100g,除正常组外,其余三组大鼠去除双侧卵巢,以青霉素4×104U/(只·d)肌内注射预防感染,连续3d。
1.3 干预方法
大鼠在术后喂养12周后,从第13周开始给药。正常组和模型组大鼠接受10ml/kg的双蒸水灌胃;戊酸雌二醇组大鼠接受0.36mg/kg的戊酸雌二醇灌胃;益骨汤组大鼠接受10ml/kg的益骨汤灌胃。灌胃持续12周。
1.4 BMD测定
颈椎脱臼法处死大鼠后,从大鼠的右侧股骨取材,使用双能X射线BMD仪测定股骨干骺端的BMD。
1.5 骨组织病理学观察
取大鼠右股骨,进行石蜡包埋、切片,厚度为5mm,行苏木精-伊红染色(hematoxylin-eosin staining,HE染色),光镜下观察。
1.6 PCR法检测BMP2信号通路相关基因表达
Trizol一步法提取总RNA,检测紫外光OD260/280比值,>1.8且<2.0者留用。總RNA逆转录为cDNA:
按照试剂盒(杭州宝赛生物科技有限公司,批号:RT02020)反应条件进行逆转录,取20μl引物,加入1μg RNA,然后42℃反应45min,再70℃反应10min,完成逆转录。荧光定量PCR:按试剂盒(杭州宝赛生物科技有限公司,批号:PM10003)要求进行操作,反应条件为94℃ 1min进行预变性,95℃ 10s变性,58℃10s退火,72℃10s延伸,40次循环。每组5只大鼠。根据2-△△Ct方法计算获得相对定量结果,见表1。
1.7 免疫组化法检测BMP2信号通路相关蛋白表达
取大鼠右股骨经过石蜡包埋、烘箱中烤片、二甲苯脱蜡处理,经梯度乙醇水化,PBS溶液清洗3次,每次5min;予牛血清白蛋白封闭抗体,加入抗BMP2抗体,抗Smad1抗体,抗Runx2抗体和抗OSX抗体,4℃过夜孵育;PBS溶液清洗3次,每次5min,加入山羊抗兔抗体;滴加新鲜配置的DAB显色液,晾干,封片[11]。
1.8 Western blot技术
取大鼠右股骨置于裂解液中进行超声粉碎,离心机离心,去上清液进行蛋白浓度测定;蛋白电泳转印至PVDF膜,加入抗BMP2抗体,抗Smad1抗体,抗Runx2抗体,抗OSX抗体,4℃冰箱中孵育过夜;PBS溶液清洗干净后,加入山羊抗兔抗体,室温孵育2h;化学发光显色液(enhanced chemiluminescence Substrate,ECL)显色,使用Image Quant LAS 4000分析仪拍照分析,比较BMP2、Smad1、Runx2、OSX蛋白的相对表达水平。
1.9 统计学方法
采用SPSS 19.0统计学软件对数据进行处理分析。计量资料以均数±标准差(![]() )表示,采用單因素方差分析,若方差不齐则采用Dunnettts T3检验。P<0.05为差异有统计学意义。
)表示,采用單因素方差分析,若方差不齐则采用Dunnettts T3检验。P<0.05为差异有统计学意义。
2 结果
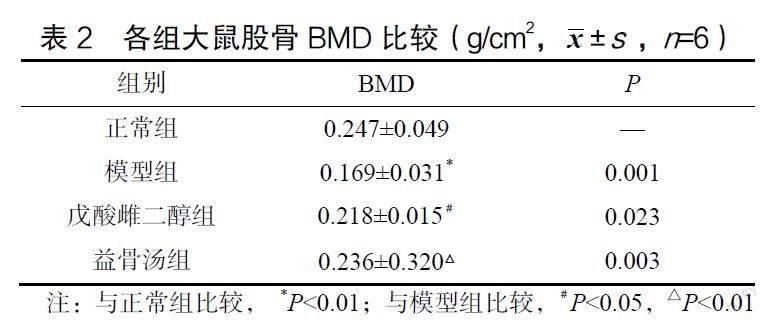
2.1 BMD测量结果
与正常组比较,模型组大鼠的BMD明显降低,差异有统计学意义(P<0.01);戊酸雌二醇组大鼠的BMD有所上升,差异有统计学意义(P<0.05);益骨汤组大鼠的BMD显著上升,差异有统计学意义(P<0.01)。益骨汤组与戊酸雌二醇组比较,益骨汤组大鼠的BMD有所上升,但差异无统计学意义(P>0.05)。结果表明戊酸雌二醇和益骨汤均可有效改善去势大鼠的低BMD状态,且两组间的效果比较差异无统计学意义,见表2。
2.2 大鼠股骨HE染色结果
在光学显微镜下观察,正常组大鼠的骨小梁形态结构呈现出更完整的状态,骨小梁连接成网状,骨髓腔较小。相比之下,模型组大鼠的骨质显得较为薄弱,骨髓腔有所扩大,骨小梁变细且总量明显减少,骨小梁之间的连接性也较差。戊酸雌二醇组和益骨汤组大鼠的骨髓腔相对于模型组有所减小,且戊酸雌二醇组和益骨汤组大鼠的骨小梁更粗壮、饱满。
2.3 各组大鼠股骨组织BMP2信号通路相关mRNA表达量
与模型组比较,戊酸雌二醇组大鼠的BMP2、Smad1和Noggin基因表达量均有所上升,差异有统计学意义(P<0.05)。益骨汤组大鼠的BMP2、Smad1、Runx2和Noggin基因表达量也有所上升,差异有统计学意义(P<0.05)。表明戊酸雌二醇和益骨汤均可提高去势大鼠股骨组织中BMP2、Smad1和Noggin基因的表达量,见表3。
2.4 免疫组化法检测各组大鼠股骨组织BMP2信号通路相关蛋白表达量
与正常组比较,模型组大鼠的BMP2、Smad1、Runx2和OSX的积分光密度(integrated optical density,IOD)值均有所降低,差异有统计学意义(P<0.05);戊酸雌二醇组大鼠的BMP2、Smad1和OSX的IOD值有所上升,与模型组比较差异有统计学意义(P<0.05),表明戊酸雌二醇可改善蛋白的表达。益骨汤组大鼠的Runx2和OSX的IOD值有所上升,与模型组比较差异有统计学意义(P<0.05),表明益骨汤可改善蛋白的表达。值得注意的是,戊酸雌二醇和益骨汤在调控BMP2、Smad1、Runx2和OSX蛋白表达量方面差异无统计学意义(P>0.05),见表4和图2。
2.5 Western blot法检测各组大鼠股骨组织BMP2信号通路相关蛋白表达量
与正常组比较,模型组大鼠的BMP2、Smad1、Runx2和OSX蛋白含量均有所降低,差异有统计学意义(P<0.05);戊酸雌二醇组大鼠的BMP2、Smad1、Runx2和OSX蛋白含量上升,与模型组比较差异有统计学意义(P<0.05);益骨汤组大鼠的Smad1、Runx2和OSX蛋白含量有所上升,与模型组比较差异有统计学意义(P<0.05),见表5和图3。
3 讨论
OP是最常见的骨重建疾病,其发病率随年龄的增长而增加,其特征是骨骼受损,从而导致骨折风险增加[13-15]。目前OP最常用的治疗是雌激素替代疗法,可明显提高骨量,但长期应用存在并发乳腺癌、子宫内膜癌、子宫平滑肌瘤、静脉血栓等风险[16]。近年来,具有类雌激素作用的天然药物如戊酸雌二醇,副作用较雌激素小,成为治疗OP的研究热点,但有情绪抑郁、乳胀等副作用[17-18]。
中医补肾益精法治疗OP临床疗效较好[19]。益骨汤由补骨脂、骨碎补、淫羊藿、丹参、生地、山药等组成。前期研究表明益骨汤含药血清可改善骨质疏松血瘀病理状态,提高去势大鼠痛域[20-21]。本研究发现戊酸雌二醇、益骨汤均可提高去势大鼠股骨BMD,改善去势大鼠OP状态。
BMP是TGF-β超家族的成员,是由成骨细胞合成的独特的细胞外多功能信号细胞因子,具有广泛的生物学活性,特别是在骨骼和软骨的生长发育、重建及修复过程中发挥关键作用[22]。本研究中益骨汤对BMP2基因表达有较大影响,但对其蛋白表达量影响不显著。笔者推测益骨汤可能不直接提高BMP2的表达量,而是通过促进BMP2与其他物质形成复合物,从而调控BMP2/Smads通路。Smads蛋白在将TGF-β信号从细胞表面受体传导至细胞核的过程中发挥关键作用[21]。TGF-β作为一种重要的生长因子,可与细胞表面的受体形成复合物,进而激活Smads蛋白。Smads蛋白磷酸化后,与其他Smads蛋白结合形成复合物,进入细胞核。在细胞核内,Smads复合物可与DNA结合,调控靶基因的转录[23]。本研究结果表明益骨汤、戊酸雌二醇均可提高Smad1基因及蛋白的表达量,益骨汤可启动BMP2/Smads信号通路的表达。Smads与Runx2相互作用可诱导成骨细胞分化[24-25]。Runx2可调控成骨细胞分化早期基因骨碱性磷酸酶的表达,促进成骨祖细胞分化为成骨细胞前体细胞[26]。OSX转录受Runx2正性调控,OSX在所有发育的骨细胞和成骨细胞中表达,可启动成骨基因[27-29]。本实验结果表明戊酸雌二醇、益骨汤可提高Runx2、OSX基因及蛋白的表达量,但免疫组化检测结果中益骨汤组大鼠的Runx2蛋白、戊酸雌二醇组大鼠的OSX蛋白只有增高趋势,这可能是由于免疫组化法只检测部分组织的蛋白含量所造成的实验误差。BMP激活Smads后通过远端启动子和近端启动子启动Runx2的表达,BMP在一定条件下可诱导Runx2的表达,但BMP并不賴于Runx2的表达,还存在BMP-2/ Smads/Msx2/OSX信号通路,OSX表达也同时受Runx2、Msx2的双重调控,因此益骨汤也可能通过BMP-2/Smads/Msx2/OSX信号通路发挥作用[29-30]。本实验仅研究了益骨汤对BMP2经典通路的影响,而对于BMP2其他相关的通路还需进一步研究。Noggin是由间质表达的BMP信号通路的一种蛋白抑制剂,Noggin可特异性结合和抑制BMP,从而影响机体骨、软骨和关节等正常发育[31]。本研究结果表明戊酸雌二醇、益骨汤均可抑制Noggin基因的高表达。笔者推测益骨汤抑制Noggin基因的高表达可能是益骨汤防治OP的另一作用机制。
综上,益骨汤防治骨质疏松的作用机制是通过BMP2经典信号通路调控Smad1、Runx2、OSX基因及蛋白的表达,并抑制Noggin基因的高表达,达到双重的抗骨质疏松的作用,但益骨汤对去势大鼠的治疗作用可能还存在其他相关的分子通路。本课题组未来将进一步通过体外细胞实验来阐述益骨汤对BMP2经典信号通路的调控作用,并进一步明确益骨汤防治骨质疏松过程中相关分子通路之间的相互作用关系。
利益冲突:所有作者均声明不存在利益冲突。
[参考文献]
[1] Nih Consensus Development Panel On Osteoporosis Prevention DAT. Osteoporosis prevention, diagnosis, and therapy[J]. JAMA, 2001, 285(6): 785–795.
[2] PISCITELLI P, IOLASCON G, GIMIGLIANO F, et al. Incidence and costs of hip fractures compared to acute myocardial infarction in the Italian population: A 4-year survey[J]. Osteoporos Int, 2007, 18(2): 211–219.
[3] 姚新苗, 冷涛, 张云鹏. 益骨口服液含药血清对成骨细胞增殖分化及矿化功能的影响[J]. 中国中医骨伤科杂志, 2010, 18(1): 6–8.
[4] 姚新苗, 杨林, 王靖, 等. 益骨汤对去势大鼠血清激素水平、骨密度和骨生物力学影响的实验研究[J]. 中医正骨, 2006 (1): 3–4.
[5] 李威, 姚新苗, 李晓亚, 等. 益骨汤对骨质疏松大鼠骨密度及BMP-2信号通路的影响[J]. 云南中医学院学报, 2016, 39(6): 5–9.
[6] ZHANG X, CHEN K, WEI B, et al. Ginsenosides Rg3 attenuates glucocorticoid-induced osteoporosis through regulating BMP-2/BMPR1A/Runx2 signaling pathway[J]. Chem Bio Interact, 2016, 256: 188–197.
[7] BANDYOPADHYAY A, TSUJI K, COX K, et al. Genetic analysis of the roles of BMP2, BMP4, and BMP7 in limb patterning and skeletogenesis[J]. PLoS Genet, 2006, 2(12): e216.
[8] NOHE A. Signal transduction of bone morphogenetic protein receptors[J]. Cell Signal, 2004, 16(3): 291–299.
[9] NAGEL A K, BALL L E. O-GlCNAC modification of the runt-related transcription factor 2 (Runx2) links osteogenesis and nutrient metabolism in bone marrow mesenchymal stem cells[J]. Mol cellular proteomics, 2014, 13(12): 3381.
[10] NOVINA C D, SHARP P A. The RNAi revolution[J]. Nature, 2004, 430(6996): 161–164.
[11] 林曉芳, 姚新苗, 李威, 等. 益骨汤对去势大鼠骨组织Wnt/β-catenin经典信号通路的影响[J]. 浙江中医药大学学报, 2018, 42(2): 97–104.
[12] 姚新苗, 黄绳武, 施昕磊, 等. 益骨口服液的制备及临床应用[J]. 中国现代应用药学, 2009, 26(12): 1034–1037.
[13] STOMATI M, BEMARDI F, LUISI S, et al. Conjugated equine estrogens, estrone sulphate and estradiol valerate oral administration in ovariectomized rats: Effects on central and peripheral allopregnanolone and beta-endorphin[J]. Maturitas, 2002, 43(3): 195–206.
[14] 熊远珍. 实验动物与人用药量的新换算[J]. 江西医学院学报, 1997 (4): 41.
[15] KHOSLA S, RIGGS B L. Pathophysiology of age-related bone loss and osteoporosis[J]. Endocrin Metab Clin North Am, 2005, 34(4): 1015–1030.
[16] BOONEN S, FERRARI S, MILLER P D, et al. Postmenopausal osteoporosis treatment with antiresorptives: Effects of discontinuation or long-term continuation on bone turnover and fracture risk--a perspective[J]. J Bone Miner Res, 2012, 27(5): 963–974.
[17] ZHANG J, LI G, CHAN C, et al. Flavonoids of Herba Epimedii regulate osteogenesis of human mesenchymal stem cells through BMP and Wnt/β-catenin signaling pathway[J]. Mol Cell Endocrinol, 2010, 314(1): 70–74.
