PD-1单抗联合芦可替尼治疗复发/难治成人EB病毒相关噬血细胞综合征1例*
2024-03-14李琬婷周明刘灿陈建军谭熹陈钊
李琬婷 周明 刘灿 陈建军 谭熹 陈钊
湖南师范大学附属第一医院(湖南省人民医院)血液科,长沙 410005
噬血细胞综合征(hemophagocytic lymphohistiocytosis,HLH)是一种以发热、肝脾大、黄疸、出血、全血细胞减少、肝功能异常、凝血障碍、骨髓和其他组织中可发现噬血细胞为特征[1]的高炎症综合征。病毒感染是成人HLH最常见的诱因,以EB病毒相关(EBV)HLH最为常见,占43%,预后差,治疗效果不理想[2]。目前EBV-HLH无标准治疗,最常用含依托泊苷和地塞米松的HLH-94/04方案[3],但是患者一般很快复发[4]。抗病毒药物疗效不佳,对复发/难治(R/R)的EBV-HLH来说,allo-HSCT是唯一的潜在治愈性手段[5]。在小鼠HLH模型中使用芦可替尼可减轻炎症反应[6]。单用程序性死亡受体1(PD-1)单抗为R/R EBV-HLH提供了一种潜在的治愈方法[7]。基于PD-1单抗、芦可替尼单药应用于EBV-HLH患者的国内外研究,我们使用PD-1单抗联合芦可替尼治疗1例成人复发/难治EBV-HLH,报道如下。
资料与方法
1 一般资料
患者,男,29岁,因反复发热19天于2023年2月21日入院。患者入院前反复发热,热峰40℃,对症支持治疗后发热未见好转,4天前全身皮肤出现红色皮疹,反复发热伴寒战。为求诊治来我院。体格检查:体温37.7℃,前额及脸颊两侧可见集中大片红色皮疹,全身皮肤可见散在红色出血点,无浅表淋巴结及肝脾肿大,无胸骨压痛。进一步检查:WBC 1.25×109/L,HGB 83 g/L,PLT 28×109/L;铁蛋白26 640.00 ng/mL,纤维蛋白原1.13 g/L,sCD25(pg/mL):159060。EBV-DNA 2.28×105拷贝/mL,B超显示脾大,厚42 mm。NK细胞活性:13.06%。骨髓活检骨髓增生极度活跃,淋巴细胞增生伴EBV阳性及噬血现象,符合EBV相关噬血细胞综合征改变:淋巴细胞增多(T、B淋巴细胞均可见,T淋巴细胞为主),散在或片状分布,少数细胞胞体大,核不规则,染色质偏细致,可见核仁,考虑为活化的免疫母细胞;巨噬细胞增多,可见吞噬核碎屑及噬血现象。免疫组化:CD20散在+,pax-5散在+,CD2散在或片状+,CD3散在或片状+,CD5散在或片状+,CD7散在或片状+,CD4大部分+,CD8大部分+,cyclinD1少数+,BCL2散在+,BCL6个别+,MUM1少数+,CD30个别+,c-myc少数+,ALK-,EMA少数+,CD45+,CD15粒细胞+,TIA1少部分+,Granzyme B少部分+。原位杂交:EBER(+)(见图1)。骨髓涂片示骨髓增生活跃,巨核细胞可见,血小板分布少,可见噬血细胞(见图1),幼淋3%,结合免疫组化考虑淋巴细胞反应性增生可能性大。流式细胞学:淋巴细胞约占有核细胞的8.6%,中性粒细胞约占有核细胞的63.2%,单核细胞约占有核细胞的0.1%,免疫表型未见异常。骨髓细胞TCR及IGH基因重排:阴性。骨髓染色体核型分析:核型:46,XY,inv(9)(p12q13)c;分析20个中期分裂相,均存在一条9号染色体臂间倒位,为体质性遗传学多态性。患者符合HLH-2004全部诊断标准[8]诊断为HLH,患者骨髓活检可见异常淋巴瘤细胞,鉴于淋巴瘤继发HLH的风险,征得患者及家属知情同意并签署知情同意书后,2月23日改用E-CHOP方案(依托泊苷100 mg d2-3+环磷酰胺1 200 mg d1+多柔比星40 mg d1+长春瑞滨40 mg d1+地塞米松15 mg d2-d5)联合芦可替尼10 mg/d抑制炎症风暴,体温降至正常,出院后继续口服激素及芦可替尼10 mg/d。4周后出现胸骨后疼痛,无发热,血红蛋白 104(g/L),sCD25:2196;NK细胞活性:13.01%,铁蛋白947.70(ng/mL),EBV-DNA 1.312×102拷贝/mL,因患者骨髓活检免疫组化淋巴瘤依据不足,诊断为EBV-HLH,初诊EBV-HLH患者使用DEP方案缓解率高于HLH-94方案[9],3月27日予以DEP方案联合芦可替尼10 mg/d后达到部分缓解,血常规未完全正常,继续芦可替尼10 mg/d维持治疗。3周后再次发热,铁蛋白17 107.03(ng/mL),WBC 2.78×109/L,PLT 22×109/L;EBV-DNA 1.661×105拷贝/mL,考虑EBV-HLH复发,4.29予以芦可替尼10 mg /d+DEP方案挽救治疗一疗程。芦可替尼10 mg/d维持治疗4周后发热,复查WBC 1.55×109/L,HGB 82 g/L,PLT 52×109/L,铁蛋白2 410.00(ng/mL),EBV-DNA 8.747×104拷贝/mL。患者现仍未达到部分缓解,考虑R/R EBV-HLH。
2 方法
患者2月23日—6月1日持续应用芦可替尼10 mg/d维持治疗,治疗期间未出现药物所致骨髓抑制予减低剂量调整,6月1日起给予信迪利单抗200 mg联合芦可替尼10 mg/d治疗。1个治疗周期后患者血小板计数恢复正常范围,后继续于7月3日、7月24日芦可替尼加量至30 mg/d同时联合信迪利单抗200 mg诱导治疗2周期后,完善血浆和外周血单个核细胞(PBMC)EBV-DNA拷贝水平、血细胞计数、铁蛋白、丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)和肌酐(Cr)水平等检查评估,后8月17日、9月7日、9月28日予以信迪利单抗单药维持治疗3疗程。共计6个疗程。患者治疗经我院伦理委员会批准([2023]-35.2)并知情同意。
结 果
PD-1单抗联合芦可替尼诱导治疗2个疗程后,血浆EBV-DNA转阴,炎症很快得到控制,治疗期间血象变化见图2,铁蛋白、甘油三酯、纤维蛋白原变化见图3,EBV-DNA及体温变化趋势见图4,肝肾功能等不良反应评估见图5,炎症因子变化等见表1,EBV分选结果见表2,外周血淋巴细胞亚群变化见图6,2个周期后评估病情进展为完全缓解。后续4个疗程患者每3周一次接受信迪利单抗200 mg维持治疗。现无发热,血象正常,铁蛋白及血浆EBV-DNA持续阴性,脾38 mm×103 mm较前缩小,疾病状态稳定,未出现肝肾功能不全及噬血活动症状。治疗结束后患者被评估为持续完全缓解。目前该患者持续跟踪随访中。

表1 治疗期间炎症因子等指标变化

表2 EBV分选检查结果
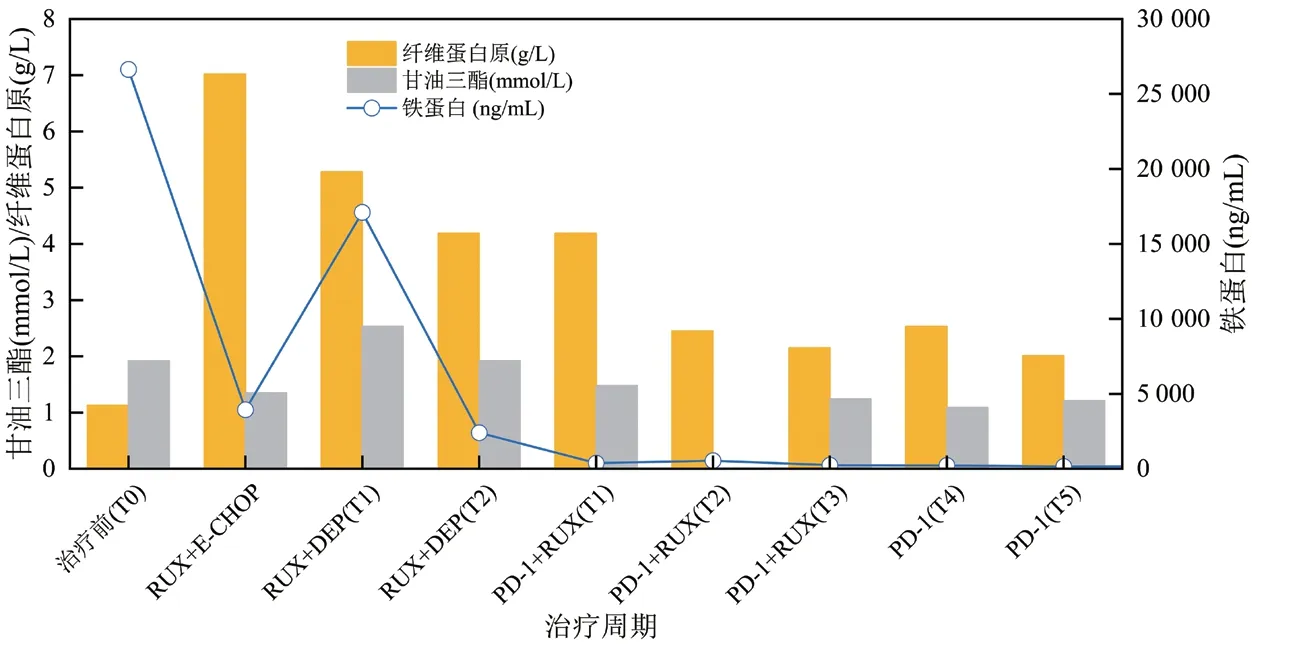
图3 铁蛋白、甘油三酯、纤维蛋白原变化
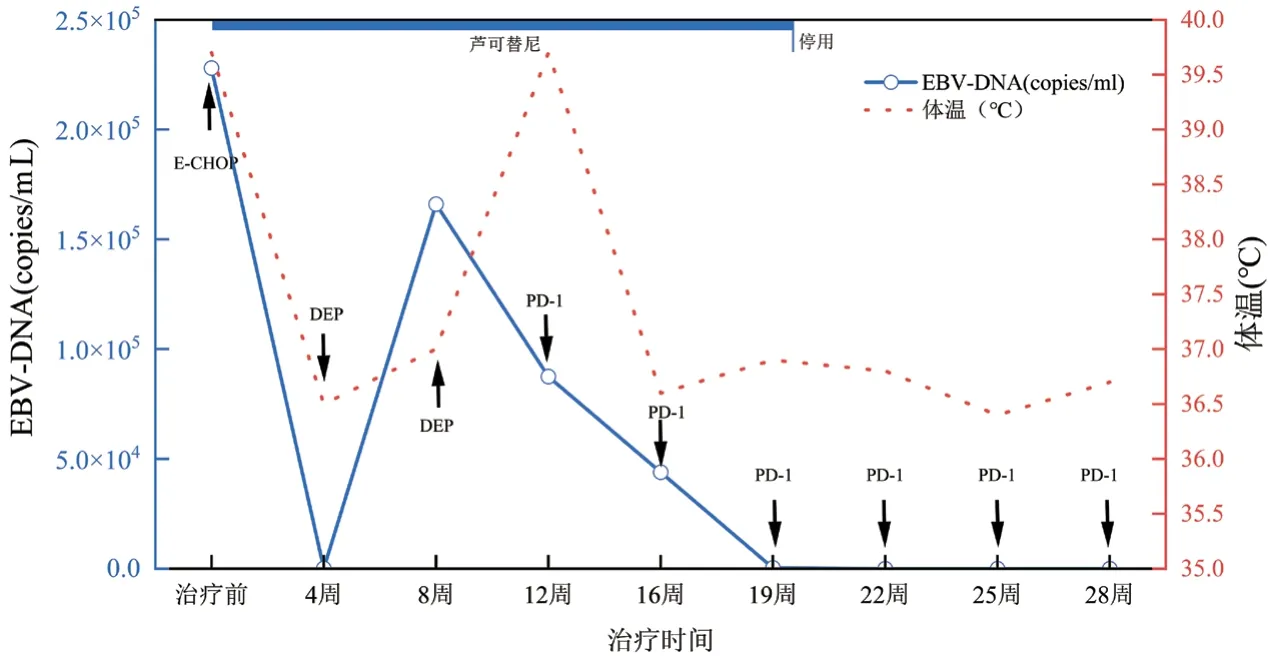
图4 血浆EBV-DNA及体温变化趋势图
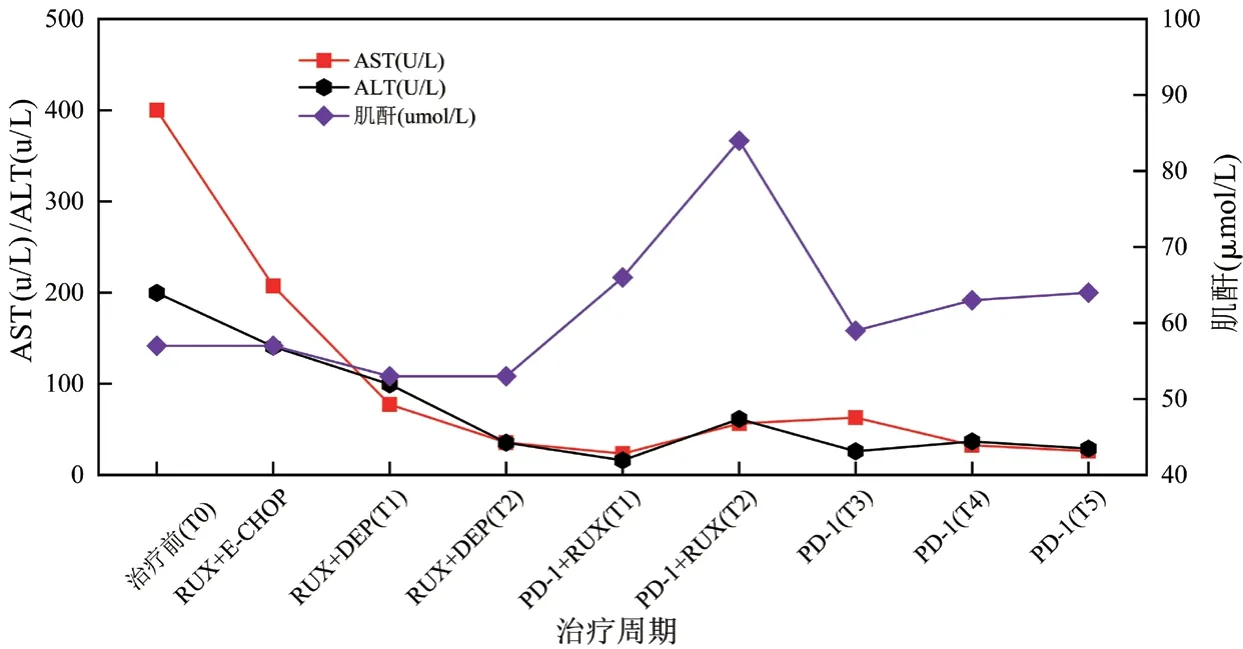
图5 治疗期间肝肾功能变化趋势图
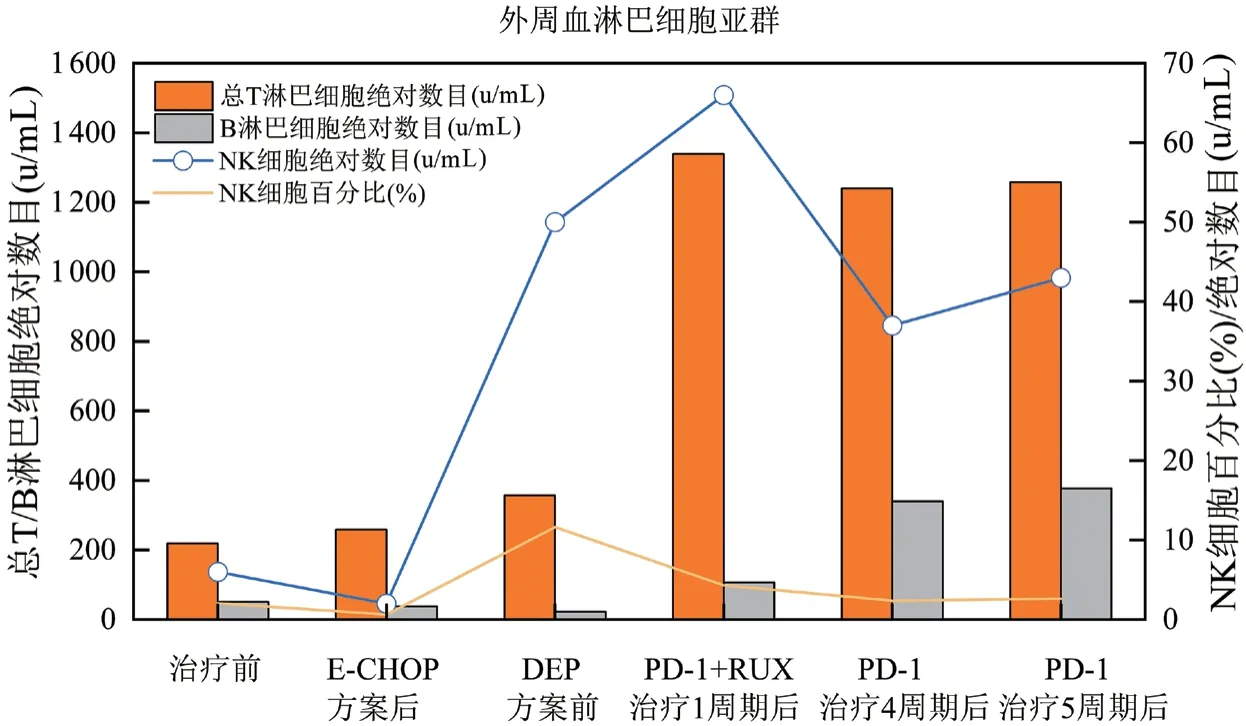
图6 外周血淋巴细胞亚群变化
讨 论
由于EBV对人类普遍易感,无论一线HLH-94方案还是挽救方案DEP治疗,成人EBV-HLH患者均易复发,复发后需行allo-HSCT方有机会治愈。但供者有限,还会导致严重并发症,影响患者长期生存和生活质量。因此,EBV-HLH需要更好的治愈性治疗策略。
HLH的发生机制是各种病因诱发机体的免疫系统紊乱,导致T细胞和巨噬细胞过度激活,生成大量细胞因子,细胞因子渗透至各个器官造成组织损伤和吞噬血细胞。EBV-HLH的病理生理机制是EB病毒感染的CTL、自然杀伤细胞功能缺陷、增殖异常致高细胞因子血症和巨噬细胞活化引起组织损伤[10]。JAK激酶是细胞因子受体的下游通路,通过JAK/STAT通路传导信号,IL-6、IL-10和IFN-γ等细胞因子均可激活JAK1/2通路,使与受体偶联的JAK相互靠近并发生磷酸化,激活信号通路,进一步激活下游的STAT5,最终使IL-6、IL-10和IFN-γ的转录增加,引发细胞因子风暴[11]。芦可替尼(JAK1/2通道抑制剂)可通过调节JAK1/2降低多种细胞因子来缓解HLH。2019年公布了国际上首次探索芦可替尼在成人HLH患者中有效性和安全性的前瞻性研究[12],初步确认了其疗效和安全性。2022年研究[13]说明了芦可替尼治疗儿童HLH的安全性与有效性,CR为73.1%,在42.3%患者中达到持续CR,且EBV-HLH患者最敏感,ORR为87.5%,耐受性良好。目前,临床已证实大剂量芦可替尼可作为HLH的挽救治疗,小剂量芦可替尼作为R/R HLH缓解后、allo-HSCT治疗前的桥接治疗[14]。
EBV编码的BART11和BART17-3p分别靶向抑制FOXP1和PBRM1这两个转录调控蛋白,而FOXP1和PBRM1能共同结合于PD-L1的增强子区并抑制PD-L1表达,因此可上调PD-L1表达,促进EBV相关肿瘤发生免疫逃逸[15]。2020年LIU[7]使用PD-1单抗治疗7例R/R EBV-HLH。患者均耐受治疗,6例有效,5例获得临床完全缓解,EBV-DNA在4例患者中被完全清除,PD-1单抗扩增PD1+T细胞,并恢复CD8+T细胞中HLH相关脱颗粒和共刺激基因的表达,表示PD-1单抗为EBV-HLH提供了一种潜在的治愈方法。2021年的研究也发现PD-1单抗可使功能耗竭的CTL恢复杀伤活性,控制病毒载量、改善HLH临床进程[16]。2022年报道了一例成功应用PD-1单抗治疗的allo-HSCT后复发的EBV-HLH病例[17]。基于最新文献报道:PD-1单抗、芦可替尼可分别通过清除病毒、减少病理性细胞因子、降低炎症反应治疗EBV-HLH。因此,我们对一名R/R EBV-HLH患者使用PD-1单抗联合芦可替尼治疗。
本文中患者在DEP治疗后复发,改用PD-1单抗联合芦可替尼短期内血象可恢复正常,脱离输血依赖,细胞因子及器官功能逐渐恢复,疗效维持至治疗第28周未复发。该方案控制炎症风暴比传统化疗方案更快,骨髓毒性更小,不易复发。患者在治疗前可能因疾病活动导致转氨酶升高,治疗后逐渐下降。在整个治疗过程中安全性良好,对机体免疫功能无抑制作用。在接受信迪利单抗治疗后,急性期临床症状得到明显缓解,体温下降至正常范围,脾较前缩小,sCD25、铁蛋白、甘油三酯、血细胞、纤维蛋白原等指标恢复正常,达到完全缓解。EBV-DNA拷贝水平是EBV相关恶性疾病的重要评价指标[18],该患者在接受PD-1单抗治疗后,2个周期后血浆EBV-DNA转阴,对于细胞内EBV-DNA而言,治疗3周期后,T细胞内未检测到病毒,B细胞内EBV总体呈减低趋势,未完全转阴,这可能因HLH患者的CTL在刺激后表达较高水平的功能衰竭标志物PD-1,抗PD-1可恢复CTL功能,有效清除感染细胞[19],而对B细胞而言,治疗后胞内EBV-DNA呈下降趋势,仍有效果,因监测时间较短,后患者因经济原因拒绝行EBV-DNA分选检测,随访至今患者血浆EBV-DNA持续阴性,若延长PD-1监测周期,有望彻底清除B淋巴细胞内病毒。并且EB病毒在记忆性B淋巴细胞中建立潜伏感染,会终生携带病毒[20]。这个也可能是B细胞中病毒更难清除的原因。EBV-HLH患者免疫细胞被病毒侵犯,引起炎症风暴及免疫细胞的过度耗竭,传统的化疗方案由于化疗药物的细胞毒性,消灭了被过度活化的免疫细胞,减轻了炎症风暴,同时也使得患者细胞免疫受到抑制,短时间机体难以恢复正常免疫功能,期间EBV复燃导致噬血复发。PD-1单抗联合芦可替尼治疗后患者外周血NK细胞绝对数目及比例恢复正常,总T淋巴细胞数目较化疗方案明显升高,提示细胞免疫功能改善。PD-1单抗联合芦可替尼治疗成人EBV-HLH可有效降低血浆EBV-DNA拷贝水平,控制患者的细胞因子风暴及急性活动期临床症状,为复发难治的成人EBV-HLH患者桥接移植提供机会,改善临床预后。新方案是否可能成为治愈EBV-HLH的无化疗方案,噬血活动期控制后,能否停用PD-1单抗,停用的标准是什么,这些问题有待进一步研究和探索。
综合以上数据,我们认为PD-1单抗联合芦可替尼有望成为成人复发/难治EB病毒相关噬血细胞综合征新的二线治疗药物选择。本报道尚属于探索性研究,仍然需要在规范的临床试验中进一步验证其疗效及安全性。
利益冲突所有作者均声明不存在利益冲突
