多模式MR 和多模式CT 影像学对急性脑梗塞介入治疗的临床效果和安全性影响
2024-03-14刘春娥李雯飞曹玉娟韩金玲王传明通讯作者
刘春娥,李雯飞,曹玉娟,韩金玲,李 巷,王传明(通讯作者)
(华中科技大学协和深圳医院〈南山医院〉神经内科 广东 深圳 518012)
急性脑梗死(acute cerebral infarction,ACI)为临床多发脑血管疾病,多发于中老年人群[1]。介入取栓术为ACI 重要治疗措施,中国急性缺血性卒中早期血管内介入诊疗指南2022 进一步提升血管内治疗推荐等级,前循环闭塞发病时间为6~24 h,经过严格的影像学筛选后可推荐血管内治疗[2]。同时,术前明确血管闭塞位置及直径、血流状态等,对保证介入治疗的有效性及安全性具有重要意义。多模式计算机断层扫描(multimodal computed tomography,mCT)及多模式磁共振(multimodal magnetic resonance,mMR)均为脑血管疾病重要的诊断评估技术,其中mCT 能迅速呈现责任血管闭塞情况与责任病灶的血流灌注情况,明确有无可挽救的缺血半暗带区域[3]。mMR 能参照水分子运动状态明确水分子扩散受限状况、细胞毒性水肿与血管源性水肿等情况,定量分析组织微细结构,为疾病治疗方案的制定提供参考依据[4]。本研究选取华中科技大学协和深圳医院121 例ACI 患者进行分组研究,现报道如下。
1 资料与方法
1.1 一般资料
选 取2021 年1 月—2023 年6 月华中科技大学协和深圳医院121 例ACI 患者作为研究对象,根据研究方案随机分为mCT 组(n=61)和mMR 组(n=60)。mCT 组男32 例,女29 例;年龄22~74 岁,平均年龄(57.38±7.82)岁。mMR 组中,男34 例,女26 例;年龄22~75 岁,平均年龄(56.64±8.12)岁。所有研究对象均签署临床研究知情同意书。
纳入标准:(1)符合ACI 诊断标准[5];(2)具备介入取栓指征;(3)年龄为18~80 岁;(4)发病至急诊室到院时间<24 h;(5)临床资料完整。排除标准:(1)凝血功能异常;(2)血糖异常增高;(3)纳入研究前3 个月内发生颅脑外伤;(4)存在重度代谢性疾病;(5)存在恶病质;(6)合并急慢性感染;(7)神经系统存在其他病者;(8)存在严重创伤或活动性出血。
1.2 研究方法
mCT 组:研究对象采集头颅CT、CTA、CTP 图像,设备选取GE REvolutionCT 256 排螺旋CT,首先实施CT 平扫,电流为350 mA,电压为120 kV,层间距为10 mm,层厚为2.5 mm;再实施CT 灌注成像,通过肘正中静脉经高压注射器以5 mL/s 速率注入50 mL 碘海醇(300 mgI/mL)+40 mL 生理盐水,层间距为5 mm,层厚为5 mm,间隔时间4 s,扫描速度为0.33 s/r,电流为125 mA,电压为80 kV,延迟4 s,扫描范围覆盖全脑,获取360 幅图像;间隔5 min 实施CT 血管成像,通过肘正中静脉经高压注射器以5 mL/s 速率注入60 mL碘海醇+20 mL 生理盐水,延迟时间18 s,采取螺旋扫描,电流为250 mA,电压为100 kV,螺距为0.946,层厚为0.8 mm,获取原始图像。图像后处理:所有图像传输至Philips Brilliance Portal V 5.0.1 工作站,采取Brain Perfusion 软件处理CT 灌注成像原始数据,以大脑前动脉作输入动脉,以上矢状窦作输出静脉,获取感兴趣区的时间-密度曲线,系统自动计算平均通过时间、达峰时间等伪彩图像及mismatch 图像;以AVA 软件处理CT 血管成像原始图像。根据多模式CT 资料筛选出符合急性脑梗死血管内治疗的病例,立即实施血管内治疗,均采用气管插管全身麻醉;首先超选择脑动脉造影明确闭塞部位、侧支循环及代偿状况,术者根据病史、体征及相关影像学等资料,自行选择直接吸引一次性通过技术或补救性支架取栓、球囊扩张、支架植入术,不限定神经介入材料及技术。
mMR 组:研究对象采集头颅MR 轴位FLAIR、DWI、ADC、SWI、ASL 序列,设备选取GE SIGNA Architect 3.0T MR 检查仪,矩阵128×128,视野230×230,层间隔1 mm,层厚5 mm;T1WI 参 数:TE 15 ms,TR 400 ms;T2WI 参 数:TE 105 ms,TR 3 500 ms;FLAIR 参 数:TE 175 ms,TR 10 000 ms;激励次数1 次,DWI 64 个方向施加敏感梯度:扫描时 间5 min42 s,矩 阵128×128,视 野230×230,层厚5 mm,层间隔1 mm,b值=0、1 000 s/mm2,TE 97 ms,TR 5 000 ms,激励次数1 次;所有图像传送至工作站,获取感兴趣区ADC 值及FA 值,明确不可逆损伤缺血组织体积和未梗死缺血脑组织体积;随后实施介入取栓治疗,具体操作同mCT 组。
1.3 观察指标
(1)神经功能:依据美国国立卫生研究院卒中量表(National Institute of Health stroke scale,NIHSS)、改良Rankin 量表(modified Rankin scale,mRS)评估。NIHSS 总分为42 分,分值越高神经功能损伤越严重;mRS 总分为6 分,分值越低越好。(2)治疗效果:NIHSS 下降≥90%,生活自理能力基本恢复正常为基本痊愈;NIHSS 下降45%~89%,生活自理能力显著改善但未正常为显效;NIHSS 下降18%~44%,生活自理能力有所改善为好转;NIHSS 下降<18%,生活自理能力无恢复为无效;NIHSS 增高>18%为恶化;基本痊愈、显效、好转计入总有效率。(3)不良反应。
1.4 统计学方法
通过SPSS 26.0 对数据进行分析,符合正态分布的计量资料采用均数±标准差(± s)表示,行t检验;计数资料采用频数和百分率[n(%)]表示,组间比较采用χ2检验。P<0.05 表示差异有统计学意义。
2 结果
2.1 神经功能
治疗后,两组NIHSS 及mRS 评分均较治疗前下降,且mMR 组较mCT 组低,差异有统计学意义(P<0.05)。见表1。
表1 两组治疗后神经功能比较(± s,分)
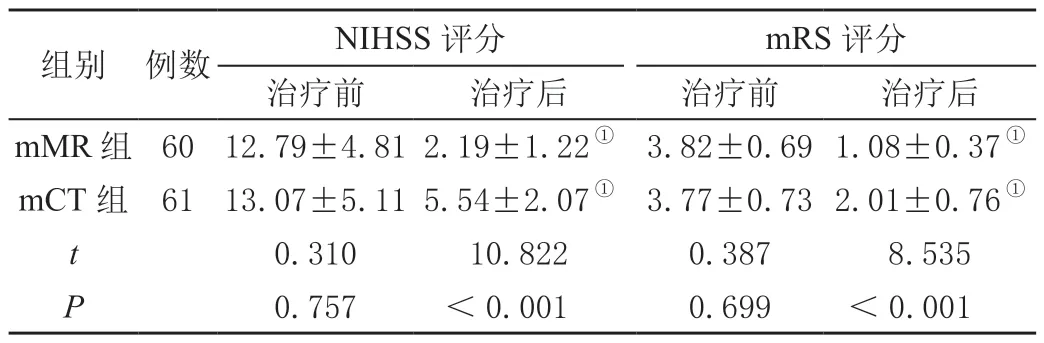
表1 两组治疗后神经功能比较(± s,分)
注:①与本组治疗前比较,P <0.05。
2.2 总有效率
mMR 组总有效率高于mCT 组,差异有统计学意义(P<0.05),见表2。
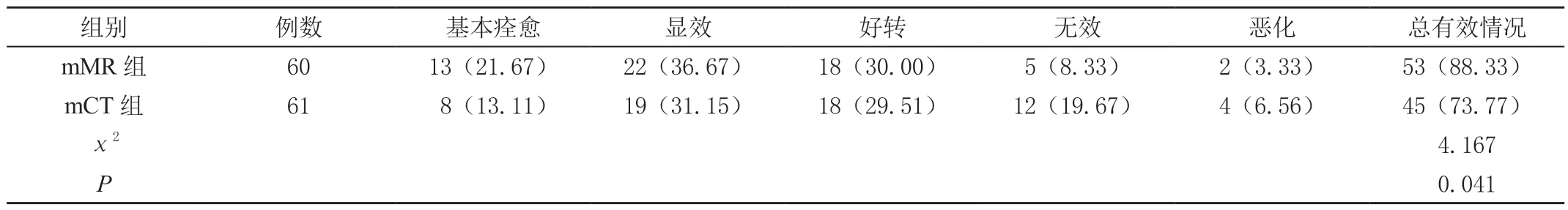
表2 两组总有效率比较[n(%)]
2.3 不良反应
mMR 组不良反应发生率低于mCT 组,差异有统计学意义(P<0.05),见表3。

表3 两组不良反应比较[n(%)]
3 讨论
介入取栓是ACI 闭塞血管开通的重要手段,其能迅速复通血管,且对内皮损伤小,加之其无药物禁忌,具备溶栓治疗不具有的优势,因此,在国内外得到了广泛应用。同时,既往临床多是在介入取栓前实施CT 平扫明确脑梗死灶、排除脑出血,但其难以在介入取栓前预先评估责任血管状况及责任区缺血半暗带范围,在一定程度上增加了ACI 介入取栓的难度及风险[6]。随着医疗技术的提升,mMR 和mCT 在多种疾病的诊疗评估中得到推广应用,其可有效弥补CT 平扫的不足,为疾病的诊疗提供参考依据。
本研究分别采取mMR 和mCT 辅助实施ACI 介入取栓术,结果显示,mMR 组NIHSS 和mRS 评分较mCT 组低,治疗总有效率较mCT 组高,不良反应发生率较mCT 组低(均P<0.05),表明mMR 和mCT 在ACI 介入取栓术中具有一定应用价值。而mMR 在促进ACI 患者神经功能康复、提升治疗效果方面更具显著优势,且有利于减少不良反应的发生,保证治疗有效性及安全性。分析其原因可能是:(1)mCT 能对ACI 予以早期、全面、准确的诊断,其中CT 平扫可排除未发生明显梗死的病灶及脑出血,CT 血管成像可直观呈现闭塞血管具体位置及直径大小,CT 灌注成像则可精准评估梗死核心区及半暗带脑组织血流灌注状态,从而为介入取栓提供术前评估信息;但mCT 在早期梗死病灶的识别中存在局限性,虽能显示异常灌注区,但不能准确识别新发梗死灶或陈旧性梗死灶,有时难以有效辨别分支动脉闭塞责任血管[7]。(2)mMR 能早期检出超急性与急性脑梗死患者脑部病变具体位置、半暗带情况、脑损伤范围、血流灌注与过度灌注状态,为疾病的治疗提供清晰、直观的影像学资料[8]。朱锦奎[9]研究显示,mMR 能呈现ACI 患者脑血管病变与侧支循环、耐受状况,并反映组织时间窗,尤其是若脑组织尚未见血管源性水肿时,DWI 可呈现出高信号影,FLAIR 序列无高信号,DWI/FLAIR 不匹配,此时可确认疾病处于急性期,同时,ACI 发病后脑组织处于缺血状态,其细胞功能存在不同程度异常及细胞水肿,通过DWI 检查可检出高强度信号。李侃侃[10]研究指出,ACI 早期,梗死病灶中心范围内的神经元电衰竭,周围存在缺血边缘(缺血半暗带),ASL 可显示脑灌注受损的程度和严重程度,若缺血状态不断加剧,则会造成梗死面积不断增加。本研究mMR 也进行SWI 序列扫描,有助于术前评估颅内微出血灶、钙化、溶栓后新发微出血灶,指导围手术期抗血小板药物的使用。通过实施mMR,可精准定位梗死核心范围及脑组织血流动力学特征等,参照灌注加权成像与扩散加权成像影像匹配结果能及早检出缺血半暗带,明确可挽救的脑组织分布情况,还能呈现梗死区域狭窄程度。
本研究存在一定的局限性,DIRECT-MT 研究显示前循环大血管闭塞引起的急性缺血性卒中的中国患者中,直接取栓并不劣于桥接治疗[11],本研究ACI ≤4.5 h 患者符合静脉溶栓指征者均给予阿替普酶溶栓治疗,给予桥接治疗而未跳过溶栓直接取栓,未能说明mMR 对超早期ACI 患者直接取栓是否优于mCT 组。另外,本研究未能阐明mMR 对后循环ACI 临床效果,BEST 试验结果表明,与单纯药物治疗组相比,接受血管内治疗患者90 d 良好预后率更高[12]。本研究需要亚组分析进一步阐明后循环ACI 取栓患者mMR 较mCT 影像学对血管内治疗的优势。
综上所述,采取mMR 辅助实施介入取栓术治疗ACI,临床效果优于mCT,可提升手术安全性,促进神经功能恢复,且可降低不良反应发生风险,值得有条件的卒中中心采用mMR 指导ACI 神经介入治疗。
