废加氢催化剂熔炼合金酸浸液中钼、镍萃取分离研究
2024-03-13窦中堃张家靓陈永强王成彦
窦中堃, 张家靓,2, 陈永强*,2, 王成彦,2
(1.北京科技大学冶金与生态工程学院,北京 100083; 2.稀贵金属绿色回收与提取北京市重点实验室,北京 100083)
在石油化工行业的生产过程中,90%以上的反应都需要催化剂的参与[1]。资料显示,完成炼化1吨原油平均需要消耗0.354 kg催化剂[2]。近年来,随着石油的产量越来越高,石油炼制催化剂的使用量也逐年增大。目前,全球每年石油产业产出的废催化剂达到40多万吨,其中,废加氢催化剂的产量可达15~17万吨。我国废加氢催化剂的产量每年可达5万吨[3-4]。废加氢催化剂中含有多种有价元素,其中含有0.5%~6% Ni、1%~3% Co、3%~20% Mo、1%~15% V以及3%~15% W等[5],其有价金属的含量远高于天然矿物中的品位,具有高回收价值。其次,这些金属在我国属于战略金属,尤其是镍钴这些对外依存度特别高的金属[6-7],因此,对其二次资源的合理利用变得愈发重要。
目前,废加氢催化剂的回收方法主要有湿法工艺[8-9]、焙烧-浸出工艺[10]及火法工艺[11-12]。废加氢催化剂中有价金属以氧化物、硫化物等多种形式存在,并且其中还含有油、积碳等,因此直接湿法工艺的浸出率偏低[13-14];焙烧-浸出工艺首先将各种类型的有价金属转型为氧化物形式,并可将油、积碳等高温除去,但在后续浸出过程中铝/硅会与有价金属同步浸出,使得净化工序复杂,产生铝硅渣夹带部分有价金属造成回收率降低以及产生大量的废气、危废渣和含盐废水等问题[2,15]。针对传统工艺存在的问题,王成彦等[16]提出废加氢催化剂火法熔炼工艺,该工艺通过添加助熔剂和辅料,有效降低熔炼的操作温度,使火法熔炼过程能够在常规电炉中进行。铝、硅等杂质与造渣剂反应形成的稳定渣相与合金相完全分离,后续溶液净化工序简单,同时含盐废水量少且没有危废渣产生[17]。但是,该火法熔炼工艺只能得到富含有价金属的合金,后续还需对其中的有价金属进行分离回收。
本文以废加氢催化剂火法熔炼合金经加压氧化酸浸得到的含镍钼酸浸液为原料,借鉴镍钼矿处理工艺中分离回收镍钼的方法,采用胺类萃取剂N235选择性萃取钼。考察了酸浸液中SO42-浓度、酸浸液pH值、有机相组成、有机相与水相的相比(O/A)对钼萃取过程的影响,以及反萃剂氨水浓度与相比对钼反萃过程的影响。最后,将含钼反萃液与含镍萃余液通过后续的常规净化、结晶等操作制备得到三氧化钼与硝酸镍,实现了废加氢催化剂中有价金属的循环利用。
1 实验部分
1.1 实验原料
本实验的原料为废加氢催化剂熔炼合金经氧压酸浸得到的酸浸液,溶液的pH = 0.9,其主要组分含量如表1所列。
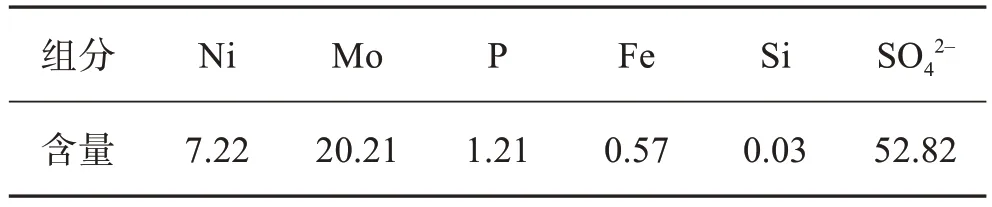
表1 酸浸液中主要组分含量Table1 Main component content in acid leaching solution单位:g/L
1.2 实验试剂
实验采用的萃取剂为胺类萃取剂N235(含量≥95%,国药集团化学试剂有限公司),改质剂为仲辛醇(含量≥99%,国药集团化学试剂有限公司),稀释剂为磺化煤油。实验所用硫酸、氢氧化钠、硫酸钠及氨水均为分析纯(国药集团化学试剂有限公司)。
1.3 实验方法
采用硫酸钠及氢氧化钠溶液调节酸浸液的SO42-浓度及pH值。将胺类萃取剂N235与1 mol/L H2SO4按V(O)∶V(A)=1∶1混合,在室温条件下振荡10 min进行转型[18]。将转型后的N235萃取剂与仲辛醇、磺化煤油按一定比例要求混合均匀。按预定相比分别移取适量水相和有机相,倒入分液漏斗中,将分液漏斗在恒温振荡器中振荡一定时间后,静置至分相,采用ⅠCP-OES测定萃余水相中钼及其他元素的浓度,用差减法计算出各元素萃取率。负载有机相经洗涤后采用氨水溶液进行反萃,分析反萃液中各组分的浓度,计算各组分的反萃率。将钼酸铵反萃液使用镁盐法沉淀去除P、Si等杂质,再经蒸发结晶、煅烧后得到三氧化钼[19]。将含镍萃余液使用氢氧化钠调节至pH = 5.5,除去Fe等杂质,再采用磷酸脂类萃取剂P507萃取镍,分相后使用硝酸溶液反萃有机相中的镍,硝酸镍反萃液经蒸发和结晶后得到硝酸镍。
1.4 数据处理
元素i的萃取率Ei与反萃率Si的计算公式如式(1)和式(2)所示:
式(1)、式(2)中:C0,i、C1,i、C2,i分别代表酸浸液、萃余液、反萃液中元素i的浓度的数值,单位g/L;V0、V1、V2分别代表酸浸液、萃余液、反萃液的体积的数值,单位L。
2 结果与讨论
2.1 N235萃取钼
含镍、钼和铁的硫酸浸出液中,Ni、Fe等元素以阳离子的形式存在,而Mo可与SO42-发生络合形成MoO2(SO4)22-,质子化胺阳离子(R3NH)+较易与金属络阴离子结合,而不易与简单的阴离子结合。萃取反应如式(3)和式(4)所示[20]:
在前期的探索实验中,发现各萃取条件不仅影响钼和镍的萃取率,同时也会影响振荡萃取后有机相和水相的分相时间。分相时间过长会降低萃取过程的生产效率,因此在后续的条件实验中,重点考察各萃取条件对镍、钼的萃取率及分相时间的影响。
2.1.1 SO42-浓度对萃取过程的影响
在有机相配比(V/V)为20% N235/10% 仲辛醇/70% 磺化煤油、V(O)/V(A)= 1/1、酸浸原液pH = 0.9的条件下,通过向原液中添加适量硫酸钠改变SO42-浓度,考察SO42-浓度对镍、钼的萃取率及分相时间的影响,实验结果如图1所示。
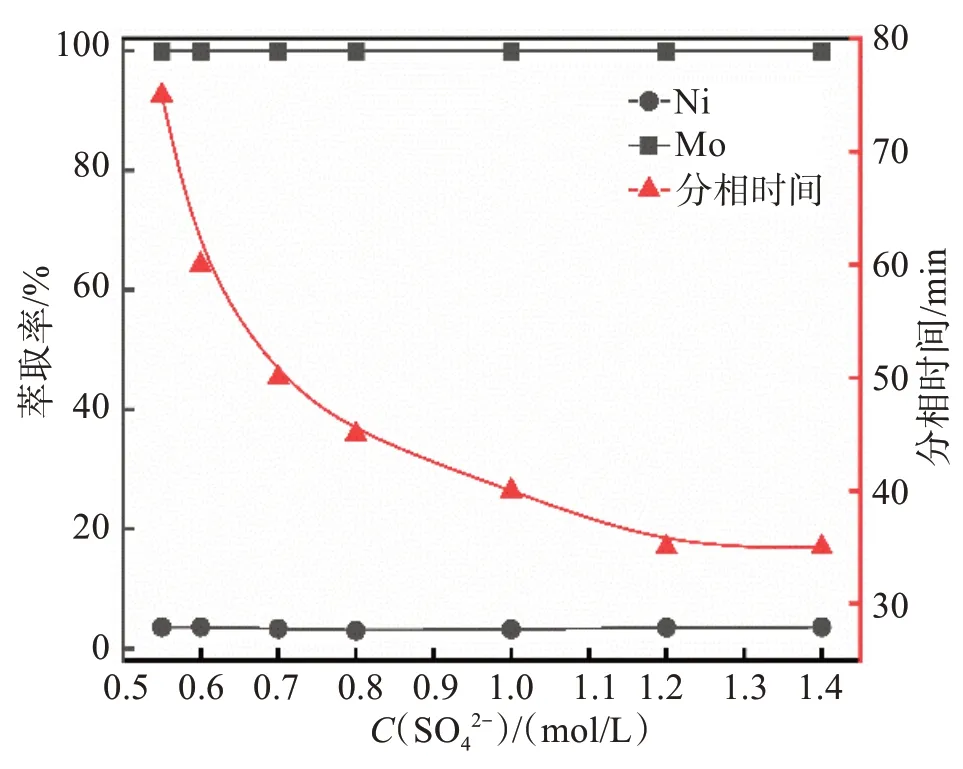
图1 SO42-浓度对萃取过程的影响Fig.1 Effects of SO42- concentration on extraction process
由图1可知,随着SO42-浓度增加,钼和镍的萃取率基本保持不变,钼几乎可以完全萃取,而镍萃取率很低,说明SO42-浓度对钼和镍的萃取率影响很小。但是,随着SO42-浓度增加,振荡萃取后有机相和水相的分相时间明显减少。当SO42-浓度增加至1.2 mol/L时,分相时间最短,为35 min,此时钼的萃取率为99.9%,镍的萃取率为3.5%。
分析SO42-浓度与分相时间变化的原因在于:提高溶液中SO42-的浓度,有利于MoO(2SO4)22-络合离子的形成和保持稳定,从而促进萃取反应的进行;另一方面,由于加入的硫酸钠在水溶液中有强烈的水合作用,能吸引大量自由水分子,降低水溶液中自由水分子浓度,可相对增加被萃物在水相中的浓度,有利于被萃物萃入有机相。因此,通过提高体系中SO42-浓度,可使得萃取分相时间大幅缩短,在后续的实验中均调节酸浸液中SO42-的浓度至1.2 mol/L。
2.1.2 pH值对萃取过程的影响
在有机相配比(V/V)为20% N235/10% 仲辛醇/70% 磺化煤油、V(O)/V(A)=1/1、酸浸原液中SO42-浓度为1.2 mol/L的条件下,通过向酸浸液中添加氢氧化钠溶液调节酸浸液的pH值,考察酸浸液pH值对镍、钼的萃取率及分相时间的影响,实验结果如图2所示。
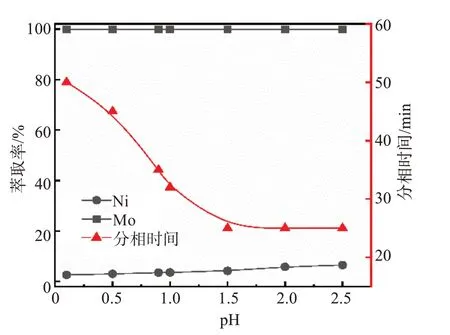
图2 溶液pH值对萃取过程的影响Fig.2 Effects of solution pH on extraction process
由图2可知,随着溶液pH值增加,钼的萃取率几乎不变,均接近100%,而镍的萃取率均较低。然而,有机相和水相的分相时间随pH值变化较大,随着溶液pH值从0增加到1.5,分相时间从80 min缩短至25 min。其原因可能是因为此时钼的存在形态从钼酰阳离子MoO22+转变为同多酸根离子Mo8O264-,相应的萃取机理会发生变化,此时萃取反应式转变为:
Mo8O264-+ 2(R3NH)2SO4= (R3NH)4Mo8O26+2SO42-但在调节溶液pH值的过程中也发现,当溶液的pH ≥ 2.0时,溶液中会出现沉淀物,将对萃取造成不利的影响。与pH = 1.5相比,不调节酸浸液pH值(pH = 0.9)萃取时,虽然分相时间略长,但钼、镍的分离效果更好,并且无需加入碱。因此,萃取过程无需对溶液pH值进行调节,此时分相时间为35 min,钼的萃取率为99.9%,镍的萃取率为3.5%。
2.1.3 有机相中N235的体积分数对萃取过程的影响
在V(O)/V(A)=1/1,酸浸原液中SO42-浓度1.2 mol/L、pH = 0.9的条件下,控制有机相中仲辛醇的体积分数为10%,通过调节N235和磺化煤油的比例改变N235体积分数,考察了有机相中N235的体积分数对镍、钼的萃取率及分相时间的影响,实验结果如图3和图4所示。
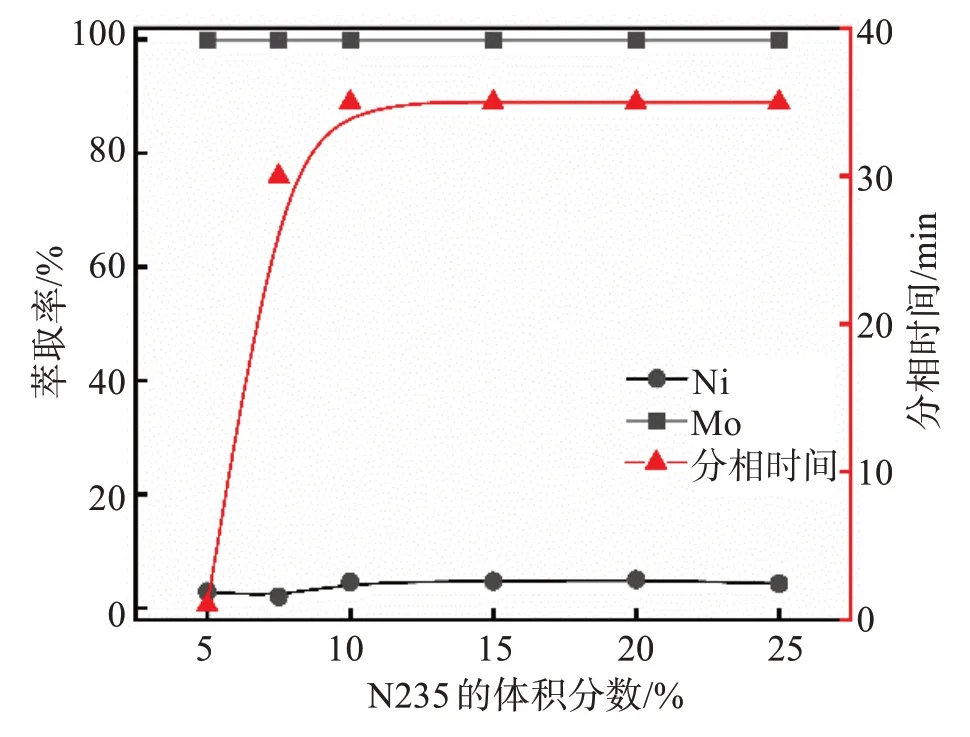
图3 N235的体积分数对萃取过程的影响Fig.3 Effects of N235 volume fraction on extraction process

图4 不同萃取条件下的分相情况(N235∶仲辛醇:磺化煤油、V(O)/V(A):(a) 5∶10∶85、1/1; (b) 10∶10∶80、1/1; (c) 10∶0∶90、1/1; (d) 10∶15∶75、1/2)Fig.4 Phase separation under different extraction conditions (N235: secoctanol: sulfonated kerosene, V(O)/V(A):(a) 5∶10∶85, 1/1; (b) 10∶10∶80, 1/1; (c) 10∶0∶90, 1/1; (d) 10∶15∶75, 1/2)
当N235的体积分数为5%时,振荡萃取后分相时间极短,但会出现墨绿色且黏稠的第三相(图4(a)),此时N235体积分数较小,单位有机相负载的钼过高,致使形成了第三相;当N235的体积分数为7.5%时,单位有机相负载的钼减少,第三相减少但仍然存在;直至N235的体积分数增加为10%时,水相与有机相才会完全分离(图4(b)),良好的分相情况为分相后两相清澈且明晰,不产生第三相。此时,两相的分相时间为35 min,钼的萃取率为99.9%,镍的萃取率为4.6%。
2.1.4 仲辛醇的体积分数对萃取过程的影响
在V(O)/V(A)=1/1,酸浸原液中SO42-浓度为1.2 mol/L、pH = 0.9的条件下,控制有机相组成中N235的体积分数为10%,通过调节仲辛醇和磺化煤油的比例改变仲辛醇的体积分数,考察了有机相中仲辛醇的体积分数对镍、钼的萃取率及分相时间的影响,实验结果如图5所示。
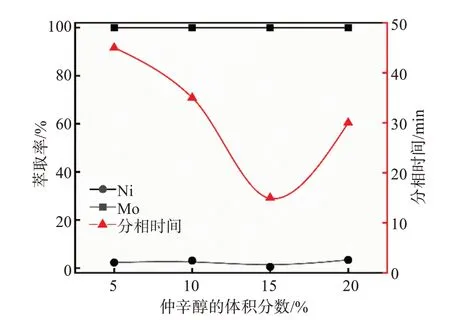
图5 仲辛醇的体积分数对萃取过程的影响Fig.5 Effects of volume fraction of secoctanol on extraction process
在不添加仲辛醇萃取时,分相时间虽然很短,但产生了大量的第三相,分相不完全(图4(c))。当仲辛醇体积分数为5%时,虽未产生第三相,但是会存在一层乳化相,导致无法完全分相;直至仲辛醇的体积分数增加至15%时,分相效果较好,仲辛醇的添加增加了萃合物在煤油中的溶解度,避免在萃取过程中产生第三相。但是,继续增加仲辛醇的体积分数至20%,分相时间会从15 min延长至30 min。因此选取有机相中仲辛醇的体积分数为15%,此时分相时间为15 min,钼的萃取率为99.9%,镍的萃取率为2.1%。
2.1.5 相比对萃取过程的影响
在有机相配比(V/V)为10% N235/15% 仲辛醇/75%磺化煤油,酸浸原液中SO42-浓度为1.2 mol/L、pH = 0.9的条件下,通过控制加入有机相和水相体积,考察了相比对钼萃取及分相时间的影响,实验结果如图6所示。
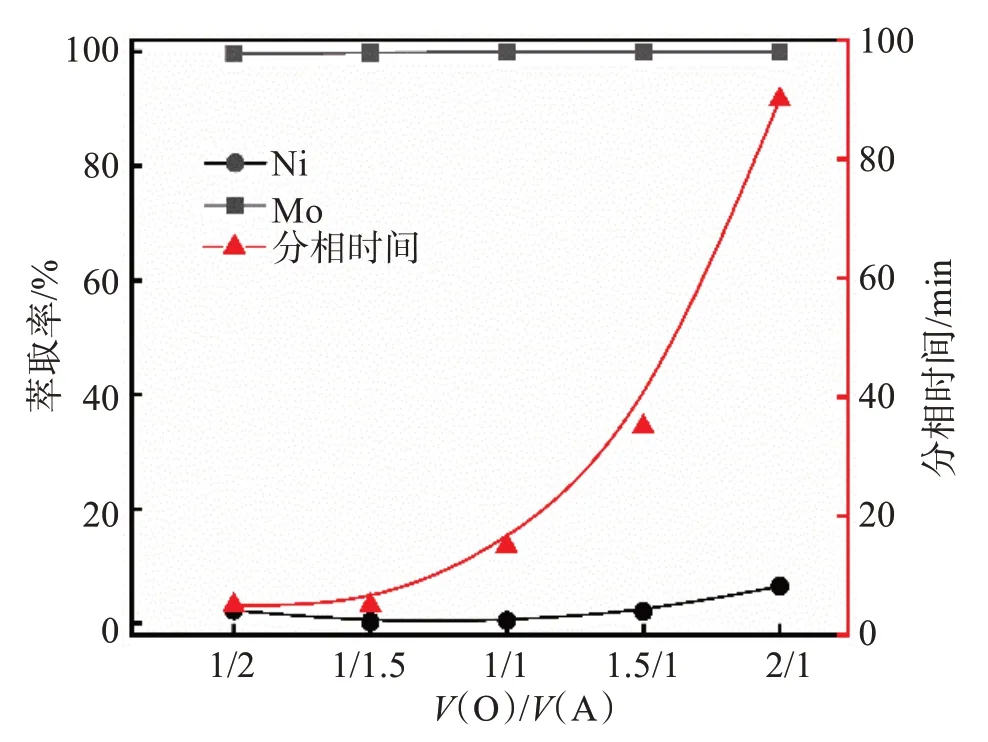
图6 相比对萃取过程的影响Fig.6 Effects of V(O)/V(A) ratio on extraction process
随着V(O)/V(A)增大,钼的萃取率没有明显的变化,但是分相时间明显延长。当V(O)/V(A)=1/1.5时,在水相与有机相之间产生了明显的第三相,无法完全分相;当V(O)/V(A)= 1/2时,虽然分相时间很短,但出现了有机相挂壁的情况(图4(d))。当V(O)/V(A)较小时,单位有机相负载的钼较高,致使有机相过饱和而产生第三相。因此,选择V(O)/V(A)= 1/1,此时分相时间为15 min,钼萃取率为99.9%,镍萃取率为2.1%。
经过上述条件实验,确定了废加氢催化剂熔炼合金酸浸液中钼、镍的萃取分离的较优条件为:有机相的组成(V/V)为10% N235/15% 仲辛醇/75% 磺化煤油、酸浸原液SO42-浓度为1.2 mol/L、pH = 0.9、V(O)/V(A)= 1/1,在此条件下,萃余液中各元素含量如表2所列。

表2 萃余液中各元素含量与萃取率Table 2 Contents and extraction rate of elements in raffinate
2.2 负载有机相洗涤与反萃
2.2.1 负载有机相的洗涤
在反萃之前,对负载钼的有机相进行洗涤,尽可能将有机相中夹带的杂质洗脱,减轻后续除杂过程的压力。为了提高杂质的洗脱效果,并避免钼在pH值较高条件下洗涤损失,采用0.05 mol/L稀硫酸溶液对负载钼有机相进行洗涤,钼的洗脱率几乎为0,杂质元素洗脱率分别为Ni 72.6%、P 0.6%、Fe 70.6%、Si 5.5%。Ni和Fe是由于萃取夹带进入有机相,故在洗涤过程中较易被洗脱;P和Si易与Mo形成杂多酸PMo12O403-、SiMo12O404-,与钼同时被萃取,故在洗涤过程的洗脱率很低。在反萃后再进行P和Si的除杂,可避免Mo的损失。
2.2.2 氨水浓度对反萃过程的影响
萃取后的负载钼有机相经过洗涤后直接用于反萃。实验所用萃取剂N235为叔胺类萃取剂,在酸性条件下以氢键与络合阴离子结合而生成萃合物,但在碱性条件下更易与羟基结合从而脱除萃合物,因此选择使用氨水进行反萃,可以将萃合物分解,直接得到粗钼酸铵溶液[21]。反萃过程反应方程式可由式(5)表示[22]:
在V(O)/V(A)=1/1,反萃时间10 min的条件下,分别以不同浓度的氨溶液作为反萃剂,考察氨水浓度对钼反萃效果的影响,实验结果如图7所示。
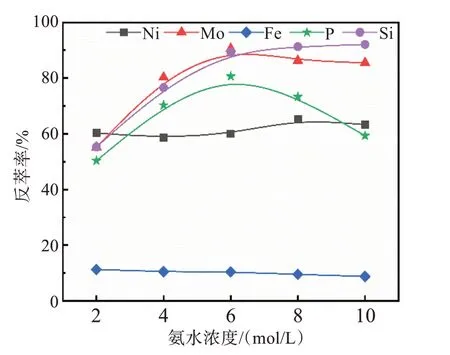
图7 氨水浓度对各元素反萃率的影响Fig.7 Effects of ammonia concentration on reverse extraction rate of each element
由图7可知,随着氨水浓度增加,钼的反萃率逐渐增大;当氨水浓度大于6 mol/L后,钼的反萃率略有下降。实验过程中发现,当氨水浓度低于6 mol/L时,振荡过程中反萃水相会出现墨绿色球状黏性沉淀,静置后黏性沉淀会堆积在水相底部,堵塞分液漏斗出液口;当氨水浓度高于6 mol/L时,水相和有机相界面会出现蓝色悬浮不溶的第三相,水相和有机相均浑浊;当氨水的浓度为6 mol/L时,反萃振荡结束后水相和有机相均较清澈,两相之间仅出现少量的不溶物,分相效果较好。杂质P、Si、Fe与钼的反萃率相似,进一步说明萃取与反萃过程中P、Si等杂质元素是由于其与Mo生成杂多酸而被萃取。当氨水浓度大于6 mol/L时,P的反萃率明显下降,与此同时出现了蓝色不溶物,经验证此蓝色不溶物的出现与P有关。
2.2.3 相比对反萃过程的影响
在氨水浓度为6 mol/L,反萃时间10 min条件下,通过控制加入有机相和水相的体积,考察了相比对钼反萃效果的影响,实验结果如图8所示。
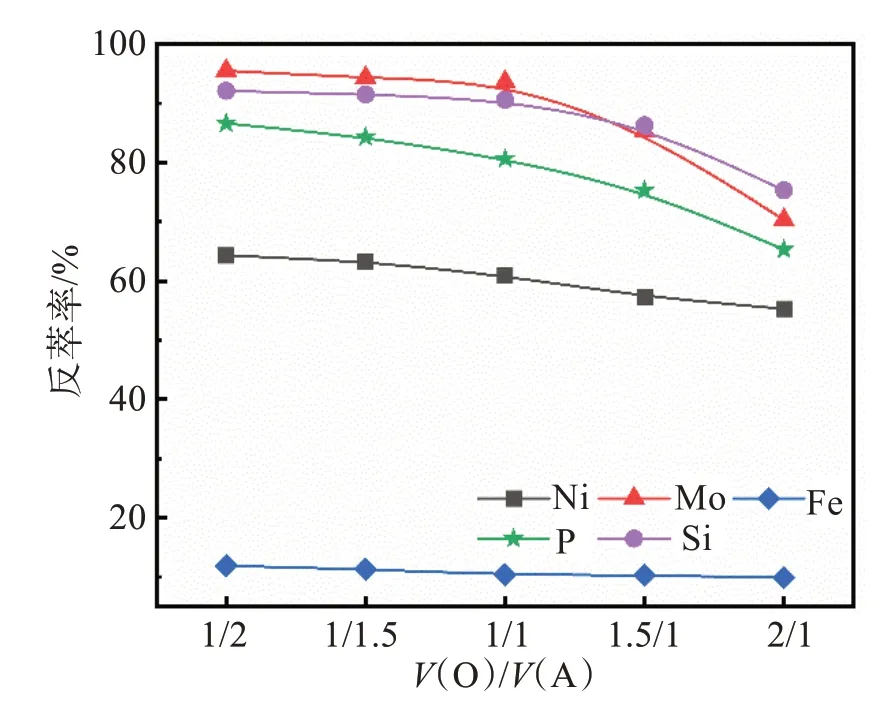
图8 相比对各元素反萃率的影响Fig.8 Effects of V(O)/V(A) ratio on reverse extraction rate of each element
由图8可知,随着反萃相比V(O)/V(A)提高,钼的反萃率逐渐降低,杂质元素与钼的反萃率相似。由实验现象可知,V(O)/V(A)在1/2~1/1范围内,两相界面有少量的蓝色不溶物;当V(O)/V(A)分别为1.5/1、2/1时,反萃水相中会出现墨绿色球状黏性沉淀。为了避免出现第三相与沉淀,并最大限度地提高反萃液中钼的浓度,反萃相比V(O)/V(A)选择1/1。
经过上述条件实验,确定了萃钼有机相反萃取的较优条件为:反萃剂氨溶液6 mol/L,V(O)/V(A)=1/1,经此条件反萃后,反萃液中各元素含量如表3所列。
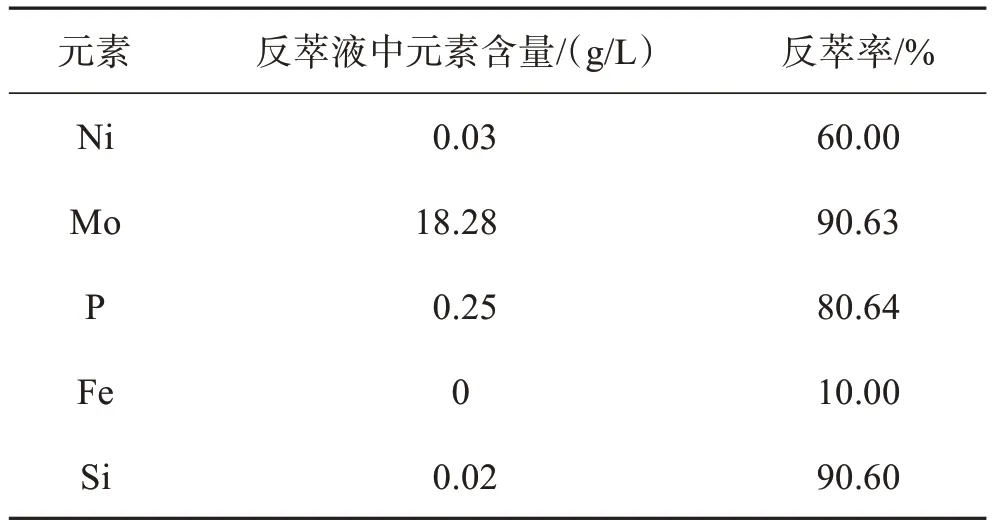
表3 反萃液中各元素含量与反萃率Table 3 Contents and reextraction of elements in strip liquor
2.3 产品制备
综合萃取和反萃条件实验的研究结果,在优化条件下,对废加氢催化剂熔炼合金经氧压酸浸得到的酸浸液进行萃取,分离钼、镍后,得到富钼反萃液与萃钼后的萃余液,再进行钼和镍的产品制备。
2.3.1 反萃液制取三氧化钼
向含钼反萃液中加入3%(质量分数) MgCl2·6H2O沉淀除去反萃液中仍存有的P和Si等杂质。将除杂后的溶液在90~110 ℃进行蒸发结晶,蒸发到体积减少80%左右时出现灰白色的钼酸铵晶体,再利用余热蒸干余液。将蒸发得到的钼酸铵晶体放置于马弗炉中,在600 ℃下煅烧2 h,得到浅黄色粉末状MoO3。将得到的MoO3使用王水溶解,对其中的杂质元素含量进行检测,结果如表4所列。
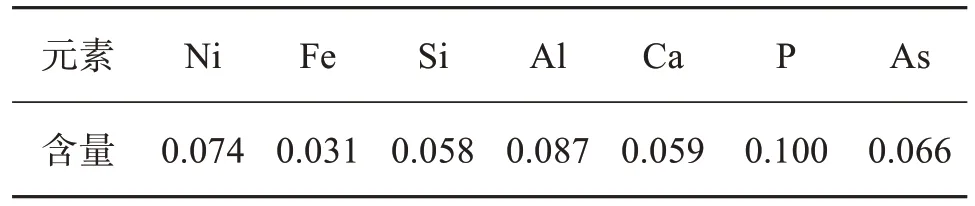
表4 三氧化钼产品杂质含量Table 4 Content of impurities in molybdenum trioxide products单位:%(质量分数)
2.3.2 萃余液制取硝酸镍
将含镍萃余液使用氢氧化钠溶液调节pH至5~6,使萃余液中仍存在的Fe等杂质被沉淀去除。采用氢氧化钠溶液皂化磷酸酯类萃取剂P507,P507和磺化煤油按3∶7(V/V)配制成有机相,V(O)/V(A)=1/2,萃取时间5 min,振荡萃取后,分相检测镍的萃取率可达99%。对萃镍有机相使用50 g/L硝酸溶液进行反萃,V(O)/V(A)为1/1,反萃时间5 min,分相后检测镍的反萃率为99%。将得到的硝酸镍溶液在90~100 ℃蒸发结晶,得到绿色的硝酸镍晶体,将其溶解后,对其中的杂质元素含量进行检测,结果如表5所列。
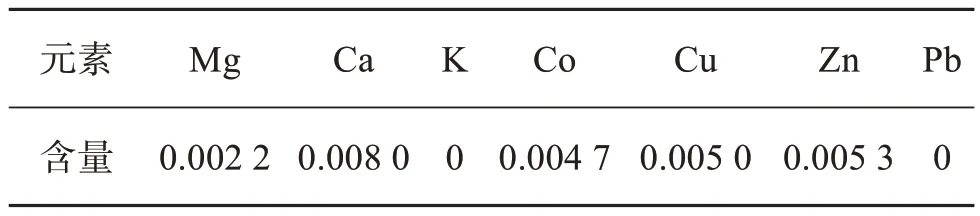
表5 硝酸镍产品中杂质含量Table 5 Content of impurities in nickel nitrate products单位:%(质量分数)
3 结论
1)采用N235-仲辛醇-磺化煤油体系对废加氢催化剂还原熔炼合金酸浸液中钼、镍进行萃取分离的研究,较优的实验条件为:有机相的组成(V/V)为10% N235/15% 仲辛醇/75%磺化煤油、酸浸原液中SO4
2-浓度为1.2 mol/L、pH=0.9、相比V(O)/V(A)=1/1,此时钼的萃取率为99.80%,镍的萃取率为2.35%,分相时间仅为15 min。
2)采用氨溶液反萃负载有机相中的钼,较优实验条件为:反萃剂氨溶液6 mol/L,V(O)/V(A)= 1/1,此时钼的反萃率为90.63%。
3)此工艺流程可以实现废加氢催化剂还原熔炼合金酸浸液中钼与镍的高效分离,并且有价金属回收率高,通过后续的常规净化、结晶等制备工艺可得到三氧化钼与硝酸镍产品,实现了废加氢催化剂中有价金属的循环利用。
