白芍根腐病病株与健株根际土壤微生物群落及酶活性变化
2024-03-13张英英吴之涛杨宪忠魏玉杰杜雷超
张英英,吴之涛,杨宪忠,魏玉杰,吴 芳,杜雷超
(1.甘肃省农业工程技术研究院,甘肃 武威 733006;2.甘肃省特种药源植物种质创新与安全利用重点实验室,甘肃 武威 733006;3.武威市祁连山区道地中药材生态栽培技术创新中心,甘肃 武威 733006)
【研究意义】白芍是毛茛科植物芍药(Paeonialactiflora. pall)的干燥根,芍药以根入药,为多年生药用植物,具有抗炎、免疫调节、抗病毒、抗氧化等作用,芍药性温和,喜阳光充足,且耐寒性强。目前已在甘肃河西地区推广种植,随种植年限不断增加,病原微生物不断积累,特别是多种病菌混合侵染引起根腐病等病害发生逐渐加重[1-2],严重影响芍药品质和产量,因此,探明药用植物根际微生物多样性,对于揭示土壤根际微生物与药用植物的互作机制、抑制土壤病原微生物活动,及筛选和挖掘有益微生物防治根腐病具有重要意义。【前人研究进展】目前对白芍的研究主要集中在药理成分、临床试验、加工炮制等方面[3-5],而对于药用植物根腐病的研究主要集中在三七、人参、黄精等中药材[6-8],特别是高通量测序技术的广泛应用,从分子层面揭示土壤微生物群落多样性的变化已成为研究热点,根腐病致病原因复杂,当下研究认为在常用大宗道地药材中镰刀菌(Fusariumoxysporum)、立枯丝核菌(Rhizoctoniasolani)、腐霉菌(Pythium)等是连作土壤中的主要病原菌[9]。陈士宁等[10]研究认为,芍药根腐病主要是由腐皮镰刀菌引起,而尖孢镰孢菌、串珠镰刀菌、立枯丝核菌等也是引起牡丹根腐病的重要病原。连作可能引起土壤养分失衡、酶活性下降,进而促使微生物群落结构发生改变,病原微生物数量增加,最终导致植株发病率增高。土壤pH、硝态氮等土壤化学性质改变也是引起连作土壤微生物群落变化的重要影响因素[11-13]。【本研究切入点】白芍在河西地区种植过程中出现的根腐病及土壤微生物群落多样性变化缺乏系统深入的研究,因此,深入探索土壤微生物群落结构差异、土壤养分与酶活性变化以及三者之间的相互关系,明确可能引起该地区白芍根腐病的主导因子,对该地区白芍病害防治和品质提升具有重要意义。【拟解决的关键问题】本研究以白芍根腐病病株和健株根际土壤为研究对象,运用Illumina MiSeq高通量测序技术研究白芍植株根际土壤微生物群落结构变化,并探明土壤微生物群落、根际环境因子与酶活性之间关系,揭示河西地区白芍根腐病的土壤微生物与环境之间的互作机制,为该地区药用芍药病害绿色防控和土壤微生态调控提供理论依据。
1 材料与方法
1.1 试验区概况与样品采集
试验区位于甘肃省武威市凉州区黄羊镇“国家中药材产业技术体系河西综合试验站试验基地”(102°50′58′′ E,37°40′31′′ N),属温带大陆性气候,年平均降雨量154.3 mm,多年平均气温7.8 ℃,土壤类型为灌漠土,0~30 cm土层有机质15.75 g/kg、pH 8.41、全氮0.97 g/kg、碱解氮70.16 mg/kg、有效磷61.0 mg/kg、速效钾290.0 mg/kg。试验供试材料为安徽亳芍,种苗购置于安徽中药材市场,试验于2018年10月移栽,于2022年7月上旬对已移栽4年的芍药进行取样,健株与病株分别取3个点,每个取样点随机选择3株,用取样铲分别将健株和病株整个根系完整挖出,采集根际表面0~4 mm根际土壤,装入低温冰盒中带回实验室后,立即保存至-80 ℃超低温冰箱,用于高通量微生物多样性分析,采集距离根茎3 cm内的土壤,去除残根与石砾后,自然风干用于土壤酶活性及土壤理化性质分析。
1.2 土壤理化性质及酶活性测定方法
土壤测定指标:有机质、pH、水溶性总盐、全氮、碱解氮、有效磷和速效钾均参照鲍士旦[14]的土壤农化分析(第三版)相关方法进行测定。
土壤酶活性测定:用土壤脲酶(Solid-Urease,S-UE)试剂盒(JC0901-M)、土壤蔗糖酶(Solid-Sucrase,S-SC)试剂盒(JC0907-M)、土壤碱性磷酸酶(Soil alkaline phosphatase,S-AKP/ALP)活性测定试剂盒(JC0917-M)(南京集测生物科技有限公司生产)提取,通过紫外可见分光光度计(上海元析UV-8000)测定。
1.3 土壤DNA提取和高通量测序
土壤微生物DNA提取:用HiPure Soil DNA Kits 土壤 DNA专用试剂盒进行土壤微生物基因组总DNA提取。设计ITS1区特定引物扩增特异区域,得到310 bp左右扩增片段,加接头,采用Illumina Novaseq6000平台,测序得到2×250 bp的paired-end数据,通过拼接得到较长序列,再进行16S和ITS分析。所有土壤样品的细菌扩增用引物338F(5′-ACTCCTACGGGAGGCAGCA-3′)和引物 806R(5′-GGACTACHVTWTCTAAT-3′)进行, 所有土壤样品的真菌扩增用引物ITS1-1F-F(5′-CTTGGTCATTTAGAGGAAGTAA-3′)和ITS1-1F-R(5′-GCTGCGTTCTTCATCGATGC-3′)进行。
1.4 测序数据处理与分析
将拼接测序得到的原始数据(Raw data)去噪过滤,得到有效数据(Clean data),基于有效数据进行聚类和物种分类分析。测序序列首先需要根据barcode得到所有样品的有效序列;用pandaseq软件根据PE reads之间的overlap关系,将成对reads拼接(merge)成一条序列;用PRINSEQ软件过滤read平均质量值20以下的碱基,过滤掉N碱基长度占序列总长5%的序列,最后得到每个样本的优质序列。进行多样性分析、差异分析、相关性分析。建库和测序工作委托南京集思慧远生物科技有限公司完成。
1.5 统计分析
利用SPSS 19.0软件,采用独立T检验分析方法,检验土壤化学性质、酶活性及高通量测序得到的微生物丰富度、多样性指数之间的差异。检验水平为α<0.05。
2 结果与分析
2.1 白芍根腐病病株和健株根际土壤养分和酶活性变化特征
由表1可知,与健株相比,白芍根腐病病株土壤有机质显著增加,速效钾含量显著降低,pH、水解性氮、水溶性盐含量均增加,全氮、有效磷含量均降低,但差异不显著。白芍根腐病病株根际土壤碱性磷酸酶、过氧化物酶较健株显著增加,对β-葡萄糖苷酶、脲酶、蔗糖酶没有显著影响,但β-葡萄糖苷酶活性升高,脲酶、蔗糖酶活性下降。由此可知,白芍根际土壤养分失衡及酶活性变化可能是促进白芍根腐病发病的重要原因之一。

表1 白芍健株和根腐病病株根际土壤养分和酶活性变化
2.2 白芍根腐病病株和健株根际土壤微生物α-多样性指数比较
α-多样性指数能很好地反映微生物群落的丰度和多样性。由表2可知,土壤细菌和土壤真菌goods_Coverage指数均达到1,说明本次测序结果能全面代表白芍根际土壤微生物多样性的真实情况。白芍健株根际土壤细菌ACE、Chao1、Simpson、Shannon指数显著高于病株,与健株相比,病株分别减少11.6%、11.5%、2.2%和9.9%;白芍健株根际土壤真菌ACE、Chao1、Simpson、Shannon指数均低于病株,较健株分别增加15.9%、15.9%、8.7%和19.4%,但差异不显著。因此,白芍根际土壤细菌群落a-多样性指数下降和真菌a-多样性指数上升是导致白芍根腐病发生的重要原因。
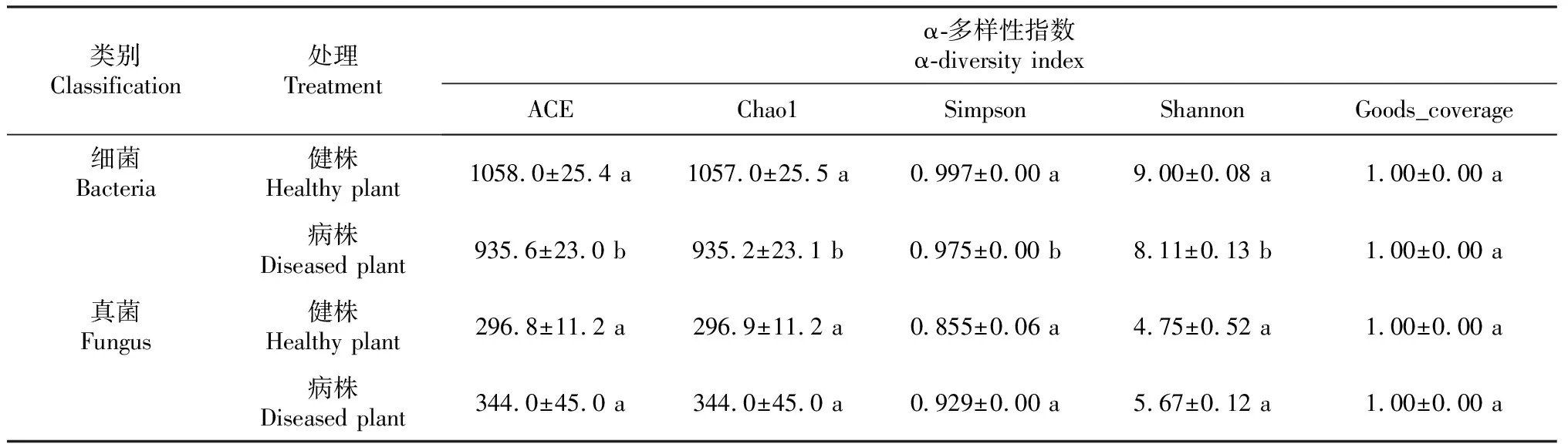
表2 白芍健株和根腐病病株根际土壤微生物α-多样性指数
2.3 白芍根腐病病株和健株根际土壤微生物不同分类水平组成
由表3可知,白芍病株根际土壤细菌各分类学水平数量与健株相比均有所下降。其中,病株根际土壤细菌减少3个门、6个纲、19目、24科、13属和366个OTU。病株根际土壤真菌各分类学水平数量与健株相比均有所增加。病株根际土壤真菌增加1个门、2个纲、2个目、4个科、13个属、16个种和140个OTU。白芍健株与病株根际土壤样品中在属分类水平共有细菌属254个,其中健株根际土壤特有121个属,病株根际土壤特有99个属。真菌群落中,共有真菌属84个,健株根际土壤特有真菌属32个,而病株根际土壤特有真菌属49个。
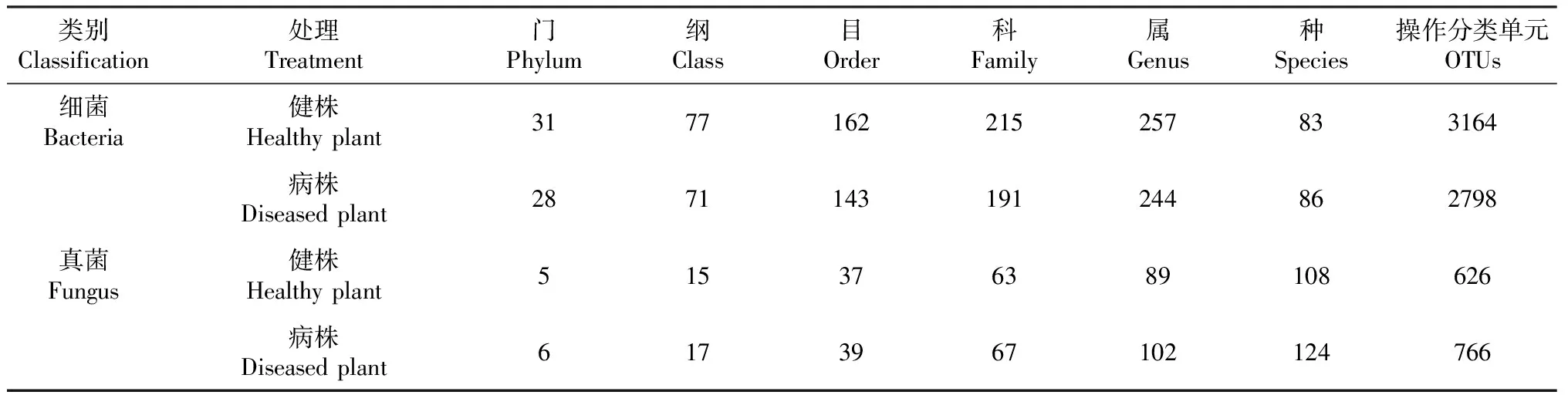
表3 白芍健株和根腐病病株根际土壤不同分类水平微生物群落数
2.4 白芍根腐病病株与健株根际土壤细菌在门水平和属水平的群落组成
白芍根际土壤细菌门水平上的群落组成及相对丰度如图1-a所示,相对丰度前3位的细菌门分别是变形菌门(Proteobacteria)、酸杆菌门(Acidobacteriota)、浮霉菌门(Planctomycetota),白芍健株根际土壤的相对丰度分别为21.4%、18.4%、14.4%,病株根际土壤的相对丰度分别为30.0%、20.8%、12.7%。其中变形菌门在病株中的相对丰度显著高于健株,与健株相比,病株相对丰度增加40.2%。拟杆菌门(Bacteroidota)、Sumerlaeota在健株中的相对丰度分别为3.4%、0.01%,在病株中的相对丰度分别为8.2%、0.2%,病株显著高于健株,与健株相比,分别增加141%、1900%。而绿弯菌门(Chloroflexi)、放线菌门(Actinobacteriota)、ethylomirabilota、厚壁菌门(Firmicutes)、Latescibacterota、NB1-j在健株中的相对丰度分别为10.1%、9.8%、2.1%、1.1%、0.7%、0.5%,在病株中的相对丰度分别为4.8%、3.3%、0.6%、0.3%、0.2%、0.1%,健株显著高于病株,病株与健株相比,相对丰度分别减少52.5%、66.3%、73.4%、72.7%、71.4%、80.0%。

图1 白芍健株和根腐病病株际土壤细菌群落组成在门和属水平上的相对丰度Fig.1 Relative abundance of bacterial community composition in the rhizosphere soil of healthy and diseased P. lactiflora at the level of phylum and genus
细菌属水平上的群落组成及相对丰度如图1-b所示,相对丰度前3位的分别是鞘氨醇单胞菌属(Sphingomonas)及未知菌属WD2101_soil_group、RB41,白芍健株中的相对丰度分别为4.2%、6.0%、5.2%,病株中的相对丰度分别10.2%、8.1%、4.1%,但均没有显著差异。Vicinamibacteraceae、KD4-96、S0134_terrestrial_group、Rokubacteriales、MND1、S085、JG30-KF-CM45、OM190、Tepidisphaerales在健株根际土壤中的相对丰度分别为4.9%、2.2%、2.2%、2.1%、2.2%、1.9%、1.3%、1.5%、1.0%,在病株中的相对丰度分别为2.9%、0.7%、0.6%、0.6%、0.3%、0.6%、0.6%、0.2%、0.4%,健株显著高于病株,与健株相比,病株分别减少40.8%、68.2%、71.4%、72.7%、86.4%、68.4%、53.8%、86.7%、60.0%。而Chthoniobacter、Subgroup7、Saccharimonadales在白芍健株中的相对丰度分别为0.7%、0.8%、0.8%,在病株中的相对丰度分别为2.3%、1.7%、1.6%,病株显著高于健株,与健株相比,病株相对丰度分别增加229%、113%、100%。
2.5 白芍根腐病病株与健株根际土壤真菌在门水平和属水平的群落组成
白芍根际土壤真菌门水平上的群落组成及相对丰度如图2-a所示,前3位优势门分别是子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、接合菌门(Zygomycota),白芍健株中的相对丰度分别为64.2%、15.6%、0.7%,病株中相对丰度分别为76.3%、4.0%、3.1%,其中Basidiomycota、Chytridiomycota在健株中的相对丰度显著高于病株,与健株相比,病株减少74.4%、91.7%。病株中Zygomycota的相对丰度显著高于健株,与健株相比,病株相对丰度增加342%。病株中Ascomycota相对丰度高于健株,但差异不显著。

图2 白芍健株和根腐病病株根际土壤真菌群落组成在门和属水平上的相对丰度Fig.2 Relative abundance of fungal community composition in the rhizosphere soil of healthy and diseased P. lactiflora at the level of phylum and genus
真菌属水平上的群落组成及相对丰度如图2-b所示,白芍病株根际土壤中土赤壳属(Ilyonectria)、白粉菌属(Erysiphe)、毛壳菌属(Chaetomium)为优势菌属,其相对丰度分别18.0%、14.5%、4.8%。白芍健株根际土壤中篮状菌属(Talaromyces)、隐球菌属(Cryptococcus)、葡萄孢菌属(Botrytis)为优势菌属,其相对丰度分别为28.8%、10.2%、3.7%。Ilyonectria、Erysiphe在白芍病株中的相对丰度显著高于健株,分别是健株的166.5和53.3倍。健株中Talaromyces、Cryptococcus、Botrytis的相对丰度显著高于病株,分别是白芍病株根际土壤的13.3、4.30、4.1倍。在白芍病株中,被孢霉属(Mortierella)、明梭孢属(Monographella)、镰刀菌属(Fusarium)、蜡蚧菌属(Lecanicillium)的相对丰度分别为3.0%、1.7%、1.7%、1.3%,显著高于健株,与健株相比,病株提高329%、325%、467%和550%。
2.6 白芍根腐病病株与健康植株根际土壤微生物群落PCoA分析
细菌群落PCoA分析结果(图3-a)表明,群落组成的变异受11个主坐标成分的控制,其中前2个主坐标成分影响最大,PC1和PC2分别解释72.22%和13.07%的方差变异,二者累计贡献率为85.29%。真菌群落PCoA分析结果(图3-b)表明,群落组成的变异受11个主坐标成分的控制,其中前两个主坐标成分影响最大,PC1和PC2分别解释55.26%和21.33%的方差变异,二者累计贡献率为76.59%,细菌群落与真菌群落中PC1主坐标成分均可将白芍病株和健株明显区分开。
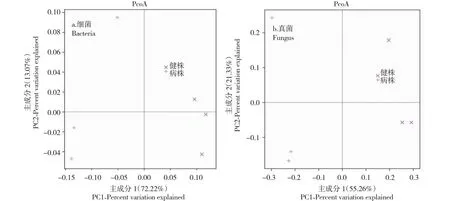
图3 土壤微生物群落PCoA分析Fig.3 PCoA analysis of soil microbial community
2.7 白芍根腐病病株和健康植株根际土壤环境因子、酶活性与土壤微生物群落结构的相关性分析
由图4可知,土壤有机质与pH、碱性磷酸酶呈极显著正相关,与过氧化物酶呈显著正相关,水解性氮与蔗糖酶呈显著正相关,速效钾与碱性磷酸酶、过氧化物酶呈显著负相关,碱性磷酸酶和过氧化物酶、β-葡萄糖苷酶与脲酶呈显著正相关,其余土壤化学性质指标与酶活性之间均无显著相关性。

图4 土壤环境因子、酶活性与土壤微生物群落的相关性Fig.4 Correlation between soil environmental factors, enzyme activity and soil microbial community
芍药根际土壤细菌群落门水平相对丰度前10位与土壤化学性质、酶活性相关分析表明,土壤有机质与Chloroflexi、Methylomirabilota、Actinobacteriota相对丰度呈显著或极显著负相关;水溶性盐与Patescibacteria、Proteobacteria呈显著或极显著正相关,而与Planctomycetota、Chloroflexi呈显著负相关。碱性磷酸酶与Chloroflexi、Actinobacteriota、Methylomirabilota呈显著负相关,而与Bacteroidota呈显著正相关;脲酶与Acidobacteriota、Verrucomicrobiota呈显著或极显著负相关;过氧化物酶与Actinobacteriota、Methylomirabilota、Chloroflexi呈显著或极显著负相关;蔗糖酶与Bacteroidota、Patescibacteria呈显著正相关,与Chloroflexi、Methylomirabilota呈显著负相关。
白芍根际土壤优势真菌群落门水平相对丰度与土壤环境因子、酶活性相关分析表明,土壤pH与Chytridiomycota呈显著负相关;有机质与Chytridio-mycota呈极显著负相关;有效磷与Rozellomycota呈极显著正相关;速效钾与Basidiomycota呈显著正相关;水溶性盐与Ascomycota呈显著正相关,与Basidiomycota呈显著负相关;碱性磷酸酶与Chytridiomycota呈极显著负相关;脲酶与Glomeromycota呈极显著负相关;过氧化物酶与Chytridiomycota、Basidiomycota呈极显著负相关;蔗糖酶与Ascomycota呈显著正相关。
3 讨 论
土壤微生物参与土壤养分循环、动植物残体的降解与转化,是维持土壤生态系统稳定和养分转化的重要驱动力[15],土壤酶活性是反映土壤质量状况的重要指标,主要参与有机质的转化与营养元素的生物循环,而土壤理化性质、酶活性和土壤微生物多样性三者相互作用、相互制约,对维持土壤微生态系统稳定发挥了重要作用[16-17]。赵林艳等[11]研究发现健康白及根际土壤脲酶、蔗糖酶活性和有效钾含量显著高于发病土壤,pH、有机质含量较低,这与本研究结果相似。原因可能是植物根表皮腐烂,细胞膜透性增大,细胞膜完整性被破坏,导致根腐病病株水分与养分吸收功能减弱,根际土壤有机质、水溶性盐含量增加,而钾能促进蛋白质、糖、淀粉的合成和运输,协调碳氮代谢,对提高作物抗性具有重要意义[18-19],白芍根腐病病株钾含量显著降低,引起植株抗性下降。过氧化物酶能催化过氧化氢、氧化酚类和胺类化合物,消除过氧化氢和酚类、醛类等物质的毒害作用,而碱性磷酸酶与微生物群落结构和组成变化关系密切[20]。白芍根际土壤养分失衡及酶活性变化可能是促进白芍根腐病发病的重要原因之一。
闫欢等[21]研究认为土壤细菌多样性降低是引起黄芪根腐病加重的重要原因。赵林艳等[11]研究发现,白及患根腐病后,真菌α-多样性指数增加,这与本研究结果相似。但卢圣鄂等[22]研究认为黄精根腐病根际土壤真菌OTUs数显著少于健康土壤,病株种群多样性指数最低,这与本研究有差异。大多数研究认为,土壤微生物群落多样性和组成与土传病害发生关联密切,丰富的微生物群落多样性能维持土壤微生态系统稳定,同时抑制土传病害的发生[23-24],但二者关系十分复杂,还有待进一步研究。
孙兰平[25]研究表明4种芍药根际微生物多样性优势菌群主要是Proteobacteria、Acidobacteriota,唐涛等[26]研究认为酸杆菌门和绿弯菌门在健康黄连根际土壤中相对丰度显著高于根腐病病株,而变形菌门和拟杆菌门的相对丰度显著低于根腐病病株,敖金成等[27]研究认为烤烟连作后变形菌门相对丰度呈明显增加,且在根腐病烟株的相对丰度明显高于健株,这均与本研究结果相一致。变形菌门包含大量的动植物致病菌,病原菌侵染植物后相对丰度增加,可能引起土壤抗逆性下降,而放线菌门、绿弯菌门、厚壁菌门中含有大量有益微生物,特别是放线菌门包含的细菌能产生抗生素、酶和有机酸等物质,可以作为土壤质量的评价指标,其丰度下降,可能会导致植株发病率增加[28]。
本研究表明白芍病株根际土壤的Sphingomonas相对丰度高于健株,但差异不显著。其他细菌属Vicinamibacteraceae、Rokubacteriales、Tepidisphaerales在健株根际土壤中的相对丰度显著高于病株,而Chthoniobacter、Subgroup7、Saccharimonadales在病株根际土壤中的相对丰度显著高于健株。唐涛等[26]研究表明在感病黄连叶片样品中鞘氨醇单胞菌属相对丰度高于健康叶片,李华伟等[29]研究认为马铃薯晚疫病根际土壤中鞘氨醇单胞菌属的丰度高于健康植株,但未达到显著差异,这与本研究完全一致。可能与鞘氨醇单胞菌属能降解土壤有毒物质,提高植物抗逆性有关[30]。其他未知菌属因现有分析手段有限,还需进一步进行研究。
余妙等[31]研究认为根腐病西洋参土壤中的Zygomycota丰度显著增加,Basidiomycota和Glomeromycota丰度均减少。有研究表明,担子菌门微生物能分解木质素、纤维素等,是土壤碳循环的重要分解者,能有利促进土壤碳循环[32]。但赵卫松等[23]研究认为,在马铃薯病株根际土壤中,子囊菌门、担子菌门和壶菌门相对丰度显著提高,接合菌门、球囊菌门相对丰度显著降低,这与本研究有所差异。可能与作物属性、地域差异,土壤类型等有关。
本研究表明白芍病株根际土壤真菌Ilyonectria、Erysiphe、Mortierella、Monographella、Fusarium、Lecanicillium的相对丰度显著高于健株。健株根际土壤中Talaromyces、Cryptococcus、Botrytis的相对丰度高于病株。土赤壳属真菌是西洋参锈腐病[33]、天麻褐腐病[34]、黄连根腐病[35]的主要致病菌。而Fusarium、Erysiph是引起白及根腐病与白粉病的主要致病菌[11]。Fusarium则是引起根和根茎类药用植物病害的重要真菌,其中尖孢镰刀菌和腐皮镰刀菌会导致中药材根腐病发生[8]。而Lecanicillium能寄生线虫及锈病病菌、白粉病菌等多种植物病原真菌[36]。篮状菌属中部分种可以产生高活性的木质纤维素酶类,对矿质营养元素吸收、提高作物抗逆性有积极的促进作用[37]。基于现有分析手段,对部分真菌的生态功能有待进一步深入研究。因此,有害真菌Ilyonectria、Erysiphe、Fusarium等相对丰度增加,是导致河西地区白芍根腐病发生的重要原因之一。
张智浩等[12]认为,pH、全氮、碱解氮、速效钾、阳离子交换量是影响白菜健株与根肿病病株细菌群落和真菌群落的重要因子,张英英等[13]研究认为,特殊药材连作土壤中pH、电导率、硝态氮、有效磷、速效钾是影响土壤微生物群落变化的主要因素。Actinobacteriota、Bacteroidetes与有机质、全磷、碱解氮、速效钾呈正相关,Basidiomycota、Ascomycota、Chytridiomycota等与电导率和土壤硝态氮呈正相关,这与本研究相似。植物根系与土壤微生物相互作用可能受到多面影响,土壤理化性质与土壤微生物的互作关系还有待进一步深入研究。
4 结 论
与健株相比,白芍根腐病病株土壤有机质含量显著增加,速效钾含量显著降低,土壤碱性磷酸酶、过氧化物酶显著增加,白芍病株根际土壤细菌丰富度和多样性减少,真菌丰富度和多样性增加。细菌门水平上Proteobacteria、Bacteroidota、Sumerlaeota在病株根际土壤中的相对丰度显著高于健株,分别增加40.2%、141%和1900%,病株根际土壤细菌群落中Chthoniobacter、Subgroup7、Saccharimonadales等相对丰度显著增加。真菌门水平上Zygomycota在白芍病株根际土壤中的相对丰度显著高于健株,相对丰度增加342%。真菌群落中Ilyonectria、Erysiphe、Fusarium等有害真菌相对丰度显著增加,分别是健株的166.5、53.3、5.7倍。土壤pH、有机质、有效磷、速效钾、水溶性盐、碱性磷酸酶、过氧化物酶、脲酶、蔗糖酶是影响白芍根际土壤微生物群落变化的重要因子,主要与细菌优势菌门Chloroflexi、Methylomirabilota、Actinobacteriota,真菌优势菌门Chytridiomycota、Basidiomycota、Ascomycota的变化密切相关。
