种植年限对头花蓼土壤微生物群落的影响
2024-03-13魏升华杜富强严福林朱勋翠安江勇
杨 玲,魏升华,杜富强,严福林,朱勋翠,安江勇
(1.贵州中医药大学药学院,贵阳 550025;2.兴黔科技发展有限公司,贵阳 550025)
【研究意义】头花蓼(PolygonumcapitatumBuch.-Ham. ex D. Don)来源于蓼科植物头花蓼干燥全草或地上部分[1],收载于2019年版《贵州省中药材、民族药材质量标准》[2],是贵州十大苗药之一,为贵州省中药材领域15个重点支持的道地特色中药材品种之一。近年来,以头花蓼为原料的多个中成药(如热淋清颗粒、宁泌泰胶囊和四季草颗粒等单、复方成药)市场销量较好,头花蓼药材原料需求逐年上升,种植面积随之扩大。自2017年以来,贵州各地推广种植头花蓼约1333 hm2,药材销售收入约1.4亿元。然而,连作障碍是当前限制头花蓼产业发展的重要问题,连续种植3年的地块所产的药材质量及产量均有所下降;连续种植4年的地块植株长势较差,基本绝收。为满足其市场需求,贵州头花蓼种植区域自2000年以来已多次迁移。因此,研究头花蓼连作障碍,探明头花蓼发生连作障碍的原因,对头花蓼产业的可持续发展具有重要意义。【前人研究进展】目前头花蓼的连作障碍主要依靠迁移种植地的方式解决,治标不治本。对头花蓼连作障碍机制的研究较少,前人对头花蓼连作后土壤的理化性质和合理施肥等方面的研究已有文献报道。刘燕等[3]检测种植头花蓼不同年限土壤的pH和有机质等理化性质发现,随连作年限增加土壤营养状况呈不同程度降低且出现酸化。何佳芳等[4]通过合理施肥以缓解头花蓼的连作障碍问题,研究显示,施用不同肥料可以促进茎的生长与植株分蘖,改善土壤微生物群落结构,增加了头花蓼的产量与质量。刘勇等[5-7]的研究结果表明,头花蓼植株及各部位浸提液、根际土壤浸提液、好氧与厌氧腐解液对其种子萌发及幼苗生长均有较强的化感自毒作用,并存在低促高抑现象,其中腐解液组均出现种子(胚)根芽倾倒、腐烂等症状。土壤作为植物吸收与代谢的中间枢纽,其中所含养分、微量元素等的变化主要由植物与微生物系统间相互作用引起,而土壤中微生物群落组成的变化也与土壤环境息息相关[8-9]。中药材连作土壤的微生物间存在显著差异。李茜等[10]发现,随栽培年限增加,土壤中真菌、细菌及放线菌丰富度均逐年降低;同时,连作会减少土壤中的有益微生物而增加有害微生物,降低土壤微生物群落的多样性,刘诗蓉等[11-12]发现,连茬次数的增加,使潜在致病细菌(如镰刀菌属真菌、果胶杆菌细菌等)丰度逐渐增加,而球囊菌门真菌作为该植物的有益真菌丰度逐渐降低,同时真菌与细菌多样性均有所降低;结合植物生长生物量与代谢组学得出结论,连作还会导致中药材的生长发育受到限制,产量降低[13-14]。【本研究切入点】关于头花蓼连作障碍问题,前人多聚焦于连作土壤理化性质、酶活性,而对连作后土壤微生物群落的相关变化仍不清楚。【拟解决的关键问题】本研究采用Illumina高通量测序技术对头花蓼连作土壤进行微生物多样性分析,探明不同种植年限头花蓼土壤微生物(细菌和真菌)的群落组成及物种多样性变化规律,以期从土壤微生物的角度分析造成头花蓼连作障碍的原因。探明不同种植年限头花蓼土壤的变化趋势,以期从土壤微生物的角度探究其连作障碍机制,为贵州头花蓼产业的可持续发展提供理论依据。
1 材料与方法
1.1 材料
1.1.1 土样 采自贵阳市乌当区贵州兴黔科技发展有限公司威门药业种繁基地(106.874 44°E,26.793 61°N,海拔1178.87 m),于2021年11月21日对已采收头花蓼地块土壤进行采集。
1.1.2 试剂 DP812 DNA提取试剂盒由天根生化科技(北京)有限公司生产;KOD FX Neo Buffer由北京百灵克生物科技有限责任公司生产。
1.2 方法
1.2.1 土壤样品采集 以头花蓼和玉米轮作地块土壤(CK)为对照,采用5点取样法,分别采集头花蓼连续种植2年(T2)、3年(T3)和4年(T4)的植株周围15 cm的土壤,取样后去除须根、残枝,将5点土壤样品混合均匀后,装入无菌管低温保存,每个处理3次重复。新鲜土样均为黄色壤土,基本理化性质见表1。

表1 供试土壤的理化性质
1.2.2 DNA 提取和高通量测序 称取0.5 g土壤,使用DNA提取试剂盒提取样品总DNA,再进行PCR扩增,用1.8%琼脂糖凝胶电泳检测PCR扩增产物。使用细菌通用引物338F(5′-ACTCCTACGGGAGGCAGCA-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)对细菌16SrRNA V3~V4区进行PCR扩增,通用真菌引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS2(5′-GCTGCGTTCTTCATCGATGC-3′)对真菌ITS片段进行扩增[15]。扩增体系:5 μL KOD FX Neo Buffer,0.2 μL KOD FX Neo,正向引物0.3 μL(0.2 μmol/L),反向引物0.3 μL(2 μmol/L),2 μL dNTP,50 ng模板DNA,ddH2O补至10 μL。反应条件:95 ℃预变性5 min,95 ℃变性30 s,50 ℃退火30 s,72 ℃延伸40 s,共25个循环,72 ℃终延伸7 min。PCR扩增产物用1.8%琼脂糖凝胶电泳检测。委托北京百迈客生物科技有限公司Illumina Novaseq平台进行测序。
1.3 数据处理与分析
1.3.1 测序数据质量评估 首先使用Trimmomatic对原始数据进行质量过滤,然后使用Cutadapt进行引物序列的识别与去除,其后使用USEARCH对双端reads进行拼接并去除嵌合体UCHIME最终得到高质量的序列用于后续分析。
1.3.2 OTU聚类分析 使用USEARCH在相似性97%的水平上对序列进行聚类,以测序所有序列数的0.005%作为阈值过滤OTUs。
1.3.3 Alpha指数分析 Alpha多样性是指一个特定区域或者生态系统内的多样性,常用的度量菌群丰度的指标有Chao丰富度估计量(Chao1 richness estimator)、Ace丰富度估计量(Ace richness estimator);度量菌群多样性的指标有香农指数(Shannon wiener diversity index,种群多样性指数)、辛普森指数(Simpson diversity index,物种均匀度指数)。使用QIIME2(https://qiime2.org/org/)分析软件进行分析。
1.3.4 Beta多样性分析 Beta多样性分析用于分析时间、空间尺度上的物种组成变化。方法:基于binary jaccard、bray curtis和(un)weighted unifrac(限细菌)多种算法呈现物种多样性矩阵。本研究主要运用主坐标分析(PCoA)与非加权组平均法(UPGMA)进行分析。
1.3.5 物种注释及分类学分析 以UNITE为参考数据库使用朴素贝叶斯分类器对特征序列进行分类学注释,可得到每个特征对应的物种分类信息,进而在各水平(phylum,class,order,family,genus,species)统计各样品群落组成,利用QIIME软件生成不同分类水平上的物种丰度表,再绘制样品各分类学水平下的群落结构图。本研究仅展示门水平与属水平下相对丰度变化;采用SPSS 26.0统计软件对测序数据进行分析处理,组间比较采用t检验,以P<0.05 表示差异显著。
2 结果与分析
2.1 连作种植头花蓼根际土壤细菌的相对丰度与多样性
2.1.1 土壤细菌DNA高通量测序数据质量评估 从表2可知,Illumina测序共获得1599 095对序列。高质量序列数为79 571~79 802对,随头花蓼种植年限增加呈下降再趋于平稳趋势;有效序列数为77 876~78 796对,随头花蓼种植年限增加呈先降后升再降趋势;序列平均长度为420.2~424.4 bp,随头花蓼种植年限增加呈先降后升再降趋势。各处理间高质量序列数、有效序列数和序列平均长度差异均不显著。有效序列占比为97.47%~98.56%,均在97.00%以上,表明在当前测序深度下可以很好地揭示细菌群落的绝大部分物种。
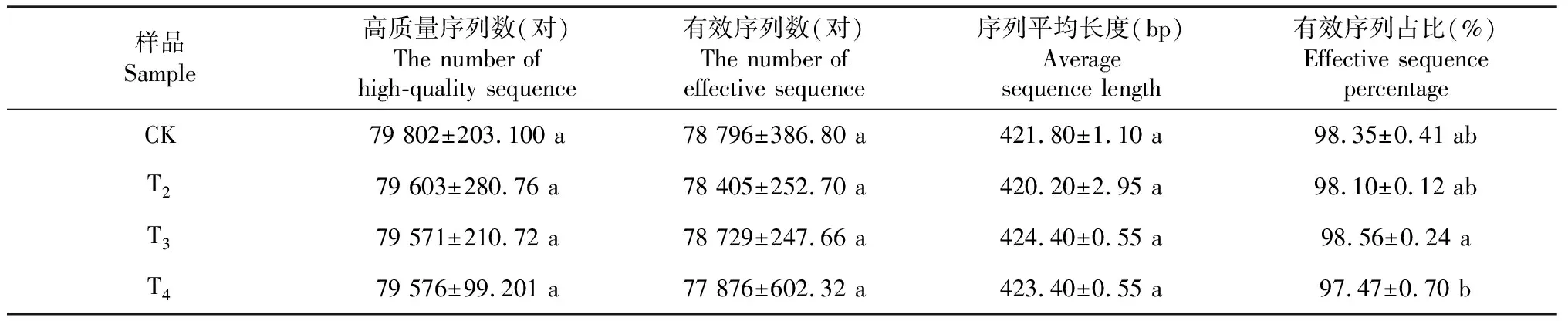
表2 不同处理土壤细菌的高通量序列特征
2.1.2 土壤细菌OTU聚类分析 从图1直观看出4个处理间共有或特有的OTU数,4个处理共得到细菌OTU总数为1969,CK、T2、T3和T4的OTU数分别是1905、1925、1876和1877。其中,T2(连续种植2年)的OTU数最大,T4(连续种植4年)的OTU数最小。T3的OTU数下降且之后趋于平稳。表明,随着头花蓼种植年限的增加,细菌OTU数呈先增后减再趋于平稳趋势。4个处理土壤细菌共有OTU数为1772,其特有OTU数分别是12、14、0和0。T2土壤特有细菌OTU数较CK增加16%,而在T3和T4则减少到零。综合看,细菌OTU总数及其特有OTU数均随头花蓼种植年限的增加而减少。

图1 不同处理土壤细菌的OTU聚类Fig.1 Soil bacteria OTU cluster with different treatments
2.1.3 土壤细菌的Alpha多样性 Alpha多样性分析可以有效反映单个样品物种丰度及物种多样性。Alpha多样性分析结果(表3)表明,T2、T3和T4细菌群落种群丰富度指数中ACE指数分别为1620.30、1749.70和1787.22,分别较CK(1720.63)上升-6.19%、1.66%和3.73%;Chao1指数分别为1644.75、1770.32和1818.03,分别较CK(1739.37)上升-5.75%、1.75%和4.33%。辛普森指数分别为1.00、0.99、1.00和1.00,不同处理间几乎无变化;香农指数分别为8.70、9.07和9.23,分别较CK(9.17)上升-5.43%、-1.03%和0.68%。综合看,细菌群落物种丰富度与物种多样性从连作2年开始逐渐增加。

表3 不同处理土壤细菌的Alpha多样性指数
2.1.4 土壤细菌群落的聚类分析 从图2看出,细菌群落CK与部分T2分别聚在两端,T3、T4和部分T2聚为1支,与CK分别聚为2支。表明,CK与T2、T3、T4的细菌群落存在差异,且随连作年限增加差异逐渐增大。主成分分析与聚类分析的结果相同,即随连作年限增加,土壤微生物群落组成逐渐发生变化,T3与T4较相似,T2与上述差异相对较大。综合看,细菌群落结构的相似度随头花蓼连作年限增加而逐渐降低。

图2 细菌的UPGMA聚类和PcoA图谱Fig.2 The UPGMA cluster and PcoA of bacteria
2.1.5 土壤细菌群落的组成 土壤细菌群落包括32门86纲184目276科440属471种。从图3看出,门水平下:前十大菌群依次为变形菌门(Proteobacteria,34.80%~40.80%)、酸杆菌门(Acidobacteria,24.20%~31.70%)、绿湾菌门(Chloroflexi,5.70%~9.40%)、芽单胞菌门(Gemmatimonadetes,3.50%~5.50%)、己科河菌门(Rokubacteria,3.40%~5.10%)、放线菌门(Actinobacteria,1.70%~3.80%)、拟杆菌门(Bacteroidetes,2.80%~4.60%)、匿杆菌门(Latescibacteria,1.80%~3.80%)、硝化螺旋菌门(Nitrospirae,1.70%~2.50%)和浮霉菌门(Planctomycetes,1.50%~2.60%)。其中,变形菌门(Proteobacteria)与酸杆菌门(Acidobacteria)为优势菌群,总占比>64%以上。CK、T2、T3和T4的变形菌门占比分别为40.80%、40.20%、37.60%和34.80%,随连作年限增加而显著降低;酸杆菌门的占比分别24.20%、26.50%、31.70%和29.10%,随连作年限增加而逐渐增加,T4略微降低。

A:1.变形菌门;2.酸杆菌门;3.绿湾菌门;4.芽单胞菌门;5.己科河菌门;6.放线菌门;7.拟杆菌门;8.匿杆菌门;9.硝化螺旋菌门;10.浮霉菌门。B:1.第6子群c型未培养的细菌;2.罗库菌目o型未培养的细菌;3.芽单胞菌科f型未培养的细菌;4.NB1-j f型未培养的细菌;5.MND1;6.第117子群c型未培养的细菌;7.匿杆菌门p型未培养的细菌;8.硝化螺菌属;9.黄色杆菌科f型未培养的细菌;10. δ变形菌门c型未培养的细菌。A:1.Proteobacteria;2.Acidobacteria;3.Chloroflexi;4.Gemmatimonadetes;5.Rokubacteria;6.Actinobacteria;7.Bacteroidetes;8.Latescibacteria;9.Nitrospirae;10.Planctomycetes.B.1.uncultured_bacterium_c_Subgroup_6;2.uncultured_bacterium_o_Rokubacteriales;3.uncultured_bacterium_f_Gemmatimonadaceae;4.uncultured_bacterium_o_NB1-j;5.MND1;6.uncultured_bacterium_c_Subgroup_17;7.uncultured_bacterium_p_Latescibacteria;8.Nitrospira;9.uncultured_bacterium_f_Xanthobacteraceae;10.uncultured_bacterium_c_Deltaproteobacteria.
属水平下:前十大菌群分别为第6子群c型未培养的(uncultured_bacterium_c_Subgroup_6,10.66%~20.42%)、罗库菌目o型未培养的(uncultured_bacterium_o_Rokubacteriales,2.84%~4.14%)、芽单胞菌科f型未培养的(uncultured_bacterium_f_Gemmatimonadaceae,2.78%~4.38%)、uncultured_bacterium_o_NB1-j(2.62%~3.92%)、MND1(1.10%~4.32%)、第117子群c型未培养的(uncultured_bacterium_c_Subgroup_17,2.42%~3.50%)、匿杆菌门p型未培养的(uncultured_bacterium_p_Latescibacteria,1.72%~3.32%)、硝化螺菌属(Nitrospira,1.52%~2.46%)、黄色杆菌科f型未培养的细菌(uncultured_bacterium_f_Xanthobacteraceae,0.88%~4.40%)、δ变形菌门c型未培养的(uncultured_bacterium_c_Deltaproteobacteria,1.34%~2.22%)。其中,uncultured_bacterium_c_Subgroup_6的占比最大,CK、T2、T3和T4的占比分别为13.62%、10.66%、20.42%和18.50%,与T2相比,T3相对丰度显著增加,T4略微降低。除uncultured_f_Gemmatimonadaceae外,其他属几乎均在T2(连作第2年)下降后呈再上升并保持稳定趋势。
2.2 连作种植头花蓼根际土壤真菌的相对丰度与多样性
2.2.1 土壤真菌DNA高通量测序数据的质量评估 从表4看出,Illumina测序共获得1594 194对序列。高质量序列数为73 755~82 168对,随头花蓼种植年限增加呈先升后降再升趋势;有效序列数为72 607~81 067对,随头花蓼种植年限增加呈先升后降再升趋势;序列平均长度为248.8~261.0 bp,随头花蓼种植年限增加呈先降后升趋势。各处理间高质量序列数、有效序列数和序列平均长度差异均不显著;有效序列占比为97.42%~98.23%,均在97.00%以上。表明,在当前测序深度下可以很好地揭示真菌群落的绝大部分物种。

表4 不同处理土壤真菌的高通量序列特征
2.2.2 土壤真菌OTU聚类分析 由图4可知,4个处理共得到真菌OTU总数为4769,其中,CK、T2、T3和T4的OTU数分别是1172、1288、1084和1225,T2的OTU数最大,T3的OTU数最小;T4的OTU数较T3高。表明,随头花蓼种植年限增加,土壤真菌OTU数呈先增后减再增趋势。4个处理土壤真菌共有OTU数为614,其特有OTU数分别是81、58、38和42。随年限增加,各处理土壤特有真菌OTU序列较CK分别减少28%、53%和48%。综合看,真菌OTU总数及其特有OTU数均随头花蓼种植年限增加而减少。

图4 不同处理土壤真菌的OTU聚类Fig.4 OTU cluster of fungi in soil with different treatments
2.2.3 土壤真菌的Alpha多样性 从表5看出,T2、T3和T4的真菌群落种群丰富度指数中ACE指数依次为635.00、568.60和612.89,分别较CK(887.38)下降39.74%、56.06%和44.79%;Chao1指数分别为647.00、575.18和614.05,与CK相比,分别较CK(715.61)下降10.61%、24.42%和16.54%。普森指数分别为0.95、0.92和0.96,分别较CK(0.96)上升-0.42%、-3.41%和0.26%;香农指数分别为6.67、6.20和6.54,与CK相比,分别较CK(6.52)上升2.32%、5.10%和0.37%。综合看,真菌群落物种丰富度与物种多样性随头花蓼种植年限增加呈先降后增趋势,但总体呈降低趋势。

表5 不同处理土壤真菌的Alpha多样性指数
2.2.4 土壤真菌的群落聚类 从图5看出,真菌群落CK与T3、T4分别聚为一支,T2分别分布于2分支,部分T2与T3、T4交织,表明,T2处于CK与其余处理的过渡段,随连作年限增加而逐渐发生变化。主成分分析与聚类分析结果相同,随连作年限增加,土壤微生物群落组成逐渐发生变化,T3与T4较相似,T2与其余处理差异相对较大。综合看,真菌群落结构的相似度随头花蓼连作年限增加而逐渐降低。

图5 不同处理土壤真菌的UPGMA聚类和PcoA图谱Fig.5 The UPGMA cluster diagram and PcoA diagram of fungi with different treatments
2.2.5 土壤真菌的群落组成 从图6看出,土壤真菌群落包括12门33纲81目170科351属429种。门水平下,前十大菌群分别为子囊菌门(Ascomycota,42.90%~50.50%)、担子菌门(Basidiomycota,18.90%~29.90%)、被孢霉门(Mortierellomycota,2.00%~14.00%)、球囊菌门(Glomeromycota,0.40%~7.40%)、壶菌门(Chytridiomycota,0.80%~6.10%)、罗兹菌门(Rozellomycota,0.80%~3.60%)、梳霉门(Kickxellomycota,0.00%~0.20%)、油壶菌门(Olpidiomycota,0.00%~0.10%)、蛙粪霉门(Basidiobolomycota,0.00%~0.20%)和捕虫霉门(Zoopagomycota,0.00%~0.10%)。其中,子囊菌门与担子菌门为优势菌群,总占比在61%以上。CK、T2、T3和T4的子囊菌门占比分别为50.50%、42.90%、46.30%和46.00%,担子菌门分别为26.90%、18.90%、29.80%和29.90%,二者相对丰度在T2后开始下降,再小幅度上升后趋于平稳;被孢霉门和壶菌门呈先增后减趋势,T4时占比已经极小。

A:门水平下;1.子囊菌门;2.担子菌门;3.被孢霉门;4.球囊菌门;5.壶菌门;6.罗兹菌门;7.梳霉门;8.油壶菌门;9.蛙粪霉门;10.捕虫霉门。B:属水平下;1.被孢霉属;2.古根菌属;3.镰孢属;4.曲霉属;5.枝孢属;6.红菇属;7.Tetracladium;8.淡紫紫孢菌属;9.链格孢属;10.多孢囊霉属。A:Phylum level;1.Ascomycota;2.Basidiomycota;3.Mortierellomycota;4.Glomeromycota;5.Chytridiomycota;6.Rozellomycota;7.Kickxellomycota;8.Olpidiomycota;9.Basidiobolomycota;10.Zoopagomycota.B:Genus level;1.Mortierella;2.Archaeorhizomyces;3.Fusarium;4.Aspergillus;5.Cladosporium;6.Russula;7.Tetracladium;8.Purpureocillium;9.Alternaria;10.Diversispora.
属水平下,前十大菌群分别为被孢霉属(Mortierella,2.66%~14.30%)、古根菌属(Archaeorhizomyces,2.48%~3.88%)、镰孢属(Fusarium,2.46%~3.62%)、曲霉属(Aspergillus,2.04%~2.70%)、枝孢属(Cladosporium,1.60%~2.94%)、红菇属(Russula,1.30%~2.36%)、四枝孢属(Tetracladium,0.82%~2.26%)、淡紫紫孢菌属(Purpureocillium,0.16%~3.72%)、链格孢属(Alternaria,0.76%~1.00%)和多孢囊霉属(Diversispora,0.00%~1.70%)。其中,CK、T2、T3和T4的被孢霉属占比最大,分别为5.96%、14.30%、9.50%和2.66%,在T2后相对丰度急剧升高,后随连作年限增加而逐渐降低。在T3和T4均出现多孢囊霉属(Diversispora),且无显著变化。除被孢菌属外,其余属真菌相对丰度均随连作年限增加而减少或上下小幅度波动。
3 讨 论
土壤微生物是土壤生态系统的重要组成部分,其多样性和群落组成主要受植物物种与环境因子的变化影响。细菌和真菌是土壤中最主要的微生物,是土壤微生物多样性的重要指标。华菊玲等[16]研究表明,连续种植可使土壤微生物的区系平衡遭到破坏。大量研究表明,土壤微生物与土壤生态系统相互作用、相互影响,特别是在连作情况下,其根际土壤微生物种群发生改变。肖春萍等[17]和殷继忠等[18]分别对人参和大豆土壤微生物进行研究的结果显示,细菌群落相对丰度均随连作年限增加而降低,而真菌群落相对丰度增加。但在短期连作过程中,不同药用植物的连作障碍程度及表现各不相同。张敏等[13]研究甘草连作土壤微生物群落变化规律发现,随着种植年限增加,土壤细菌群落相对丰度增加,而真菌群落相对丰度降低,二者多样性均呈下降趋势,本研究结果与之相似。
本研究表明,连作头花蓼地块土壤细菌群落相对丰度排前三位的菌群分别为变形菌门、酸杆菌门与绿弯菌门。其中,变形菌门和酸杆菌门相对丰度远高于绿弯菌门,故列为其细菌群落的优势菌群。前人对广藿香[19]、甘薯[20-21]及烤烟[22-23]等不同植物根际土壤微生物群落结构及多样性研究发现,变形菌门、放线菌门、酸杆菌门和绿弯菌门为主要菌群,本研究结果与之相似。崔纪超等[21]认为,变形菌门是自然界最普遍的菌门,包含多种代谢种类的细菌,大多数营兼性或者专性厌氧及异养生活。在本研究中变形菌门随连作年限的增加呈小幅度降低,可能是引起土壤板结的原因之一;而酸杆菌门细菌为嗜酸性菌,与土壤pH变化有紧密联系[24],其相对丰度随连作年限增加而增加,可能是土壤酸化的原因之一。属水平下uncultured_bacterium_c_Subgroup_6相对丰度占比最大,且远高于其他属菌群,为优势菌群,与连作第2年相比,第3年相对丰度显著性增加,第4年略微降低。除uncultured_f_Gemmatimonadaceae外,其他属几乎均在连作第2年下降而后再上升并保持稳定。uncultured_bacterium_o_Rokubacteriales、uncultured_bacterium_f_Gemmatimonadaceae等菌群与Wang等[25]研究结果一致,其认为uncultured_d_bacterum_o_Rokobacteriales、uncultured_g_bacterum_f_Gemmatimonadaceae与uncultured_c_bacterum_c_Subgroup_6是造成不同树种间细菌群落差异的主要原因,可能也是造成头花蓼不同连作年限间细菌群落差异的主要因素。
在真菌门水平下,子囊菌门和担子菌门为优势菌群,与崔纪超等[21,26]对真菌群落研究结果一致,二者相对丰度在连作第2年后开始逐渐上升,但低于对照组。连作后变化与Gao等[26]研究甘薯连作中子囊菌门相对丰度变化相反,该研究表明连作会降低其相对丰度,可能会影响有机质的降解而降低土壤肥力。被孢霉门、壶菌门呈现先增加后降低趋势,连作第4年时占比已经极小。属水平上,与对照相比,被孢霉属、枝孢属在连作第3年开始相对丰度持续下降,而被孢霉属为腐生真菌,被认为可以增加土壤养分有效性、提高酶活性以及缓解土壤酸化[27];古根菌属、镰刀菌属、红菇属相对丰度在连作第2年增加,其中镰刀菌属真菌可以侵染多种植物而引起根腐病、茎腐病、腐败病等多种腐烂病,同时会产生毒素使植株萎蔫甚至死亡[28],与前人研究头花蓼枯萎病[29]与茎枯病[30]的结果一致。
连作破坏微生物的正常生长繁殖环境,同时根系分泌物的积累导致土壤碳氮循环失衡、土壤酸化及理化性质恶化[31]。相关研究表明,在连续种植情况下,植物生长过程中分泌的化感自毒物质会影响植株的生长与发育[32-33],同时根系分泌物也会使根际微生物群落重构,导致土壤理化性质发生改变,三者相互关联、相互影响[34]。在连续种植单一物种条件下,其根系分泌物随着植物的生长发育等生命活动被释放到根际土壤中并逐渐累积,根际土壤理化性质也逐渐发生改变,进而使根际土壤微生物群落结构被改变,三者协同互作导致原有的植物-土壤-微生物平衡系统被打破,增强了根际病原菌的侵染能力,还加剧了植物化感自毒物质的释放和土壤理化性质的劣变。如此恶性循环的变化使得土壤环境无法再适应作物的连续种植,便产生了较为严重的连作障碍现象。刘勇等[5-7]对头花蓼植株及土壤浸提液的研究也验证头花蓼有较强的化感自毒作用,结合前期研究基础与基地种植情况,连作头花蓼采收后未去除植株残留茎基会极大地影响头花蓼种子萌发,并发生倒苗腐烂的现象,表明残留茎基与连作土壤中的根系分泌物极大可能影响了土壤微生物群落结构与土壤理化性质,导致头花蓼连作障碍的发生,进而影响头花蓼种苗的后续生长与含量积累。后期进一步研究连作头花蓼与其土壤理化性质、根系分泌物之间的关系,可为解决头花蓼连作障碍问题提供理论基础。
4 结 论
头花蓼连作加大了其根际土壤微生物群落结构组成的差异,随着连续种植年限增加,变形菌门细菌、被孢霉属真菌等的相对丰度逐渐降低,而酸杆菌门细菌、镰刀菌属真菌等的相对丰度逐渐增加,可能是头花蓼连作障碍发生的原因之一。
