环状RNA GRIN2B通过调控微小RNA-135b对食管癌细胞增殖和侵袭的影响实验研究
2024-03-13易三凤屈银宗龚承先赵艳洁杨建美
易三凤,屈银宗,龚承先,赵艳洁,杨建美
(1.湖北省中西医结合医院消化内科,湖北 武汉 430015;2.青岛大学附属医院肿瘤科,山东 青岛 266003)
食管癌是全球高发的消化系统恶性肿瘤,发病率及病死率均较高,给人类健康带来重大威胁[1-3]。深入研究新的分子治疗靶点和潜在的诊断标志物对改善食管癌患者预后至关重要。环状RNA(Circular RNA,circRNA)是一种闭环状RNA,没有蛋白质编码功能,呈现显著的细胞特异性和组织特异性[4]。研究[5-6]表明,绝大多数癌症均存在circRNA表达失调,其表达水平与癌症患者的临床分期、淋巴结转移、预后以及复发有关。在食管癌中circRNA充当肿瘤促进因子或肿瘤抑制因子,影响食管癌细胞的分化、脂肪代谢和铁死亡等过程,是食管癌发生和进展的重要生物标志物[7]。探究circRNA与食管癌治疗的潜在关系,可能有利于食管癌的临床病理诊断和靶向治疗。环状RNA GRIN2B(Circular RNA GRIN2B,circ-GRIN2B)位于人基因组12p13.1区域,由12号外显子首尾相接而成,在食管癌中的表达和活性鲜有报道。基因表达综合数据库(Gene Expression Omnibus,GEO)分析显示circ-GRIN2B在食管癌组织中的表达明显低于正常组织。研究证实,微小RNA(microRNA,miR)-135b在多种恶性肿瘤如卵巢癌、食管癌中表达上调,发挥癌基因功能,沉默miR-135b表达能够抑制肿瘤细胞的恶性生物学行为[8]。本研究探讨circ-GRIN2B是否通过调控miR-135b影响食管癌细胞增殖和侵袭。
1 材料与方法
1.1 实验细胞与主要试剂 食管癌细胞株(Eca109、TE-13、KYSE30、OE33、EC9706)和正常食管上皮细胞株HET-1A购自美国ATCC公司。空载对照质粒、circ-GRIN2B过表达质粒(批号:TSP12-13、TSP12-49)购自北京擎科生物科技有限公司;RPMI-1640培养基、Lipofectamine 2000(批号:AM1660TS、AM826PE)购自美国赛默飞公司;总RNA提取试剂盒(批号:15596026)购自美国Invitrogen公司;胎牛血清(FBS)、蛋白定量试剂盒(批号:T8593E、T9300A)购自日本Takara公司;Transwell小室、双荧光素酶检测系统(批号:PICM0RG50、PICM0TO10)购自美国Merck Millipore公司;荧光素酶质粒circ-GRIN2B-wt和circ-GRIN2B-mut及基质胶(批号:84574、84575、66589)购自美国Proteintech公司;抗体周期蛋白依赖性激酶8(CDK8)、周期素C(Cyclin C)、β-微管蛋白(β-tubulin)和纤维结合蛋白(FN)、转录因子8(ZLF8)、叉头盒蛋白C2(FOXC2)(批号:ab229192、ab85927、ab18207、ab2413、ab168527、ab308055)购自美国Abcam公司。
1.2 实验方法
1.2.1 细胞培养与转染:采用含13% FBS的RPMI-1640培养基培养Eca109、TE-13、KYSE30、OE33、EC9706 和HET-1A细胞。取对数期的EC9706细胞消化并接种在6孔板,培养箱内培养12 h。采用Lipofectamine 2000试剂分别转染circ-GRIN2B过表达质粒(circ-GRIN2B组)和空载对照质粒(NC组)至EC9706细胞。转染50 h后,验证质粒转染效果。
1.2.2 RT-qPCR检测circ-GRIN2B和miR-135b表达:使用总RNA提取试剂盒裂解并提取细胞总RNA,以500 ng RNA为模板合成cDNA。以U6和GAPDH为内参,引物序列见表1。以2-ΔΔCt法分析circ-GRIN2B和miR-135b相对表达量。

表1 各基因引物序列
1.2.3 平板克隆实验检测EC9706细胞增殖:转染20 h后,胰酶消化并重悬EC9706细胞,每组加入约900个细胞至6孔板,最终培养体积为3 ml,保证每孔底呈单细胞状态,培养箱中连续培养13 d。弃去剩余培养基,流水洗涤5次,用1%多聚甲醛固定50 min。加入0.3%结晶紫染色50 min后进行观察、拍照并统计分析。
1.2.4 侵袭实验检测EC9706细胞侵袭:取200 μl基质胶均匀铺在Transwell室上部,培养箱内静置形成基质屏障。转染20 h后,胰酶消化并重悬EC9706细胞,在Transwell室上部每组加入3.5×105个EC9706细胞,培养基体积为200 μl。在Transwell室下部加750 μl含30% FBS的培养基,保证Transwell室上下均无气泡,培养箱内培养25 h。流水洗涤5次,用1%多聚甲醛固定50 min后加入0.3%结晶紫染色50 min。在倒置光学显微镜下拍照并统计分析。
1.2.5 双荧光素酶报告实验检测circ-GRIN2B与miR-135b靶向关系:将对数生长期的EC9706细胞铺于6孔板,分别共转染circ-GRIN2B-wt和miR-NC、circ-GRIN2B-mut和miR-NC、circ-GRIN2B-wt和miR-135b、circ-GRIN2B-mut和miR-135b,每组转染终浓度为150 nmol/L。转染45 h后,裂解每组细胞,分别检测海肾荧光素酶活性和萤火虫荧光素酶活性作为对照和校正参数。
1.2.6 Western blot检测EC9706细胞增殖和侵袭相关蛋白:使用蛋白裂解液充分裂解EC9706细胞,高速离心30 min收集总蛋白后煮沸9 min。采用11% SDS-PAGE胶电泳分离,恒温下转移到聚偏二氯乙烯膜,10%质量浓度脱脂牛奶封膜3 h。稀释一抗,均匀覆盖在聚偏二氯乙烯膜,室温反应6 h。将稀释后的二抗均匀覆盖在聚偏二氯乙烯膜,室温孵育2.5 h。将ECL试剂盒的A液和B液混合,均匀覆盖在膜蛋白面,在化学发光仪中曝光、显影,以β-tubulin为内参,对条带进行分析。

2 结 果
2.1 不同食管癌细胞株circ-GRIN2B表达比较 见图1。RT-qPCR结果显示,与HET-1A细胞比较,circ-GRIN2B在食管癌细胞株Eca109、TE-13、KYSE30、OE33、EC9706表达降低,且EC9706细胞中最低(均P<0.05)。故采用EC9706细胞进行后续实验。
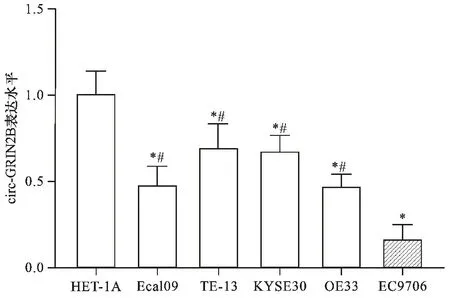
注:与HET-1A细胞比较,*P<0.05;与EC9706细胞比较,#P<0.05图1 不同食管癌细胞株circ-GRIN2B表达比较
2.2 NC组与circ-GRIN2B组circ-GRIN2B表达量比较 在EC9706细胞中转染circ-GRIN2B质粒后,NC组与circ-GRIN2B组circ-GRIN2B表达量分别为1.01±0.38和10.56±2.02,circ-GRIN2B组circ-GRIN2B表达量高于NC组(t=4.657,P<0.01)。
2.3 circ-GRIN2B对EC9706细胞增殖的影响 见图2。平板克隆实验结果显示,NC组和circ-GRIN2B组EC9706细胞集落数量分别为(149.80±11.68)个和(41.24±6.47)个,circ-GRIN2B组EC9706细胞集落数量少于NC组(t=8.127,P<0.01)。

图2 两组EC9706细胞平板克隆实验结果(结晶紫染色,×100)
2.4 circ-GRIN2B对EC9706细胞侵袭的影响 见图3。Transwell实验显示,NC组和circ-GRIN2B组EC9706细胞侵袭数目分别为(90.25±7.48)个和(41.43±8.48)个,circ-GRIN2B组EC9706细胞侵袭数目少于NC组(t=4.317,P<0.01)。
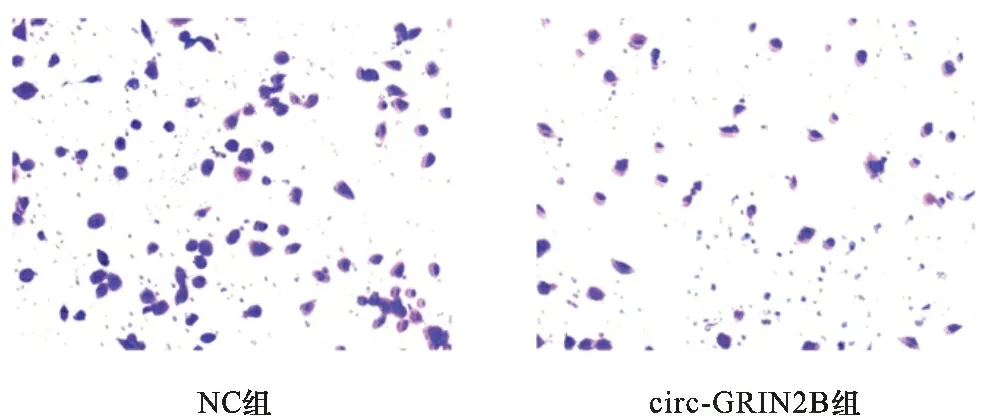
图3 两组EC9706细胞Transwell实验结果(结晶紫染色,×100)
2.5 circ-GRIN2B对miR-135b的靶向调控作用 见图4、5。circRNADb软件预测显示,circ-GRIN2B与miR-135b间存在结合序列。双荧光素酶报告基因结果显示,与miR-NC+circ-GRIN2B-wt组比较,miR-135b+circ-GRIN2B-wt组EC9706细胞荧光素酶活性下降(P<0.01)。
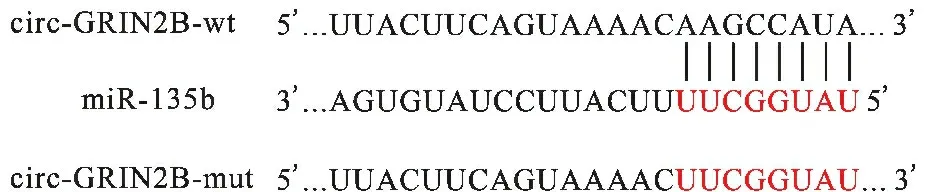
图4 circ-GRIN2B与miR-135b结合位点
2.6 circ-GRIN2B对EC9706细胞miR-135b表达的影响 NC组与circ-GRIN2B组EC9706细胞miR-135b表达量分别为(7.07±0.90)和(1.01±0.18),circ-GRIN2B组miR-135b表达量低于NC组(t=6.596,P<0.01)。
2.7 circ-GRIN2B对EC9706细胞增殖和侵袭相关蛋白表达的影响 见图6。Western blot结果显示,circ-GRIN2B组EC9706细胞增殖相关蛋白(CDK8、Cyclin C)和侵袭相关蛋白(FN、ZLF8、FOXC2)表达水平较NC组降低(均P<0.05)。

注:与NC组比较,*P<0.05图6 circ-GRIN2B对EC9706细胞增殖和侵袭相关蛋白表达的影响
3 讨 论
食管癌属于原发性消化道肿瘤,其发生与原癌基因的激活和抑癌基因的缺失相关[9-11]。circRNA广泛参与肿瘤如喉癌、视网膜母细胞瘤、胸腺瘤等恶性演进过程,调控细胞周期、近端浸润和远端转移,其突变或失活与细胞的恶性转化密切相关[12-14]。近年来研究[15-17]显示,circRNA参与调控关于食管癌细胞的生长、侵袭、放疗敏感性等,可能是食管癌的潜在诊疗靶点。例如,食管癌组织和细胞中circ_0006948表达上调,circ_0006948表达减少可抑制食管癌细胞的生长、迁移、侵袭和上皮间充质转化[17]。circ_141539在食管癌组织中显著上调,其高表达与患者TNM分期、分化程度和预后不良显著相关,具有较高的诊断价值;circ_141539过表达通过海绵化 miR-4469和激活细胞周期蛋白依赖性激酶3表达,促进食管癌细胞的增殖和侵袭[18]。研究[19]发现,在食管癌组织和细胞株中检测到circ-VIM表达显著上调,通过吸附miR-124在体外促进食管癌细胞的免疫逃逸和恶性转化,在体内促进异种移植物的生长和肺转移。本研究结果发现,circ-GRIN2B在食管癌Eca109、TE-13、KYSE30、OE33、EC9706细胞株中表达下调,且EC9706细胞中最低,因此后续选用EC9706细胞进行实验,进一步研究发现过表达circ-GRIN2B能够显著抑制EC9706细胞的增殖和侵袭,同时使EC9706细胞增殖相关蛋白(CDK8、Cyclin C)和侵袭相关蛋白(FN、ZLF8、FOXC2)表达水平下调,表明circ-GRIN2B参与食管癌的发生和发展。
研究[20-22]表明,circRNA在细胞中扮演miRNA的海绵分子,通过调节miRNA含量影响细胞的形态学改变和生物学过程。例如,circ-PSMC3在吉非替尼耐药食管鳞癌细胞中表达下调,过表达circ-PSMC3通过靶向抑制miR-135b表达增加了食管鳞癌细胞对吉非替尼的敏感性,促进食管鳞癌细胞的凋亡[22]。本研究通过circRNADb软件预测并经双荧光素酶报告基因实验证实,circ-GRIN2B与miR-135b存在靶向调控关系。研究[23]显示,miR-135b在细胞内负责调节配体识别,影响多种信号通路的转导,与细胞免疫应答有关。miR-135b可能在非小细胞肺癌、胃癌、胰腺癌等恶性肿瘤中表达升高,能够显著促进肿瘤细胞的生长、侵袭和化疗耐药性[24-25]。DI等[26]研究发现,食管癌组织样本中miR-135b表达升高,并且在Eca109、EC9706、KYSE150细胞中的表达高于正常食管上皮细胞,沉默miR-135b表达在体外能够抑制Eca109和EC9706细胞的增殖、侵袭、迁移并促进细胞凋亡,在体内能够抑制异种移植肿块的生长。本研究结果发现,circ-GRIN2B能负调控miR-135b的表达,表明了circ-GRIN2B抑制食管癌细胞的增殖、侵袭可能与调控miR-135b表达有关。
综上所述,circ-GRIN2B在食管癌细胞中低表达,其可能通过下调miR-135b表达抑制食管癌细胞的增殖和侵袭。circ-GRIN2B未来有望成为一种新的食管癌治疗靶点。本研究的不足之处在于,未能证明circ-GRIN2B在体内对食管癌细胞增殖和侵袭的抑制作用,下一步研究将通过裸鼠荷瘤实验来验证circ-GRIN2B在体内的抑癌作用。
