前列腺癌中PI3K/AKT通路调控PHF19基因表达的机制研究
2024-03-13明道靖郭梦梦张晋辉刘梦洋史明慧刘姝言曾宪涛
明道靖,郭梦梦,张晋辉,刘梦洋,3,史明慧,3,刘姝言,3,袁 帅,曾宪涛,3
1. 河南大学淮河医院泌尿外科(河南开封 475000)
2. 武汉大学中南医院循证与转化医学中心(武汉 430071)
3. 武汉大学中南医院泌尿外科(武汉 430071)
前列腺癌是全球男性最常见的恶性肿瘤之一[1-2]。尽管雄激素剥夺疗法(androgen deprivation therapy, ADT)为主的多种治疗手段具有较好的治疗效果,但绝大多数患者仍不可避免地进展到无法治愈的去势抵抗性前列腺癌 (castration-resistant prostate cancer, CRPC),并伴随复杂分子信号通路的改变,如PI3K/AKT 通路的激活、表观遗传重塑等[3-4]。因此,迫切需要找到前列腺癌进展的关键作用因子及其相关分子机制。
多梳抑制复合物2(Polycomb repressive complex 2,PRC2)由核心亚基(EZH2、EED、SUZ12 和RBBP4)和不同的附属亚基组成,其功能失调与癌症发生发展密切相关[5]。PRC2 在前列腺癌进展中发挥着重要作用,其中zeste 基因增强子同源物2(enhancer of zeste homolog 2,EZH2)作为PRC2 的核心亚基之一,其表达和活性的增加可促进前列腺癌发生和进展[6-7]。EZH2 功能的发挥在很大程度上依赖于附属亚基对PRC2 的募集作用,其中附属亚基PHF19(PHD finger protein 19)在前列腺癌中表达上调,并通过调节PRC2复合体功能介导前列腺癌细胞功能[8]。目前仍不清楚PHF19在前列腺癌中上调的确切调控机制,因此,本研究探索了前列腺癌中PHF19基因表达的调控机制,发现PI3K/AKT 通路通过转录因子TP63 调控PHF19基因在前列腺癌中的表达。
1 材料与方法
1.1 材料与试剂
人前列腺癌细胞系PC-3 购自中国科学院细胞库(中国上海);F-12K 细胞培养基、0.25%胰酶购自美国Gibico 公司;Eastep® Super 总RNA提取试剂盒购自中国上海Promega 公司;Pierce™琼脂糖ChIP 试剂盒购自美国Thermo Scientific 公司;SYBR Green Fast qPCR Mix 购自中国武汉ABclonal 公司;PrimeScript RT 逆转录试剂盒购自日本TaKaRa 公司;表皮生长因子EGF、PI3K/AKT 通路抑制剂LY294002 购自美国MCE 公司;qRT-PCR 引物序列由上海生工合成。
1.2 实验方法
1.2.1 细胞培养
PC-3 细胞在含有10%胎牛血清的F-12K 细胞培养基中培养(37℃、5% CO2),待密度达到80%左右进行传代、冻存、提取总RNA 等后续实验。
1.2.2 药物处理实验
将PC-3 细胞铺板至6 孔板内,每孔2×105个细胞;37℃孵育24 h 后,抑制剂处理组给予LY294002(20 μM)处理0、6、12、24、48 h;表皮生长因子处理组给予EGF(100 ng·mL-1)处理0、6、12 h。
1.2.3 ChIP-qPCR实验
ChIP 实验采用赛默飞Pierce™琼脂糖 ChIP试剂盒,并按照说明书相应步骤进行,简要步骤如下:PC-3 细胞用1%(重量/体积)甲醛固定,随后用甘氨酸终止交联。用PBS 洗涤后,将样品悬浮于细胞裂解缓冲液中,随后离心,向沉淀中加入染色质裂解缓冲液,再次离心后取上清液,按1 : 9 加入适量1×IP 稀释缓冲液。加入抗ΔNp63(美国Cell Signaling Technology 公司)抗体,4℃旋转孵育过夜。随后将样品过色谱柱,洗脱并富集DNA。继续进行qPCR 检测,引物序列如下:PHF19promoter 上游引物序列为5'-TCAGTCTTAGGGGACGGTGG-3',下游引物序列为5'-GGACGACCCTAATCATGGCA-3'。
1.2.4 qRT-PCR检测细胞中TP63、ΔNp63、PHF19的mRNA表达
使用Eastep® Super 总RNA 提取试剂盒提取总RNA 并测量RNA 浓度。使用带有gDNA Eraser 的PrimeScript RT 试剂盒,参照说明书,将1000 ng RNA 逆转录为cDNA。 以cDNA 为模版使用SYBR Green Fast qPCR Mix(ABclonal公司)进行实时PCR。TP63上游引物序列为5'-CAGGAAGACAGAGTGTGCTGGT-3',下游引物序列为5'-AATTGGACGGCGGTTCATCCCT-3';ΔNp63上游引物序列为5'-AGCCAGAAGAAAGGAC AGCA-3',下游引物序列为5'-CAGGTTCGTGT A C T G T G G C T-3';PHF19-L上游引物序列为5'-CGTGAAGATGGTGCTGTCCT-3',下游引物序列为5'-TGGAACCACTGCCTGCAC-3';PHF19-S上游引物序列为 5'-GCAGACCAGAGACTCCCATCAC-3',下游引物序列为5'-GAGGCGCTATCTGTCTCCAAAG-3';内参基因GAPDH上游引物序列为 5'-CCATGG AGAAGGCTGGGG-3',下游引物序列为5'-CAAAGTT GTCATGGATGACC-3'。将结果标准化为GAPDH,并使用2^-(ΔΔCt)方法计算相对基因表达。
1.2.5 生物信息学分析
本研究中生物信息学分析数据来自于公共数据库,主要包括:使用JASPAR 数据库(http://jaspar.genereg.net/)预测PHF19基因启动子区域存在的转录因子结合位点;使用ChIPBase v3.0数据库(https://rnasysu.com/chipbase3/index.php)分析可能调节PHF19基因表达的转录因子;使用STRING(https://cn.string-db.org/)数据库探索TP53 及其同源家族转录因子TP63 与MDM2 蛋白之间的蛋白相互作用关系;使用GEPIA 2(http://gepia2.cancer-pku.cn/#index)工具分析TCGA 前列腺癌数据库中TP53、TP63与PHF19基因mRNA 的表达相关性。
1.3 统计学分析
使用Pearson 相关系数计算各种基因表达之间的关联。使用Prism 8.0 软件完成图表制作。所有统计分析均使用SPSS 22.0 软件进行,两组间比较选用独立样本t检验,多组比较采用单因素方差分析,P<0.05 表示差异有统计学意义。
2 结果
2.1 PI3K/AKT通路调节PHF19基因mRNA表达
为验证PHF19基因是否受到PI3K/AKT 通路的调节,本研究选用PI3K/AKT 通路抑制剂LY294002 处理前列腺癌细胞,利用qRT-PCR检测PHF19mRNA 表达变化情况。结果显示,在PC-3 细胞系中,使用LY294002 处理后,与处理0 h 组相比,其余时间处理组PHF19-L和PHF19-S的mRNA 水平均显著下调(图1-A、图1-B)。随后,利用PI3K/AKT 通路激动剂EGF处理PC-3 细胞,发现与处理0 h 组相比,其余时间处理组PHF19-L与PHF19-SmRNA 水平均显著上调(图1-C、图1-D)。提示PI3K/AKT 通路可在转录水平调节PHF19基因的表达。
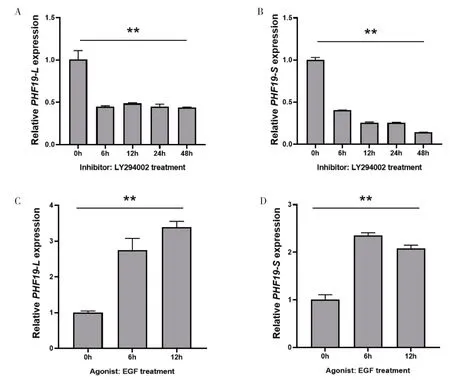
图1 LY294002、EGF处理后PHF19 mRNA水平变化Figure 1. PHF19 mRNA expression levels after treatment with LY294002 and EGF
2.2 PHF19启动子区域存在转录因子TP53、TP63结合位点
为研究PI3K/AKT 通路在转录水平调节PHF19基因mRNA 的潜在机制,本研究利用ChIPBase v3.0 数据库寻找可能调节PHF19基因表达的转录因子,发现PHF19基因启动子区域存在TP53、TP63 等转录因子结合位点(图2-A);利用JASPAR 数据库也预测发现PHF19基因启动子区域存在转录因子TP53、TP63 结合位点(图2-B、图2-C);利用STRING 数据库分析发现TP53 及其同源家族转录因子TP63 均与MDM2 蛋白具有蛋白相互作用关系(图2-D)。提示转录因子TP53、TP63 可能参与了PI3K/AKT 通路对PHF19基因的调控作用。

图2 转录因子TP53、TP63与PHF19基因的潜在调控关系Figure 2. The regulatory effects of transcription factors TP53 and TP63 on the PHF19 gene
2.3 TP63参与调节PHF19基因表达
为了进一步验证转录因子TP53、TP63 是否调节PHF19基因表达,本研究利用GEPIA 2 工具,分析TCGA 前列腺癌数据库中TP53、TP63与PHF19基因mRNA 的表达相关性。结果显示,TP63与PHF19的mRNA 表达水平显著正相关(r=0.43,P<0.05);而TP53与PHF19的mRNA 表达水平相关性较弱(r=0.11,P=0.013)(图3-A、图3-B)。提示与TP53 相比,TP63更可能参与PHF19基因的转录调控。进一步利用ChIP-qPCR 实验检测TP63 突变亚型ΔNp63 蛋白在PHF19基因启动子区域的富集情况。结果显示ΔNp63 蛋白可结合PHF19启动子区域的DNA片段(图3-C)。提示转录因子TP63 突变亚型ΔNp63 可结合PHF19基因启动子,参与PHF19基因的调控作用。

图3 TP63参与PHF19基因表达调控Figure 3. TP63 is involved in the regulation of PHF19 gene expression
2.4 TP63受到PI3K/AKT通路的调节
为探究TP63是否同样受到PI3K/AKT 通路的调节,本研究再次利用PI3K/AKT 通路抑制剂LY294002 处理PC-3 细胞, 进而检测TP63、ΔNp63mRNA 水平变化情况。qRTPCR 结果显示,LY294002 处理PC-3 细胞后,与处理0 h 组相比,其余时间处理组TP63以及ΔNp63mRNA 水平均显著下调(图4-A、图4-B)。提示TP63基因mRNA 的表达受到PI3K/AKT 通路的调控。

图4 LY294002处理PC-3细胞后TP63、ΔNp63 mRNA水平变化Figure 4. TP63 andΔNp63 mRNA expression levels after treatment of LY294002 in PC-3 cells
3 讨论
PHF19基因在前列腺癌中表达上调且促进肿瘤增殖,然而其表达上调的具体原因尚不清楚。本研究发现PI3K/AKT 通路可能通过TP63 对PHF19基因的转录产生调控作用(图4-C)。本研究利用ChIP-qPCR 证明了转录因子TP63 的突变亚型ΔNp63 可结合PHF19基因启动子区域的DNA 片段,并通过PI3K/AKT 通路抑制剂LY294002、表皮生长因子EGF 等处理方式确定了PI3K/AKT 通路对TP63、ΔNp63、PHF19mRNA的调节作用。
PRC2 复合体介导的表观遗传调控机制在前列腺癌的发生发展过程中具有重要作用[9]。PRC2是一种多蛋白复合体,其关键功能是催化组蛋白H3 第27 位赖氨酸(H3K27)的甲基化,进而抑制基因表达[10]。在前列腺癌细胞中,PHF19 可介导PRC2 复合体在染色质上的募集,发挥表观遗传调控作用。PHF19 在多种肿瘤中发挥重要作用[11-12],包括肝细胞癌(hepatocellular carcinoma,HCC)[13]、胶质母细胞瘤(glioblastoma, GBM)[14]和多发性骨髓瘤(multiple myeloma, MM)[15]。在HCC 中,PHF19 参与调节细胞周期和DNA 复制等过程[13]。在GBM中,PHF19通过SIAH1/β-catenin轴的调节影响GBM 细胞对常用化疗药物多柔比星的化疗敏感性[14]。此外,PHF19 还可通过增强PRC2介导的H3K27me3甲基化促进MM的发生[15]。在前列腺癌中,干扰PHF19基因表达可抑制细胞增殖[8]。近期研究也表明,PHF19 在前列腺癌恶性进展(尤其是NEPC 分化亚型)过程中表达上调[16],然而其表达上调的具体原因仍不清楚。
PI3K/AKT 通路是细胞中重要的信号转导通路。近年来,有许多研究关注了PI3K/AKT 通路在前列腺癌中的作用,例如PTEN的缺失可以导致PI3K/AKT 通路的持续活化,从而促进癌症的发生和发展[17];PI3K/AKT 通路的活化可以促进前列腺癌的侵袭性和迁移能力,促进肿瘤组织内血管生成[18];同时针对PI3K/AKT 通路的药物可以有效抑制前列腺癌的生长和侵袭[19]等。因此,PI3K/AKT 通路的异常活化对前列腺癌的发生、发展和治疗具有重要的临床意义。本研究通过PI3K/AKT 信号通路的抑制剂和激动剂处理前列腺癌细胞发现,PHF19基因的转录受到PI3K/ AKT信号通路的正向调控。表明随着前列腺癌的进展,PI3K/AKT 信号通路持续激活,PHF19基因的表达也随之增强。
本研究进一步探索了调控PHF19基因转录的潜在转录因子。以往研究证实,TP53 可受到PI3K/AKT/MDM2 通路的调控[20-21]。本研究通过ChIPBase v3.0 和JASPAR 数据库,发现PI3K/AKT 信号通路中的TP53 可能是PHF19的转录因子,并且其家族成员TP63 也可能对PHF19的转录具有调控作用;通过GEPIA 2 数据库分析发现,TP63与PHF19基因的表达具有较高的正相关性。双微体同源基因2(mouse double minute 2,MDM2)是PI3K/AKT 信号通路中重要的下游调控因子,在肿瘤中高表达,主要通过负向调控P53肿瘤抑制蛋白,降低其稳定性和活性,从而抑制P53 介导的细胞凋亡和细胞周期阻滞功能,促进肿瘤进展[22-23]。MDM2 同样与TP63 蛋白具有潜在的相互作用关系,与TP53 蛋白不同得是MDM2通过稳定TP63 蛋白进而增加其转录活性[24-25]。本研究发现,抑制PI3K/AKT 信号通路可降低TP63基因的表达水平,提示除了MDM2 稳定TP63 蛋白的调控机制外,PI3K/AKT 也可能通过其他途径促进TP63基因的表达。推测PI3K/AKT 信号通路对TP63 转录因子存在正相调控关系。
TP63 是TP53 转录因子家族的成员,位于人类染色体3 的长臂(3q27-29)。TP63基因主要在上皮组织中表达,可维持组织的发育、分化、形态发生等功能[26]。同时,研究还发现TP63基因的突变或异常表达可能与前列腺癌的发生发展有关[27]。TP63基因产生的蛋白质具有多个亚型,其中两种主要亚型分别为具有反式激活区的TAp63 和缺乏N 末端反式激活结构域的ΔNp63[28]。TAp63 主要参与细胞凋亡的调控,而ΔNp63 则在细胞增殖和上皮细胞分化中发挥作用。这两个亚型的平衡和相互作用对于维持正常的生物学功能至关重要。在前列腺癌中,文献报道TP63 主要存在于正常前列腺组织以及其他基底细胞癌症组织中[29],TP63 突变亚型ΔNp63 蛋白仅在骨转移前列腺癌细胞PC-3亚群中高表达,并促进前列腺癌的进展[29-30]。值得注意的是,近期一项研究提出,神经内分泌前列腺癌细胞来源于表达p63 的基底细胞,而不是来源于小鼠原有的腺癌细胞[31]。此外,有研究发现表达TP63 的前列腺基底细胞,能够分化成腔上皮、神经内分泌和基底细胞,并且该类型细胞在β-catenin 稳定表达的情况下,具有启动肿瘤形成的能力[32]。以上研究表明TP63 在前列腺癌(尤其是NEPC 分化亚型)恶性进展过程中发挥重要作用。本研究发现TP63 突变亚型ΔNp63 可结合PHF19基因启动子,且TP63 的表达受到PI3K/AKT 信号通路的正向调节。因此,前列腺癌中PI3K/AKT 通路可能通过转录因子TP63 对PHF19基因的表达产生调节作用。
本研究也存在一定局限性。例如,在药物处理实验中,参考其他研究只选用了单一药物浓度进行处理,未选用不同的药物浓度梯度。后续研究中将针对这一问题开展深入的探索。
综上所述,本研究发现PHF19基因的转录受到PI3K/AKT 通路的调节,此外转录因子TP63 可能部分介导了PI3K/AKT 通路对PHF19基因的调控作用,研究有望揭示前列腺癌中基因表达调控的新机制,并为前列腺癌的靶向治疗提供新思路。
